|
|
|
АНАЛІТИЧНА ХІМІЯ Електронний посібник |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
РОЗДІЛ 1. ТЕОРЕТИЧНІ ОСНОВИ АНАЛІТИЧНОЇ ХІМІЇ |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
1.1. Хімічна рівновага
в гомогенних системах 1.1.1.1.
Швидкість хімічної реакції 1.1.2.2. Хімічна
рівновага та її константа 1.1.2.3. Вплив зміни зовнішніх умов на стан хімічної
рівноваги 1.1.3. Електролітична дисоціація. Сильні та слабкі
електроліти 1.1.3.1. Основні
положення теорії електролітичної дисоціації 1.1.3.2. Механізм
електролітичної дисоціації 1.1.3.3. Дисоціація
електролітів різних класів сполук 1.1.3.4. Сильні та
слабкі електроліти 1.1.3.6. Активність
та коефіцієнт активності 1.1.4. Рівновага в розчинах електролітів 1.1.4.1. Реакції у розчинах електролітів 1.1.4.2. Реакції утворення осаду 1.1.4.3. Реакції утворення газоподібних сполук 1.1.4.4. Реакції з малодисоційованими сполуками 1.1.5. Йонний добуток води. Водневий показник 1.1.5.1. Дисоціація
та йонний добуток води 1.1.5.3. Приклади
розрахунку рН для розчинів кислот і основ 1.1.6.2. Гідроліз солей різних типів 1.1.6.3. Приклади розрахунку рН розчину, константи і ступеня гідролізу
солі 1.1.7.2. Механізм дії буферного розчину 1.2. Хімічна рівновага в гетерогенних системах 1.2.1.2. Приклади розрахунку добутку розчинності
та розчинності малорозчинних електролітів 1.2.2. Утворення й розчинення осадів 1.2.2.2. Дробове
осадження йонів 1.2.3. Амфотерні основи в хімічному аналізі 1.2.3.2.
Використання явища амфотерності в якісному аналізі 1.3.1. Загальна характеристика та номенклатура
комплексних сполук 1.3.1.1.
Характеристика комплексних сполук 1.3.1.2.
Класифікація комплексних сполук 1.3.1.3.
Номенклатура комплексних сполук 1.3.2. Константа нестійкості комплексних йонів 1.3.2.1. Дисоціація комплексних сполук 1.3.2.2. Константа рівноваги комплексного йона 1.3.3. Реакції обміну в розчинах комплексних сполук 1.3.3.1. Реакції
йонного обміну та заміщення лігандів 1.3.3.3. Руйнування
комплексів 1.4.2. Сутність
окисно-відновних реакцій 1.4.3.
Окисно-відновний потенціал. Напрямок окисно-відновних реакцій 1.1. Хімічна рівновага в гомогенних
системах 1.1.1.1. Швидкість хімічної
реакції Для проведення хімічного
аналізу дуже важливо вміти керувати швидкістю хімічної реакції.
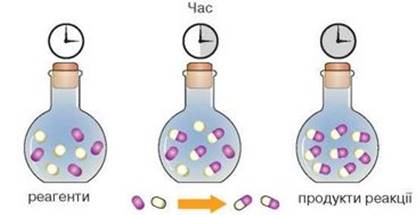
Рис. 1.1. Схема зміни концентрації
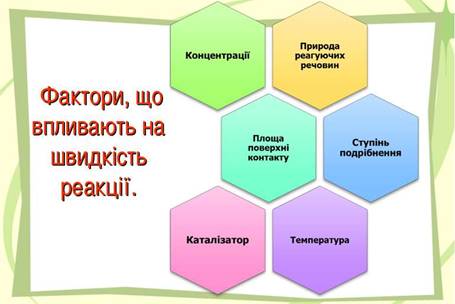
речовин за певний проміжок часу Швидкість хімічної реакції залежить від природи реагуючих речовин, площі
поверхні (для гетерогенних
реакцій), концентрації реагуючих речовин, температури, впливу тиску (для газів),
а також наявності каталізаторів та інгібіторів.
Рис. 1.2. Чинники, що впливають на
швидкість реакції
Залежність швидкості хімічної реакції
від концентрації реагуючих речовин дослідили норвезькі вчені К. Гульдберг і
П. Вааге (1867 р.).
Наприклад, для
реакції, що відбувається в розчині згідно з гіпотетичним рівнянням:
швидкість реакції
виражається рівнянням:
де k – константа швидкості, що є сталою для цієї реакції за певних
температурних умов, яка залежить від природи реагуючих речовин. Її фізичний зміст полягає в тому, що це швидкість реакції за
концентрації реагуючих речовин 1 моль/л. Квадратними дужками позначають
молярну концентрацію речовин. Для прикладу
розглянемо гомогенну
реакцію, яка відбувається в розчині:
Для цієї хімічної
реакції кінетичне
рівняння має вигляд:
Для гетерогенних реакцій у кінетичне рівняння не
входять тверді (кристалічні) речовини. Наприклад,
гетерогенна реакція відбувається в розчині:
Для такої реакції
кінетичне рівняння має вигляд:
У гетерогенних
системах за участі твердої фази швидкість реакції не залежить від маси
твердої речовини (якщо її поверхня незначна), а залежить лише від концентрації
розчиненої або газоподібної речовини. Таким чином, збільшуючи
або зменшуючи концентрацію речовин-учасників реакції, можна пришвидшувати або
сповільнювати швидкість хімічної реакції або впливати на хімічну рівновагу
для реакції, що є оборотною.
Контрольні
питання 1.
Від яких
чинників залежить швидкість хімічних реакцій? 3.
Який фізичний
зміст константи швидкості? 4.
Чим
відрізняється кінетичне рівняння для гетерогенних реакцій? 5. Яким чином можна пришвидшити
або сповільнити швидкість хімічної реакції?
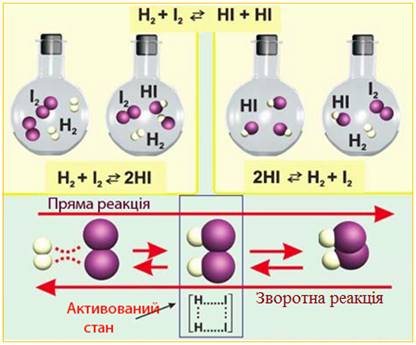
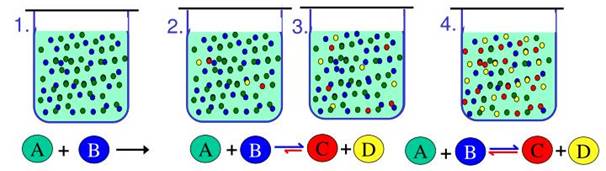
1.1.2.1.Оборотні реакції У природі існує
багато хімічних реакцій, які відбуваються як у прямому, так і у зворотному
напрямках.
Рис. 1.7. Схема оборотної хімічної реакції
1.1.2.2. Хімічна рівновага та її константа Під час перебігу
оборотних реакцій у системі встановлюється динамічна
хімічна рівновага, за якої у системі водночас існують і
вихідні речовини, і продукти реакції.
Рис. 1.8. Хімічна рівновага
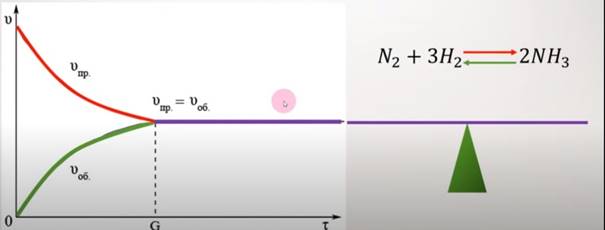
Рис. 1.9. Графік встановлення хімічної рівноваги Для рівноважної
системи:
швидкість прямої реакції:
а швидкість зворотної реакції:
У стані хімічної
рівноваги Тому можна
записати:
Після математичних перетворень
отримаємо:
Відношення двох
сталих величин
Константа хімічної рівноваги показує, у скільки разів швидкість
прямої реакції більша ніж швидкість зворотної реакції (за сталих концентрацій
і конкретної температури). Якщо константа хімічної рівноваги K = 1, то швидкість прямої і зворотної реакції приблизно
однакові. Якщо константа хімічної рівноваги K > 1, то переважає пряма реакція і хімічна рівновага зміщується
праворуч. Якщо К < 1, то переважно відбувається
зворотна реакція і хімічна рівновага зміщена ліворуч. Розглянемо
оборотну хімічну реакцію, яку застосовують у хімічному аналізі:
Вираз для
константи хімічної рівноваги має вигляд:
1.1.2.3. Вплив зміни зовнішніх умов на стан хімічної рівноваги
Для того щоб керувати хімічною рівновагою, користуються
принципом
Ле Шательє сформулюваний французьким фізиком і хіміком Анрі
Луї Ле Шательє, (1884 р.).
Таким чином, якщо
в систему додавати одну з вихідних речовин, це сприятиме зміні рівноважних
концентрацій. Рівновага знову встановиться, але вже за нових концентрацій
вихідних речовин і продуктів реакції. У цьому випадку підвищується швидкість тієї
реакції, за якої зменшується концентрація речовини, що додається. Якщо в
запропонованій реакції збільшити концентрацію калій роданіду, то хімічна
рівновага зміститься в бік прямої реакції, а концентрація ферум(ІІІ) роданіду
зросте й інтенсивність забарвлення посилиться. Якщо навпаки, додати до
реакційної системи калій хлорид, то це сприятиме посиленню швидкості
зворотної реакції, хімічна рівновага зміщуватиметься ліворуч, тобто в бік
зворотної реакції, концентрація ферум(ІІІ) роданіду зменшиться і забарвлення
послабиться.
Your browser does not support the video tag Щоб досягти більш повного зміщення хімічної рівноваги, слід
діяти надлишком реактиву, що викликає це зміщення.
Слід пам’ятати, що
поняття про хімічну рівновагу застосовують до неелектролітів та слабких електролітів у розведених
розчинах. Слабкі електроліти в концентрованих розчинах та всі
сильні електроліти (луги, кислоти, розчинні солі) не підпорядковуються закону діючих
мас.
Контрольні питання 1.
Які речовини
перебувають у системі під час встановлення динамічної хімічної рівноваги? 2.
Як константа
хімічної рівноваги характеризує напрямок перебігу хімічної реакції? 3.
Якщо К>1,
то яка реакція відбувається швидше – пряма чи зворотна? 4.
Яким принципом
необхідно користуватися для того, щоб керувати хімічною рівновагою? 5.
Що потрібно
зробити для досягнення більш повного зміщення хімічної рівноваги? 6.
Які речовини
не підпорядковуються закону діючих мас?
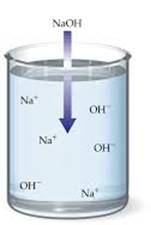
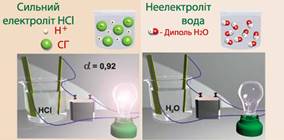
1.1.3. Електролітична дисоціація. Сильні
та слабкі електроліти 1.1.3.1. Основні положення теорії
електролітичної дисоціації У середині XIX ст.
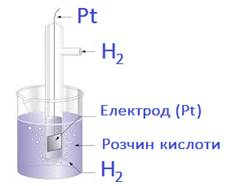
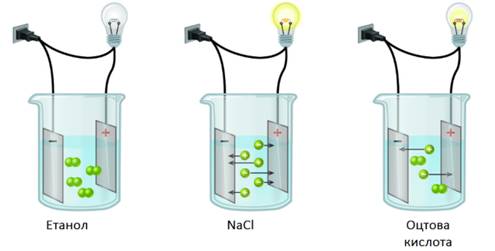
завдяки роботам М. Фарадея стали відомі явища електролізу та електропровідності розчинів і розплавів деяких речовин.
Як відомо, провідниками електричного струму є метали, їх вважають провідниками
першого роду (мають електронну провідність). Дистильована
вода, тверді солі, луги та безводні кислоти не проводять електричного струму.
Навпаки, водні розчини солей, кислот, лугів та розплави
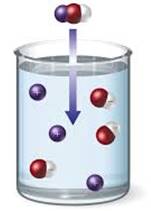
солей і лугів проводять електричний струм (рис. 1.12).
Рис. 1.12. Електропровідність розчинів
Шведський хімік С. Арреніус (1887 р.) як результат експериментальних досліджень
розробив теорію електролітичної дисоціації.
Основні положення
її такі. ►1. Під час
розчинення в полярному
розчиннику (воді) відбувається розпад електролітів на йони. ►2. Електролітичній дисоціації підлягають речовини з йонним або ковалентним полярним зв’язками, у розплавах – тільки з йонним. ►3. У водних
розчинах йони оточені гідратною оболонкою, тобто існують у гідратованому
стані. ►4. Сильні
електроліти у водних розчинах дисоційовані повністю, слабкі – частково. ►5.
Дисоціація – процес оборотний. ►6.
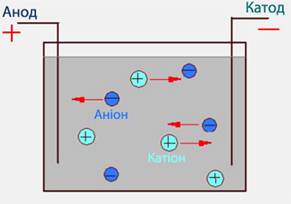
Електроліти – провідники з йонною провідністю. Електропровідність розчинів та
розплавів зумовлена наявністю в них йонів, що утворилися внаслідок
електролітичної дисоціації.
Рис. 1.14. Рух йонів в електричному полі
До електролітів належать кислоти, солі, луги.
Представниками неелектролітів є спирти, глюкоза, сечовина, сахароза та
інші.
1.1.3.2. Механізм електролітичної
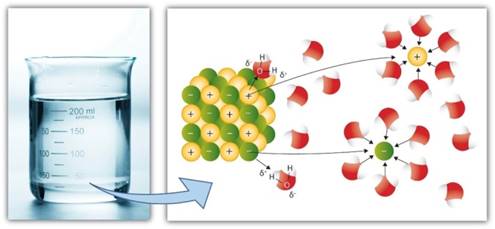
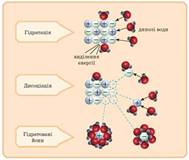
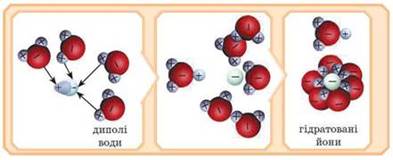
дисоціації Під час розчинення
речовин у полярному розчиннику (воді) відбувається взаємодія речовини з
останнім. Полярні молекули води, орієнтовані щодо йонів або полярних молекул,
які розташовані у вузлах кристалічних
ґрат, притягують їх до себе. При цьому відбувається йонізація – розпад
речовини на йони. Як результат гідратовані йони переходять у розчин (рис.
1.15).
Рис. 1.15. Механізм електролітичної
дисоціації речовин У разі полярних
молекул (HCl, H2SO4) під час розчинення відбувається
їх йонізація та гідратація й вони переходять у розчин у вигляді гідратованих
йонів.
1.1.3.3. Дисоціація електролітів різних
класів сполук
Наприклад:
Багатоосновні
слабкі кислоти дисоціюють ступінчасто.
Наприклад:
Наприклад:
Наприклад:
Наприклад:
Слід наголосити, що в розчинах електролітів багатоступінчаста дисоціація
переважно відбувається за першим ступенем. Дисоціація за другим ступенем
значно менша, ніж за першим, а за третім ступенем менша, ніж за другим. Це
пояснює те, що розчини кислих солей містять катіони Гідрогену й проявляють
слабкі кислотні властивості. Розчини основних солей містять незначну
кількість гідроксильних йонів і мають слабкі основні властивості. Для того
щоб дисоціація відбувалася і за наступним ступенем, необхідно створити певні
умови – для кислот і кислих солей нейтралізувати катіони Гідрогену, а для
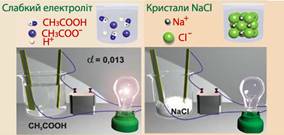
основ та основних солей нейтралізувати йони гідроксилу. 1.1.3.4. Сильні та слабкі електроліти Не всі електроліти
повністю розпадаються на йони. У розчинах багатьох електролітів разом із йонами
містяться й недисоційовані молекули. Кількісно це характеризується ступенем
електролітичної дисоціації.
де α – ступінь електролітичної
дисоціації; n
– кількість молекул, що розпалися на йони; N
– загальна кількість молекул. Часто ступінь дисоціації
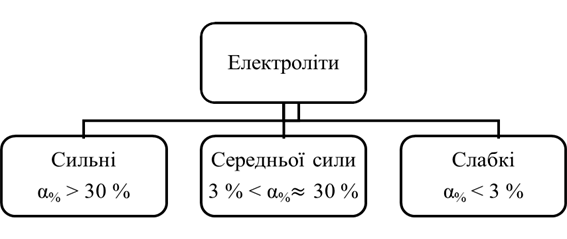
виражають у відсотках, у цьому випадку вираз (1.3) слід помножити на 100. Залежно від
значення ступеня електролітичної дисоціації електроліти поділяють на сильні,
середньої сили та слабкі (рис. 1.3).
Рис. 1.20. Класифікація електролітів До сильних електролітів належать: ►1. Сильні кислоти: H2SO4, HCl, HI, HBr, HNO3, HClO4. ►2. Сильні основи – луги: NaOH, LiOH, KOH, Ba(OH)2, Ca(OH)2. ►3. Розчинні у воді солі: NaCl, Ba(NO3)2, CuSO4 та інші. Електролітом
середньої сили є .
Для характеристики сили слабкого електроліту використовують константу
дисоціації.
Наприклад, для
слабкого електроліту:
вираз константи
дисоціації має вигляд:
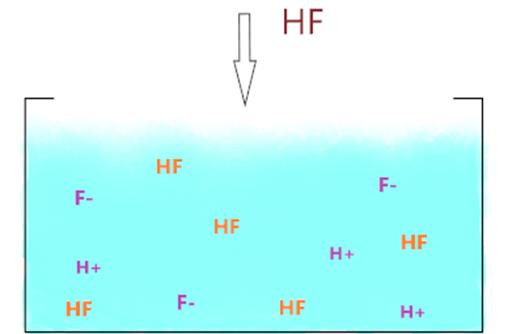
Так, для фторидної
кислоти, що дисоціює за рівнянням:
Рис. 1.22. Дисоціація HF вираз для константи
дисоціації:
Для слабких
електролітів, що дисоціюють ступінчасто, існують декілька констант
дисоціації. Наприклад:
Рис. 1.23. Дисоціація H2S
Із виразу бачимо,
що менше значення константи дисоціації, то вона відбувається гірше. Значення
констант дисоціації вказують у довідкових таблицях. Таблиця 1.1 Константи дисоціації слабких електролітів у водних
розчинах за 25 0С
Інколи
користуються від’ємним десятковим логарифмом константи дисоціації: рKa – для кислот та pKb – для основ.
Що менше значення pKa, то кислота сильніша. Взаємозв’язок константи дисоціації зі ступенем дисоціації описує закон розведення Оствальда:
Для розведених розчинів цей вираз спрощується:
1.1.3.6. Активність та коефіцієнт активності Розчини сильних електролітів навіть за дуже великого
розведення не є ідеальними. Це реальні розчини, де кожний йон взаємодіє з усіма
оточуючими його йонами, що викликає відхилення властивостей сильних
електролітів від властивостей ідеальних розчинів. Щоб врахувати відхилення
властивостей сильних електролітів, ввели поняття активність – а.
Активність
пов’язана з концентрацією розчину через коефіцієнт активності:
де Для розрахунку
коефіцієнта активності в дуже розведених розчинах використовують рівняння
першого наближення теорії Дебая-Хюккеля.
де
Рівняння (1.7)
справедливе для розчинів з Якщо
Контрольні питання 1. Які речовини
підлягають електролітичній дисоціації? 2. Які речовини належать до електролітів? 3. Які речовини належать до неелектролітів? 4. За яким ступенем переважно відбувається багатоступінчаста дисоціація у
розчинах електролітів? 5. Який показник використовують для характеристики сили слабкого
електроліту? 6. Визначити зв’язок між константою та ступенем дисоціації електроліту.
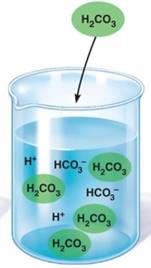
1.1.4. Рівновага в розчинах електролітів 1.1.4.1. Реакції у розчинах електролітів У водних розчинах сильних електролітів містяться йони. У таких розчинах відбувається
постійне зіткнення йонів між собою. Якщо внаслідок їх взаємодії утворюється малодисоційована сполука (вода,
слабка кислота), малорозчинна сполука (осад) або газоподібна речовина, то
йони зв’язуються й виводяться з реакційної суміші. При цьому хімічна рівновага зміщується в бік утворення слабкого електроліту, тобто в бік прямої
реакції. Такі хімічні
реакції є необоротними й відбуваються до кінця. Якщо під час перебігу хімічної реакції не відбувається взаємодія між
йонами, то така реакція є оборотною й перебуває в стані динамічної рівноваги. 1.1.4.2. Реакції утворення осаду Розглянемо принцип
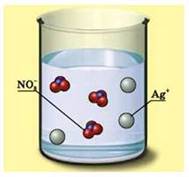
складання таких рівнянь на прикладі реакції, що відбувається між розчинами
арґентум нітрату та натрій хлориду. Складемо
молекулярне рівняння цієї хімічної реакції:
Якщо скористатися
таблицею розчинності кислот, основ і солей у воді, то можна дійти висновку,
що обидві солі добре розчиняються у воді, тобто є сильними електролітами й містяться в
розчині у вигляді йонів.
Один із продуктів
хімічної реакції – натрій нітрат – також добре розчиняється у воді й міститиметься в
розчині у вигляді йонів. Другий продукт реакції ‒ арґентум хлорид – нерозчинна сіль, тому існуватиме у вигляді осаду й
виходитиме з реакційної суміші.
Складемо повне
йонне рівняння, враховуючи, що малорозчинна сіль буде записана в молекулярній
формі:
Для складання
скороченого йонного рівняння слід скоротити подібні йони в лівій та правій
частині рівняння, а ті йони та недисоційовані сполуки, що залишилися, необхідно
виписати окремо, вони й будуть скороченим йонним рівнянням:
Ця хімічна реакція
відбувається до кінця, оскільки утворився осад. 1.1.4.3. Реакції утворення газоподібних сполук Розглянемо
приклади необоротних реакцій у розчинах електролітів, унаслідок яких
утворюються газоподібні сполуки. Приклади таких
речовин:
Розглянемо приклад
реакції йонного обміну, внаслідок якої утворюється газоподібна речовина.
Запишемо рівняння хімічної реакції, що відбувається під час взаємодії
розчинів нітратної кислоти та натрій карбонату: а) молекулярна
форма:
б) повна йонна
форма:
в) скорочена йонна
форма:
1.1.4.4. Реакції з малодисоційованими
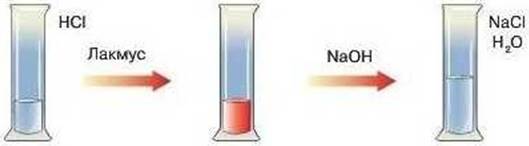
сполуками Прикладом
утворення малодисоційованої сполуки може бути реакція нейтралізації хлоридної
кислоти натрій гідроксидом. Утворюється малодисоційована сполука – вода.
Рис. 1.29. Реакція нейтралізації
хлоридної кислоти натрій гідроксидом
Існують багато
хімічних реакцій, що відбуваються в розчинах електролітів, коли слабкий електроліт розташований у лівій частині рівняння. Його також слід записувати в
молекулярній формі. Наприклад,
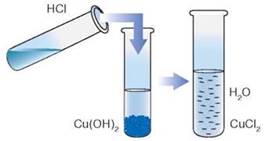
розчинення осаду Купрум (ІІ) гідроксиду під дією хлоридної кислоти:
Розглянемо рівняння
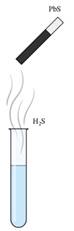
хімічної реакції осадження катіонів Плюмбуму (ІІ) у вигляді сульфіду
сірководнем:
Контрольні питання 1. Які особливості
взаємодії між розчинами сильних електролітів? 2. У вигляді яких рівнянь зображують хімічні
реакції, що відбуваються між електролітами? 3. За яких умов між розчинами сильних електролітів хімічна рівновага
зміщується у бік прямої реакції? 4. Яка хімічна реакція між розчинами електролітів є оборотною? 5. Як слабкі електроліти записують в йонних рівняннях реакцій?
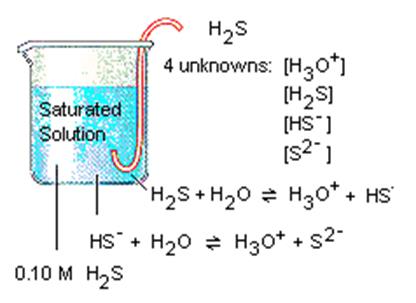
1.1.5. Йонний добуток води. Водневий
показник 1.1.5.1. Дисоціація та йонний добуток
води Вода – дуже слабкий електроліт, який дисоціює лише частково, розпадаючись
на гідроксид-йони та йони
Гідрогену
Рис. 1.30. Дисоціація води Застосовуючи до
рівняння дисоціації води закон діючих мас, дістанемо:
де Kw
– константа дисоціації води; Ступінь дисоціації
води надзвичайно малий, тому кількістю недисоційованих молекул нехтують.
Отже, концентрацію недисоційованих молекул води можна
вважати сталою величиною, її легко обчислити, поділивши масу 1 л води на
молярну масу води (1000 г : 18 г/моль = 55,55 моль). Таким чином,
вираз для добутку концентрації йонів Гідрогену й гідроксилу можна записати
так:
За температури 25 0С
[H +] · [OH –] = 10 – 14.
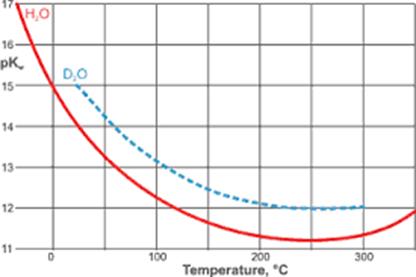
Значення йонного добутку змінюється із зміною
температури, оскільки з підвищенням температури дисоціація води збільшується.
Рис. 1.31. Графік залежності рКw
від температури У чистій воді
концентрація йонів Гідрогену дорівнює концентрації гідроксид-йонів:
Якщо до води
додати розчин якої-небудь кислоти, тобто ввести додаткову кількість йонів
Гідрогену, то стан йонної рівноваги води порушиться. Збільшення концентрації
йонів Гідрогену призводить до відповідного зменшення концентрації
гідроксид-йонів; добуток же цих концентрацій залишається сталою величиною.
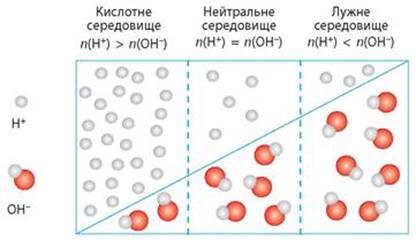
Рис. 1.32. Вміст йонів Гідрогену та гідроксид-йонів у
кислому, нейтральному, лужному середовищах Таким чином: ► у
нейтральному середовищі: [H+] = [OH –] = 10–7 моль/л; ► у
кислому середовищі: [H+]>[OH-], тобто [H+]=10–6, 10–5, 10– 3… моль/л; ► у
лужних розчинах концентрація йонів Гідрогену менше за 10-7 моль/л,
тобто [H+] = 10 –8, 10 –9,
10 –10, 10 –11, 10 –12 … моль/л. Значно зручніше оперувати не концентрацією йонів Гідрогену, яка
виражається малим дробовим числом, а показником степеня концентрації йонів
Гідрогену. На початку ХХ ст. було запропоновано концентрацію йонів Гідрогену
виражати за степеневим показником, тобто як логарифм концентрації йонів
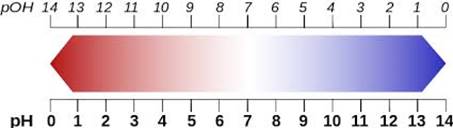
Гідрогену, узятий з оберненим знаком, і позначати символом рН (водневий показник).
Аналогічно вміст
гідроксид-йонів виражають через показник степеня концентрації гідроксид-йонів
– рОН: рОН = – lg [ОH–].
Рис. 1.33. Шкала співвідношення рН та рОН Водні розчини
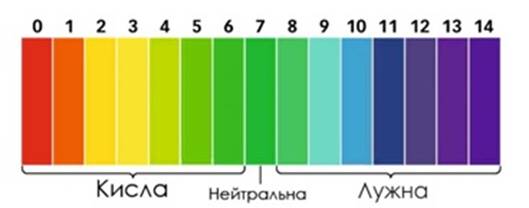
бувають кислі, нейтральні, лужні. ►Для
нейтрального розчину [H+]=10-7 моль/л,
рН = - lg 10–7 = 7. ►Для кислого
розчину [H+]>10-7
моль/л (10-6, 10-5, 10-4 тощо), рН – 6, 5, 4, 3, 2, 1, 0. ►Для лужного
розчину [H+]<10–7 моль/л (10-8,
10-9, 10-10 тощо), рН
– 8, 9, 10, 11, 12, 13,14. Залежність між
концентрацією йонів Гідрогену (моль/л) і рН
ілюструє табл. 1.2. Таблиця 1.2 Залежність між концентрацією йонів Гідрогену і рН
середовища
Рис. 1.34. Шкала рН Для практичного
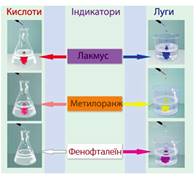
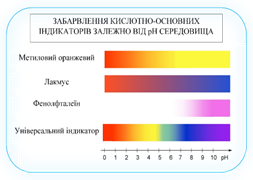
визначення рН розчинів користуються
індикаторами.
Індикаторний метод визначення рН
ґрунтується на тому, що різні індикатори за різних значень рН неоднаково змінюють своє
забарвлення: метиловий
оранжевий змінює своє
забарвлення в інтервалах рН =
3,1…4,4, лакмус – в інтервалах
5,0…8,0, фенолфталеїн – в інтервалах 8,0…10,0.
Рис. 1.35. Зміна забарвлення
кислотно-основних індикаторів залежно від рН-середовища
Існують індикатори, які мають властивість змінювати
свій колір за послідовної зміни рН.
Це такі індикатори, як м-нітрофенол,
n-нітрофенол тощо, які можна
використовувати для кількісного визначення рН.
Рис. 1.36. Колориметричний
метод аналізу Для визначення рН
користуються й потенціометричним
методом. Він базується на
вимірюванні електродного потенціалу водневого, хінгідронного, скляного електродів,
які перебувають у рівновазі з йонами Гідрогену. Для цього використовують
прилади, які називають рН-метрами.
1.1.5.3. Приклади розрахунку рН для
розчинів кислот і основ Для розчину одноосновної сильної кислоти концентрацію йонів Гідрогену та її кислотність
розраховують за рівняннями:
де Для концентрованих розчинів розраховують водневий показник, виражений через активність йонів
Гідрогену:
Для сильних
однокислотних основ концентрація йонів H+
визначається за рівняннями:
де Концентрацію йонів
Гідрогену в розчинах одноосновної слабкої кислоти розраховують за рівнянням:
де Водневий показник
таких кислот визначається за рівнянням:
де Для слабких однокислотних основ
де Водневий показник
слабких основ розраховується за рівнянням:
де . Приклад 1. Розрахуйте рН розчину нітратної кислоти концентрацією
0,05 моль/л. Розв’язання: нітратна кислота – одноосновна, сильна, дисоціює в
розчині повністю:
Концентрація йонів
Гідрогену дорівнюватиме концентрації кислоти:
Приклад 2. Розрахуйте рН розчину оцтової кислоти – СН3СООН з
концентрацією 0,2 моль/л. КД = 1,8·10-5. Розв’язання: оцтова кислота є слабким електролітом. Скористаємося формулою (1.4): Приклад 3. Розрахуйте рН розчину калій гідроксиду з концентрацією
лугу 0,2 моль/л. Розв’язання: калій гідроксид – сильна основа, дисоціює повністю. Концентрація йонів
гідроксилу дорівнюватиме концентрації лугу:
Приклад 4. Розрахуйте рН розчину амоній гідроксиду з концентрацією 0,1 моль/л. КД
= 1,8·10-5. Розв’язання: за формулою (1.16)
Контрольні питання 1. До яких електролітів
належить вода та як вона дисоціює? 2. Як можна обчислити концентрацію недисоційованих молекул води? 3. Як змінюється значення йонного добутку води залежно від температури? 4. Чому реакцію середовища розчину визначають за показником рН? 5. За допомогою яких методів визначають рН розчинів?
Розглянемо чотири
типи солей залежно від сили кислоти та основи, якими вони утворені.
Рис. 1.38. Типи солей за здатністю до
гідролізу Розчини солей можуть викликати різну реакцію середовища, залежно від того, до якого типу вони належать.
Причина такої
взаємодії полягає в можливості утворення під час хімічної реакції слабких електролітів.
До гідролізу
здатні солі, що утворені слабкою кислотою і сильною основою, сильною кислотою
і слабкою основою та слабкою кислотою і слабкою основою. Солі,
утворені сильною кислотою і сильною основою (наприклад, Кількісно гідроліз характеризують, як і процес дисоціації, двома
величинами: 1) ступенем гідролізу 2) константою гідролізу Перебігу гідролізу сприяє розведення розчину та його нагрівання.
1.1.6.2. Гідроліз солей різних типів Гідроліз солі, утвореної одноосновною слабкою кислотою та сильною основою Гідроліз таких
солей можна представити реакціями в молекулярній та йонно-молекулярній
формах:
pH >7, середовище лужне. Константу і
ступінь гідролізу солей цього типу розраховують за рівняннями:
Як результат гідролізу
в розчині накопичуються йони OH-, змінюючи кислотність середовища.
При цьому
Таким чином, рН розчину зростає зі збільшенням
концентрації солі та величини Гідроліз солі, утвореної двохосновною слабкою кислотою та сильною основою Гідроліз солей дво- та багатоосновних кислот ускладнюється тим, що
відповідно до ступінчастої дисоціації останніх процес гідролізу також
відбувається ступінчасто. Наприклад, гідроліз солі перший ступінь:
другий ступінь:
Солі цього типу гідролізують переважно за першим ступенем,
що випливає з порівняння констант дисоціації кислоти за першим та другим
ступенями. Гідроліз за другим ступенем майже не здійснюється, оскільки вже на
першому ступені утворюється більш слабка кислота
Константу
гідролізу солей цього типу розраховують за рівнянням:
де Ступінь гідролізу
визначають за рівнянням:
Кислотність
розчину такої солі обчислюють за рівняннями:
Гідроліз кислої солі, утвореної слабкою кислотою та сильною основою Схема гідролізу:
Константу та
ступінь гідролізу цих солей розраховують за рівняннями:
де Кислотність
розчину солі визначають за рівняннями:
Гідроліз солі, утвореної слабкою основою та сильною кислотою Гідроліз таких
солей можна представити реакціями в молекулярній та йонно-молекулярній
формах:
pH < 7, середовище кисле. Схема гідролізу
цих солей у загальному вигляді:
У процесі гідролізу таких солей у розчині накопичуються йони Гідрогену. Кислотність розчину розраховують за рівняннями:
Константу та
ступінь гідролізу визначають за рівняннями:
Гідроліз солі, утвореної слабкою кислотою та слабкою основою Гідроліз таких солей
можна представити реакцією в молекулярній формі
Такі реакції є майже необоротними, оскільки під час їх перебігу
утворюються два слабких електроліти. Схема гідролізу:
Константа
гідролізу такої солі дорівнює:
Ступінь гідролізу
розраховують за рівнянням:
Водневий показник
середовища визначають за рівняннями:
1.1.6.3. Приклади розрахунку рН розчину,
константи і ступеня гідролізу солі Приклад 1. Розрахуйте ступінь гідролізу та рН розчину натрій ацетату концентрацією
0,1 моль/л. КД (СН3СООН) = 1,86·10-5. Розв’язання: за формулою (1.18) розрахуємо
константу гідролізу:
Ступінь гідролізу
розрахуємо за формулою (1.19):
Концентрацію
катіонів Гідрогену розрахуємо за формулою (1.20):
Розрахуємо рН:
Приклад 2. рН розчину натрієвої солі слабкої одноосновної кислоти з концентрацією
0,2 моль/л дорівнює 10. Розрахуйте константу і ступінь гідролізу солі. Розв’язання: Щоб розрахувати константу й ступінь гідролізу солі, утвореної слабкою
кислотою і сильною основою, слід визначити константу дисоціації кислоти за
рівнянням (1.23): Оскільки рН=10, то
Константа
гідролізу дорівнює: . Ступінь гідролізу
– за рівнянням (1.19):
Контрольні питання 1. Від чого залежить реакція
середовища розчину солі та чим вона зумовлена? 2. Які солі не вступають у реакцію гідролізу? 3. Які величини характеризують кількісно гідроліз? 4. Які чинники сприяють
перебігу гідролізу? 5. Як відбувається гідроліз солей, утворених багатоосновною слабкою кислотою
та сильною основою? 7. Чому гідроліз солі, утвореної слабкою основою і слабкою кислотою, є майже
необоротним?
В аналітичній практиці часто виникає потреба
підтримувати постійне значення рН системи. Для цього використовують буферні суміші (або буферні розчини).
Рис. 1.39. Суміші буферних систем Прикладом таких
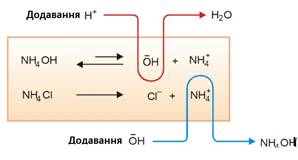
розчинів є амоніачна буферна суміш (суміш Буферні суміші мають такі характеристики: ►1. Постійний рівень рН, який забезпечує ця
буферна суміш. ►2. Межі рН, у яких може підтримуватись його
сталість. ►3. Буферна ємність, тобто кількість речовини
(моль) сильної кислоти або основи, яку слід додати до буферного розчину
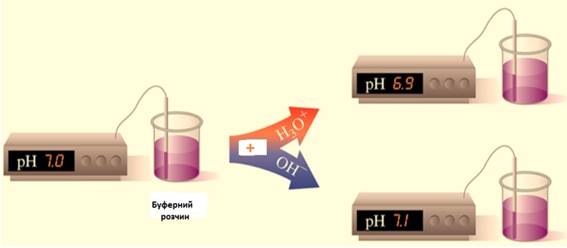
об’ємом 1 л, щоб його рН змінилося на 1. Уразі введення до
буферної суміші розчину сильної кислоти або сильної основи змінюється
концентрація слабкої кислоти або основи, проте рН буферного розчину практично
не змінюється. Це пояснюється тим, що слабка кислота
або слабка основа взагалі мало дисоціює, а за наявності однойменних йонів її
солі дисоціація буде ще менш відчутною. Розведення розчину не впливає на його
рН, оскільки водневий показник залежить лише від співвідношення концентрацій
солі (Ссолі) та кислоти (Скислоти) і не
залежить від ступеня розведення.
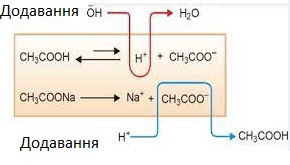
Рис. 1.40. Введення до буферної суміші розчину сильної кислоти або сильної основи 1.1.7.2. Механізм дії буферного розчину Розглянемо
регулювальний механізм буферного розчину. Його дія базується на зміщенні
рівноваги, яка в ньому встановлюється. Це може бути наведено на прикладі
ацетатного буферного розчину. Додавання до цієї суміші
сильної кислоти призводить до зміщення хімічної рівноваги праворуч:
Тобто відбувається
зв’язування катіонів Гідрогену і збільшення концентрації слабкого електроліту
– оцтової кислоти. Якщо до цієї суміші додати луг, то це призведе до зміщення хімічної
рівноваги праворуч:
У цьому випадку
відбувається зв’язування гідроксильних йонів і утворення води.
Для кислотного буферного
розчину (наприклад, ацетатного), утвореного слабкою кислотою та її сіллю,
кислотність обчислюють за рівняннями:
Для основного
буферного розчину, утвореного слабкою основою та її сіллю (наприклад, амоніачного),
кислотність розраховують за рівняннями:
Приклад 1. Амоніачна буферна суміш складається з 0,28 моль NH4Cl і 0,07
моль NH3. Розрахувати рН
цієї буферної суміші. Розв’язання: за формулою (1.35):
Контрольні питання 1. Яке значення буферних розчинів в аналітичній практиці? 2. Визначити характеристики буферних сумішей. 5. В який бік зміщується хімічна рівновага у разі додавання до ацетатної
буферної суміші розчину лугу?
1.2. Хімічна рівновага в гетерогенних
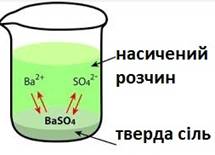
системах У насичених розчинах малорозчинних електролітів, наприклад
Перехід йонів у
розчин і зворотний процес – проникнення йонів у кристалічну структуру твердої
фази – відбуваються лише на його поверхні.
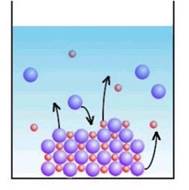
Рис. 1.44. Процеси на поверхні твердої
фази У таких умовах на підставі закону діючих мас стан рівноваги залежить лише
від добутку концентрації йонів. Ця величина для цього малорозчинного електроліту є сталою.
Добуток розчинності являє собою константу рівноваги гетерогенної системи, що
складається з твердої фази малорозчинної речовини та її насиченого розчину.
Для барій сульфату вираз добутку розчинності має вигляд:
Ця величина є довідниковою
й за температури 25 0С становить . У більш точних розрахунках враховують не концентрацію йонів, а їх
активність:
Для розрахунків, що не вимагають високої точності,
можна користуватися добутком концентрації йонів у насиченому розчині
малорозчинної речовини. Добуток
розчинності дає можливість розрахувати його розчинність в молях на літр
(моль/л). Якщо для барій сульфату концентрацію йонів Для малорозчинної сполуки
Вираз для добутку
розчинності має вигляд:
Вираз для
розчинності таких сполук описується рівнянням:
1.2.1.2. Приклади розрахунку добутку
розчинності та розчинності малорозчинних електролітів Приклад 1. Визначте добуток розчинності стронцій карбонату, якщо його розчинність
за 25 0С дорівнює 0,001554 г/л. Розв’язання: визначимо розчинність Стронцій карбонат
дисоціює за схемою Виходячи з
рівняння дисоціації, одержуємо формулу добутку розчинності: Приклад 2. Розрахуйте розчинність арґентум ортофосфату (моль/л). Розв’язання: за формулою ( 1.38 ) :
Контрольні питання 2. Від чого залежить стан рівноваги в гетерогенних системах на підставі
закону діючих мас? 3. Що називається добутком розчинності? 4. Які величини враховують замість концентрації йонів у більш точних
розрахунках добутку розчинності? 5. Яку властивість електроліту характеризує добуток розчинності?
1.2.2. Утворення й розчинення осадів Відомості про добуток розчинності дозволяють прогнозувати можливість утворення та розчинення
осадів. При цьому користуються правилом: Для електроліту,
що утворює осад складу ► якщо ► якщо ► якщо Приклад 1. Розрахуйте, чи буде утворюватися осад за змішування
рівних об’ємів розчинів Плюмбум(ІІ) ацетату з концентрацією солі 0,05 моль/л
та калій хлориду з концентрацією солі 0,5 моль/л? Розв’язання: 1. За змішування
однакових об’ємів розчинів концентрація і одної, й другої солі зменшиться
вдвічі. І концентрація йонів відповідно:
2. Добуток
концентрації йонів у цьому випадку дорівнює:
Ця величина значно
перевищує добуток розчинності плюмбум (ІІ) хлориду, тому осад
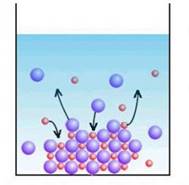
утворюватиметься. Малорозчинний
електроліт осаджується, доки йонний добуток, який постійно зменшується, не
буде дорівнювати добутку розчинності осаду. Після цього осадження
зупиняється, оскільки встановлюється динамічна рівновага між осадом і
розчином. Осадження малорозчинного електроліту вважають
повним, коли концентрація йонів у розчині не перевищує 10-6
моль/л, або 10-4 г/л. Це пояснюється межею точності аналітичних
терезів. Під час осадження малорозчинного
електроліту слід враховувати вплив однойменного йона на повноту його
осадження.
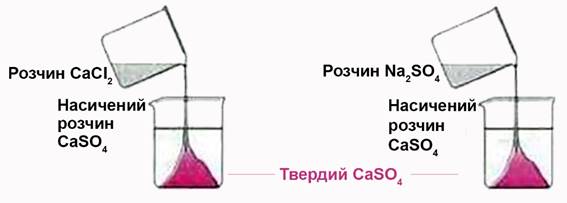
Наприклад, ДР(
Рис. 1.45. Найбільш повне осадження CaSO4 за додавання надлишку реактиву-осадувача Добуток
концентрації йонів 1.2.2.2. Дробове осадження йонів У практиці хімічного аналізу дуже часто роблять осадження суміші йонів, які
водночас утворюють малорозчинні сполуки з реактивом-осаджувачем.
Послідовність осадження йонів буде різною. У цьому випадку слід користуватися
правилом:
У методі аргентометричного
титрування застосовують хімічні реакції:
Величини їх
добутків розчинності становлять: ДР (AgCl) = 1,56 · 10-10; ДР (Ag2CrO4) = 9 · 10-10. Розрахуємо концентрацію
йонів Ag+, що необхідна
для осадження першої і другої малорозчинної солі. Наприклад, для концентрації
хлорид- і хромат-йонів, що дорівнюють 10-1 моль/л: для AgCl:
для Ag2CrO4:
Таким чином, насамперед в осад випадає арґентум хлорид, для якого добуток розчинності досягається за меншого
значення концентрації йонів Ag+.
Тільки після того, коли всі йони Cl-
будуть зв’язані в осад AgCl,
розпочне осадження йонів
Для керування
процесом розчинення осаду слід застосовувати правило: Наприклад: малорозчинний
магній гідроксид перебуває в рівновазі:
Зменшивши
концентрацію аніонів OH-,
збільшують розчинність магній гідроксиду. Цього можна досягти двома шляхами.
Додаванням кислоти:
Осад може бути
розчиненим і внаслідок інших процесів, наприклад комплексоутворення.
Контрольні питання 1. За яких умов утворюється осад малорозчинного електроліту? 2. Коли осадження малорозчинного електроліту вважають повним? 3. Яку кількість йона-осаджувача оптимально потрібно додати, щоб практично
повно осадити цей йон? 5. Що необхідно зробити для того, щоб розчинити
осад малорозчинного електроліту?
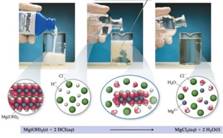
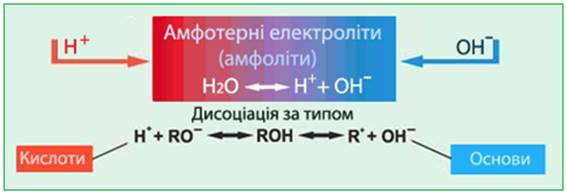
1.2.3. Амфотерні основи в хімічному
аналізі
Амфотерність притаманна оксидам деяких металів та їх основам. Амфотерні сполуки ще називають амфолітами.
Рис. 1. 49. Амфотерні сполуки (амфоліти) До типових
амфолітів належить вода, Zn(OH)2, Al(OH)3, Cr(OH)3, Sn(OH)2, Pb(OH)2 тощо. Амфотерні гідроксиди поєднують властивості основ і кислот.
Вони можуть вступати в реакцію нейтралізації як з кислотами, так і з основами і утворювати при цьому сіль і воду. Наприклад, цинк гідроксид розчиняється як у кислоті,
проявляючи при цьому основні властивості, так і в лугах, проявляючи
властивості кислот:
У другому рівнянні
формула калій цинкату записана спрощено, у розчинах лугів цинк гідроксид перетворюється
на розчинну комплексну сполуку – калій тетрагідроксоцинкат:
Рис. 1.50. Розчинення осаду Zn(OH)2
За сплавлення амфотерних основ з лугами утворюються негідратовані
продукти реакції. Наприклад, алюміній гідроксид за взаємодії з кристалічними лугами утворює
метаалюмінат:
Якщо подіяти
надлишком розчину лугу на алюміній гідроксид, то утворюється розчинна
комплексна сполука – натрій тетрагідроксоалюмінат:
За надлишку лугу
може утворитися і натрій гексагадроксоалюмінат: 1.2.3.2. Використання явища амфотерності в
якісному аналізі Амфотерність основ використовують в якісному аналізі для розділення сумішей йонів, для проведення якісних реакцій на катіони Al3+,Zn2+,Cr3+.
Амфотерні властивості гідроксидів цих катіонів покладено в основу
відокремлення йонів Al3+,Zn2+,Cr3+ від катіонів інших аналітичних груп. Якщо подіяти на ці катіони розчином лугу, то спочатку
вони всі осаджуються у вигляді гідроксидів:
За додавання до
осадів надлишку лугу вони розчиняються з утворенням йонів:
Алюмінат- і цинкат-йони можна перевести в катіони Al3+і Zn2+ за додавання кислоти:
або в йонному вигляді:
Контрольні питання 1. Для яких класів неорганічних сполук притаманні амфотерні властивості? 2. Які хімічні властивості характерні для амфотерних гідроксидів? 3. Які продукти реакції утворюються за сплавлення амфотерних основ з лугами? 4. Де в якісному аналізі використовують амфотерні властивості основ? 5. Яким чином можна перевести алюмінат- і цинкат-іони в катіони Al3+
і Zn2+?
1.3.1. Загальна характеристика та
номенклатура комплексних сполук 1.3.1.1. Характеристика комплексних
сполук У хімічному аналізі широко застосовують комплексні сполуки. Їх застосовують як у якісному,
так і в кількісному аналізі.
Будова і властивості
комплексних сполук була закладена швейцарським хіміком А. Вернером у 1893 році.
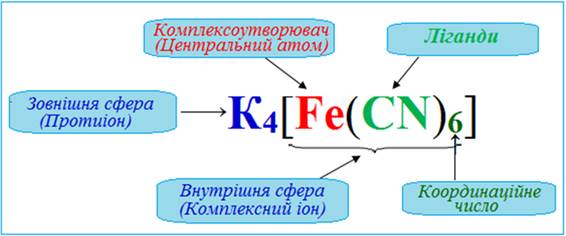
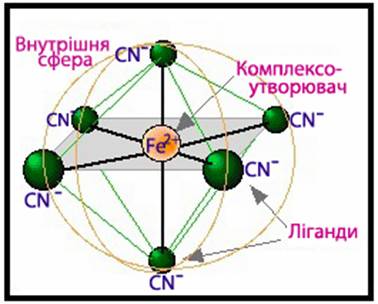
Рис. 1.53. Будова комплексної сполуки на прикладі K4[Fe(CN)6] Заряд комплексного йона визначається як алгебраїчна
сума заряду комплексоутворювача й заряду всіх лігандів:
За знаком заряду
розрізняють комплекси: катіонні -
аніонні -
нейтральні –
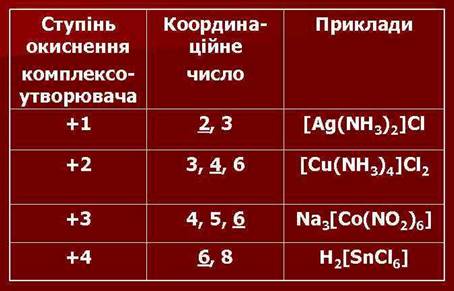
Комплексоутворювачами найчастіше бувають перехідні метали (d – елементи). Координаційне
число, що притаманне металу-комплексоутворювачу, значною мірою залежить від
заряду його йона.
Рис.
1.55. Залежність значення координаційного числа від
заряду комплексоутворювача Лігандами можуть бути прості йони: 1.3.1.2. Класифікація комплексних сполук Найбільш поширеною є класифікація комплексних сполук за
природою ліганду. Залежно від природи ліганду
комплексні сполуки поділяють на такі типи: ► аквакомплекси (ліганд – молекула
► амоніакати (ліганд – молекула
► гідроксокомплекси (ліганд – йони
► ацидокомплекси (лігад – кислотний залишок різних кислот):
Існують також циклічні (хелатні) комплекси, комплекси змішаного типу.
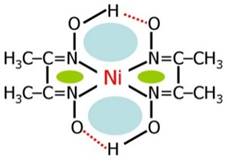
Біс(диметилгліоксимато)нікель (II) – малорозчинна комплексна сполука
яскраво-червоного кольору утворюється під час проведення реакції Чугаєва –
якісної реакції на катіони Ni2+ (за взаємодії солей
нікелю (ІІ) з диметилгліоксимом).
1.3.1.3. Номенклатура комплексних сполук Назва комплексних сполук регламентується Міжнародною спілкою
чистої та прикладної хімії (IUPAC). Згідно з правилами спочатку дається назва катіона, а потім аніона.
Назва комплексного йона утворюється за назвою ліганду із зазначенням їх числа
та назвою центрального атома-комплексоутворювача із вказівкою його ступеня окиснення (валентності). Для зазначення кількості лігандів використовують префікси:2 – ди; 3 –
три; 4 – тетра; 5 – пента; 6 – гекса. Якщо є декілька різних лігандів, то їх називають в
алфавітному порядку. Назви аніонних лігандів утворюють додаванням до назви
аніонів закінчення – о.
Наприклад:
Контрольні питання 1. Яке застосування комплексних сполук в аналітичній хімії? 2. У чому суть координаційної теорії будови комплексних сполук А.Вернера? 3. Які хімічні елементи найчастіше відіграють роль
комплексоутворювача? 4. Які розрізняють комплексні йони за знаком
заряду? 5. На які типи поділяють комплексні сполуки залежно
від природи ліганду?
1.3.2. Константа нестійкості комплексних
йонів 1.3.2.1. Дисоціація комплексних сполук Розчиняючись у
воді, комплексні сполуки дисоціюють таким чином, що внутрішня сфера (комплексний йон) веде
себе як єдине ціле і являє собою комплексний катіон або комплексний аніон:
Така дисоціація називається первинною і відбувається за
механізмом дисоціації сильних електролітів з йонним типом хімічного зв’язку.
1.3.2.2. Константа рівноваги комплексного
йона Як у випадку із
слабкими електролітами, дисоціація комплексних йонів може бути описана на
підставі закону діючих мас.
Розглянемо вираз для
константи нестійкості комплексного йона
Якщо порівняти цю
величину з константою нестійкості йона Процес дисоціації комплексного йона відбувається ступінчасто. Для кожної стадії можна визначити відповідну
константу дисоціації.
Контрольні питання 1. За яким механізмом відбувається первинна дисоціація комплексних сполук? 2. Як відбувається дисоціація внутрішньої сфери комплексної сполуки? 3. Що таке константа стійкості та як її визначають? 4. Від чого залежить стійкість комплексу? 5. Як відбувається процес дисоціації комплексного йона?
1.3.3. Реакції обміну в розчинах
комплексних сполук 1.3.3.1. Реакції йонного обміну та
заміщення лігандів Для комплексних сполук притаманні хімічні властивості, які мають кислоти,
основи, солі. Комплексні солі
вступають у реакції йонного обміну:
Остання хімічна
реакція застосовується в якісному аналізі для визначення йонів .
У розчинах комплексних сполук відбуваються реакції заміщення лігандів:
Реакції утворення
комплексних сполук застосовують для переведення в розчин малорозчинних
речовин:
Комплексоутворення використовують для маскування йонів, які заважають проведенню іншої якісної реакції. Наприклад, йони 1.3.3.3. Руйнування комплексів У деяких випадках у ході аналізу необхідно зруйнувати
комплекс. Це досягається
такими шляхами: ► осадженням металу-комплексоутворювача:
► утворенням більш міцних комплексів:
► термічним розкладанням комплексної
сполуки:
Контрольні питання 1. Чи притаманні для комплексних сполук хімічні властивості кислот, основ,
солей? 2. Яку реакцію використовують в якісному аналізі для визначення йонів Fe3+? 3. Яким чином відбувається заміщення лігандів у комплексних сполуках? 5. Яким чином досягається в хімічному аналізі руйнування комплексних сполук?
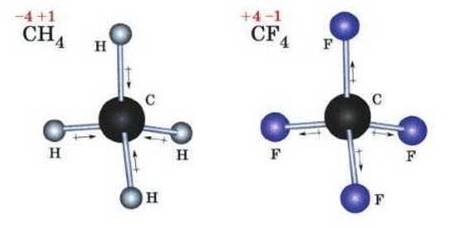
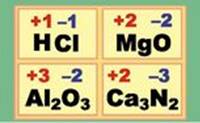
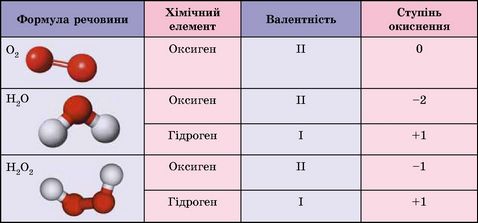
1.4.1. Ступінь окиснення Поняття про
ступінь окиснення використовується для класифікації речовин, складання формул
та рівнянь окисно-відновних реакцій.
Можна сказати, що ступінь
окиснення розраховується з припущення, що сполука складається тільки з йонів.
На відміну від валентності, ступінь окиснення може мати нульове, позитивне й
негативне значення.
Рис. 1.58. Ступінь окиснення елементів у
сполуці Для визначення
ступеня окиснення елемента в хімічній сполуці слід користуватися такими правилами: ►1. Ступінь
окиснення атомів у простих речовинах дорівнює нулю:
►2. У
сполуках лужні метали (Li, Na, K) мають ступінь окиснення +1. Елементи
головних підгруп 2-ї групи (Mg, Ca, Sr, Ba) мають у сполуках ступінь
окиснення +2. Алюміній у сполуках має ступінь окиснення +3. Ступінь окиснення
Оксигену в більшості сполук -2, за винятком пероксидів, у яких його ступінь окиснення дорівнює -1. Гідроген в
більшості сполук має ступінь окиснення +1, крім гідридів, у яких у нього ступінь окиснення -1 (наприклад: ►3.
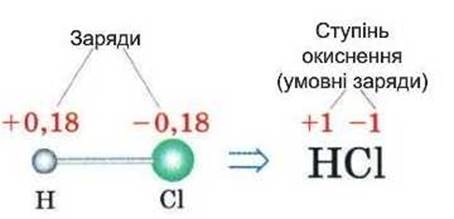
Алгебраїчна сума ступенів окиснення всіх атомів у сполуці дорівнює нулю.
Рис. 1.59. Заряди та ступінь окиснення
атомів у молекулі HCl Наприклад, слід
розрахувати ступінь окиснення Хлору в калій хлораті
Ступінь окиснення
розраховується на один атом. Наприклад, у сполуці ►4. Сума
ступенів окиснення елемента в йоні
Рис. 1.60. Моделі молекул метану та
карбон(IV) флуориду Багато хімічних елементів
мають змінний ступінь окиснення, що пояснюється особливістю будови їх атомів. 1.4.2. Сутність окисно-відновних реакцій
У процесі окиснення ступінь окиснення атому хімічного елемента зростає.
У процесі відновлення ступінь окиснення зменшується.
Рис. 1.61. Процеси окиснення та
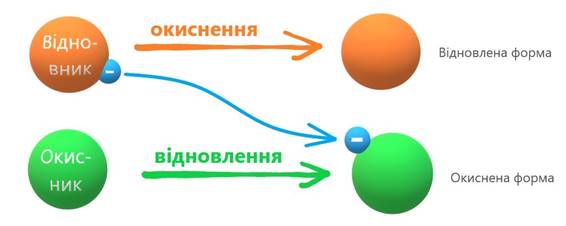
відновлення Відновна властивість елемента – це його здатність
віддавати електрони, а окисна властивість – приєднувати їх. Окиснення завжди супроводжується
відновленням і навпаки. Відновники в процесі віддавання електронів
окиснюються, а окисники під час приєднання електронів відновлюються.
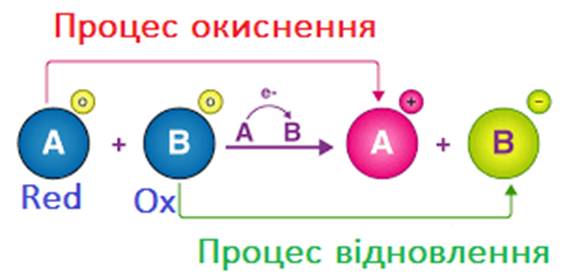
Окисно-відновні реакції ілюструють єдність двох протилежних процесів –
окиснення й відновлення.
Рис. 1.62. Схема окисно-відновної реакції
Окисниками є атоми
в таких ступенях окиснення, у яких вони здатні приєднувати електрони, тобто у
високих. Типовими
окисниками є галогени:
та інші.
Відновниками є
атоми і йони в таких ступенях окиснення, у яких вони можуть віддавати електрони.
Це атоми й молекули, негативні йони неметалів, позитивні йони металів у
проміжних ступенях окиснення. Типовими
відновниками є метали, молекули:
прості
речовини-неметали:
Складання рівнянь окисно-відновних
реакцій Розглянемо
найбільш простий метод складання окисно-відновних реакцій – метод
електронного балансу. ►1. Запишемо
схему хімічної реакції, наприклад:
►2. Над символами
хімічних елементів проставимо їх ступені окиснення й визначимо елементи, що
їх змінили в процесі хімічної реакції:
Ступінь окиснення
змінили елементи і ►3. Складемо
електронні схеми процесів окиснення і відновлення. Знайдемо найменше спільне
кратне для числа відданих та прийнятих електронів і підберемо на підставі цього
коефіцієнти так, щоб загальне число електронів, які віддає відновник і
приєднує окисник, було однаковим. Позначимо, окисник (Ox) і відновник (Red),
та процес окиснення та відновлення:
►4. Підставимо
коефіцієнти в рівняння хімічної реакції, при цьому коефіцієнт перед водою
поставимо в останню чергу:
►5. Перевіримо
правильність складання рівняння за кількістю атомів Оксигену в лівій та правій
частині рівняння. У нашому випадку кількість атомів Оксигену в лівій і правій
частині рівняння дорівнює 40. 1.4.3. Окисно-відновний потенціал.
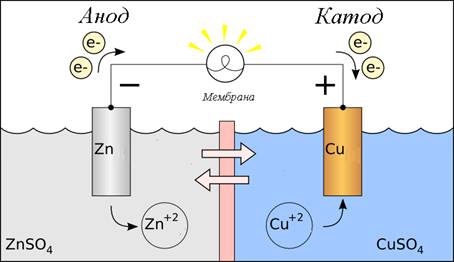
Напрямок окисно-відновних реакцій Під час занурення
металу в розчин своєї солі виникає подвійний електричний шар. Пластинка
металу й розчин утворюють єдину окисно-відновну систему, що характеризується
певним електродним потенціалом (Е).
Рис. 1.63. Схема гальванічного елемента Стрибок потенціалу
виникає також на межі з’єднань двох металів, на межі двох рідин, які не
змішуються між собою, або між розчинами різної концентрації, які розділені
напівпроникною мембраною. У випадку металу,
зануреного у розчин його солі, величина електродного потенціалу залежить від
природи металу та від активності (концентрації) його йонів у розчині. Значення
електродного потенціалу розраховують за рівнянням Нернста:
де Е0
– стандартний електродний потенціал, коли активність йонів дорівнює одиниці; R – універсальна газова стала (R=8,31
Дж"моль-1"К-1); T – температура, К; F – число Фарадея (F = 96500
Кл/моль); n – заряд йона; a – активність йона.
Для достатньо розведених
розчинів активність йонів можна замінити концентрацією (моль/л). Для
температури 298 К (25 0С) рівняння Нернста у разі переходу
від натурального логарифма до десяткового набуває вигляду:
Для обчислення електродного
потенціалу Е необхідно знати
величину стандартного електродного потенціалу Е0.
Виміряти абсолютну
величину стандартного електродного потенціалу неможливо. Тому вимірюють
стандартний електродний потенціал відносно потенціалу стандартного водневого електроду,
який приймають за нуль. Для цього складають гальванічний елемент із електрода, стандартний потенціал якого вимірюється,
і стандартного електрода (електрода порівняння). Як стандартний електрод
застосовують водневий електрод, потенціал якого приймають за нуль.
Водневий електрод є платиновою пластинкою, що покрита порошком платини
(платиновою черню), яка занурена в розчин сульфатної кислоти з концентрацією
1 моль/л і омивається струмом чистого водню за нормального тиску (101325 Па). Відносно
потенціалу стандартного водневого електрода всі стандартні потенціали
металічних електродів будуть позитивними або негативними. Якщо розташувати
метали за порядком зростання їх стандартних електродних потенціалів Е0, то отримаємо ряд,
відомий під назвою ряд стандартних електродних потенціалів (електрохімічний ряд напруги):
Рис. 1.66. Електрохімічний ряд напруг
металів Знаючи стандартний
потенціал металу, можна розрахувати за рівнянням Нернста його електродний
потенціал за будь-якої концентрації йонів у розчині. За величиною стандартного
потенціалу можна визначити напрямок окисно-відновної реакції.
При цьому пара з більшим
значенням стандартного електродного потенціалу буде окисником, а з меншим –
відновником. Наприклад, для
визначення можливості перебігу окисно-відновної реакції:
скористаємося значеннями
стандартних електродних потенціалів: Оскільки У загальному
вигляді можна зробити такий висновок.
Окисно-відновні реакції широко застосовуються в якісному аналізі для
визначення та відокремлення йонів та в кількісному титриметричному аналізі.
Контрольні питання 2. Як змінюється ступінь окиснення елементів у процесі окиснення? 3. Як змінюється ступінь окиснення елементів у
процесі відновлення? 4. Що таке відновна властивість елемента? 5. Що являє собою стандартний водневий електрод? 6. Які чинники впливають на перебіг окисно-відновних реакцій? 7. Де застосовують окисно-відновні реакції в хімічному аналізі?
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||








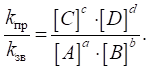
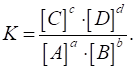
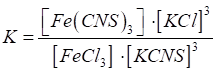








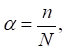



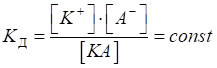
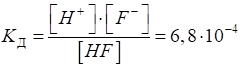
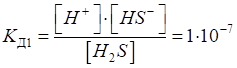

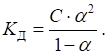


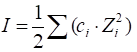
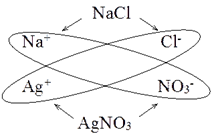





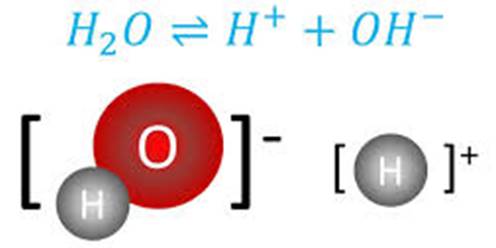
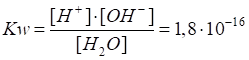






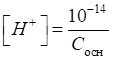
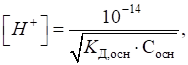
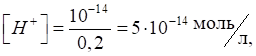
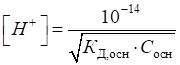
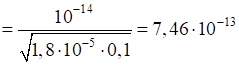 моль/л;
моль/л;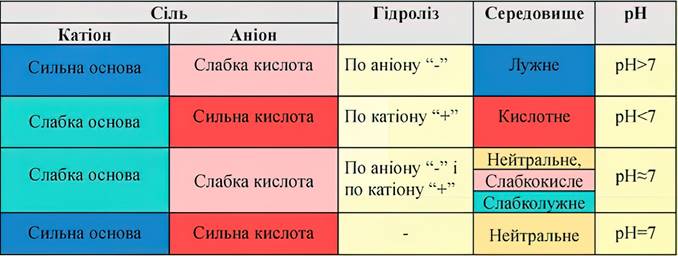
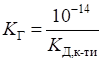 , (1.18)
, (1.18)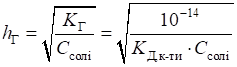 . (1.19)
. (1.19)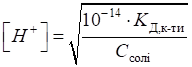
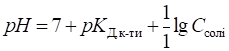 .
.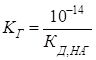
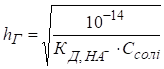
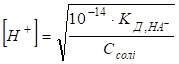
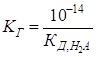
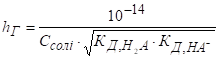
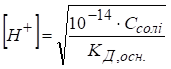
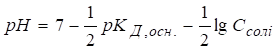
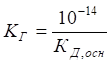
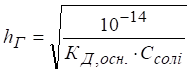
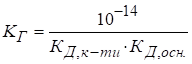
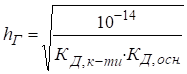
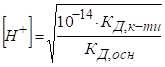
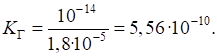
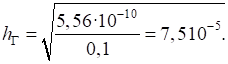
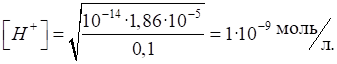
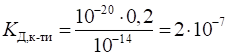 .
.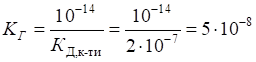
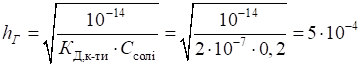


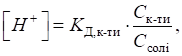
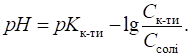
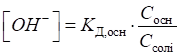 ,
,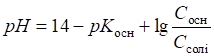
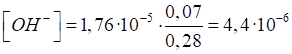
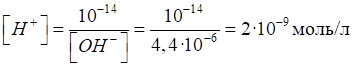
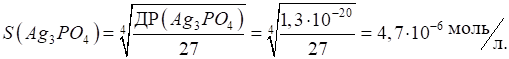


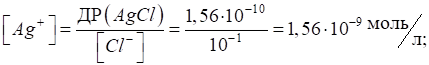
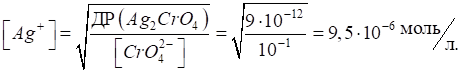










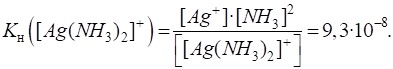
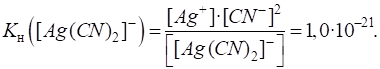

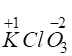 . Якщо позначити невідомий ступінь окиснення Хлору через x, то можна скласти рівняння:
. Якщо позначити невідомий ступінь окиснення Хлору через x, то можна скласти рівняння: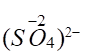 дорівнює заряду йона. Наприклад, слід розрахувати ступінь
окиснення Сульфуру в сульфат-йоні . Сума всіх ступенів окиснення в цьому йоні
буде дорівнювати його заряду (-2). Складемо алгебраїчне рівняння:
дорівнює заряду йона. Наприклад, слід розрахувати ступінь
окиснення Сульфуру в сульфат-йоні . Сума всіх ступенів окиснення в цьому йоні
буде дорівнювати його заряду (-2). Складемо алгебраїчне рівняння: