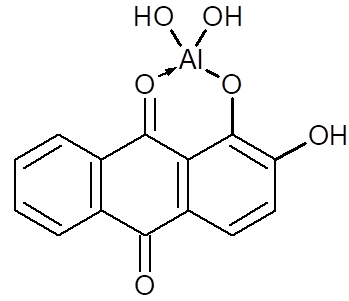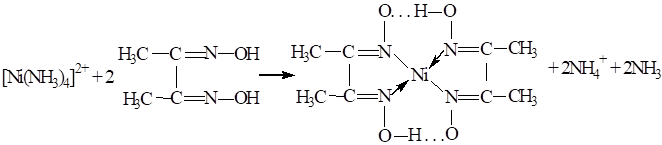|
|
|
АНАЛІТИЧНА ХІМІЯ Електронний посібник |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
РОЗДІЛ 2. ЯКІСНИЙ АНАЛІЗ НЕОРГАНІЧНИХ СПОЛУК |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2.1
Загальні положення якісного аналізу 2.1.1. Методи якісного
аналізу 2.1.2.
Аналітичні реакції, їх чутливість та селективність 2.1.3. Дробний
та систематичний аналіз 2.1.4.
Лабораторний посуд та реактиви в якісному аналізі 2.2.1.
Аналітична класифікація катіонів 2.2.1.1. Сірководневий метод класифікації катіонів 2.2.1.2. Амонійно-фосфатний метод класифікації катіонів 2.2.1.3.
Кислотно-основна класифікація катіонів 2.2.2.
Аналіз катіонів першої групи 2.2.2.1. Загальна характеристика катіонів першої групи 2.2.2.4. Реакції катіонів NH4+ 2.2.2.5. Систематичний хід аналізу суміші катіонів першої групи 2.2.3.
Аналіз катіонів другої групи 2.2.3.1. Загальна характеристика катіонів другої групи 2.2.3.2. Дія групового реагенту на катіони другої групи 2.2.3.4. Реакція катіонів Pb2+ 2.2.3.5. Систематичний хід аналізу суміші катіонів другої групи 2.2.4.
Аналіз катіонів третьої групи 2.2.4.1. Загальна характеристика катіонів третьої групи 2.2.4.2. Дія групового реагенту на катіони третьої групи 2.2.4.3. Реакція катіонів Ba2+ 2.2.4.4. Реакція катіонів Сa2+ 2.2.4.5. Систематичний хід аналізу суміші катіонів третьої групи 2.2.5.
Аналіз катіонів четвертої групи 2.2.5.1. Загальна характеристика катіонів
четвертої групи 2.2.5.2. Дія групового реактиву на
катіони четвертої групи 2.2.5.3. Реакція катіонів Zn2+ 2.2.5.4. Реакція катіона Al 3+ 2.2.5.6. Систематичний хід аналізу суміші
катіонів четвертої групи 2.2.6.
Аналіз катіонів п’ятої групи 2.2.6.1. Загальна характеристика катіонів п’ятої групи 2.2.6.2. Дія групового реактиву на
катіони п’ятої групи 2.2.6.7. Систематичний хід аналізу суміші
катіонів п’ятої групи 2.2.7. Аналіз катіонів
шостої групи 2.2.7.1. Загальна характеристика катіонів
шостої групи 2.2.7.2. Дія групового реактиву на
катіони шостої групи 2.2.7.6. Систематичний хід аналізу суміші
катіонів шостої групи 2.3.1.
Аналітична класифікація аніонів 2.3.2.
Аналіз аніонів першої групи 2.3.2.1. Загальна характеристика аніонів
першої групи 2.3.2.2. Якісні реакції на аніони першої
групи 2.3.2.3. Аналіз суміші аніонів першої
групи 2.3.3.
Аналіз аніонів другої групи 2.3.3.1. Загальна характеристика аніонів
другої групи 2.3.3.2. Якісні реакції на аніони другої
групи 2.3.3.3. Аналіз суміші аніонів другої
групи 2.3.4. Аналіз аніонів
третьої групи 2.3.4.1. Загальна характеристика аніонів
третьої групи 2.3.4.2. Якісні реакції на аніони третьої
групи 2.3.4.3. Аналіз суміші аніонів третьої
групи 2.4. Аналіз
невідомої речовини 2.4.1. Підготовка речовини
до аналізу. Попередній аналіз 2.4.1.1. Підготовка
речовини до аналізу 2.4.1.2. Попередні дослідження невідомої речовини 2.4.2. Систематичний
хід аналізу катіонів та суміші аніонів 2.4.2.1. Виявлення катіонів у розчині 2.4.2.2. Виявлення аніонів у розчині 2.1 Загальні положення якісного аналізу 2.1.1. Методи якісного аналізу
► утворенням осаду; ► виділенням газу; ► зміною забарвлення розчину; ► появою характерного запаху; ► зміною агрегатного стану речовини.
Розв’язання аналітичної задачі здійснюється шляхом виконання аналізу
речовини. За термінологією
IUPAC під аналізом
розуміють добування дослідним шляхом даних про хімічний склад речовини. Аналіз
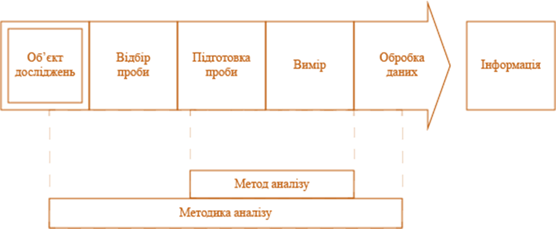
складається з декількох стадій (рис. 2.2).
Рис. 2.2. Схематичне відображення понять «метод аналізу» та «методика аналізу» Результат аналізу
може бути правильним тільки в тому випадку, якщо проба була представницькою,
тобто точно відображала склад об’єкта, з якого вона була відібрана. Для
виконання аналізу вибирають зазвичай невелику порцію речовини, яка залежить
від обраної методики аналізу.
Залежно від
кількості досліджуваної речовини, об’єму розчину методи аналізу класифікують
так (табл. 2.1). Таблиця 2.1 Класифікація методів аналізу за розміром проби
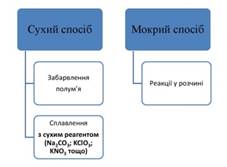
За способом
проведення аналітичні реакції виконують «сухим» та «мокрим» методами.
У разі виконання
аналізу сухим методом зразок речовини вносять в аналітичну частину полум’я пальника й за зміною кольору полум’я роблять висновок про наявність певного йона.
Наприклад: Натрій – жовтий колір; Калій – фіолетовий колір; Кальцій –
рожево-червоний колір; Барій – блідо-зелений колір; Купрум – зелений колір.
До сухих методів
відносять утворення забарвлених перлів бури з катіонами різних металів та
розтирання сухих сумішей досліджуваної речовини та реагенту.
Проводити реакції
мокрим методом запропонував у 1920 році М. О. Тананаєв, використовуючи
крапельні реакції, що відбуваються з утворенням осадів та забарвлених сполук.
Такі реакції
проводять на пластинках, фільтрувальному папері та у мікропробірках.
2.1.2. Аналітичні
реакції, їх чутливість та селективність
У хімічних методах
якісного аналізу елемент, що його визначають, чи йон переводять у будь-яку
сполуку, яка має характерні властивості, за якими можна встановити, що
утворилась саме ця сполука. У якісному аналізі використовують характерні
аналітичні реакції, що супроводжуються певним зовнішнім аналітичним
ефектом – появою або зникненням забарвлення, осаду, характерного запаху, зміною
агрегатного стану речовини. Не всі хімічні реакції
можуть задовольняти вимоги, які дають їм право вважатися аналітичними. Вимоги до аналітичних реакції: ► мають
відбуватися з високою швидкістю, майже миттєво; ►
відбуватися до кінця (бути необоротними); ► супроводжуватися
зовнішнім ефектом (зміною забарвлення, виділенням осаду, утворенням газу); ►
відрізнятися високою чутливістю та специфічністю.
Що меншу кількість
йонів можна визначити за допомогою хімічної реакції, то вона більш чутлива.
Кількісно
чутливість реакції характеризується відкриваним мінімумом (межею визначення).
Реакції поділяють
на специфічні та селективні. Наприклад, якісною реакцією на йони амонію є
взаємодія з лугом:
Ця реакція
відбувається в присутності інших йонів, тобто вони їй не заважають. Але є дуже
багато хімічних реакцій, перебігу яких інші йони заважають. Наприклад, йони Наприклад, амоній оксалат утворює білі осади з катіонами Ca2+, Ba2+, Sr2+:
Що менша кількість
таких йонів, то більш виражена селективність реакції. Умови перебігу аналітичних реакцій ►1. Температура розчину Деякі якісні реакції вимагають нагрівання реакційної
суміші, а деякі виконують за охолодження, наприклад під струмом холодної
води. Вважається, що такі
реакції ведуть «на холоді».
►2. Концентрація реагуючих речовин Якщо концентрація речовин дуже мала, йон може не давати
аналітичного ефекту, тому при цьому слід враховувати відкриваний мінімум.
►3. Реакція середовища Реакція середовища
(рН) є важливим
чинником, який слід враховувати під час проведення якісних реакцій.
Наприклад, йон Ca2+ не можна відкрити
амоній оксалатом в присутності сильної кислоти. А білий осад AgCl добре розчиняється
в амоніачному розчині. 2.1.3. Дробний та систематичний аналіз У якісному аналізі є небагато специфічних реакцій тому
для виявлення йонів застосовують вибіркові, або селективні, реакції, які
вимагають усунення впливу інших речовин, що заважають визначенню. Цього
досягають розділенням суміші йонів на певні групи, і це розділення виконують
так, щоб йони, що заважають виявленню інших, потрапили в різні групи. Залежно
від способу виконання реакцій виявлення йонів розрізняють дробний та систематичний методи аналізу.
Дробний
аналіз набув застосування в промислових та агрохімічних лабораторіях,
особливо в тих випадках, коли склад об’єкта дослідження відомий і вимагає
лише підтвердження. Якщо вплив сторонніх йонів значний або склад речовини зовсім невідомий – виконують
систематичний аналіз.
Наприклад, у
розчині містяться йони Ca2+ і Ba2+. Катіон Ca2+ визначають за реакцією утворення білого осаду кальцій
оксалату:
Ця реакція
достатньо чутлива, але не специфічна. Йони Ba2+ дають аналогічний осад. Тому перш ніж визначати
катіони Ca2+, необхідно визначити в розчині катіони Ba2+, наприклад за реакцією:
Після цього йони Ba2+ відокремлюють надлишком
реактиву-осаджувача (K2CrO4) і тільки потім визначають у розчині катіони Ca2+. 2.1.4. Лабораторний посуд та реактиви в якісному
аналізі У лабораторії
якісного аналізу для проведення аналітичних операцій користуються різними
видами хімічного посуду та обладнання. Штатив з набором реактивів у реактивних склянках має всі необхідні розчини реактивів та сухі
речовини для проведення аналізу напівмікрометодом. Зручно користуватись
склянками об’ємом 20-50 мл. Вони містять піпетки, що дозволяє проводити
реакції крапельним методом. Такі склянки розміщують у визначеному порядку в
штативі для реактивів. Кожен такий штатив є стаціонарним на робочому місці й
служить для індивідуальної роботи. Реактиви, що швидко
розкладаються під час зберігання, отруйні, ті, що мають неприємний запах,
концентровані кислоти та розчин амоніаку зберігають у спеціальних склянках
з ковпачком під витяжною шафою.
Для реактивів
спеціального призначення, індикаторів, розчину крохмалю, органічних реагентів використовують
крапельниці
Страшейна та Шустера.
Для проведення
аналітичних реакцій користуються пробірками. Пробірки бувають
звичайні та центрифужні.
Для промивання осадів користуються пластиковими або
скляними промивалками.
Нагрівальні прилади Для нагрівання
речовин та для виконання реакцій забарвлення полум’я використовують
спиртівки, газові пальники Бунзена та Теклю.
Хімічні реактиви для проведення аналізу розрізняють за ступенем чистоти (табл. 2.2). Таблиця 2.2 Класифікація реактивів за ступенем чистоти
Вимоги до чистоти хімічних
реактивів регламентує державний стандарт. Майже всі реактиви,
що їх застосовують для аналізу, повинні мати марку ч.д.а. або х.ч.
Контрольні питання 1. Які хімічні реакції можуть використовуватися для
виконання якісного аналізу? 2. Яким шляхом розв’язують аналітичну задачу? 3. Визначити та пояснити вимоги до аналітичних
реакцій. 4. Які якісні реакції є специфічними? 5. Які умови впливають на перебіг аналітичних
реакцій та слід враховувати під час якісного аналізу? 6. Що покладено в основу виявлення йонів дробним
аналізом та які межі його застосування? 7. Яким способом виконують виявлення йонів
невідомої речовини? 8. Як зберігають у лабораторії отруйні реактиви та
ті, що мають неприємний запах? 10. Яку марку повинні мати реактиви, що їх застосовують
для аналізу? 2.2.1. Аналітична класифікація катіонів 2.2.1.1.
Сірководневий метод класифікації катіонів Для систематичного аналізу застосовують декілька методів класифікації
катіонів: сірководневий, амоніачно-фосфатний, кислотно-основний. Історично першим був сірководневий
метод аналізу, запропонований в 1871 році М. О. Меншуткіним.
Таблиця
2.3 Класифікація
катіонів за сірководневим методом
Як групові реагенти в сірководневому методі
використовують амоній карбонат, амоній сульфід, хлоридну кислоту, сірководень
та амоній полісульфід. У процесі аналізу для осадження застосовують й інші
речовини – сульфатну кислоту, луг, амоніак, хромат-, фосфат-йони, натрій
тіосульфат та ін. Головним недоліком цього методу є застосування
високотоксичного сірководню.
2.2.1.2. Амонійно-фосфатний метод класифікації катіонів Через отруйність сірководню останнім часом частіше застосовують амонійно-фосфатний метод, який ґрунтується на різній
розчинності фосфатів катіонів (табл. 2.4). Корисно
під час аналізу об’єктів, що містять фосфат-іон (ґрунту, добрива) без його
попереднього відділення. Таблиця 2.4 Класифікація катіонів за амонійно-фосфатним методом
2.2.1.3. Кислотно-основна класифікація
катіонів Кислотно-основний метод базується на різній
розчинності гідроксидів і деяких
солей, утворених цими катіонами й сильними кислотами (табл. 2.5). Таблиця 2.5 Поділ катіонів на аналітичні
групи за кислотно-основною класифікацією
Систематичний аналіз починають
з попередніх випробувань, які виконують переважно сухим способом з подальшим
розчиненням проби й визначенням деяких катіонів (NH4+, Fe2+, Fe3+ і т.д.) специфічними
реакціями. Потім дією К2СО3 або Na2СО3 на окремі порції розчину осаджують у вигляді
оксидів, гідроксидів, карбонатів і основних солей катіони ІІ-VI груп), а в
аналізованому розчині визначають іони Na+
і K+, спочатку
нейтралізувавши його за допомогою розчину CH3COOH. З окремої порції аналізованого
розчину осаджують катіони ІІ аналітичної групи дією розчином хлоридної
кислоти з концентрацією 2 моль/л. З отриманої порції центрифугату осаджують
катіони ІІІ аналітичної групи розчином сульфатної кислоти з концентрацією 1 моль/л у
присутності 3 % Н2О2. При цьому гідроксиди
катіонів V і VI груп
випадають в осад, а катіони І, IV груп залишаються у розчині.
Гідроксиди катіонів V і VI груп розділяють дією надлишку розчину
аміаку, які переводять гідроксиди катіонів VI аналітичної групи в розчинні
амоніакати.
Найбільш поширені катіони-представники відповідних аналітичних груп
(табл. 2.6). Таблиця 2.6 Спрощена класифікація катіонів
на аналітичні групи за кислотно-основною
класифікацією
Контрольні питання 1. Який метод аналізу катіонів є одним з найбільш
старих і обґрунтованих? 2. Що покладено в основу розділення катіонів на
аналітичні групи за сірководневим методом? 3. Чому сірководневий метод не використовують в
якісному аналізі катіонів? 4. На чому ґрунтується
амонійно-фосфатний метод аналізу катіонів? 5. Яка група катіонів за кислотно-основною
класифікацією не має групового реагенту? 6. З чого починається систематичний аналіз суміші
катіонів за кислотно-основною класифікацією? 7. Яке призначення групового реагенту? 2.2.2. Аналіз катіонів першої групи 2.2.2. 1.
Загальна характеристика катіонів першої групи До першої групи катіонів входять Na+, K+, NH4+. Жоден із цих катіонів не осаджується ні кислотами, ні
лугами. Ця група катіонів не має групового реагенту, який би мав
можливість відокремлювати катіони цієї групи від інших. Усі катіони цієї
групи безбарвні, а забарвлення їх солей може бути зумовлено лише аніоном.
Усі солі цих катіонів розчинні, а
гідроксиди є лугами, крім амоній
гідроксиду, який є розчинною, але слабкою основою. Важливою особливістю солей амонію є розкладання під час нагрівання:
Цю
властивість застосовують для видалення йонів амонію і відокремлення їх від
катіонів Na+, K+.
Катіони першої групи відіграють важливу роль у біохімічних процесах. Так, сполука катіону Na+ – кухонна сіль – необхідна добавка до
їжі, а 0,9% розчин NaCl є фізіологічним
розчином, а також використовується як засіб, що запобігає псуванню багатьох продуктів харчування. Солі Калію та Натрію входять до складу
молока. Натрій гідрокарбонат NaHCO3 (харчова сода), амоній карбонат (NH4)2CO3 (розпушувач тіста) використовують у кондитерському та борошняному виробництвах. Солі Амонію та амоніак
утворюються під час гниття білкових речовин, наявність яких свідчить про псування продуктів.
Катіони першої групи здатні змінювати
забарвлення полум’я, що застосовують для попереднього їх визначення.
2.2.2.2. Реакції катіонів Na+ 1. Забарвлення полум’я Солі Натрію
забарвлюють безбарвне полум’я в інтенсивно-жовтий колір. Для цього беруть
платинову дротинку, що впаяна в скляну паличку, і прожарюють її в полум’ї,
доки воно не забарвлюватиметься. Інколи доводиться занурювати дротинку в
розчин хлоридної кислоти й знову її прожарювати. Очищену дротинку занурюють у
розчин солі Натрію і в полум’я. Полум’я набуває жовтого кольору.
2. Реакція з калій дигідрогенантимонатом У пробірку вносять
3-4 краплі солі Натрію (NaCl) і 2-3 краплі розчину KH2SbO4 (у літературі трапляється формула K[Sb(OH)6]). Для прискорення
реакції суміш охолоджують під струменем води й потирають скляною паличкою по
внутрішніх стінках пробірки. Спостерігають утворення білого
дрібнокристалічного осаду:
Йони NH4+ заважають цій реакції, оскільки утворюють схожий на вигляд осад. Кислоти
також заважають проведенню цієї реакції, оскільки розкладають реактив з
утворенням білого осаду матасурм’яної
кислоти.
2.2.2.3. Реакції катіонів К+ 1. Забарвлення полум’я Реакцію проводять
аналогічно, як із солями Натрію. Катіони K+ забарвлюють
полум’я у фіолетовий колір. Майже незначна кількість солей Na+ заважає дослідженню, тому за кольором полум’я
спостерігають через сине кобальтове скло.
2. Реакція з натрій гексанітрокобальтатом(ІІІ) До 2-3 крапель
розчину солі Калію додають свіжий реактив
Реакція достатньо чутлива, але важливо дотримуватися
умов її проведення: рН=7, свіжовиготовлений реактив і
відсутність йонів амонію, які заважають реакції. 3. Реакція з натрій гідрогентартратом До 4-5 крапель
солі Калію додають таку саме кількість реактиву
Реакцію слід проводити в нейтральному середовищі,
оскільки луги і кислоти заважають утворенню осаду. Присутність солей амонію
заважає реакції, оскільки утворюється аналогічний осад. До 2-3 крапель розчину солі амонію додають 3-4 краплі
розчину NaOH або KOH. Суміш обережно нагрівають. Смужку вологого фенолфталеїнового або лакмусового папірця тримають біля отвору пробірки, не торкаючись її.
Фенолфталеїновий папірець набуває рожевого забарвлення, а лакмусовий –
синього:
Ця реакція
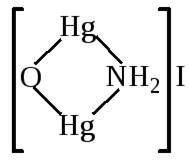
селективна і специфічна. 2. Реакція з реактивом Несслера Реактив Несслера – суміш комплексної сполуки Меркурію – калій
тетрайодомеркурту (ІІ) з калій гідроксидом
Реакція дуже чутлива й показує навіть
випадкові домішки 2.2.2.5. Систематичний хід
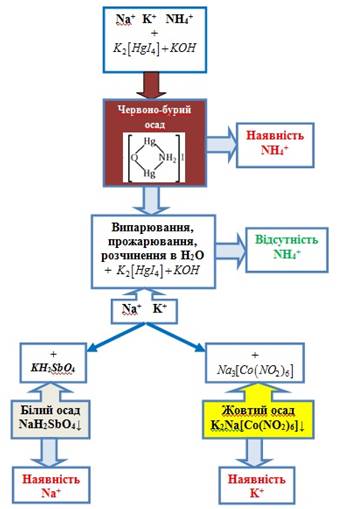
аналізу суміші катіонів першої групи Під час аналізу катіонів першої групи насамперед
визначають присутність йонів В отриманому розчині визначають катіони Na+і K+ за допомогою характерних реакції.
Рис. 2.27. Схема аналізу
суміші катіонів першої групи
Контрольні питання 1. Які катіони належать до першої групи? 2. Чому катіони першої групи не мають групового
реагенту? 3. Яке значення мають катіони першої групи в
біохімічних процесах? 4. Які властивості амонійних солей дозволяють
відокремити катіон Амонію від катіонів Калію та Натрію? 5. Чому якісну реакцію на катіон K+ з натрій
гідрогентартратом проводять в нейтральному середовищі?
2.2.3. Аналіз катіонів другої групи 2.2.3.1. Загальна характеристика катіонів
другої групи До другої групи катіонів належать Ag+, Pb2+. Катіони цієї групи легко відокремлюються від
інших груп дією на них груповим реагентом – хлоридною кислотою. Катіони другої групи не мають забарвлення. Більшість їх солей
малорозчинні. Найбільш поширеною розчинною сіллю, утвореною катіоном Аргентуму, є
Ці солі отруйні. Арґентум нітрат AgNO3 використовують для визначення вмісту кухонної солі у котлетній масі, у рибі
до та після вимочування, у кондитерських виробах. Солі Плюмбуму
використовують для визначення свіжості м’яса та м’ясних напівфабрикатів.
Присутність навіть незначної кількості катіонів Pb2+ має руйнівну дію на вітамін С. Катіон Pb2+ під дією лугів утворює
малорозчинну основу
У разі дії лугу
(NaOH, KOH) на катіони Ag+ утворюється арґентум (І) оксид:
2.2.3.2. Дія групового реагенту
на катіони другої групи Груповий реагент ‒ розчин
HCl з концентрацією 2 моль/л осаджує катіони другої групи у вигляді білих осадів:
За нагрівання до температури 100 °C розчинність 2.2.3.3. Реакція катіонів Ag+ 1. Реакція з хлоридною кислотою (або хлоридами) До 3-4 крапель солі
Осад не
розчиняється в розведених нітратній та сульфатній кислотах, але добре
розчиняється у водному розчині амоніаку:
Нітратна кислота
руйнує цей комплекс, і арґентум хлорид знову випадає в осад:
2. Реакція з калій хроматом У пробірку вносять
3-4 краплі солі
2.2.3.4. Реакція катіонів Pb2+ 1. Реакція з
хлоридною кислотою (хлоридами) До 3-4 крапель
розчину солі Плюмбуму (ІІ) додають стільки ж крапель розчину HCl з концентрацією 2 моль/л. Утворюється білий
осад, який розчиняється в лугах та гарячій воді. Реакції заважають йони Ag+:
2. Реакція з
калій йодидом У пробірку
вносять 3-4 краплі солі Плюмбуму і таку саму кількість розчину калій йодиду. Спостерігають утворення жовтого
осаду. До осаду додають невелику кількість води й розчин ацетатної кислоти з
концентрацією 2 моль/л. Суміш нагрівають до повного розчинення осаду. У разі
охолодження осаду під струменем холодної води осад з’являється у вигляді
блискучих золотистих кристалів, так званий «золотий дощ»:
3. Реакція із
сульфатною кислотою До 3-4 крапель
розчину солі Плюмбуму додають стільки ж розчину сульфатної кислоти з
концентрацією 2 моль/л. Утворюється білий осад плюмбум(ІІ) сульфату, який не
розчиняється в кислотах:
4. Реакція з калій хроматом До 3-4 крапель розчину солі Плюмбуму додають таку саму кількість розчину
калій хромату. Утворюється
жовтий осад плюмбум(ІІ) хромату:
Осад розчиняється в концентрованих розчинах лугів з утворенням плюмбітів.
2.2.3.5.
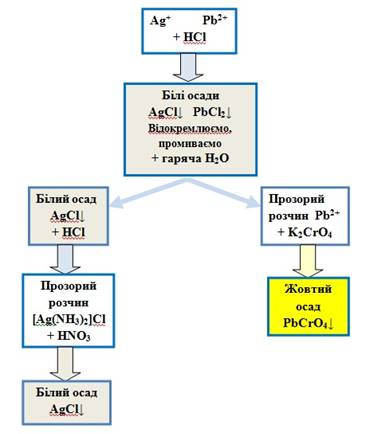
Систематичний хід аналізу суміші катіонів другої групи Під час аналізу суміші катіонів
другої групи поступово видаляють кожний катіон із суміші. 1. У пробірку вносять 0,5 мл
досліджуваного розчину й додають розчин HCl з концентрацією 2 моль/л до
повного осадження хлоридів. Осад відділяють центрифугуванням і промивають холодною водою. 2.
Промитий осад обробляють гарячою водою, при цьому катіони Pb2+ переходять у розчин. Осад арґентум хлориду відцентрифуговують. 3. У розчині визначають катіони
Pb2+ за допомогою характерних
реакцій. 4. До осаду, що містить катіони Ag+, додають розчин
амоніаку. Осад арґентум хлориду розчиняється. 5. До амоніачного комплексу Арґентуму додають нітратну
кислоту. Комплекс руйнується і утворюється білий осад арґентум хлориду.
Рис. 2.30. Схема аналізу суміші катіонів другої групи
Контрольні питання 1. Які катіони належать до другої групи? 2. Чим небезпечні солі катіонів другої групи для
організмів? 3. Який груповий реагент для
катіонів другої групи? 4. Пояснити, як використовують в аналізі
розчинність хлоридів катіонів другої групи у воді. 5. Як відокремлюють осад арґентум хлориду під час
аналізу суміші катіонів другої аналітичної групи?
2.2.4. Аналіз катіонів третьої групи 2.2.4.1. Загальна характеристика катіонів
третьої групи До третьої групи катіонів входять Ba2+, Ca2+. Ці катіони безбарвні.
Для цих катіонів характерні луги Ba(OH)2 та Ca(OH)2.
Йони Ba2+ отруйні. Йони Ca2+ входять до складу багатьох продуктів харчування. Свіже молоко містить
0,12 % Кальцію. 2.2.4.2. Дія групового реагенту
на катіони третьої групи Груповим реактивом на катіони
ІІІ групи є розведена сульфатна кислота. Вона утворює білі осади за
взаємодії з катіонами Ba2+, Ca2+:
Кальцій сульфат є найбільш розчинним, а барій сульфат – найменш
розчинним. 2.2.4.3. Реакція
катіонів Ba2+ 1. Реакція забарвлення полум’я Солі Барію забарвлюють полум’я спиртівки в жовто-зелений
колір. Для проведення досліду кілька кристалів солей Барію вносять в аналітичну
частину полум’я за допомогою платинової дротинки.
2. Реакція із сульфатною кислотою До 3-4 крапель солі Барію додають 1-2 краплі розчину
сульфатної кислоти (або натрій сульфату). Утворюється білий осад, що не розчиняється ні в
кислотах, ні в лугах:
3. Реакція з калій хроматом До 3-4 крапель солі Барію додають таку саму кількість розчину калій
хромату. Утворюється жовтий осад барій хромату. Для досягнення
повноти осадження катіонів Ba2+ до реакційної суміші додають надлишок натрій ацетату. Якщо в розчині є сильна
кислота, то вона буде заміщена слабкою – ацетатною:
2.2.4.4. Реакція катіонів Сa2+ 1. Реакція
забарвлення полум’я В аналітичну частину полум’я вносять за допомогою платинової дротинки
декілька кристаликів солі Кальцію. При цьому воно забарвлюється в
цегляно-червоний колір.
До 3-4 крапель розчину солі Кальцію додають стільки
ж крапель розчину амоній оксалату
3. Реакція з амоній карбонатом У пробірку вносять 3-4 краплі солі Кальцію і таку саму кількість розчину
амоній карбонату (або натрій карбонату). Утворюється білий осад:
Осад розчиняється в розведених хлоридній і нітратній кислотах:
2.2.4.5.
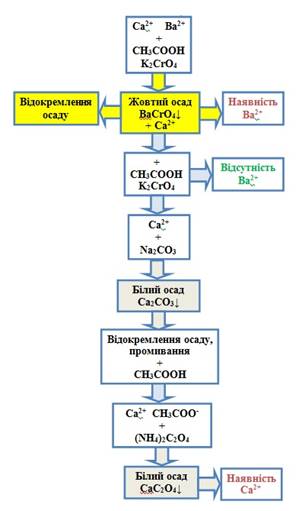
Систематичний хід аналізу суміші катіонів третьої групи 1. Для відокремлення катіонів Ba2+ від катіонів Ca2+ до досліджуваного розчину
додають ацетатну кислоту й розчин калій хромату. При цьому утворюється жовтий
осад барій хромату, а катіони Ca2+ залишаться в розчині. 2. Осад фільтрують (або центрифугують) і перевіряють повноту
осадження катіонів Ba2+. 3. До розчину додають Na2CO3 і відокремлюють осад, що утворився. 4. Осад промивають водою і
розчиняють в ацетатній кислоті. При цьому катіони Ca2+ переходять у розчин у вигляді
розчинної солі – кальцій ацетату. 5. У розчині кальцій ацетату
визначають катіони Ca2+ характерними реакціями.
Рис. 2.34. Схема аналізу суміші катіонів
третьої групи
Контрольні питання 1. Які катіони належать до третьої групи? 2. Який груповий реагент на катіони третьої групи? 3. В який колір зафарбовують полум’я катіони Барію? 4. Для чого під час реакції солей Барію з калій
хроматом додають надлишок натрій ацетату? 5. В який колір зафарбовують полум’я катіони
Кальцію?
2.2.5. Аналіз катіонів четвертої групи 2.2.5.1. Загальна характеристика катіонів
четвертої групи До четвертої групи катіонів входять катіони Al3+, Cr3+, Zn2+. Ці катіони об’єднує здатність
утворювати амфотерні
гідроксиди –
Для аналізу цих катіонів застосовують реакції комплексоутворення,
окиснення-відновлення, утворення та розчинення осадів. Серед цих йонів лише Cr3+ має
синьо-зелене забарвлення, решта – безбарвні. 2.2.5.2. Дія
групового реактиву на катіони четвертої групи Груповим реагентом на катіони четвертої групи є луг (NaOH, KOH). Продуктами дії надлишку лугу
на катіони Al3+, Cr3+, Zn2+ є гідроксокомплекси:
Надлишок лугу
перетворює їх на розчинні у воді гідроксокомплекси:
2.2.5.3. Реакція катіонів Zn2+ 1. Реакція з амоній гідроксидом У пробірку вносять 3-4 краплі розчину солі Цинку, додають 5-6 крапель
розчину NH3 ·H2O. Утворюється білий аморфний осад цинк гідроксиду, який
розчиняється у надлишку розчину амоніаку:
2. Реакція з калій гексаціанофератом (ІІ) (жовтою кров’яною
сіллю) У пробірку вносять 4-5 крапель солі Цинку й додають стільки ж крапель
розчину калій гексаціаноферату (ІІ). Утворюється білий осад, який
розчиняється і в розчинах кислот, і в розчинах лугів:
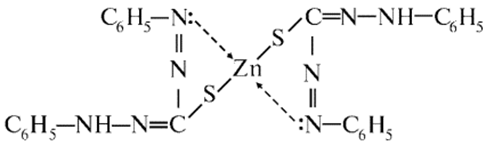
3. Реакція з дитизоном (дифенілтіокарбазоном) У пробірку вносять 3-4 краплі солі Цинку, додають 6
крапель розчину ацетатної кислоти, таку саму кількість розчину натрій ацетату
і 2-4 мл розчину органічного реагенту дитизону в хлороформі. Утворюється
червона комплексна сполука:
Ця комплексна сполука добре розчиняється в хлороформі, бензені та інших органічних розчинниках.
2.2.5.4. Реакція катіона Al 3+ 1. Реакція з
лугами і амоній хлоридом У пробірку вносять 4-5 крапель солі Алюмінію і надлишок лугу до розчинення
осаду. Потім у пробірку вносять кристалічний амоній хлорид і нагрівають суміш до кипіння,
потім охолоджують під струменем води. Утворюється білий осад у вигляді пластівців:
2. Реакція з
розчином амоніаку У пробірку вносять 4-5 крапель розчину солі алюмінію і 2-3 краплі розчину
амоніаку. Утворюється білий осад, що не розчиняється в надлишку водного розчину
амоніаку:
3. Реакція з алізарином У пробірку
вносять 3-4 краплі солі Алюмінію і розчин натрій гідроксиду до лужної реакції
і додають 2-3 краплі спиртового розчину алізарину. Утворюється яскраве
червоне забарвлення алюмінієвого лаку:
1. Реакція з
гідроген пероксидом У пробірку
вносять 3-4 краплі солі Хрому (ІІІ) і надлишок розчину натрій гідроксиду до
розчинення осаду хром (ІІІ) гідроксиду. Додають 5-6 крапель 3%-ного
розчину гідроген
пероксиду. Суміш обережно нагрівають до появи жовтого забарвлення, зумовленого
хромат-йонами:
2. Реакція з
розчином амоніаку У пробірку
вносять 3-4 краплі солі Хрому (ІІІ) і 2-3 краплі розчину амоніаку. Утворюється осад сіро-зеленого
кольору. Осад розчиняється в кислотах і лугах:
2.2.5.6.
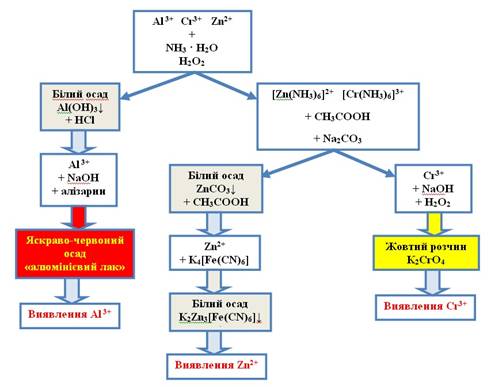
Систематичний хід аналізу суміші катіонів четвертої групи 1. Відокремлення йонів Al 3+ Для проведення цієї реакції до досліджуваного
розчину об’ємом 1 мл додають 1 мл розчину амоніаку й таку саму кількість
розчину гідроген пероксиду. Суміш нагрівають на водяній бані. Утворений осад алюміній
гідроксиду відокремлюють центрифугуванням. Осад розчиняють у хлоридній
кислоті й за допомогою якісних реакцій визначають катіон Al 3+. 2. Виявлення і відокремлення
катіонів Zn2+ Центрифугат, що містить катіони
Zn2+ та Cr3+ у вигляді амоніачних
комплексів, нейтралізують ацетатною кислотою, нагрівають протягом 2-3 хвилин
на водяній бані й додають розчин натрій карбонату для осадження катіонів Zn2+. Осад відокремлюють і
розчиняють у невеликій кількості ацетатної кислоти. У добутому розчині
визначають катіони Zn2+. 3. Відкриття катіонів Cr3+ Фільтрат після відокремлення
катіонів Zn2+ містить катіони Cr3+, які визначають за допомогою
характерних реакцій.
Рис. 2.37. Схема аналізу суміші катіонів четвертої групи
Контрольні питання 1. Які катіони належать до четвертої групи? 2. Який груповий реагент для катіонів четвертої
групи? 3. Які реакції характерні для аналізу катіонів
четвертої групи? 5. Під час аналізу суміші катіонів четвертої групи
який катіон відокремлюють та відкривають першим?
2.2.6. Аналіз катіонів п’ятої групи 2.2.6.1. Загальна характеристика катіонів п’ятої
групи До п’ятої групи катіонів належать - Mg2+, Mn2+, Fe2+, Fe3+. Крім катіонів Mg2+, решта мають характерні
забарвлення. Катіони Mn2+ забарвлені в блідо-рожевий
колір, у розчині майже безбарвні. Катіони Fe2+ забарвлені в блакитно-зелений
колір, у розчині майже безбарвні. Катіони Fe3+мають жовто-коричневе
забарвлення.
Усі гідроксиди цих металів малорозчинні, не розчиняються в лугах, але
добре розчинні в кислотах.
2.2.6.2. Дія групового реактиву
на катіони п’ятої групи Груповий реагент – водний розчин амоніаку осаджує катіони п’ятої групи у
вигляді нерозчинних основ різних за кольором: • безбарвний
• блідо-рожевий
• блідо-зеленуватий
• коричневий
1. Реакція з
натрій гідрогенфосфатом в амонічному середовищі У пробірку вносять 3-4 краплі солі Мg2+, додають 1 краплю NH4Cl , 2-3 краплі розчину амоніаку й 4-5 крапель розчину Na2HPO4 .
Утворюється осад подвійної солі магній-амоній фосфату білого кольору:
Додавання амоній хлориду сприяє утворенню аморфного осаду.
1. Реакція з натрій бісмутитом
У пробірку
вносять 2-3 краплі розчину солі Мангану, додають 4-5 крапель розчину
нітратної кислоти й декілька кристаликів NaBiO3.
Суміш забарвлюється в рожевий колір завдяки перманганат-йонам:
2. Реакція з лугами У пробірку вносять
3-4 краплі солі Мангану й таку саму кількість лугу. Утворюється
білий осад, який поступово змінює свій колір на бурий внаслідок окиснення
киснем повітря:
1. Реакція з калій гексаціанофератом (ІІІ) У пробірку
вносять 2-3 краплі солі Феруму (ІІ), додають 2-3 краплі розчину калій
гексаціаноферату (ІІІ) (червона кров’яна сіль). Утворюється синій осад, що
має історичну назву «турнбулева синь»:
1. Реакція з
калій гексаціанофератом (ІІ) У пробірку
вносять 3-4 краплі солі Феруму (ІІІ), додають таку саму кількість реактиву
калій гексаціаноферату (ІІ) (жовта кров’яна сіль). Утворюється синій осад, що
має історичну назву «берлінська блакить»:
2. Реакція з калій (або амоній)
роданідом У пробірку вносять 2-3 краплі
солі Феруму (ІІІ) і додають 1-2 краплі розчину калій роданіду (або амоній
роданіду). Утворюється криваво-червоний розчин:
Реакція дуже чутлива і
специфічна.
2.2.6.7. Систематичний хід аналізу
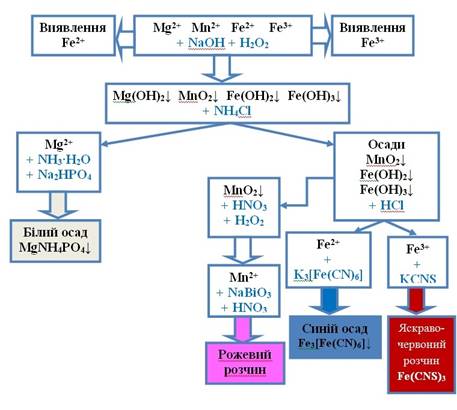
суміші катіонів п’ятої групи 1. Спочатку в розчині за допомогою якісних
реакцій визначають наявність катіонів Fe2+та Fe3+. 2. Для видалення катіонів Mg2+ на осад діють амоній хлоридом. При цьому катіони
Mg2+ переходять у розчин, де їх визначають
характерними реакціями. Решту центрифугують. 3. Центрифугат розчиняють у хлоридній кислоті, де
визначають катіони Mn2+, Fe2+, Fe3+ за допомогою характерних реакцій.
Рис. 2.41 Схема аналізу суміші катіонів п’ятої групи
Контрольні питання 1. Які катіони належать до п’ятої групи? 2. Який груповий реагент на п’яту аналітичну групу? 4. Для виявлення якого катіону п’ятої групи використовують
окисно-відновну реакцію та яку саме? 5. Яка з якісних реакцій на Fe3+ характеризується найбільшою
чутливістю і специфічністю?
2.2.7. Аналіз катіонів шостої групи 2.2.7.1. Загальна
характеристика катіонів шостої групи До шостої аналітичної групи катіонів входять Co2+, Ni2+, Cu2+. Усі катіони цієї групи в гідратованому вигляді мають характерні
забарвлення: катіони Co2+– рожеве, Ni2+ – зелене, Cu2+‒ синє.
Усі гідроксиди цих катіонів є малорозчинними основами.
Оскільки катіони цієї групи можуть проявляти змінний ступінь окиснення,
то для них характерні реакції окиснення-відновлення, що їх використовують для їх
якісного аналізу. 2.2.7.2. Дія групового реагенту на катіони шостої групи Груповий реагент – водний розчин амоніаку переводить усі катіони шостої
групи в розчинні у воді амоніачні комплекси:
1. Реакція з
калій (амоній) роданідом У пробірку
вносять 4-5 крапель розчину солі Кобальту, додають таку саму кількість
насиченого розчину калій (амоній) роданіду і 1-2
кристалики натрій фториду (для маскування катіонів Fe3+). До суміші додають 0,5 мл ізоамілового спирту або діетилового етеру. Шар органічного розчинника
забарвлюється в синій колір:
1. Реакція з
реактивом Чугаєва (диметилгліоксимом) Ця реакція є високочутливою та специфічною. Заважають її проведенню йони Fe2+, які попередньо окиснюють гідроген пероксидом до Fe3+. На смужку фільтрувального
папірця наносять одну краплю солі Ніколу й одну краплю розчину реактиву
Чугаєва. Папір витримують над відкритою склянкою з концентрованим розчином
амоніаку. Утворюється червона пляма.
1. Реакція з
розчином амоніаку У пробірку вносять 3-4 краплі солі Купруму, додають 5-6 крапель розчину
амоніаку. Утворюється амоніачний комплекс
інтенсивно-синього кольору:
2. Реакція з калій йодидом У пробірку вносять 2-3 краплі солі Купруму, додають 4-5 крапель розчину
калій йодиду. Утворюється осад купрум(І) йодиду та вільний йод. Для його
визначення краплю розчину над осадом наносять на смужку йодкрохмального
папірця. Смужка набуває синього кольору:
2.2.7.6. Систематичний хід аналізу
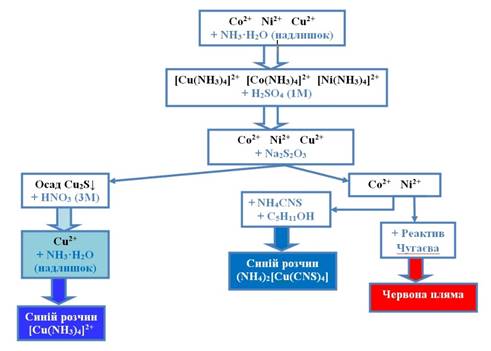
суміші катіонів шостої групи 2. На суміш катіонів шостої
групи діють розчином H2SO4 з концентрацією 1 моль/л та Na2S2O3. При цьому катіони Cu2+ переходять у осад Cu2S, а катіони Co2+ та Ni2+ будуть у розчині. 3. Катіони Co2+ та Ni2+ визначають характерними
реакціями. 4. На осад Cu2S діють розчином HNO3 з концентрацією 3 моль/л і в утвореному розчині
за допомогою характерних реакцій визначають катіони Cu2+.
Рис. 2.45. Схема аналізу
суміші катіонів шостої групи
Контрольні питання 1. Які катіони належать до шостої групи? 2. Який груповий реагент для катіонів шостої групи? 3. Які реакції характерні для катіонів шостої групи
та використовуються для їх якісного аналізу? 4. Що утворюється за дії надлишку групового
реагенту на катіони шостої групи? 5. Як усунути заважаючу дію катіонів Fe3+
під час визначення катіонів Со2+?
2.3.1. Аналітична класифікація аніонів Загальноприйнятої
класифікації аніонів не існує. Аніони класифікують на три
аналітичні групи за їх здатністю утворювати
малорозчинні солі з барій хлоридом та арґентум нітратом (табл. 2.7). Цей спосіб класифікації запропонував
німецький вчений Бунзено у 1878 р.
Особливістю аналізу аніонів є те, що вони майже не заважають визначенню
один одного. Ця обставина є підставою для того, щоб визначати аніони дробним методом. Під час аналізу аніонів груповий реактив лише дає можливість визначити, до якої групи належить цей аніон. Аналіз аніонів виконувати значно легше, ніж аналіз
катіонів. Визначення
більшості аніонів базується на тих самих реакціях, що їх застосовують для
аналізу катіонів, але тепер катіон є реактивом на певний аніон.
Таблиця 2.7 Аналітична класифікація аніонів
Контрольні питання 1. Скільки існує аналітичних груп аніонів? 2. Що покладено в основу класифікації аніонів на
аналітичні групи? 3. Які особливості аніонів дозволяють визначати їх
дробним методом? 4. Яка група аніонів не має групового реагенту? 5. Яке значення має груповий реагент під час
аналізу аніонів? 2.3.2. Аналіз аніонів першої групи 2.3.2.1. Загальна характеристика аніонів
першої групи До першої аналітичної групи аніонів належать: SO42-, SO32-, S2O32-, CO32-, PO43-, F-, SiO32-. З катіонами Ba2+ вони утворюють малорозчинні
солі білого кольору, які здатні розчинятися у розчинах неорганічних
кислот, за винятком барій сульфату.
2.3.2.2. Якісні
реакції на аніони першої групи 1. Реакція з барій хлоридом У пробірку вносять 2-3 краплі
розчину сульфатної кислоти або її солі й додають таку саму кількість розчину
барій хлориду. Утворюється білий осад, що не розчиняється в мінеральних
кислотах:
Реакції аніона
1. Реакція з хлоридною (або
сульфатною) кислотами У пробірку вносять 5-6 крапель розчину Na2SO3 і стільки ж розчину хлоридної або сульфатної
кислоти. Пробірку закривають пробкою з газовідвідною трубкою-капіляром з розчином KMnO4 або з розчином йоду. Спостерігають знебарвлення розчину калій перманганату або розчину йоду:
2. Реакція з йодною водою У пробірку
вносять 3-4 краплі розчину солі Na2SO3 і 2-3 краплі розчину
сульфатної кислоти і 2-3 краплі розчину йоду (йодна вода). Спостерігають
знебарвлення розчину йоду:
Реакції
аніона 1. Реакція з мінеральними
кислотами У пробірку вносять 5-6 крапель розчину Na2S2O3 і 3-4 краплі сульфатної кислоти. За деякий час спостерігають
помутніння розчину внаслідок утворення сірки:
2. Реакція з аргентум
нітратом У пробірку
вносять 5-6 крапель розчину натрій тіосульфату і 2-3 краплі розчину AgNO3. Утворюється білий
осад Ag2S2O3, який з часом набуває чорного кольору внаслідок
утворення Ag2S:
3. Реакція з йодною водою У пробірку
вносять 2-3 краплі розчину солі
Реакції аніона 1. Реакція із сильними кислотами У пробірку з газовідвідною
трубкою вносять 7-8 крапель розчину натрій карбонату і стільки ж розведеної
сульфатної кислоти. Закривають пробірку корком з газовідвідною трубкою,
кінець якої занурюють у пробірку з розчином кальцій гідроксиду
(вапняна вода) (рис. 2.49). Спостерігають утворення білої
каламуті.
Реакції аніона 1. Реакція з арґентум нітратом У пробірку
вносять розчин натрій фосфату і 2-3 краплі розчину AgNO3. Утворюється жовтий осад арґентум фосфату:
2. Реакція з магнезіальною сумішшю У пробірку
вносять 3-4 краплі досліджуваного фосфату й стільки ж розчину магнезіальної
суміші (MgCl2 + NH4Cl + NH4OH).
Спостерігають
утворення білого осаду амоній-магній фосфату:
3. Реакція з амоній молібдатом У пробірку
вносять 2-3 краплі натрій фосфату, 4 краплі розчину амоній молібдату, 5
крапель розчину нітратної кислоти і 2-3 краплі розчину амоній хлориду. Суміш трохи підігрівають.
Утворюється жовтий кристалічний осад:
Реакції аніона 1. Реакція з ферум (ІІІ) роданідом У пробірку
вносять 2-3 краплі солі Феруму (ІІІ) і стільки ж розчину калій (амоній)
роданіду. Утворюється ферум (ІІІ) роданід криваво-червоного кольору. До нього
додають декілька крапель натрій фториду. Розчин знебарвлюється. Реакції заважають фосфат-йони, які дають аналогічний
зовнішній ефект:
Реакції аніона 1. Реакція із сильними кислотами У пробірку
вносять 5-6 крапель розчину натрій силікату й стільки ж розведеної хлоридної
або сульфатної кислоти. Утворюється драглистий осад:
2. Реакція з амоній хлоридом У пробірку вносять 4-6 крапель натрій силікату, додають 1 мл дистильованої води і 3-4 кристаликів амоній хлориду. Суміш нагрівають. Утворюється драглистий осад:
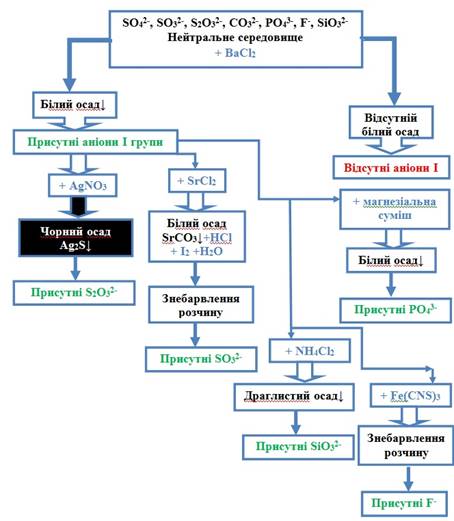
2.3.2.3. Аналіз суміші аніонів першої групи 1. На досліджуваний розчин діють
розчином барій хлориду. Якщо в нейтральному середовищі осад не утворився, то аніонів
першої групи немає. 2. Спочатку в
досліджуваній суміші визначають 3. Виконують визначення 4.
Виявляють 5. Виявляють F- йони за їх
здатністю руйнувати комплекс ферум (ІІІ) роданіду.
Рис. 2.50. Схема аналізу суміші
аніонів І групи
Контрольні питання 1. Які
аніони належать до першої групи? 2. Який катіон з аніонами
першої групи утворює білий осад? 4. Чи можна визначити
фторид-йони в присутності фосфат-йонів розчином ферум(ІІІ) роданіду? 5. Які аніони визначають
першими в суміші першої групи?
2.3.3. Аналіз аніонів другої групи 2.3.3.1. Загальна характеристика аніонів
другої групи До другої групи аніонів належать Cl-, Br-, I-, S2- йони. Груповий реагент – аргентум нітрат у присутності нітратної кислоти утворює з аніонами другої
групи різні за кольором осади:
2.3.3.2. Якісні реакції на
аніони другої групи Реакції аніона 1. Реакція з арґентум нітратом У пробірку вносять 4-5 крапель
розчину хлоридної кислоти або її солі. Додають 2-3 краплі розчину арґентум нітрату.
Утворюється білий осад. Осад розчиняється у водному розчині амоніаку та натрій тіосульфаті:
Реакції аніона 1. Реакція з аргентум нітратом У пробірку вносять 4-5 крапель розчину броміду. Додають 2-3 краплі
розчину арґентум нітрату. Утворюється жовтуватий осад. Осад розчиняється у
водному розчині амоніаку та натрій тіосульфаті:
2. Реакція з хлорною водою У пробірку вносять 4-5 крапель розчину броміду й додають таку саму
кількість хлорної води. Утворюється молекулярний бром, який добре екстрагується в органічних розчинниках (хлороформ, бензен)
Реакції аніона І- 1. Реакція з аргентум нітратом У пробірку вносять 4-5 крапель
розчину йодиду. Додають 2-3 краплі розчину арґентум нітрату. Утворюється
жовтий осад. Осад не розчиняється у водному розчині амоніаку та розчиняється у розчині
натрій тіосульфату:
2. Реакція з хлорною водою У пробірку вносять 4-5 крапель розчину йодиду й додають таку саму
кількість хлорної води. Утворюється вільний йод. З додаванням до розчину йоду
розчину крохмалю утворюється темно-синє забарвлення:
Реакції
аніона 1. Реакція з аргентум нітратом У пробірку вносять 4-5 крапель розчину сульфіду. Додають 2-3 краплі
розчину арґентум нітрату. Утворюється чорний
осад:
2. Реакція з плюмбум(ІІ) нітратом (або ацетатом) У пробірку вносять 4-5 крапель розчину сульфіду й додають таку саму
кількість розчину плюмбум(ІІ) нітрату (або ацетату). Утворюється чорний осад:
3. Реакція з натрій
нітропрусидом У пробірку вносять 3-4 краплі розчину сульфіду й 2-3 краплі розчину
натрій нітропрусиду та таку саму кількість розчину натрій гідроксиду.
Утворюється комплексна сполука червоно-фіолетового кольору:
2.3.3.3. Аналіз суміші аніонів другої
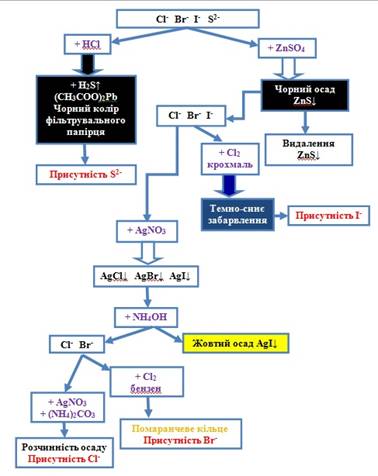
групи Аніони другої групи слід відкривати в певній послідовності, оскільки вони заважають один одному під час
визначення. 1. Визначають 2. Виявляють йони 3. Далі визначають
Рис. 2.56. Схема аналізу суміші
аніонів ІІ групи
Контрольні питання 1. Які аніони належать до
другої групи? 2. Який груповий реагент на
аніони другої групи? 4. В яких розчинниках добре
екстрагується молекулярний бром? 5. Який
аніон виявляють першим та відокремлюють з розчину під час аналізу суміші
аніонів другої групи?
2.3.4. Аналіз аніонів третьої групи 2.3.4.1. Загальна характеристика аніонів
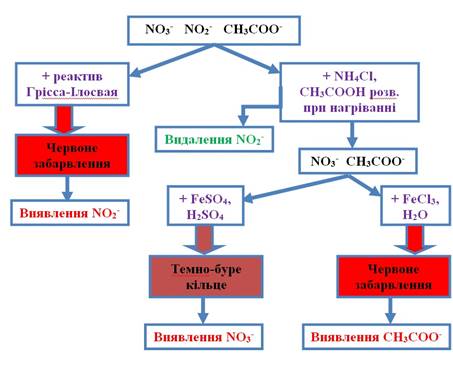
третьої групи До третьої групи аніонів належать NO3-, NO2-, CH3COO-. Аніони третьої групи не мають
групового реактиву. Нітрати, нітрити та ацетати добре розчиняються у воді. Нітрати потрапляють у продукти
харчування з рослинної сировини, у ході вирощування якої використовували нітратні добрива.
Нітрити додають у
ковбасні вироби для стабілізації рожевого кольору м’ясних виробів та як консервант.
2.3.4.2. Якісні
реакції на аніони третьої групи Реакція
аніона 1. Реакція з
металічною міддю в присутності сульфатної кислоти У пробірку вносять 1 мл
концентрованої сульфатної кислоти і 3-4 краплі розчину нітрату. У пробірку
занурюють мідну дротинку й обережно нагрівають. Утворюється нітроген(IV) оксид бурого кольору. Оскільки цей газ
отруйний, дослід проводять у витяжній шафі:
2. Реакція з ферум(ІІ) сульфатом У пробірку вносять 5-6 крапель розчину нітрату, декілька кристаликів
ферум(ІІ) сульфату й обережно по стінках пробірки концентровану сульфатну кислоту.
На межі змішування розчинів утворюється темно-буре кільце:
3. Реакція з дифеніламіном У пробірку
вносять 2-3 краплі розчину дифеніламіну в концентрованій сульфатній кислоті і
одну краплю нітрату. На стінках пробірки утворюється сполука синього кольору. Досліду
заважають нітрити.
Реакція аніона 1. Реакція з розчинами кислот У пробірку вносять 3-4 краплі розчину нітриту. Додають 1-2 краплі розчину
сульфатної кислоти. Утворюється бурий газ – нітроген (IV) оксид. Дослід проводять у витяжній
шафі.
2. Реакція з калій перманганатом У пробірку
вносять 3-4 краплі розчину нітриту й додають 2-3 краплі розчину сульфатної кислоти
і 1-2 краплі розчину калій перманганату. Після перемішування розчин
знебарвлюється:
3. Реакція з реактивом Грісса – Ілосвая На годинникове скло наносять одну краплю суміші сульфанілової кислоти і
α-нафтіламіну (реактив Грісса
– Ілосвая). Утворюється червоне забарвлення. Нітрати не заважають перебігу
цієї реакції.
Реакція аніона 1. Реакція із сульфатною кислотою У пробірку вносять 2-3 мл розчину ацетату й таку саму кількість розведеної
сульфатної кислоти. Пробірку обережно нагрівають. Утворюється ацетатна
кислота, яку ідентифікують за специфічним запахом:
2. Реакція з ферум(ІІІ) хлоридом У пробірку
вносять 5-6 крапель розчину ферум(ІІІ) хлориду, додають таку саму кількість розчину
натрій ацетату і 1-2 мл дистильованої води. Суміш нагрівають до кипіння. Утворюється розчин
червоного кольору:
2.3.4.3. Аналіз суміші аніонів третьої
групи Аналіз суміші аніонів третьої групи слід виконувати з урахуванням того,
що нітрит-аніони дають аналогічну реакцію з
дифеніламіном, як і нітрати, тому їх визначають першими, а далі
ідентифікують за допомогою характерних реакцій нітрат та ацетат-аніони.
Рис. 2.59. Схема аналізу суміші
аніонів ІІІ групи
Контрольні питання 1. Які аніони належать до
третьої групи? 2. Чим
відрізняються аніони третьої групи від аніонів інших груп? 3. Яке значення мають
нітрити у харчовій промисловості? 5. Який аніон виявляють
першим та відокремлюють з розчину під час аналізу суміші аніонів третьої
групи?
2.4. Аналіз невідомої речовини 2.4.1. Підготовка речовини до аналізу.
Попередній аналіз 2.4.1.1. Підготовка речовини до аналізу Речовина, що
підлягає аналізу, може бути у вигляді розчину або у сухому стані.
Речовину в сухому
стані ретельно оглядають за допомогою лупи та мікроскопа.
Колір кристалів може вказувати на
можливість наявності деяких йонів: сині – солі Купруму, зелені – солі Феруму
(ІІ), рожеві – солі Кобальту.
2.4.1.2. Попередні дослідження невідомої
речовини
Наступним етапом є
перевірка на розчинність. Спочатку перевіряють розчинність речовини у воді за
кімнатної температури і під час нагрівання, потім у розчинах хлоридної,
нітратної кислоти, концентрованих кислотах, «царській горілці», концентрованих розчинах лугів та амоніаку. У разі
розчинення у сульфатній кислоті можливе утворення газоподібних речовин
розкладу сполуки. За кольором, запахом та іншими властивостями газів можна
зробити попередні висновки про наявність у речовині деяких йонів.
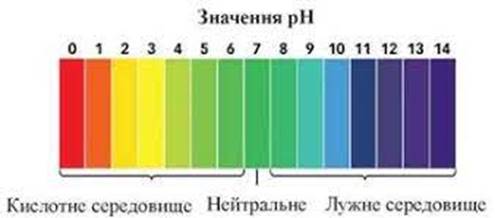
Якщо речовина
розчинна у воді, то реакція середовища може давати цінну інформацію про її склад. Кисла
реакція (рН
На підставі цих попередніх
випробувань роблять висновок про можливий склад речовини і уточнюють хід систематичного аналізу. Таблиця 2.8 Попередні дослідження невідомої речовини
Контрольні питання 1. Яку попередню оцінку можна зробити за формою та
кольором кристалів сухої речовини? 2. Яким чином проводять дослідження речовин на
забарвлення полум’я? 3. Про наявність яких сполук у розчині свідчить
кисла реакція середовища? 4. На наявність яких речовин вказує лужне
середовище розчину? 2.4.2. Систематичний
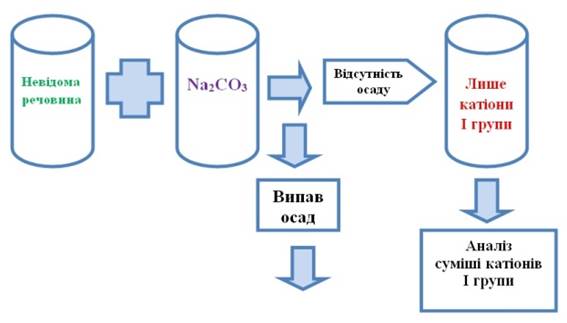
хід аналізу катіонів та суміші аніонів 2.4.2.1. Виявлення катіонів у розчині 1. У
пробірку вносять 3-5 крапель досліджуваного розчину, додають стільки ж
розчину натрій карбонату. Якщо осад не випадає, то в розчині є тільки катіони
першої аналітичної групи. Цей катіон аналізують за схемою ходу аналізу суміші катіонів І
аналітичної групи за кислотно-основною класифікацією.
Рис.
2.67. Виявлення катіонів І групи 2. Якщо осад катіонів важких металів
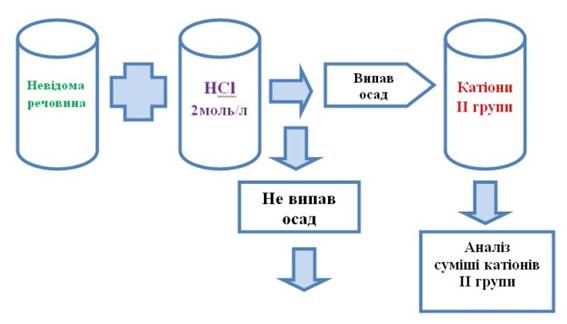
випав, то до 0,5 мл нової порції досліджуваного розчину додають
2-3 краплі розчину хлоридної кислоти з концентрацією 2
моль/л. Утворення осаду засвідчує наявність катіонів другої групи. Тому
до цієї самої порції досліджуваного розчину додають розчин хлоридної кислоти
до повного осадження катіонів ІІ групи. Осад відфільтровують і аналізують за
систематичним ходом аналізу суміші катіонів ІІ аналітичної групи.
Рис. 2.68. Виявлення катіонів ІІ групи 3. Якщо катіони ІІ групи не виявлені,
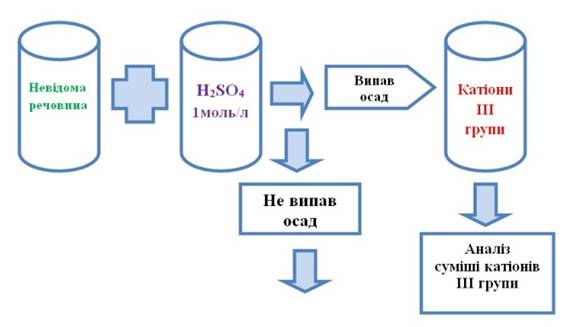
то до нової порції розчину досліджуваної речовини додають 3-4 краплі розчину сульфатної кислоти з концентрацією 1 моль/л. Утворення осаду вказує на присутність
катіонів ІІІ аналітичної групи. Тому до цієї самої порції досліджуваного
розчину додають розчин сульфатної кислоти з концентрацією 1 моль/л до повного
осадження катіонів третьої групи. Осад відокремлюють і аналізують за
систематичним ходом аналізу суміші катіонів ІІІ аналітичної групи.
Рис.
2.69. Виявлення катіонів ІІI групи 4. Якщо катіонів ІІІ групи немає,
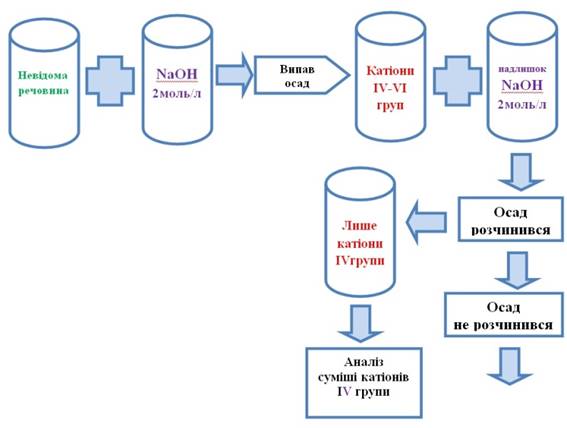
то до 0,5 мл досліджуваного розчину додають краплями розчин лугу (NaOH чи КОН) з концентрацією 2 моль/л. Утворення
осаду і його забарвлення свідчить про наявність у розчині катіонів IV-VI аналітичних груп.
Якщо осад розчинився повністю в надлишку лугу, то присутні лише катіони IV групи. Утворений розчин гідроксокомплексів катіонів IV групи аналізують за ходом аналізу катіонів IV аналітичної групи за кислотно-основною класифікацією.
Рис. 2.70. Виявлення катіонів ІV групи 5.
Якщо осад від надлишку лугу не розчинився, то досліджуваний розчин містить
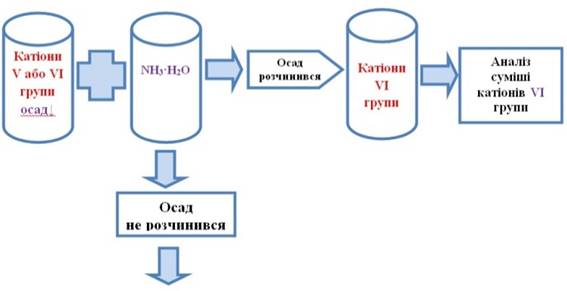
катіони V або VI груп. Тому на осад діють розчином амоній гідроксиду. Якщо осад повністю розчинився, то це підтверджує
присутність катіонів VI аналітичної
групи. Тому амоніачний
розчин катіонів VI аналітичної групи аналізують за ходом аналізу катіонів VI аналітичної групи за кислотно-основною класифікацією.
Рис. 2.71. Виявлення катіонів VІ групи 6. Якщо осад не розчиняється в розчині амоній гідроксиду
або розчиняється не повністю, то в розчині присутні катіони V
аналітичної групи.
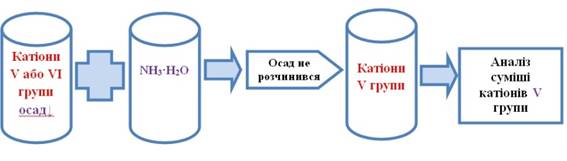
Осад аналізують за ходом аналізу суміші катіонів V аналітичної групи за кислотно-основною класифікацією.
Рис. 2.72. Виявлення катіонів V групи Одержані дані про присутність катіонів
чи катіона в розчині досліджуваної речовини полегшують відкриття аніонів,
оскільки часто відкриті катіони виключають деякі аніони, а іноді навіть цілі
групи аніонів. Наприклад, якщо водний розчин містить кальцій-катіони, то
відсутні фосфат-, карбонат- та інші аніони цієї групи. Якщо в розчині знайдені катіони барію, стронцію або
свинцю, то в ньому не може бути аніонів 2.4.2.2. Виявлення аніонів у розчині Аналізу аніонів заважають майже всі катіони, крім калію, натрію та
амонію. Причиною цього є
те, що деякі катіони здатні утворювати осади з аніонами, мають забарвлення,
проявляють окисно-відновні властивості, Для видалення катіонів лужноземельних,
важких металів проводять «содову витяжку». Для цього розчин досліджуваної
речовини кип’ятять з розчином Na2CO3. При цьому аніони залишаються в розчині, а катіони утворюють відповідні
сполуки, які не розчиняються (карбонати, гідроксиди або основні солі).
Більшість аніонів визначають дробним методом, але в певній послідовності, тому що присутність одних
аніонів заважає відкриванню інших. Наведений нижче хід аналізу аніонів
передбачає аналіз на аніони розчину, який містить солі натрію, калію або
амонію, за відсутності у розчині катіонів металів, які заважають аналізу
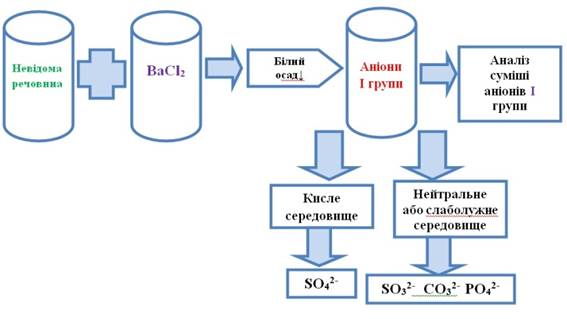
аніонів. 1. Виявлення аніонів І аналітичної групи До кількох крапель
досліджуваного розчину додають кілька крапель розчину барій хлориду або барій нітрату. Утворення білого осаду підтверджує
наявність у розчині аніонів І групи: якщо реакція розчину кисла, то присутній
сульфат-аніон, якщо реакція розчину нейтральна або слаболужна, то присутні
сульфіт-, карбонат- і фосфат-аніони. У досліджуваному розчині дробним ходом
аналізу виявляють присутність окремих аніонів І аналітичної групи.
Рис. 2.73. Виявлення аніонів І групи 2.
Виявлення аніонів ІІ аналітичної групи Якщо відсутні аніони І групи, то
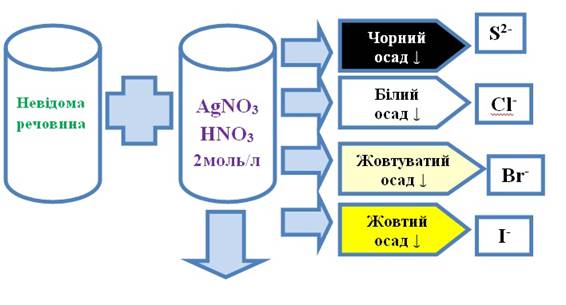
виявляють аніони ІІ групи. До кількох крапель досліджуваного розчину додають
кілька крапель розчину арґентум нітрату в присутності розчину нітратної кислоти з концентрацією 2
моль/л. Утворення осаду підтверджує присутність у розчині аніонів ІІ аналітичної
групи, зокрема: чорний осад – присутній сульфід-аніон, білий –
хлорид-аніон, жовтуватий – бромід-аніон, жовтий – йодид-аніон.
Рис. 2.74. Виявлення аніонів ІI групи 3.
Виявлення аніонів ІІІ аналітичної групи Якщо осад не
утворюється, то аніонів ІІ аналітичної групи немає. Тому з нової порції
досліджуваного розчину дробним методом відкривають аніони ІІІ
аналітичної групи характерними реакціями ацетат-, нітрит- і нітрат-аніонів. Виявивши в розчині
катіони й аніони, встановлюють склад досліджуваної речовини.
Контрольні питання 3. Катіони якої групи можна виявити, діючи
надлишком розчину лугу? 5. Які катіони не заважають аналізу аніонів під час
аналізу невідомої речовини?
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||