|
|
|
АНАЛІТИЧНА ХІМІЯ Електронний посібник |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
РОЗДІЛ 3. КІЛЬКІСНИЙ АНАЛІЗ |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
3.1.1. Терези та правила зважування 3.1.1.1. Поняття про
гравіметричний аналіз 3.1.1.2. Основні
правила зважування 3.1.2. Сутність гравіметричного аналізу 3.1.2.1. Групи гравіметричного аналізу 3.1.2.2. Вимоги до
осаджуваної та гравіметричної форми 3.1.2.3. Етапи гравіметричного
аналізу 3.1.3. Розрахунки в гравіметричному аналізі 3.1.3.2. Вологість
харчових продуктів 3.1.3.3. Приклади
гравіметричних розрахунків 3.2.1. Теоретичні положення титриметричного аналізу 3.2.1.1. Поняття про
титриметричний аналіз 3.2.1.2. Вимоги до
реакцій, що їх застосовують в титриметричному аналізі 3.2.1.3.
Класифікація методів титриметричного аналізу 3.2.2.1. Поняття про реальні та умовні частинки 3.2.2.2. Фактор
еквівалентності 3.2.3. Концентрація титрованих розчинів 3.2.3.3. Молярна
концентрація еквівалента 3.2.3.4. Титр за
визначуваною речовиною 3.2.4. Об’ємно-аналітичні розрахунки 3.2.4.1. Закон
еквівалентів в титриметричних розрахунках 3.2.4.2.
Титриметричні розрахунки за прямого титрування 3.2.4.3.
Титриметричні розрахунки за зворотного титрування 3.2.5. Лабораторний посуд для об’ємного аналізу 3.2.5.1.
Лабораторний посуд для титриметричного аналізу 3.2.6. Приготування стандартних розчинів 3.2.6.1. Вимоги до
стандартних розчинів 3.2.6.2. Поняття про
поправковий коефіцієнт 3.2.6.3.
Приготування стандартних розчинів із фіксаналів 3.2.7. Метод кислотно-основного титрування 3.2.7.1. Сутність
кислотно-основного титрування 3.2.7.2. Кислотно-основні
індикатори і принцип їх вибору 3.2.7.3. Види
кислотно-основного титрування 3.2.7.4.
Приготування стандартних розчинів для кислотно-основного титрування 3.2.7.5.
Застосування кислотно-основного титрування 3.2.8. Методи окисно-відновного титрування 3.2.8.1. Поняття про
редоксіметрію 3.2.9.1.
Характеристика методу осадження 3.2.9.6.
Приготування стандартних розчинів 3.2.10.1.
Характеристика комплексонометрії. Комплексони 3.2.10.3.
Стандартизація розчину Трилону Б 3.2.10.4. Приклади
застосування комплексонометричного титрування 3.2.11. Метрологічні основи хімічного аналізу 3.2.11.2.
Характеристика вимірювань 3.2.11.3.
Класифікація похибок 3.2.11.4. Значущі цифри
та правила заокруглення 3.1.1. Терези та правила зважування 3.1.1.1. Поняття про гравіметричний
аналіз
Оскільки
гравіметрія – точний та безеталонний метод аналізу (відносна похибка –
0,1…0,2 %), то результати аналізу переважно залежать від точності аналітичних
терезів та правильності гравіметричних операцій. Існують терези різного класу точності. У лабораторіях кількісного аналізу використовують
терези другого класу точності, що дозволяють зважувати речовину з точністю
0,01 г. До таких терезів належать технохімічні терези (рис. 3.1).
Аналітичні терези (рис. 3.2) належать до першого класу точності й дозволяють виконувати зважування
до величини 0,0002 г. Такі терези слід розташовувати в спеціальній кімнаті –
ваговій, їх використовують для виконання хімічних операцій, що вимагають
високої точності. Аналітичні терези слід оберігати від дії агресивних
речовин, вологого повітря, різких перепадів температур і механічної дії. Під
час їх використання слід враховувати максимальне навантаження, вказане в
паспорті.
Сучасна техніка
дозволяє значно скоротити час на гравіметричні операції, і тому лабораторії
обладнують електронними терезами різного класу (рис. 3.3).
До кожних
аналітичних терезів додають стандартний набір робочих важків (гир) і пінцет, які
зберігають в спеціальній дерев’яній коробочці. Гирі (рис. 3.4) – це тіла
певної маси й встановленої форми, призначені для зважування (вимірювання
маси) на терезах. Маса гир здебільшого вказана на них. Для забезпечення
стабільності маси гирі виготовляють з корозійно-стійких і немагнітних
матеріалів. З причин технологічного характеру гирям масою від 1 г до 200 г
надано форми прямого циліндра з головкою. Набір гир такий:100, 50, 20, 10, 5,
2, 2, 1 г. Крім того, в наборі є міліграмові важки: 500, 200, 200, 100, 50,
20, 20, 10 мг. Вони виготовлені з тонких металевих пластинок з одним загнутим
кутком для зручності захоплення їх пінцетом. Вони мають форму різноманітних
багатокутників. Сума маси всіх
важків, які входять у стандартний набір, не перевищує допустимого граничного
навантаження аналітичних терезів, яке визначає те граничне навантаження
шальок терезів, за якого терези залишаються непошкодженими й водночас
забезпечується необхідна точність вимірювань.
3.1.1.2. Основні правила зважування ►1. Масу
речовини, яку зважують, попередньо, як правило, визначають на технохімічних
терезах. ►2. Сипучі речовини
зважують у спеціальному посуді (бюксі, на годинниковому склі, у хімічній
склянці), рідини – у щільно закритому посуді (рис 3.5).
►3. Предмети,
які зважують, мають бути чистими й сухими, мати температуру вагової кімнати.
Зважують на терезах, зручно сидячи, не торкаючись стола з терезами. ►4. Перш ніж
розпочати зважування, слід уважно оглянути терези й набір важків. ►5.
Зважування завжди слід розпочинати з перевірки зрівноваження терезів. Якщо
терези не зрівноважені, необхідно звернутися до викладача або лаборанта.
Самостійне настроювання аналітичних терезів забороняється! Вмикати терези
слід за закритих бокових шторок. Вмикати чи вимикати терези (відкривати або
закривати аретир) завжди треба плавним і повільним поворотом ручки,
спостерігаючи за рухом коромисла. ►6. Предмет
для зважування і гирі встановлюють на шальки тільки за вимкнених терезів (за
закритого аретиру). Предмет для зважування треба ставити на ліву шальку, а
гирі – на праву, починаючи з найбільшої за масою з подальшим зменшенням їх
маси. ►7. Важки
більшої маси розташовують у центрі шальок. Важки слід брати тільки пінцетом. ►8. На
аналітичних терезах рівноваги досягають, використовуючи міліграмові важки,
якими управляють ручками – лімбами вагового механізму. ►9. Масу
зваженого предмета визначають як суму мас важків від більшого до меншого, а
також значень шкали лімбів і оптичної шкали. Тільки після запису маси
зваженого предмета шальки терезів розвантажують. Зважування слід виконувати в такій послідовності: ►1. Терези
вмикають і через 10-20 с за положенням нульової позначки шкали перевіряють
стан зрівноваження. Якщо нульова позначка шкали не збігається з відліковою
рискою, то її положення корегують ручкою встановлення нуля. Терези вимикають.
►2. Предмет,
який зважують, встановлюють на ліву шальку терезів. На праву шальку
встановлюють важки, сумарна маса яких орієнтовно близька до маси предмета. ►3. Терези
вмикають для з’ясування, яка шалька переважує. Підбір тягарців на шальці має
бути таким, щоб їх сумарна маса не перевищувала масу предмета на 1 г. Для
швидшого виконання цієї операції предмет зважують на технохімічних терезах. ►4. Коли
досягають правильного набору важків на шальці, зрівноваження терезів
продовжують за допомогою механізму підбору міліграмових важків. Під час
роботи з важками не забувають вимикати терези. ►5.
Зважування буде виконаним, якщо терези зрівноважені в межах шкали відліку
міліграмів. ►6. Результат
зважування реєструють у лабораторному журналі й вимикають терези. Аналітичні терези
різних моделей мають особливості в конструкції й системі керування, тому слід
знайомитися з порядком роботи на терезах за інструкцією з експлуатації.
Електронні терези позбавлені такого практичного недоліку, як вправи з
важками.
Контрольні питання 2. До якого класу точності належать технохімічні терези? 3. Дайте характеристику аналітичним терезам. 4. Опишіть основні
правила зважування. 3.1.2. Сутність гравіметричного аналізу 3.1.2.1. Групи гравіметричного аналізу Основною операцією
гравіметрії є визначення маси. Це може бути маса компонента, який виділяється
в елементарному вигляді або у вигляді малорозчинної сполуки, або маса залишку
після виділення компонента, що його визначають. За допомогою гравіметричного
аналізу визначають масу або концентрацію багатьох речовин, металів,
неметалів, складових часток сплавів, руд, природних і промислових об’єктів.
Гравіметричний метод аналізу дозволяє визначити вміст речовини з високою
точністю, але він потребує багато часу й праці. Гравіметричні методи аналізу ділять на три групи: ►1. Методи
виділення. ►2. Методи
відгонки. ►3. Методи
осадження. У методах
виділення компонент, який визначають, виділяють у вільному стані й зважують
на аналітичних терезах. У методах
відгонки елемент або компонент, який визначають, переводять за
допомогою будь-якого реактиву в летку речовину, потім її відганяють і
поглинають. За збільшенням маси поглинача знаходять кількість визначуваного
компонента. Це прямий метод відгонки. У непрямих методах відгонки компонент,
що визначають, відганяють, а його масу знаходять як різницю між масами
речовини до і після відгонки. Так визначають вологість сировини і продуктів
харчування.
У методах
осадження наважку речовини, яку аналізують, переводять у розчин,
потім елемент, що визначають, осаджують у вигляді малорозчинної сполуки.
Осад відокремлюють
від розчину фільтруванням, потім його промивають, висушують, прожарюють,
охолоджують і зважують. Виходячи з маси осаду, що одержали після
прожарювання, обчислюють масу елемента, який визначають, і його масову частку
в аналізованій речовині. З усіх
перерахованих операцій найбільш важливою є операція осадження. Для осадження
кристалічних ліофобних і аморфних ліофільних осадів рекомендують брати
полуторний надлишок осаджувача й створювати умови, за яких буде досягнуте повне
осадження визначуваного компонента. Залишкова концентрація компонента, що
визначається, у розчині не має перевищувати 10-6 моль/л або 10-4
г/л – межа чутливості аналітичних терезів. Найкращим осаджувачем є
такий, який утворює найменш розчинну сполуку. Бажано, щоб він був леткою
речовиною, тоді домішки його в осаді видалятимуться під час прожарювання.
Окрім того, осаджувач має реагувати тільки з йонами, які осаджують, і не
реагувати з іншими, тобто бути специфічним. Специфічність реакції досягають
умовами проведення цієї реакції: певною кислотністю та введенням маскувальних
речовин, які зв’язують йони, що заважають визначенню. У гравіметричному
аналізі розрізняють осаджувану та гравіметричну форми осаду. Та форма, у
вигляді якої переводять визначуваний компонент в осад, називається осаджуваною,
а форма сполуки, яку отримують після прожарювання осаду, – гравіметричною. 3.1.2.2. Вимоги до осаджуваної та
гравіметричної форми Осаджувана та гравіметрична форми повинні задовольняти певні вимоги: ►1. Сполука,
що є осаджуваною формою, має бути малорозчинною, що необхідно для повного
осадження визначуваного елемента. ►2. Бажано,
щоб структура осаду давала можливість з достатньою швидкістю вести
фільтрування й відмивання його від домішок. Цій вимозі відповідають крупнокристалічні
осади. ►3. Під час
прожарювання форма осадження має легко й повністю перетворюватися у
гравіметричну форму. Гравіметрична форма повинна задовольняти такі вимоги: ►1. Склад її
має відповідати певній хімічній формулі, вона має бути стійкою до зовнішнього
середовища, не реагувати і не адсорбувати вологу та діоксиду вуглецю з
повітря. ►2. Бажано,
щоб частка визначуваного компонента у гравіметричній формі була якомога
меншою. При цьому помилка визначення буде також меншою. Важливим
параметром гравіметричного аналізу є маса наважки речовини, яку аналізують.
Її маса залежить від методу аналізу й характеру осаду. Вона не може бути дуже
великою або малою. У першому випадку буде велика кількість осаду, промити
його буде дуже важко. Якщо ж наважка занадто мала, то буде велика помилка під
час зважування й виконання інших операцій аналізу. Дослідним шляхом
визначили, що раціональною наважкою аналізованої речовини буде така, з якої
отримують приблизно 0,5 г гравіметричної форми, якщо форма осадження є кристалічним
ліофобним осадом, і 0,1-0,3 г гравіметричної форми, якщо форма осадження є
аморфним ліофільним осадом. Обчислити масу
наважки речовини, що аналізують, можна, користуючись такими формулами: - форма осадження
є кристалічним осадом:
- форма осадження
є аморфним осадом:
де
m, n – коефіцієнти; 0,1 і 0,5 –
раціональні наважки речовини, залежно від характеру осаду і форми осадження. 3.1.2.3. Етапи гравіметричного аналізу Метод осадження складається з таких етапів: ►1. Відбір
середньої проби для аналізу. Для цього
подрібнену речовину висипають у вигляді квадрата або кола, поділяють на
чотири сектори. Вміст двох протилежних секторів відкидають, а решту з’єднують
між собою (рис. 3.6).
Рис. 3.6. Схема підготовки первинної
середньої проби ►2.
Розрахунок величини наважки (за формулами (3.1) і (3.2)). ►3.
Зважування наважки. ►4.
Розчинення наважки. Розраховану
наважку переносять у хімічну склянку, розчиняють в 100 – 150 мл води. У разі
потреби суміш нагрівають. ►5.
Осадження речовини у вигляді малорозчинної сполуки. Під час осадження
слід враховувати те, що добутий осад має якомога менше розчинятися у воді.
Осад має бути крупнокристалічним. Для цього осадження ведуть із нагрітих
розчинів, які охолоджуються повільно. При цьому утворюються крупніші кристали
внаслідок розчинення дрібніших. ►6.
Відділення осаду (фільтрування). У гравіметричному
аналізі застосовують беззольні фільтри. Фільтри поділяють на декілька сортів
залежно від щільності паперу: • червона стрічка
– найменш щільні; • біла стрічка –
фільтри середньої щільності; • синя стрічка – фільтри
високої щільності, їх використовують для дрібнокристалічних осадів, наприклад
барій сульфату. Для фільтрування
лійку з фільтром закріплюють в кільце штатива, складають фільтр і переносять
його в лійку, а рідину обережно переливають по скляній паличці (рис. 3.7).
►7. Видалення
адсорбованих домішок (промивання осаду). У разі промивання
осаду дистильованою водою можливе часткове його розчинення. Тому для
промивання часто використовують розведений розчин осаджувача. ►8.
Переведення осаду в гравіметричну форму (висушування або прожарювання). Осад висушують
разом із фільтром. Лійку закривають вологим фільтрувальним папірцем, краї
паперу щільно притискають до зовнішньої поверхні. Висушують у сушильній шафі
(рис. 3.8) за температури 90-1050 С протягом 20-30 хвилин.
Для прожарювання осадів використовують фарфоровий, а в деяких випадках і платиновий тиглі,
які тримають тигельними щипцями (рис. 3.9).
Тигель попередньо прожарюють
і охолоджують. Фільтр з осадом згортають і переносять у тигель. Спочатку осад
прожарюють на електричній плитці, а потім – у муфельній печі 25-30 хвилин
(рис. 3.10).
Охолоджують в
ексикаторі (рис. 3.11). Повторно прожарюють протягом 15-20 хвилин до
постійної маси.
Якщо в ході
аналізу була допущена груба помилка (наприклад, пролито розчин, розсипано
осад), то весь гравіметричний аналіз слід повторити.
Контрольні питання 1. На які групи поділяють гравіметричні методи аналізу? 2. Які вимоги мають задовольняти осаджувальна та гравіметрична форми? 3. З яких етапів складається метод осадження? 4. Який посуд та обладнання використовують для прожарювання осадів? 3.1.3. Розрахунки в гравіметричному
аналізі Для виконання
обчислень у гравіметричному аналізі використовують чинник перерахунку. Фактор перерахунку
– це величина, що показує, скільки грамів визначної речовини містить 1 г
осаду.
Молярні (атомні) маси
речовин беруть з такими коефіцієнтами, щоб вони були еквівалентні одна одній,
тобто щоб вони містили однакову кількість атомів одного елемента.
де
Для розрахунку
маси досліджуваної речовини та її масової частки користуються формулами:
де
3.1.3.2. Вологість харчових продуктів Вологість харчового продукту – це вміст пологи в продукті. Розрізняють вологість
фактичну, нормальну та нормовану. Фактична вологість – це вміст вологи у момент дослідження. Нормальна вологість – це рівноважна вологість продукту, яку він набуває за витримування
певний час в стандартних умовах. Нормована вологість – це умовна вологість, що регламентується нормативною документацією на
певний вид продукту. Вологість
визначають прямим і непрямим методами. Вологість продукту розраховують за формулою:
де: Розбіжність між двома визначеннями не має перевищувати
0,2-0,3 %. Застосовують також і прискорений метод, який
відрізняється тим, що продукт переносять в бюкс наважкою 3-5 г, і температуру
висушування збільшують від 1200 С до 1500 С (м’ясні
продукти). Для більшості продуктів температура становить 1300 С. 3.1.3.3. Приклади гравіметричних розрахунків Приклад 1. Розрахуйте гравіметричні чинники для таких
компонентів:
Розв’язання:
Приклад 2. Визначте масову частку хлорид-йонів у зразку, якщо з наважки масою 1,0000
г отримали 0,2040 г гравіметричної форми Розв’язання: найбільш поширений метод визначення вмісту хлорид-йонів – це їх
осадження у вигляді арґентум хлориду:
Переведення
осадженої форми у гравіметричну відбувається шляхом висушування осаду:
Для розрахунку
вмісту хлорид-йонів треба розрахувати фактор перерахунку за рівнянням (3.3):
Масову частку
хлорид-йонів визначимо за рівнянням (3.5):
Приклад 3. Пісочне печиво наважкою 6,368 г висушили. Маса сухого виробу стала
дорівнювати 5,318 г. Визначте вологість печива у %. Розв’язання: розрахуємо масу води, що була виділена:
вологість
дорівнює:
Контрольні питання 1. Що таке фактор
перерахунку? 2. Що таке вологість харчового продукту? 3. За якою формулою розраховують вологість?
3.2.1. Теоретичні положення
титриметричного аналізу 3.2.1.1. Поняття про титриметричний
аналіз Одним із поширених
методів аналізу для експресного визначення середніх та високих концентрацій
розчинів є титриметрія.
Якщо порівняти
гравіметричний і титриметричний методи аналізу, то можна зробити висновок, що
вони за своєю суттю й методикою роботи значно відрізняються. Якщо в
гравіметричному аналізі вимірюють масу продукту реакції, то в титриметричному
– об’єм розчину реактиву відомої концентрації, який витрачено на взаємодію з
розчином речовини, що визначається. Гравіметричний аналіз є найбільш точним
хімічним методом аналізу. Але він має і суттєвий недолік, який полягає в його
тривалості. Титриметричний аналіз щодо цього має великі переваги. Він більш
швидкий і поширений. Титриметричний
аналіз має низьку чутливість (10-3 – 10-1 моль/л) і в
деяких випадках невисоку селективність. Титриметричні методи часто
застосовують для технічного аналізу в контролі якості сировини, продуктів
харчування, об’єктів навколишнього середовища, фармацевтичних препаратів
тощо. За допомогою титриметричного аналізу визначають кислотність харчових
продуктів, уміст білкових речовин, деяких вітамінів, виконують аналіз
рослинних і тваринних жирів на їх відповідність вимогам стандарту, якості
води і напоїв, контролюють технологічні процеси майже у всіх видах промисловості. Найголовнішими
операціями титриметричного аналізу є: приготування робочих (титрованих)
розчинів, вимірювання їх об’ємів та процес титрування. Ця назва походить
від слова «титр», що кількісно виражає масу речовини в 1 мл (см3) розчину.
Точку еквівалентності
в титриметричному аналізі фіксують візуально, за зміною кольору індикатора
або самого розчину. Також існують фізико-хімічні методи фіксації точки
еквівалентності за зміною рН, оптичної густини, електропровідності та інші.
Етапи титриметричного аналізу схематично відображено на рис. 3.12.
Рис. 3.12. Етапи титриметричного аналізу 3.2.1.2. Вимоги до реакцій, що їх
застосовують в титриметричному аналізі ►1. Реакції
мають відбуватися згідно з рівнянням реакції, тобто бути стехіометричними. ►2. Реакція має
відбуватися кількісно й необоротно, з повнотою проходження 99,9 %. ►3. Реакція
між титрантом і розчином аналіту має відбуватися достатньо швидко. ►4. Титрант
має реагувати тільки з визначуваною речовиною, тобто реакція має бути
селективною. ►5. Точка еквівалентності
має фіксуватися надійним способом. ►6. Розчин
аналіту не має містити речовини, що заважають перебігу основної реакції, або
не дають можливості фіксувати точку еквівалентності. 3.2.1.3. Класифікація методів
титриметричного аналізу У титриметричному
аналізі застосовують різні типи хімічні реакції. Ці типи хімічних реакції і
покладено в основу класифікації титриметричних методів аналізу (рис. 3.13).
Рис. 3.13. Класифікація методів титриметричного аналізу ►1. Метод кислотно-основного титрування В основу цього
методу покладено кислотно-основні реакції, пов’язані зі зміною кислотності
розчину в процесі титрування. Це реакції нейтралізації та взаємодії основ з
кислими солями, солями, що під час гідролізу дають кисле середовище, або
взаємодія кислот із солями, що під час гідролізу дають лужне середовище.
Різку зміну рН спостерігають в точці еквівалентності. Для її фіксації
використовують рН-індикатори, які змінюють своє забарвлення залежно від рН
розчину. ►2. Метод окисно-відновного титрування В основу цього
методу покладено реакції окиснення – відновнення. У процесі титрування
змінюється потенціал розчину. Для визначення точки еквівалентності використовують
окисно-відновні (редокс) індикатори, які змінюють своє забарвлення залежно
від потенціалу розчину. Існують методи окисно-відновного титрування, у яких
робочий розчин сам є індикатором (перманганатометрія). ►3. Метод осадження У методі осадження
застосовують реакції утворення малорозчинних сполук. Точку еквівалентності
визначають за допомогою індикаторів спеціального призначення. ►4. Метод комплексоутворення У методі
комплексоутворення використовують реакції утворення комплексних сполук. Точку
еквівалентності в цьому методі визначають за допомогою спеціальних
індикаторів. Використання
різноманітних хімічних реакції надає титриметричному методу аналізу
універсальності, широкого застосування. Крім того, метод вирізняється високою
швидкістю й охоплює велику кількість об’єктів аналізу. За способом
титрування поділяється на пряме і непряме. За прямого титрування визначуваний компонент (аналіт) безпосередньо титрується робочим
розчином. Наприклад, розчин хлоридної кислоти можна відтитрувати стандартним
розчином лугу:
Існує багато речовин,
які не можна відтитрувати прямим методом. Це пояснюється кінетичними
труднощами або неможливістю фіксувати точку еквівалентності. У таких випадках
використовують методи непрямого титрування. Він, у свою
чергу, поділяється на метод заміщення та метод залишків. У методі
заміщення визначувані йони замішують еквівалентну кількість інших,
які вже можна відтитрувати. Наприклад, під час визначення активного хлору у
воді до неї додають невеликий надлишок калій йодиду, який під час реакції з
хлором утворює еквівалентну кількість йоду:
Вільний йод легко
відтитровується стандартним розчином натрій тіосульфату. У методі
залишків (методі зворотного титрування) до розчину досліджуваних
йонів додають відміряну кількість титрованого розчину реактиву (титрант-1),
взятого в надлишку проти кількості визначуваних іонів, і титрують надлишок
реактиву відповідним робочим розчином (титрант-2). Знаючи об’єм і
концентрацію уведеного розчину реактиву й визначивши його надлишок, який не
вступив у реакцію, легко обчислити, скільки реактиву витрачено на взаємодію з
досліджуваними йонами, а звідси можна знайти й кількість визначуваної
речовини. Наприклад, під час визначення MgO
на наважку речовини діють надлишком титрованого розчину хлоридної
кислоти: і цей надлишок відтитровують стандартним розчином лугу.
Знаходять
кількість хлоридної кислоти, що прореагувала з магній оксидом, а звідси й
кількість MgO у досліджуваному
об’єкті. Прийоми титрування ►1. Спосіб піпетування Визначений об’єм
розчину досліджуваної речовини відбирають за допомогою піпетки, потім
переносять у конічну колбу і титрують робочим розчином. ►2. Спосіб окремих наважок Точну наважку речовини
переносять у конічну колбу, розчиняють у довільному об’ємі води й титрують
робочим розчином. Розрахунки вмісту досліджуваної речовини будуть в цих
випадках різними. Схематично прийоми зображено на рис. 3.14.
Контрольні питання 4. Що таке точка еквівалентності? 5. Які вимоги до реакцій у титриметрії? 6. Як класифікують методи титриметричного аналізу? 7. Які існують способи титрування? 3.2.2.1. Поняття про реальні та умовні частинки Для з’ясування
поняття «еквівалент» необхідно розрізняти реальні й умовні частинки.
Наприклад, Експериментально
доведено, що в 12 г вуглецю міститься 6,02·1023 атомів Карбону-12.
Ця величина має назву числа Авогадро. Відповідно 1 моль атомів, молекул,
йонів містить число Авогадро цих частинок. Наприклад, 1 моль
атомов Mg = 6,02×1023 атомів Магнію, 1 моль йонів Mg2+=
6,02×1023 йонів Магнію, 1 моль молекул СO2 =
6,02×1023 молекул вуглекислого газу. Кількість речовини
знаходять як відношення маси речовини до молярної маси:
де
3.2.2.2. Фактор еквівалентності
Чинник
еквівалентності може дорівнювати 1, або бути в z разів менше 1:
Наприклад, у
кислотно-основній реакції fe(H2SO4) =
Наприклад, fe(KMnO4) =
Наприклад, для
простих речовин:
Для атомів хімічного елемента: Для бінарних сполук молярна маса еквівалента сполуки дорівнює сумі
молярних мас еквівалентів обох елементів.
Її розраховують як
відношення маси речовини до молярної маси еквівалента речовини:
Наприклад,
Для розрахунку фактора
еквівалентності та молярної маси еквівалента слід враховувати хімічну
реакцію, у якій бере участь певна речовина. ►Для кислот фактор еквівалентності можна розрахувати за числом йонів Гідрогену (z) , якими вони обмінюються.
еквівалент кислоти
дорівнюватиме:
Молярна маса
еквівалента кислоти дорівнюватиме:
Наприклад, для
хімічної реакції:
Фактор еквівалентності
сульфатної кислоти дорівнюватиме 1, оскільки лише один йон Гідрогену бере
участь у реакції нейтралізації. Молярна маса
еквівалента дорівнюватиме молярній масі молекули.
Якщо відбувається
повна нейтралізація кислоти за рівнянням:
то в цьому випадку
фактор еквівалентності дорівнюватиме 1/2, оскільки в реакції бере участь два йони
Гідрогену. Молярна маса еквівалента дорівнюватиме відповідно:
►Для основ фактор еквівалентності залежатиме від кількості гідроксильних груп, що
беруть участь у хімічній реакції:
Молярна маса
еквівалента основи дорівнюватиме:
Наприклад, для
хімічної реакції:
у ній беруть
участь дві гідроксильні групи й фактор еквівалентності дорівнюватиме:
►Для солей фактор еквівалентності залежатиме від числа заміщених йонів металу (n) та заряду йона металу (Z):
Молярна маса
еквівалента солі дорівнюватиме:
Наприклад, для
алюміній сульфату фактор еквівалентності дорівнюватиме:
►Для
окисників (Ox) та відновників (Red) фактор еквівалентності залежатиме від кількості відданих
відновником та прийнятих окисником електронів:
Молярна маса
еквівалента окисника (відновника) дорівнюватиме співвідношенню:
Наприклад, калій
перманганат бере участь в окисно-відновній реакції, що описується скороченим йонно-електронним
рівнянням:
Перманганат-йон,
як окисник, приймає п’ять електронів, відповідно фактор еквівалентності калій
перманганату дорівнюватиме:
а молярна маса
еквівалента дорівнюватиме відповідно:
Для хімічної
реакції:
Кількість
еквівалентів однієї речовини реагує з такою самою кількістю еквівалентів
іншої речовини й утворюється така сама кількість еквівалентів продуктів реакції:
Співвідношення мас
реагуючих речовин і продуктів дорівнюватиме:
Існують і
експериментальні методи визначення еквівалента та молярної маси еквівалента
речовини.
Контрольні питання 1. Які частинки належать до реальних і умовних? 3. Що таке фактор еквівалентності? 5. Що таке молярна маса еквівалента?
3.2.3. Концентрація титрованих розчинів У титриметричному
аналізі існують декілька способів виразу складу розчину. Розглянемо
найголовніші з них.
►Титр вказує
масу речовини, що міститься в 1 мл (см3) розчину.
де T – титр, г/мл
(г/см3); m – маса
розчиненої речовини, г; V – об'єм
розчину, мл (см3).
►Молярна концентрація
вказує кількість розчиненої речовини, що міститься в 1 л (дм3)
розчину.
де Форма запису: С(HNO3) = 0,2500 моль/л або
0,2500 М HNO3. Остання форма запису відрізняється
від стандарту SІ, але трапляється в літературі.
►Масова
частка розчиненої речовини вказує на масу речовини, що міститься в 100 г розчину.
Виражається найчастіше у відсотках.
де 3.2.3.3. Молярна концентрація еквівалента
►Молярна
концентрація еквівалента вказує кількість еквівалентів розчиненої речовини,
що міститься в 1 л (дм3) розчину.
де У літературі
трапляється термін «нормальність», що відповідає терміну «молярна
концентрація еквівалента», але він є застарілим. У літературних джерелах і
нормативній документації інколи вказують молярну концентрацію еквівалента
(нормальність) таким чином: 0,1н NaOH,
0,05 н КMnO4. Таке
позначення не рекомендоване системою SІ. Зв’язок молярної
концентрації речовини або молярної концентрації еквівалента речовини з
масовою часткою розчиненої речовини й густиною розчину
Зв’язок між молярною
концентрацією еквівалента і титром:
3.2.3.4. Титр за визначуваною речовиною
Наприклад,
Співвідношення
показує, скільки грам Цим титром зручно
користуватися, коли виконують серію титрувань однієї й тієї самої речовини
одним робочим розчином. Під час
розрахунків у значенні титру й молярної концентрації еквівалента слід
залишати чотири значущі цифри. В значенні титру вказують шість
десяткових знаків. Маса речовини, що
міститься в розчині з певною молярною концентрацією еквівалента,
розраховується за формулою:
Приклад 1. Розрахуйте кількість речовини еквівалентів, що міститься в 1,1460 г
натрій карбонату Na2CO3. Розв’язання:
Приклад 2. Розрахуйте масу речовини, що міститься в 200 мл розчину NaCl з молярною концентрацією 0,2000
моль/л. Розв’язання:
Приклад 3. Наважку безводного натрій карбонату Na2CO3 1,1520
г розчинили в 1 л води. Розрахуйте титр отриманого розчину, молярну
концентрацію еквівалента, титр соди за хлоридною
кислотою Розв’язання: для розрахунку простого титру скористаємося формулою:
Для розрахунку
молярної концентрації еквівалента розрахуємо молярну масу еквівалента соди:
Молярну
концентрацію еквівалента розраховують за формулою:
Складний титр
розраховуємо за формулою:
Контрольні питання 2. Що таке молярна концентрація? 3. Що таке молярна концентрація еквівалента? 4. Що таке титр за визначуваною речовиною?
3.2.4. Об’ємно-аналітичні розрахунки 3.2.4.1. Закон еквівалентів в
титриметричних розрахунках В
об’ємно-аналітичних розрахунках прийнято, що речовини реагують між собою в
еквівалентних кількостях. Якщо розчини мають однакове значення молярної
концентрації еквівалента, то їх об’єми, що витрачаються на титрування, будуть
однаковими. Якщо концентрація їх відрізнятиметься, то об’єми розчинів, що
витрачаються на титрування, будуть обернено пропорційні їх молярним
концентраціям еквівалента. Згідно із законом еквівалентів:
де 3.2.4.2. Титриметричні розрахунки за
прямого титрування Для розрахунку
титру аналіту (Х) користуються
формулою:
де Для знаходження
маси наважки аналіту в об’ємі мірної колби
Загальна формула
для визначення масової частки аналіту в досліджуваному зразку:
де
Якщо для аналізу
було застосовано титр за визначуваною речовиною, то масу досліджуваної
речовини розраховують за формулою:
де Маса визначуваного
компонента в довільному об’ємі колби дорівнюватиме:
де
Масова частка
компонента в досліджуваному зразку розраховуватиметься за формулою:
де Якщо в методі
окремих наважок слід визначити масу компонента в речовині за об’ємом
титранту, концентрація якого виражена у вигляді титру за визначуваною
речовиною, то користуються формулою:
де
3.2.4.3. Титриметричні розрахунки за
зворотного титрування За зворотного
титрування до аналіту додають надлишок розчину реагенту, а залишок реагенту,
що не прореагував, титрують відповідним титрантом. На титрування взято певний
об’єм розчину визначуваної речовини із загального об’єму колби. До нього
долито точний надлишковий об’єм першого робочого розчину. Залишок останнього
титрують другим робочим розчином. Для
розрахунку маси речовини в наважці в цьому способі користуються формулою:
де Для розрахунку
масової частки визначуваного компонента в зразку користуються формулою:
►Спосіб окремих наважок До наважки визначуваної
речовини, що розчинена в довільному об’ємі води, долито надлишок титрованого
робочого розчину точного об’єму
Приклад 1. На титрування 22,00 мл розчину натрій гідроксиду витрачено 20,00 мл
розчину оксалатної кислоти, Розв’язання: за законом еквівалентів:
Розрахуємо титр
розчину лугу за формулою:
Приклад 2. Наважку безводного натрій карбонату розчинили в мірній колбі об’ємом 200
мл. На титрування аліквоти цього розчину об’ємом 20,00 мл було витрачено 22,00
мл 0,09951 моль/л розчину хлоридної кислоти. Яка наважка натрій карбонату
містилась у мірній колбі? Розв’язання: молярна концентрація еквівалента натрій карбонату становить:
Розрахуємо
наважку:
Приклад 3. Зразок питної соди масою 0,2000 г розчинили у воді. На титрування
розчину соди витратили 20,00 мл 0,1000 моль/л розчину хлоридної кислоти.
Розрахуйте масову частку NaHCO3
у соді. Розв’язання: фактор еквівалентності NaHCO3
дорівнює одиниці, а молярна маса еквівалента – 84 г/моль. Масова частка NaHCO3 розраховується за
формулою:
Приклад 4. Для визначення вмісту Кальцію наважку мінералу масою 0,5215 г розчинили
в 50,00 мл 0,1018 моль/л HCl. Після
закінчення хімічної реакції надлишок хлоридної кислоти відтитрували 23,70 мл
0,1037 моль/л NaOH. Розрахуйте
масову частку Кальцію в мінералі. Розв’язання: скористаємося формулою для розрахунку масової частки речовини за
зворотного титрування способом окремих наважок:
Оскільки
Кальцій – метал двовалентний:
Контрольні питання 1. Як розраховують титр аналіту за прямого титрування (спосіб
піпетування? 2. Як розраховують масу визначуваного компонента за прямого титрування
(спосіб окремих наважок)? 3. В чому полягає спосіб піпетування за зворотного титрування?
3.2.5. Лабораторний посуд для об’ємного
аналізу 3.2.5.1. Лабораторний посуд для титриметричного
аналізу Для проведення
об’ємного аналізу потрібен хімічний посуд спеціального призначення. ►Мірні колби (рис. 3.15)
використовують в титриметричному аналізі для приготування розчинів з точно
відомою концентрацією. Мірна колба має довге вузьке горло, на якому нанесено
кільцеву позначку, до якої наливається рідина.
Як і кожний мірний
посуд, мірна колба перед застосуванням має бути ретельно вимита й промита
дистильованою водою. Мірні колби, як і інший вимірювальний посуд, калібрують
за температури 20 0С. Тільки за цієї температури об’єм відповідає
зазначеному на колбі. Наповнюють мірну колбу спочатку через вставлену в неї
лійку, а під кінець з піпетки. Доливають рідину
краплями, доки нижній край меніска не доторкнеться риски на колбі. Око при
цьому слід тримати на рівні риски (рис. 3.16).
►Мірні циліндри та мензурки (рис. 3.17) –
мірний посуд для відмірювання приблизних об’ємів рідини. Оскільки вони мають
великий діаметр, то точність їх вимірювання знижується. Похибка становить 0,2
– 0,3 мл.
►Піпетки використовують для
відмірювання аліквоти рідини (точно відміряної порції). Вони являють собою
довгі вузькі трубки з розширенням посередні й кільцевою позначкою. На
піпетках вказують їх об’єм і температуру, за якої вони були градуйовані.
Піпетки є об’ємом 1, 2, 5, 10, 15, 20, 25, 50, 100 мл. Крім звичайних піпеток
(піпеток Мора), існують і градуйовані піпетки. Зберігають піпетки в
спеціальних штативах. Перед застосуванням їх ретельно миють і промивають
дистильованою водою. Перед відбором аліквоти піпетку ополіскують тим
розчином, який будуть відміряти. Для відмірювання
точного об’єму рідини піпетку занурюють у розчин і за допомогою гумової груші
або балону (для піпеток з клапаном) її заповнюють рідною вище риски.
Затикають отвір піпетки вологим вказівним пальцем (не великим!) правої руки.
Тримають піпетку великим і середнім пальцями. За такого прийому торкання
піпетки рукою та її нагрівання від тіла мінімальне. Зайву рідину обережно
випускають, доки нижній край меніска не торкнеться риски. Око дослідника має
при цьому розташовуватися перпендикулярно позначки (рис. 3.18).
Рис 3.18. Піпетки і вимірювання аліквоти Піпетку переносять
у інший підготовлений посуд (наприклад, у конічну колбу) і, тримаючи її
вертикально, дають вилитися рідині. Після цього торкаються кінцем піпетки стінок
колби і дають вилитись останній краплі (рис. 3.19). У жодному разі залишок не
видувають!
►Бюретки – це вузькі, градуйовані скляні трубки зі скляним краном або гумовим
затискачем (рис. 3.20). Точність вимірювання 0,1 мл. Під час титрування
розчинами йоду, калій перманганату, аргентум нітрату використовують тільки
бюретки зі скляним краном, оскільки ці речовини псують гуму. А луги, навпаки,
руйнують шліфи скляного крану, тому їх не застосовують.
Перед
використанням бюретки миють і ополіскують розчином титранту. Бюретки
закріплюють у штативі (рис. 3.21) і за допомогою лійки заповнюють розчином
титранту, при цьому спочатку відкривають кран або затискувач. Це необхідно,
щоб не залишилося пухирців повітря.
Далі проводять
титрування за такими правилами. ►1. Кожне
титрування починають з нульової поділки, що значно знижує похибку. ►2. Випускають
розчин із бюретки повільно (3-4 краплі за секунду). ►3. Об’єм
рідини, що витрачається на титрування, не має перевищувати місткість бюретки. ►4.
Титрування виконують не менше ніж тричі й беруть середнє значення. ►5. Під час
вимірювання об’єму око слід тримати точно на рівні рідини. Якщо цього не
дотримуватися, вимірювання будуть неправильними (рис. 3.22).
►6. Під час титрування
слід кран (затискач) тримати лівою рукою, а правою тримають конічну колбу,
перемішуючи її вміст обертальними рухами (рис. 3.23).
►7. Під
колбою для титрування має бути білий фон. ►8. Відлік
поділок на шкалі знімають за нижнім краєм меніска, якщо рідина безбарвна.
Якщо рідина забарвлена (розчин йоду, калій перманганату), то за верхнім краєм
меніска. ►9. Під час
титрування слід додавати якомога менше індикатора. ►Конічна колба (колба Ерленмейєра) не є мірним посудом, але її широко застосовують під
час титрування. Її відрізняє конічний корпус і плоске дно (рис. 3.24).
Контрольні питання 1. Яке призначення мірної колби? 2. Де застосовують мірні циліндри та мензурки? 3. Поясніть призначення піпеток. 4. Поясніть правила користування бюретками. 5. Які правила титрування відомі? 3.2.6. Приготування стандартних розчинів 3.2.6.1. Вимоги до стандартних розчинів Титровані розчини
повинні мати точно відому концентрацію. Їх можна приготувати різними
способами. Залежно від цього розрізняють первинний
стандарт – речовину, з наважки якої можна приготувати титрований
розчин. Такі речовини мають відповідати низці вимог: ►1. Склад
речовини має точно відповідати хімічній формулі. ►2. Речовина
має бути хімічно чистою (х.ч. або ч.д.а). ►3. Речовина
має бути стійкою під час збереження за кімнатної температури у твердому стані
й у вигляді розчину. ►4. Реакція
між первинним стандартом і титрантом має відбуватися швидко і стехіометрично. ►5. Речовини
повинні мати за можливості велике значення молярної маси, оскільки за збільшення
маси речовини під час зважування зменшується відносна похибка досліду. Речовин, які мають
перелічені властивості, на так багато. До них належать, наприклад, оксалатна
(щавлева) кислота – H2C2O4 · 2H2O, натрій карбонат – Na2CO3, натрій тетраборат (бура) Na2B4O7 · 10H2O, калій оксалат K2C2O4 , калій біхромат K2Cr2O7 та деякі інші. Під час
приготування стандартного розчину із установочної речовини, що відповідає цим
вимогам, діють таким чином: точну наважку речовини, взяту на аналітичних
терезах, переносять в мірну колбу, розчиняють в 1/3 об’єму води й доводять
об’єм розчину водою до позначки. Для
титриметричного аналізу дуже часто застосовують такі титранти, як кислоти,
луги, калій перманганат, розчин йоду, натрій тіосульфат. Усі ці речовини не
задовольняють вимоги, що ставляться до вихідних речовин. Мінеральні кислоти
не мають постійного складу, луги реагують з вуглекислим газом повітря,
поглинають воду. Окисники й відновники (калій перманганат, йод, натрій
тіосульфат) змінюються вже навіть під час розчинення. Тому розраховані
наважки цих речовин (або об’єми) розчиняють у певному об’ємі води й
стандартизують їх титриметричним методом за первинними стандартами. Розчини, титр яких
знайдений не за точною наважкою, а встановлений за первинним стандартом,
називають стандартизованим (або розчином вторинного стандарту). 3.2.6.2. Поняття про поправковий
коефіцієнт Для таких розчинів
широко застосовують поправковий коефіцієнт.
де У таких випадках у
розрахунках використовують добуток номінальної концентрації на поправковий
коефіцієнт. 3.2.6.3. Приготування стандартних
розчинів із фіксаналів Ще одним методом
приготування титрованих розчинів є застосування фіксаналу (стандарт-титру).
Промисловість
випускає фіксанали у вигляді розчинів і у вигляді сухих речовин. Для приготування
стандартних розчинів із фіксаналу в горло колби вставляють лійку і вкладають
скляний бойок. Об цей бойок і розбивається ампула (рис. 3.25). Потім другим
бойком пробивають верхню частину ампули. Вміст переносять у мірну колбу.
Через отвір ампулу промивають водою, лійку приймають і доводять вміст колби
водою до позначки.
Контрольні питання 1. Що таке первинний стандарт? 2. Які вимоги до первинних стандартів? 3. Що таке поправковий коефіцієнт? 4. Що таке
фіксанали? Як готувати стандартні розчини за їх допомогою? 3.2.7. Метод кислотно-основного
титрування 3.2.7.1. Сутність кислотно-основного
титрування
Цим методом
користуються для кількісного визначення основ, солей, що зазнають гідролізу,
кислот. Метод кислотно-основного титрування застосовують для визначення
кислотності молока й молочних продуктів, жирів, хліба, борошна та кондитерських
виробів, безалкогольних напоїв, вмісту молочної кислоти в продуктах
молочно-кислого бродіння, визначення карбонатної твердості води тощо. Згідно з природою
титранту методи кислотно-основного титрування поділяють на ацидиметрію
(титрант – кислота, від латинської «acid») та алкаліметрію (титрант – луг,
від латинського слова «alkaly»). Стислу характеристику методів наведено в
табл. 3.1. Таблиця 3.1 Характеристика методів кислотно-основного титрування
3.2.7.2. Кислотно-основні індикатори та
принцип їх вибору
Згідно з йонною
теорією індикаторів, що запропонована В. Оствальдом (1894 р), індикатори – це
слабкі органічні кислоти чи основи, у яких недисоційовані молекули та йони
мають різне забарвлення. Індикатори, що
здатні приєднувати протон, мають основні властивості. Такі індикатори
дисоціюють за схемою:
Індикатори, що
мають властивість віддавати протон, є кислотними:
До таких
індикаторів належить фенолфталеїн. У разі додавання
до розчину фенолфталеїну лугу йони ОН-
зв’язуватимуть протони в молекули води. При цьому рівновага зміщуватиметься
праворуч з утворенням аніонів Фенолфталеїн
належить до одноколірних індикаторів. У сильно-лужному середовищі він
забарвлюється в малиновий колір:
Типовим
двоколірним індикатором є метиловий оранжевий. У водних розчинах він оранжевий, за
У табл. 3.2 наведено
характеристику деяких кислотно-основних індикаторів. Таблиця 3.2 Характеристика деяких кислотно-основних індикаторів
Вимоги до кислотно-основних індикаторів ►1.
Мінімальний інтервал зміни забарвлення. ►2.
Контрастний перехід забарвлення. ►3.
Стабільність забарвлення індикатора. ►4. Оборотність
зміни забарвлення. ►5. Зміна
забарвлення повинна відбуватися за мінімальних кількостей кислоти або лугу. У методі
кислотно-основного титрування індикатор вибирають так, щоб його рТ збігався
або наближався до точки еквівалентності, інтервал зміни його забарвлення
розташовувався в межах стрибка на кривій титрування.
3.2.7.3. Види кислотно-основного
титрування Титрування сильної кислоти сильною основою Під час титрування
сильної кислоти сильною основою, наприклад:
точка еквівалентності
збігається з точкою нейтральності (рН 7). У фенолфталеїна показник титрування
дорівнює 9. Під час титрування із цим індикатором титрування закінчується не
в точці еквівалентності, а за досить незначного надлишку лугу. Цей надлишок
становить частини краплі, чим можна нехтувати. У метилового
оранжевого показник титрування дорівнює 4. Цей показник входить в інтервал
стрибка рН на кривій титрування (рис. 3.26).
Застосовуючи цей
індикатор, недотитровують кислоту лише на 0,1 %, що є дуже незначною
помилкою.
Титрування слабкої кислоти сильною основою Прикладом цього
виду титрування може бути взаємодія натрій гідроксиду з оцтовою кислотою:
Оскільки оцтова
кислота є слабкою, то перед початком титрування рН розчину оцтової кислоти матиме
більше значення, ніж хлоридної. Під час титрування в ході реакції утворюється
натрій ацетат, який гідролізується з утворенням надлишку гідроксильних йонів ОН-. Тому в цьому випадку
точка еквівалентності не збігатиметься з точкою нейтральності й буде
розташована в лужній ділянці (рН 8,9), що бачимо на кривій титрування (рис.
3.27).
Його показник
титрування входить у межі стрибка титрування слабкої кислоти сильною основою.
Метиловий оранжевий, метиловий червоний не можуть бути використані в цьому
випадку, оскільки їх показники титрування не входять в інтервали стрибка. Титрування слабкої основи сильною кислотою Прикладом цього
виду титрування може бути титрування розчину амоніаку хлоридною кислотою:
Під час
нейтралізації розчину амоніаку хлоридною кислотою утворюється сіль – амоній
хлорид. Під час гідролізу цієї солі утворюється надлишок катіонів Н+. Тому в цьому випадку
точка еквівалентності також не збігатиметься з точкою нейтральності й буде
розташована в кислій ділянці за
Під час титрування
слабкої основи сильною кислотою межі стрибка титрування лежать від рН 4 до рН
6,2.
Титрування слабкої
кислоти слабкою основою не виконується, оскільки точку еквівалентності
зафіксувати неможливо.
3.2.7.4. Приготування стандартних
розчинів для кислотно-основного титрування Приготування стандартних розчинів для кислотно-основного титрування Оскільки неорганічні
кислоти й луги не задовольняють вимоги, що ставляться до первинних
стандартів, то готують їх розчини приблизної концентрації і уточнюють
(стандартизують) за речовинами-первинними стандартами. Стандартизація розчину хлоридної кислоти за натрій тетраборатом (бурою) Для стандартизації
робочого розчину HCl як первинний
стандарт використовують натрій тетраборат (Na2B4O7 × 10H2O), який взаємодіє з кислотою за рівнянням:
Натрій тетраборат
під час зберігання втрачає частину кристалізаційної води, тому перед
приготуванням цю сіль потрібно перекристалізувати. Для титрування
використовують розчин з концентрацією Приготування розчину первинного стандарту натрій тетраборату. Розраховують масу
наважки натрій тетраборату, необхідну для приготування 200 мл розчину з концентрацією:
У скляному бюксі
зважують (точна наважка) необхідну кількість натрій тетраборату, переносять
через лійку в мірну колбу місткістю 200 мл, після чого бюкс із залишками
натрій тетраборату знову зважують. Наважку в мірній колбі розчиняють в
гарячій воді, змиваючи з лійки залишки солі водою з промивалки в мірну колбу.
Після повного розчинення наважки розчин охолоджують і тільки тоді доводять
об’єм розчину водою до позначки, закривають корком і ретельно перемішують. За масою наважки
розраховують молярну концентрацію розчину первинного стандарту натрій
тетраборату, а також молярну концентрацію еквівалента. Стандартизація розчину хлоридної кислоти. У плоскодонну
колбу місткістю 100 мл відбирають
піпеткою 25 мл розчину первинного стандарту натрій тетраборату, додають 1-2
краплі розчину метилового червоного й титрують за постійного перемішування
розчином HCl до зміни забарвлення
розчину від жовтого до червоно-оранжевого. Титрування
повторюють до одержання відтворюваних результатів. На основі одержаних
результатів розраховують молярну концентрацію розчину хлоридної кислоти. Якщо як індикатор використовують
метиловий оранжевий, то необхідно в іншій колбі для титрування приготувати
«свідок». Для цього циліндром відміряють 50 мл води, додають 1-2 краплі
метилового оранжевого і 1 краплю хлоридної кислоти з бюретки; розчин матиме
слабке рожеве забарвлення. Титрування розчину натрій тетраборату розчином HCl
виконують до появи такого самого забарвлення, як забарвлення розчину
«свідка». Стандартизація розчину натрій гідроксиду за оксалатною (щавлевою)
кислотою Розчин лугу
стандартизують за первинним стандартом – розчином оксалатної кислоти.
Оксалатна кислота (Н2С2О4 × 2Н2О) у процесі зберігання втрачає
частину кристалізаційної води, тому перед використанням її бажано
перекристалізувати. Слід також мати на увазі, що розчин оксалатної кислоти з
часом може змінювати концентрацію. Приготування розчину первинного стандарту оксалатної кислоти. Розраховують масу
наважки оксалатної кислоти, необхідну для приготування 100 мл розчину
концентрацією С(1/2 Н2С2О4 × 2Н2О)= 0,0500 моль/л. У фарфоровому
тиглі або скляному бюксі зважують (точна наважка) необхідну кількість
оксалатної кислоти, переносять через лійку в мірну колбу місткістю 100 мл,
після чого тигель із залишками оксалатної кислоти знову зважують. Наважку в
мірній колбі розчиняють у воді, змиваючи з лійки залишки кислоти водою з
промивалки в мірну колбу. Після повного розчинення наважки об’єм розчину в
колбі доводять до мітки водою, закупорюють колбу корком і ретельно
перемішують. За масою наважки
розраховують титр розчину первинного стандарту оксалатної кислоти та молярну
концентрацію еквівалента. Стандартизація розчину натрій гідроксиду У конічну колбу
місткістю 100 мл переносять піпеткою 10 мл розчину первинного стандарту Н2С2О4 × 2Н2О, додають 1-2 краплі фенолфталеїну і титрують розчином лугу до
появи блідо-рожевого забарвлення. Титрування
повторюють до одержання відтворюваних результатів. На основі одержаних
результатів розраховують молярну концентрацію розчину натрій гідроксиду.
3.2.7.5. Застосування кислотно-основного
титрування Визначення карбонатної твердості води
Розрізняють
твердість тимчасову (карбонатну), яка зумовлена наявністю гідрогенкарбонатів
Кальцію і Магнію, та постійну, яка характеризується наявністю сульфатів,
хлоридів і нітратів Кальцію та Магнію. Сума тимчасової і постійної твердості
дають загальну твердість, у такій воді наявні всі солі Кальцію і Магнію.
Карбонатну твердість води визначають методом кислотно-основного титрування. У конічну колбу
для титрування відбирають 100 мл аналізованої води. Додають 2-3 краплі
розчину метилового оранжевого й титрують розчином хлоридної кислоти з
концентрацією 0,1000 моль/л до появи рожевого забарвлення. Титрування
виконують тричі, для розрахунків беруть середнє значення об’ємів розчину
хлоридної кислоти, що витрачено на титрування аналізованої води. Карбонатну
твердість води розраховують за формулою:
де
Визначення масової частки оцтової кислоти в оцті спиртовому харчовому
натуральному (за ДСТУ 2450 – 94) У мірну колбу
об’ємом 100 мл за допомогою піпетки вносять 5 мл столового оцту. Доводять об'єм
дистильованою водою до риски. Перемішують розчин. У конічну колбу вносять 10
мл добутого розчину оцту, додають 2-3 краплі 1% розчину фенолфталеїну.
Титрують розчином NaOH (С = 0,1000
моль/л) до появи рожевого забарвлення. Титрують тричі, беруть середнє
значення. Масову частку
оцтової кислоти розраховують за формулою:
де
Кислотність харчових продуктів Титрована кислотність характеризується об’ємом розчину лугу заданої
концентрації, що витрачається на нейтралізацію певної маси продукту. Нейтралізацію
продукту, або його витяжки проводять розчином натрій гідроксиду, або калій
гідроксиду з C (NaOH) = 0,1000
моль/л. Індикатором в цьому методі є найчастіше 1 % спиртовий розчин
фенолфталеїну, а в деяких випадках – тимолфталеїну. Під градусом
Тернера (0Т) розуміють об’єм
Градус Неймана (0Н) – це об’єм розчину лугу з C (NaOH) = 1 моль/л, що витрачається на титрування 10 г (мл)
продукту). Його застосовують для характеристики титрованої кислотності хліба,
борошна, макаронних виробів. Градус Кеттсторфера (0К) – це об’єм розчину натрій гідроксиду з C (NaOH) = 0,1000 моль/л, що витрачається
на титрування 10 г продукту. Цей градус кислотності використовують для
маргарину, спредів. В Німеччині,
Чехії, Польщі, Словенії титрована кислотність харчових продуктів виражається
в градусах Сокслєта – Генкеля (0SH). Градус Сокслєта – Генкеля (0SH) – це об’єм розчину натрій гідроксиду з концентрацією C
(NaOH) = 0,2500 моль/л, що
витрачається на титрування 100 г продукту. У Нідерландах
титрована кислотність виражається в градусах Дорніка. Градус Дорніка (0D) – це об’єм розчину натрій гідроксиду з концентрацією C (NaOH) = 0,0900 моль/л, що витрачається
на титрування 100 г продукту. У США кислотність
продуктів харчування виражається у відсотках молочної кислоти. Для взаємного
перерахунку титрованої кислотності, що виражена у різних градусах,
користуються співвідношенням:
Контрольні питання 1. Що таке метод кислотно-основного титрування? 2. Що таке кислотно-основні індикатори? 3. Що таке інтервал переходу забарвлення індикатора? 4. Які вимоги до кислотно-основних індикаторів? 5. Які індикатори слід застосовувати під час титрування сильної кислоти
сильною основою? 6. Які індикатори слід застосовувати під час титрування слабкої кислоти
сильною основою? 7. Які індикатори слід застосовувати під час титрування слабкої основи
сильною кислотою? 8. Як готують стандартні розчини для кислотно-основного титрування? 9. Як визначають карбонатну твердість води? 10. Як визначають кислотність харчових продуктів?
3.2.8. Методи окисно-відновного
титрування 3.2.8.1. Поняття про редоксіметрію
Для окисно-відновного
титрування можна застосовувати реакції, які відбуваються кількісно до кінця,
з достатньою швидкістю й мають постійне співвідношення між окисником і
відновником. Ці методи
класифікують залежно від застосування робочого розчину окисника або
відновника (табл. 3.3). Таблиця 3.3 Характеристика методів окисно-відновного титрування
Точку
еквівалентності в цих методах встановлюють за допомогою специфічних індикаторів
(крохмаль у методі йодометрії), окисно-відновних індикаторів (дифеніламін),
або безіндикаторним методом (перманганатометрія). Що більше значення
окисно-відновного потенціалу, то більшу окисну здатність матиме пара
«окисник-відновник». Наприклад, йони Характеристика методу
Цей метод є безіндикаторним, сам калій перманганат виступає в ролі індикатора, оскільки чітко змінює
своє забарвлення в точці еквівалентності. Калій перманганат проявляє свої окисні
властивості як в кислому, так і в лужному середовищі. Залежно від реакції
середовища перманганат-йон може приймати 5, 3 або 1 електрон.
У кислому
середовищі відбувається процес:
Стандартний
потенціал пари Приготування робочого розчину калій перманганату Титрований розчин
калій перманганату неможна приготувати шляхом розчинення його точної наважки
в мірній колбі. Це пояснюється тим, що кристалічний калій перманганат завжди
містить домішки манган (IV) оксиду. У розчині концентрація калій перманганату
знижується, оскільки він реагує з органічними домішками, що є у воді,
амоніаком та іншими речовинами. Тому розраховану наважку калій перманганату,
необхідну для приготування розчину приблизної концентрації (частіше з Для цього бюретку
зі скляним краном промивають і заповнюють розчином калій перманганату. За допомогою
піпетки в конічну колбу переносять аліквоту оксалатної кислоти й за допомогою
мірного циліндру додають 10 мл розчину
сульфатної кислоти з Титрування
проводять повільно, додають наступну порцію титранту лише після знебарвлення
попередньої порції. Спочатку знебарвлення відбувається повільно, але в міру
накопичення в розчині йонів Mn2+ швидкість процесу зростатиме.
Йони Mn2+ відіграватимуть роль каталізатора процесу. Таке явище,
коли каталізатор утворюється в ході хімічної реакції і прискорює її перебіг,
має назву аутокаталізу. Титрування
виконують тричі і для розрахунків беруть середнє значення. Оскільки розчин
забарвлений, об’єм вимірюють за верхнім меніском. В основу цього
титрування покладено хімічну реакцію:
Застосування перманганатометрії Прикладом
застосування методу перманганатометрії може бути визначення вмісту йонів Fe2+
у солі Мора ‒ (NH4)2 SO4 · FeSO4 · 6 H2O. Реакція між калій
перманганатом і ферум (ΙΙ) сульфатом, що міститься в солі Мора,
відбувається згідно з рівнянням:
Для проведення
аналізу в мірну колбу на 100 мл переносять наважку солі Мора й доводять об’єм
розчину до риски. Піпетку ополіскують отриманим розчином, переносять 10,00 мл
його в конічну колбу, додають 10 мл
розчину сульфатної кислоти Характеристика методу
Окисно-відновний
потенціал системи Умови проведення йодометричного титрування ►1.
Титрування виконують на холоді, оскільки йод – летка речовина. Друга причина
полягає в тому, що йодкрохмальні комплекси руйнуються під час нагрівання й
точку еквівалентності не можна буде зафіксувати. ►2. Пряме
титрування йодом виконують у нейтральному або в слабо кислому середовищі. При
рН > 11 йод окиснюється до гіпойодиду:
При цьому можливий
перебіг побічної реакції, оскільки гіпойодид-йон більш сильний окисник, ніж
йод. ►3. Йод дуже
погано розчиняється у воді. Для збільшення його розчинності додають калій
йодид. При цьому відбувається утворення комплексного йона:
►4. Реакція
між визначуваною речовиною і аніонами ►5.
Реакційну суміш слід витримувати в темряві, оскільки під дією світла калій
йодид окиснюється киснем повітря. ►6.
Індикатором методу йодометрії є розчин крохмалю. Амілоза, що входить до
складу крохмалю, утворює з йодом адсорбційно-комплексні сполуки, забарвлені в
синій колір.
Особливість
застосування розчину крохмалю як індикатора полягає в тому, що його додають
наприкінці титрування, коли концентрація йоду мала, і розчин має блідо-жовте
забарвлення. У присутності крохмалю розчин набуває синього забарвлення, а
далі його титрують до знебарвлення. Якщо крохмаль додати до початку
титрування, створюватиметься міцний комплекс, на руйнування якого знадобиться
надлишок титранту. Розчин при цьому буде перетитрованим. Йодометричне визначення відновників виконують методом прямого титрування. Титрант – розчин йоду.
Титрований розчин йоду готують із йоду, який було очищено методом сублімації.
Точну наважку йоду змішують із калій йодидом і розчиняють у мірній колбі.
Розчин зберігають в склянці з темного скла. Прямим титруванням визначають
вміст аскорбінової кислоти у фруктових соках, вміст сульфіт-йонів у
сульфітованій картоплі. Йодометричне визначення окисників виконують методом зворотного титрування. Для цього в колбу
для титрування вносять надлишкову кількість розчину калій йодиду, який
підкиснюють розчином сульфатної кислоти. До суміші додають окисник, що
аналізують. Колбу закривають годинниковим склом і на 5 хвилин залишають у
темряві. Унаслідок хімічної реакції виділяється еквівалентна кількість йоду.
Забарвлений у коричневий колір розчин титрують стандартним розчином натрій
тіосульфату до блідо-жовтого забарвлення, потім додають розчин крохмалю і
дотитровують до повного знебарвлення синього комплексу. Приготування робочих розчинів для йодометрії Розчин натрій тіосульфату Розчин натрій
тіосульфату готують приблизної концентрації і встановлюють його титр за
допомогою первинного стандарту – калій дихромату
де Розчин йоду готують із очищеного препарату, розчиняючи наважку в 10 %-ному розчині
калій йодиду. Оскільки йод – летка речовина, його титр уточнюють за натрій
тіосульфатом. Розчин крохмалю готують із наважки
розчинного крохмалю, що становить 0,5 г. Готують суспензію крохмалю у воді,
яку вливають в 100 мл киплячої води, кип’ятять протягом 2 хвилин і фільтрують
гарячим. Слід зауважити, що цей індикатор є досить нестійким і для досліджень
слід готувати його безпосередньо перед виконанням роботи. Приклади йодометричних визначень Визначення вмісту Купруму в розчині купрум(ІІ) сульфату Реакція між
купрум(ІІ) сульфатом і калій йодидом відбувається за рівнянням
Під час титрування
йоду відбувається хімічна реакція:
Оскільки реакція
між Купрум(ІІ) сульфатом і розчином йоду оборотна, для повного її перебігу
використовують надлишок калій йодиду. Контрольний розчин
купрум(ІІ) сульфату готують у мірній колбі на 100 мл. Бюретку заповнюють до
нульової поділки розчином натрій тіосульфату. Ополіскують піпетку розчином
Характеристика методу
В основу методу покладено
реакції окиснення дихромат-йонами відновників, що містяться в розчині:
Стандартний
окисний потенціал цієї системи становить +1,36 В. З рівняння реакції видно,
що фактор еквівалентності калій дихромату дорівнює Переваги методу дихроматометрії ►1. Калій
дихромат під час перекристалізації його із водного розчину й висушування за
температури 200 0С є хімічно чистим і має постійний склад. Тому з точної
наважки цієї речовини можна приготувати титрований розчин, який буде
первинним стандартом. ►2. Розчин
калій дихромату не руйнується під час зберігання й навіть нагрівання у
підкисненому розчині. ►3. Дозволяє
проводити титрування за наявності хлоридної кислоти, оскільки не окиснює
хлорид-йони. Недоліком калій
дихромату як окисника є те, що за його відновнення утворюються йони Індикатори методу
дихроматометрії Індикатором у
цьому методі є дифеніламін, також застосовують фенілантранілову
кислоту. Дифеніламін у точці еквівалентності набуває фіолетового забарвлення.
Такі індикатори належать до групи окисно-відновних. Приготування
стандартного розчину калій дихромату Кристалічний
перекристалізований калій дихромат зважують спочатку на технічних, а потім на
аналітичних терезах і розчиняють у мірній колбі. Молярна маса еквівалента
калій дихромату дорівнює:
Застосовують цей
метод для визначення йонів
Контрольні питання 2. Що таке переманганатометрія? 3. Що є індикатором в методі перманганатометрії? 4. Як готують робочий розчин калій перманганату? 5. Наведіть приклади застосування методу перманганатометрії. 7. Які умови йодометричного тирування? 8. Як готують робочі розчини для йодометрії?
3.2.9.1. Характеристика методу осадження
Для методу осадження
застосовуються лише ті реакції, що відповідають таким вимогам: ►1. Реакція
між визначуваною речовиною й титрантом мають перебігати в умовах, що
забезпечують утворення осаду з мінімальною розчинністю. ►2. Реакції
в методі осадження мають перебігати швидко й стехіометрично. Утворення
пересичених розчинів не має відбуватися. ►3. Для
фіксації точки еквівалентності має бути підібраний надійний індикатор. ►4. На
результати аналізу не мають впливати явища адсорбції.
Для титрування
застосовують розчини арґентум нітрату з концентрацією солі 0,1000 або 0,0500
моль/л. Залежно від індикатора, що використовується для фіксації точки
еквівалентності, в аргентометрії виділяють такі методи (табл. 3.4). Таблиця 3.4 Класифікація методів осадження
У методі Мора індикатором є насичений розчин калій хромату. При
титрування галогенідів відбувається така реакція:
Коли всі галогенід-йони
повністю осаджуються катіонами Арґентуму у вигляді осаду, починається
утворення цегляно-червоного осаду Ag2CrO4:
Це пояснюється
тим, що розчинність Ag2CrO4 на порядок вища, ніж
арґентум хлориду.
Умови титрування: ►1.
Титрування слід проводити в нейтральному або слаболужному середовищі (рН
6,5…10,0). У кислому середовищі розчиняється осад Ag2CrO4,
а в лужному руйнується титрант з утворенням Ag2O. ►2. У
розчині не має бути катіонів, що утворюють малорозчинні хромати (Pb2+, Ba2+). ►3. У
розчині не мають міститися аніони, що утворюють осади з катіонами Ag+ (PO43-, CO32- ). ►4. Метод не
застосовується для титрування розчинів, що містять йони NH4+,
оскільки при цьому утворюються розчинні амоніачні комплекси. ►5.
Йодид-йони сильно адсорбуються осадом, тому цим методом не визначаються. Метод Мора є
арбітражним для визначення вмісту кухонної солі в харчовій продукції.
3.2.9.4. Метод Фаянса (Фаянса–Ходакова) У методі Фаянса
застосовують аргентометричне титрування в присутності адсорбційних
індикаторів. Ці індикатори адсорбуються
на поверхні осаду за наближення точки еквівалентності. У процесі титрування в
певний час утворюється колоїдний розчин, у якого міцели мають заряд і
адсорбція індикатора неможлива. У точці еквівалентності колоїдні частинки
витрачають заряд і надлишкова крапля титранту змінює заряд міцели.
Протийонами в такій міцелі є індикатор, що призводить до зміни забарвлення
поверхні осаду. До адсорбційних
індикаторів належить флоуресцеїн, еозин та деякі інші.
Умови титрування ►1.
Нейтральне або слабколужне середовище (рН 7-10) у разі застосування
флоуресцеїну. Для еозину можна застосовувати й кисле середовище (рН = 2). ►2. Для
утворення осаду у вигляді колоїдних частинок використовують захисні колоїди: крохмаль,
декстрин.
Метод Фольгарда (тіоціанатометричне титрування) базується на осадженні катіонів Ag+ тіоціанатами
(роданідами):
Сутність методу
полягає в тому, що до досліджуваного розчину хлориду додають надлишок
титрованого розчину арґентум нітрату. Надлишок арґентум нітрату відтитровують
розчином тіоцианату і проводять відповідні розрахунки. Індикатор методу – насичений
розчин залізо-амонійного галуну NH4Fe(SO4)2·12H2O. Доки в розчині є
йони Ag+, додавання
титранту (KCNS, NH4CNS) супроводжуватиметься зв’язуванням
йонів CNS – в
осад. Після досягнення точки еквівалентності одна крапля титранту
викличе утворення забарвлених у
червоний колір роданідних комплексів Феруму (ІІІ).
Умови методу Фольгарда ►1.
Титрування слід виконувати в кислому середовищі для запобігання гідролізу
солей Феруму. ►2.
Титрування виконують з енергійним перемішуванням для запобігання адсорбції. ►3.
Досліджуваний розчин не повинен мати окисників та аніонів, що маскують
катіони Fe3+, утворюючи з ними стійкі
комплекси (F – , PO43-). 3.2.9.6. Приготування розчинів, що застосовуються
в аргентометрії Стандартний розчин арґентум нітрату Кристалічний
арґентум нітрат є нестійкою речовиною і завжди містить домішки. Тому
розраховану наважку розчиняють у мірній колбі й зберігають у темряві. Перед
використанням його стандартизують за розчином первинного стандарту – натрій
хлориду. Для цього бюретку ополіскують і заповнюють розчином аргентум
нітрату. Піпетку ополіскують стандартним розчином натрій хлориду (С = 0,0500 моль/л) і аліквотну частину
переносять в конічну колбу для титрування. Додають 2-3 краплі насиченого
розчину калій хромату і обережно, по краплях титрують розчин до зміни жовтого
забарвлення на цегляно-червоне від однієї зайвої краплі. Повторюють
титрування тричі і для розрахунків беруть середнє значення. Стандартний розчин калій роданіду (амоній роданіду) Розчини KCNS, NH4CNS не можна приготувати з точної
наважки, оскільки ці речовини дуже гігроскопічні. Тому готують їх розчини
приблизної концентрації і стандартизують за титрованим розчином арґентум
нітрату. Для цього бюретку ополіскують і заповнюють розчином KCNS або NH4CNS.
Піпеткою переносять аліквоту арґентум нітрату в конічну колбу. Додають 1 мл
розчину NH4Fe(SO4)2·12H2O і 3 мл розчину нітратної кислоти з концентрацією 6 моль/л.
Суміш повільно титрують до появи червоно-рожевого забарвлення, що не зникає
за енергійного перемішування. Титрування виконують тричі, для розрахунків
беруть середнє значення. Методи осадження
використовують для технічного аналізу, аналізу фармацевтичних препаратів,
промислових об’єктів, харчових продуктів.
Контрольні питання 1. Які хімічні реакції покладено в основу методу осадження? 3. Який індикатор застосовують в методі Мора? 4. Які умови титрування за методом Мора? 5. Які індикатори застосовують в методі Фаянса-Ходакова? 6. Які хімічні реакції покладено в основу методу Фольгарда?
3.2.10.1. Характеристика
комплексонометрії. Комплексони Дослідження в цій
галузі, які датуються 1946 роком, належать швейцарському хіміку
Г. Шварценбаху, Найпоширенішим у
застосуванні є Комплексон ІІІ – динатрієва
сіль етилендіамінтетраацетатної кислоти – ЕДТА. Один з найбільших у світі хімічний концерн BASF (Німеччина) запропонував торговельну назву – Трилон Б, яка набула поширення й увійшла в хімічну
термінологію. Хімічна формула Трилону Б:
Умовне позначення
Трилону Б –
Оскільки внаслідок
реакції утворюються катіони Гідрогену, важливо контролювати рН за
комплексонометричного титрування. Точку
еквівалентності в цьому методі встановлюють за допомогою металіндикаторів.
До таких металіндикаторів належать: Еріохром чорний Т, Хромовий темно-синій, Мурексид та інші. Наприклад,
катіони Кальцію і Магнію утворюють з індикатором Еріохромом чорним Т
внутрішньокомплексні сполуки червоного кольору. Але ці сполуки менш міцні,
ніж комплекси цих самих катіонів з Трилоном Б. У процесі титрування
аналізованого розчину Трилоном Б йони металу переходять від індикатора до
комплексона, виділяється індикатор у вільному стані, який має синє
забарвлення. Тобто відбувається утворення більш стійкого комплексу за рахунок
руйнування менш стійкого забарвленого. У точці еквівалентності відбувається
різка зміна забарвлення і червоний колір розчину змінюється на синій.
Схематично це можна зобразити у вигляді рівняння: а) додавання
індикатора до аналізованого розчину ‒
б) титрування
Трилоном Б аналізованого розчину з індикатором –
Найбільш чітка
зміна забарвлення індикатора відбувається за рН 8-10. Тому до аналізованого
розчину додають амоніачну буферну суміш (NH4Cl + NH4OH). Ця суміш нейтралізує катіони
Гідрогену, що вивільнюються із Трилону Б в процесі титрування. Особливість приготування індикаторів Оскільки
металіндикатори в розчині нестійкі, то готують суху індикаторну суміш. Для
цього сухий індикатор змішують з індиферентним наповнювачем (NaCl, KCl) у співвідношенні 1:100,
ретельно розтирають у порцеляновій ступці й зберігають в закритій склянці. Перед
титруванням цю суміш у кількості 20-30 мг вносять на кінчику шпателя. Приготування
робочого розчину Трилону Б Трилон Б –
кристалогідрат, що кристалізується з двома молекулами води. Його молекулярна
формула:
Найчастіше
застосовують розчини Трилону Б з молярною концентрацією еквівалента 0,1000
або 0,0500 моль/л. Розраховану наважку переносять у мірну колбу, розчиняють і
доводять об’єм до риски. Якщо розчин готують із фіксаналу, то його титр
уточнювати не треба. 3.2.10.3. Стандартизація розчину Трилону
Б Відбирають
піпеткою в конічну колбу аліквотну кількість первинного стандарту – розчину
магній сульфату або стандартного розчину солі Кальцію. Додають дистильовану
воду, амоніачну буферну суміш і сухий індикатор – Еріохром чорний Т або
Хромовий темно-синій. Титрують розчином Трилону Б до зміни червоного кольору
на синій. Титрування проводять тричі, для розрахунків беруть середнє значення
об’ємів. Розраховують молярну концентрацію еквіваленті й титр розчину Трилону
Б за стандартними формулами.
3.2.10.4. Приклади застосування
комплексонометричного титрування Визначення загальної твердості води Твердість (жорсткість) води характеризується
числом ммоль-еквівалентів йонів Кальцію і Магнію в 1 літрі води. Розрізняють
твердість карбонатну (тимчасову) і некарбонатну (постійну). Карбонатна
твердість зумовлена вмістом кислих солей – кальцій гідрогенкарбонату
і магній гідрогенкарбонату, які переходять у середні солі під час кип’ятіння
води. Некарбонатну твердість надають воді інші солі – хлориди,
сульфати. Вони стійкі до нагрівання. Сума карбонатної і некарбонатної
твердості становить загальну твердість води.
Загальну твердість
води визначають на багатьох виробництвах. Використання твердої води призводить
до утворенню накипу на котлах, руйнування деяких вітамінів та барвників
природного походження. Твердість води регламентують державні стандарти. Для аналізу в
конічну колбу для титрування переносять 100 мл досліджуваної води за
допомогою піпетки або мірної колби. Мірним циліндром додають 5 мл амоніачної
буферної суміші й на кінчику шпателя сухий індикатор – Еріохром чорний Т (або
Хромовий темно-синій).
Вміст колби
титрують розчином Трилону Б з концентрацією Титрування
проводять тричі, і для розрахунків беруть середнє значення. Загальну твердість
води розраховують за формулою:
де
Класифікація води за твердістю ● Дуже м’яка
– до 1,5 ммоль/л; ● м’яка – 1,5-3,0
ммоль/л; ● помірно
тверда – 3,0-6,0 ммоль/л; ● тверда –
6,0-9,0 ммоль/л; ● дуже
тверда – понад 9,0 ммоль/л. Визначення кальцієвої та магнієвої твердості води У деяких випадках важливо
знати кількісний склад солей, що зумовлюють загальну твердість води. Для цього в
конічну колбу переносять за допомогою піпетки або мірної колби 100 мл
досліджуваної води, додають у колбу за допомогою мірного циліндру 5 мл
розчину натрій гідроксиду з концентрацією 2 моль/л та 20 – 30 мг (на кінчику
шпателя) індикатора Мурексиду. Повільно титрують
вміст колби розчином Трилону Б з концентрацією Твердість,
зумовлену присутністю у воді солей Кальцію, розраховують за формулою:
де За різницею загальної
твердості води й кальцієвої твердості води знаходять магнієву твердість води.
Контрольні питання 2. Які речовина належать до комплексонів? 3. Наведіть структурну формулу Трилону Б 5. Які особливості приготування металіндикаторів? 6. Як готують і стандартизують розчин Трилону Б? 7. Що таке твердість води? Які її види? 8. Як визначають кальцієву і магнієву твердість води?
3.2.11. Метрологічні основи хімічного
аналізу
У хімічному аналізі,
як в будь-якому експерименті, доводиться мати справу з різного роду
похибками.
Залежно від місця
виникнення розрізняють інструментальні, методичні та суб'єктивні похибки. Meтодична складова похибки вимірювання – це наслідок недосконалості методу
вимірювання або деяких припущень чи наближень у розрахункових формулах. Інструментальна складова похибки вимірювання зумовлена властивостями
засобів вимірювальної техніки ‒ якістю виготовлення та стабільністю
вимірювальних приладів, їх способом градуювання та похибкою відліку. Суб'єктивна складова похибки вимірювання може виникати через недосконалість органів
чуття спостерігача, а також через його недосвідченість і неуважність у момент
відліку показу. 3.2.11.2. Характеристика вимірювань Для характеристики
якості вимірювань застосовують такі терміни, як точність, правильність,
збіжність і відтворюваність.
Для методик
виконання вимірювань збіжність є одною з найважливіших характеристик.
Правильність,
відтворюваність результатів аналізу пов’язані з похибками. 3.2.11.3. Класифікація похибок
Похибки в експерименті
зумовлені багатьма причинами: клас точності вимірювальних приладів,
калібрування посуду, методика аналізу, сенсорні особливості спостерігача,
охайність у виконанні аналізу. Похибки класифікують за різними підходами:
Рис. 3.29. Класифікація похибок Кожен із одержаних
у ході аналізу результатів позначається
Ця величина
виражається в частках від одиниці або у відсотках.
Інтервал
достовірних значень (довірчий інтервал) розраховують за формулою:
де Важливо визначити,
у яких межах відповідність середнього значення найбільш імовірна істинному
значенню – μ. Звичайно, така ймовірність не може дорівнювати 100 %. Тому
використовують довірчу ймовірність P. В аналітичній
хімії більшість методів характеризується довірчою ймовірністю 95 %. Інтервал
довірчих значень визначається розподілом Стьюдента. У формулі (3.50) значення
коефіцієнта Стьюдента за ймовірності 95 % (Р = 0,95) залежно від
кількості паралельних дослідів n має
різні значення (табл. 3.5). Таблиця 3.5 Значення коефіцієнта Стьюдента залежно від кількості паралельних дослідів
Результати аналізу
записують у вигляді:
3.2.11.4. Значущі цифри та правила
заокруглення
Наприклад, виділимо
значущі цифри зеленим кольором: а) 3,43; б) 0,353; в) 4,208; г) 0,008; д) 7,0004; є) 0,0500 Усі результати
округлюють до першої недостовірної цифри. Визначаючи значущі цифри, слід
пам’ятати, що нулі можуть бути і значущими, і незначущими. Нулі на початку
числа завжди незначущі. Нулі, що розташовані між цифрами числа, є значущими.
Наприклад, у числі 0,002 є тільки одна значуща цифра, а в числі 0,702 є три
значущі цифри. Нулі, що знаходяться в кінці числа, є значущими. Наприклад, у
числі 23000 усі п’ять цифр є значущими. Під час заокруглення чисел слід дотримуватися таких правил: ►1. Якщо за
останньою цифрою, що округлюється, стоїть цифра менша за 5, то цифру, що
підлягає округленню, збільшують на одиницю. ►2. Якщо за
першою недостовірною цифрою стоїть цифра 5, то цифру не округлюють, а
залишають без змін; якщо більша за 5, то цифру, що округлюється, збільшують
на одиницю. ►3. Якщо за
першою недостовірною цифрою стоїть цифра 5 – округлення виконують у бік
найближчого парного числа. Наприклад, число 15,245 слід округлити до 15,24, а
число 15,255 – до 15,26. Під час додавання й віднімання – значущість суми або різниці чисел визначається
значущістю того числа, у якого менше десяткових знаків. Наприклад, 26,1 + 5 +
0,22 = 31,32 слід заокруглити до 31. Під час множення й ділення – значущість добутку або частки слід визначати значущістю співмножника з
найменшим числом значущих цифр. Наприклад, 96 : 83,25 = 1,15 (а не 1,15315…). Під час піднесення до степеня – відносна недостовірність результатів збільшується в
число разів, що дорівнює показнику степеня. У разі піднесенні до квадрата
вона подвоюється, а до куба – потроюється. Під час добування кореня – відносна недостовірність результату вдвічі менша відносної
недостовірності підкореневого числа. Під час логарифмування – кількість значущих цифр у мантисі дорівнює кількості цифр, які має
нестепеневий ряд числа. Наприклад, lg
0,1·10-2 = -3,0; lg 0,1
= -1,0. У разі обчислення антилогарифму число значущих цифр зменшується.
Наприклад, ant lg 10,23 = 1,7·10-10. Для характеристики
методу аналізу використовують чутливість, яку характеризують межею
виявлення або нижньою межею визначення. Така характеристика, як межа
виявлення – мінімальна кількість (
Контрольні питання 2. Що називають грубими промахами? 3. Що таке точність, правильність та збіжність вимірювань? 4. Що таке відтворюваність вимірювань? 5. Як розраховують абсолютну та відносну похибку? 6. Як розраховують стандартне відхилення та відносне стандартне відхилення? 7. Які цифри називаються значущими? 8. Якими правилами слід користуватися під час
заокруглення чисел? |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||









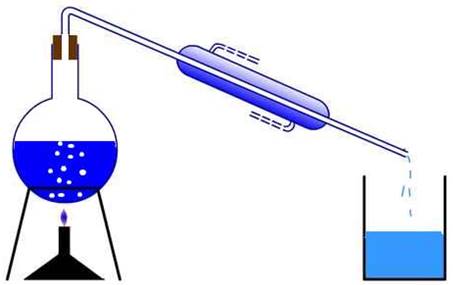
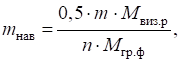
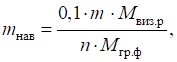
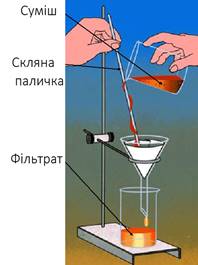





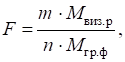
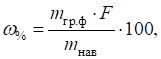
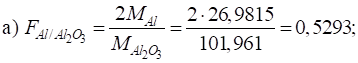
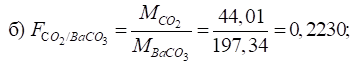
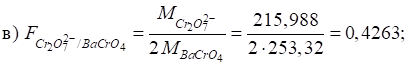
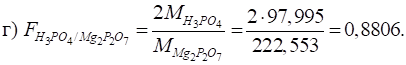
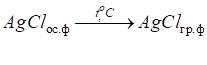
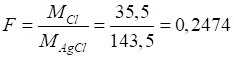
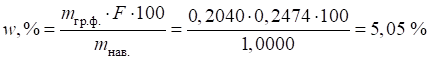
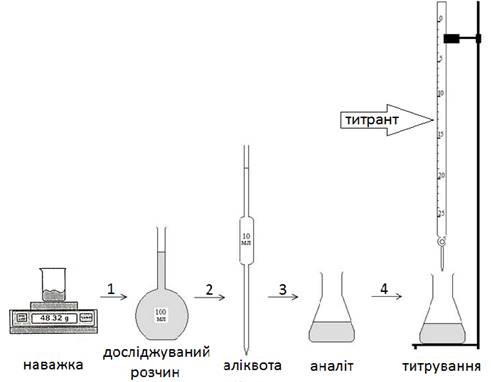
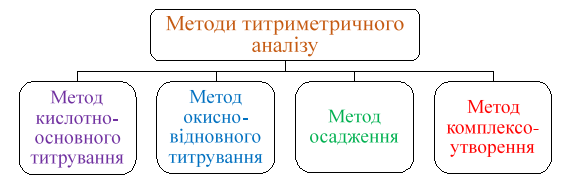
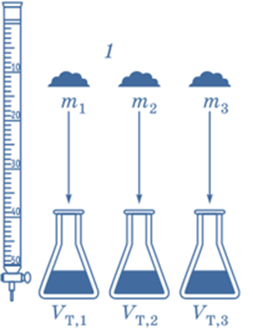
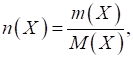
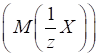
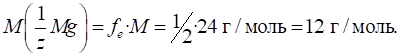
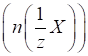
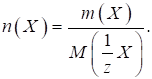
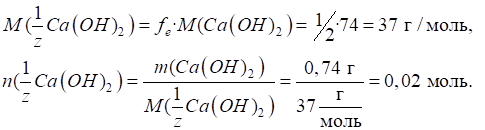

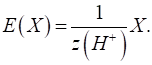
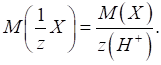
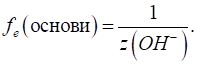
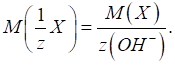
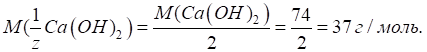
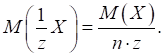
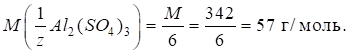
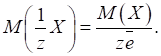
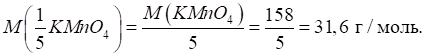
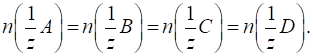 (3.18)
(3.18)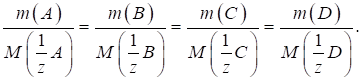 (3.19)
(3.19)
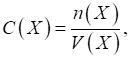
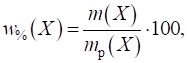
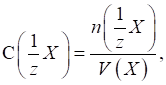
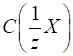
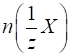
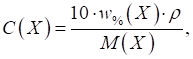
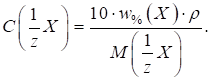
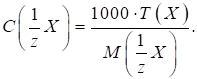
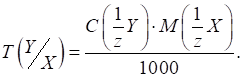
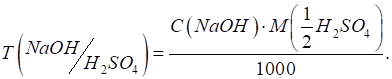
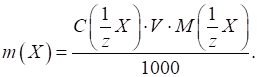
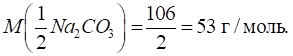
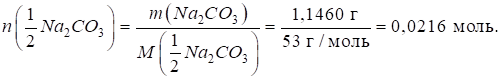
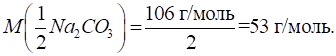
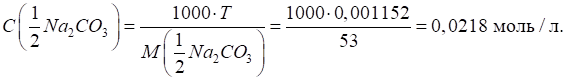
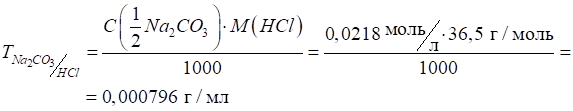
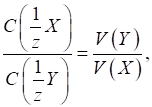
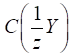 ,
, 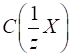 – молярні концентрації еквівалента відповідно титранту та розчину
аналіту; V(Y), V(X) – об’єми
розчину відповідно титранту та аналіту, що витрачаються на
– молярні концентрації еквівалента відповідно титранту та розчину
аналіту; V(Y), V(X) – об’єми
розчину відповідно титранту та аналіту, що витрачаються на 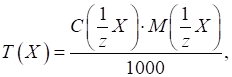
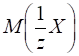 – молярна маса еквівалента аналіту, г/моль.
– молярна маса еквівалента аналіту, г/моль.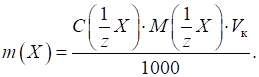
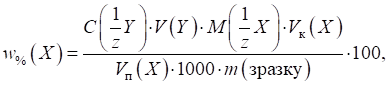 (3.32)
(3.32)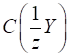 – молярна концентрація еквівалента титранту, моль/л;
– молярна концентрація еквівалента титранту, моль/л;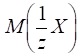 – молярна маса еквівалента
– молярна маса еквівалента 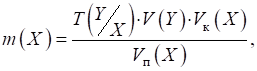
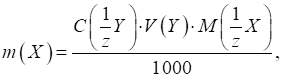
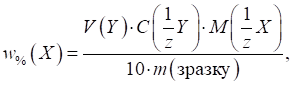
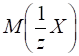
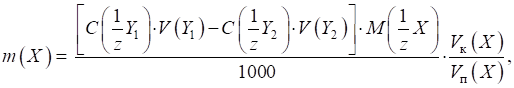
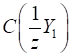 – молярна концентрація еквівалента першого робочого
розчину, моль/л;
– молярна концентрація еквівалента першого робочого
розчину, моль/л; 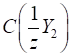 – молярна концентрація еквівалента другого робочого
розчину, що витрачається на реакцію з надлишком першого робочого розчину,
моль/л;
– молярна концентрація еквівалента другого робочого
розчину, що витрачається на реакцію з надлишком першого робочого розчину,
моль/л; 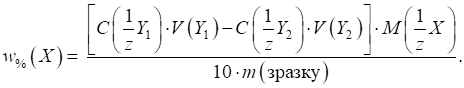
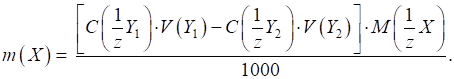
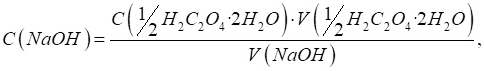
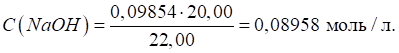
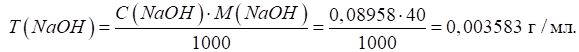
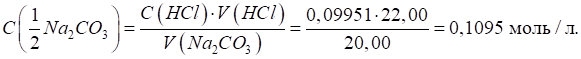
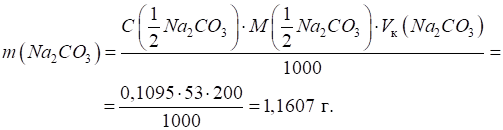
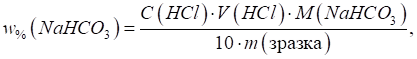

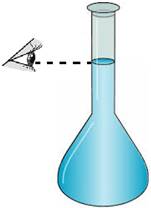

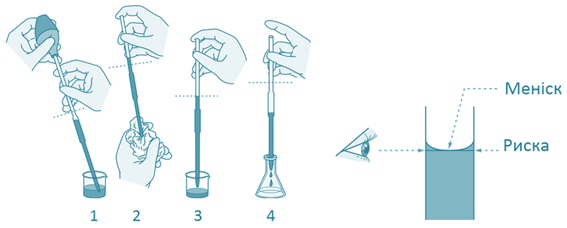
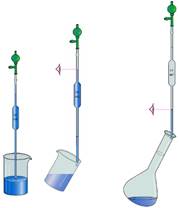
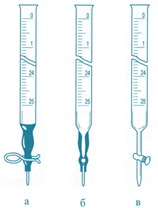

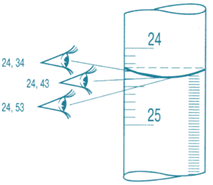


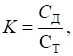


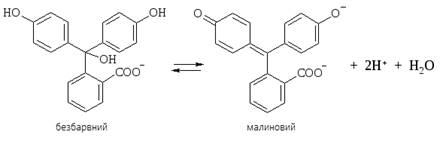

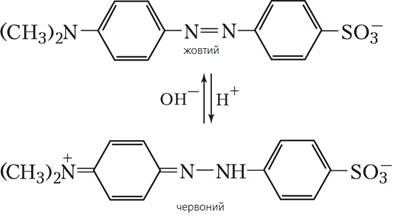
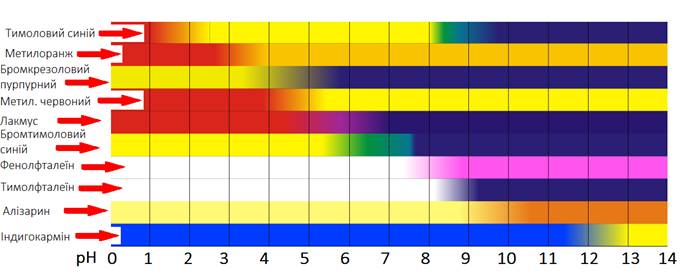
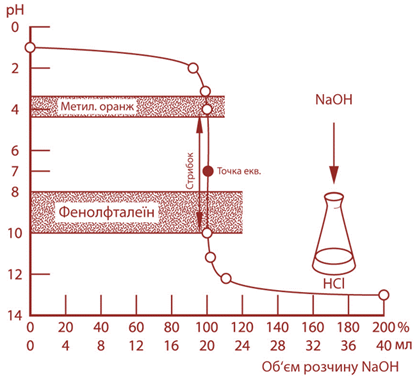
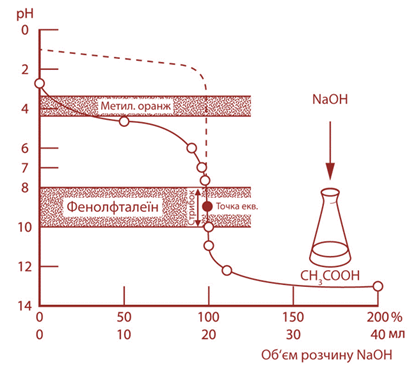
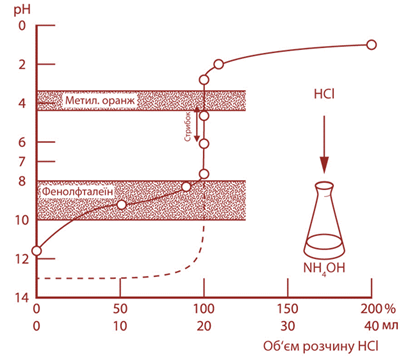
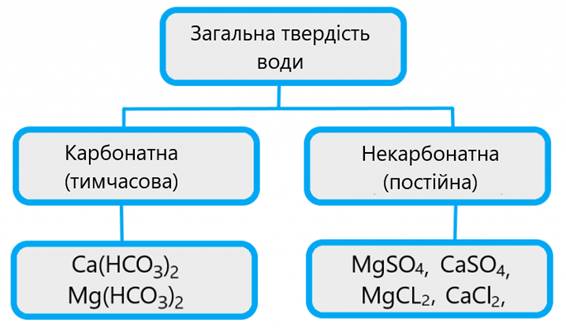
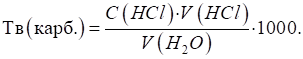
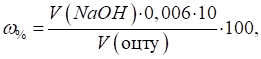
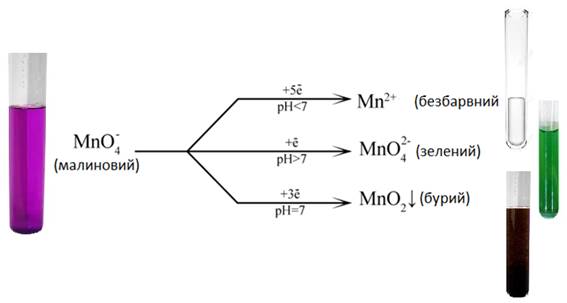
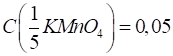
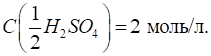
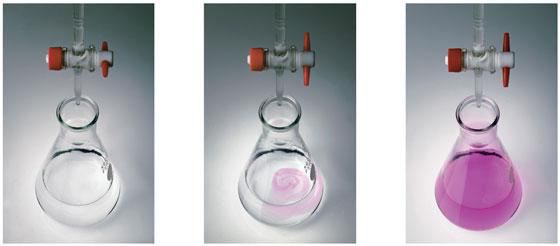
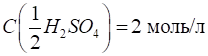

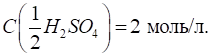
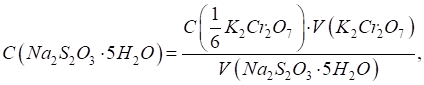


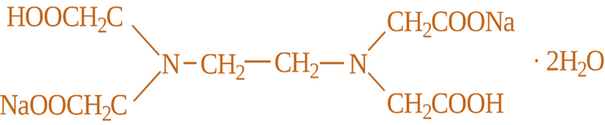
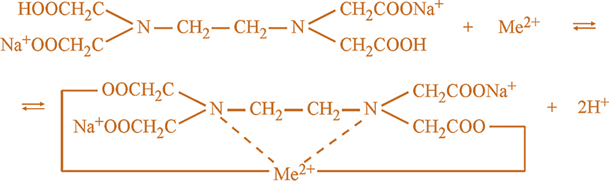

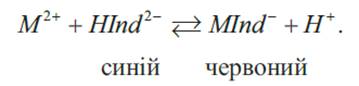

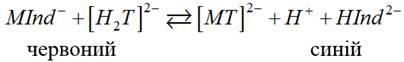
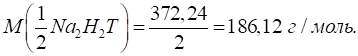


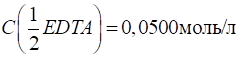
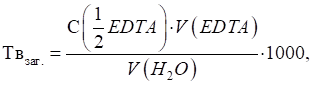
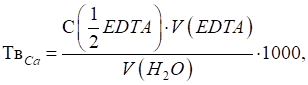
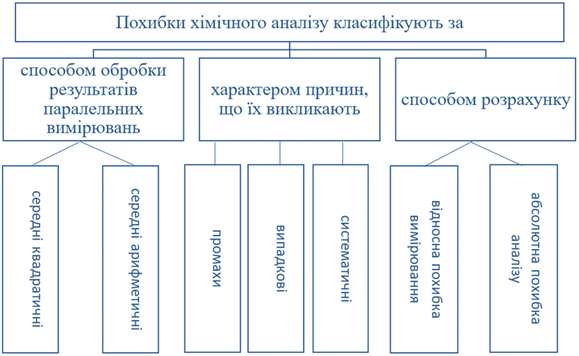
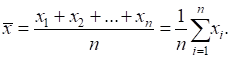
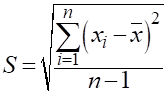 .
.