|
|
ХІМІЯ Електронний посібник |
|||||||||||||||||||||||
|
|
||||||||||||||||||||||||
|
9.1. Необоротні і оборотні хімічні процеси. Хімічна
рівновага. Принцип Ле Шательє 9.2. Гідроліз солей. Поняття гальванічний елемент 9.1. Необоротні і оборотні хімічні процеси.
Хімічна рівновага. Принцип Ле Шательє За напрямом реакції можна поділити на оборотні та необоротні. Для необоротних
реакцій характерні такі ознаки: виділення газу, утворення осаду або води.
Прикладом такої реакції може бути розклад калій
перманганату під час нагрівання. 2KMnO₄→K₂MnO₄+MnO₂+O₂ Реакція, припиниться тоді, коли весь калій
перманганат розкладеться. Необоротних реакцій не так багато. Більшість реакцій
оборотні. Часто буває, що речовини, які
утворилися під час хімічної реакції, перетворюються на ті, що були на початку
реакції. Наприклад, якщо крізь воду пропускати вуглекислий газ, то
утворюється карбонатна кислота: H₂O+CO₂→H₂CO₃ Коли припинити пропускання газу, то ми
помітимо, як газ виділяється з розчину. Відбувається зворотний процес:
карбонатна кислота розкладається на вуглекислий газ і воду: H₂CO₃→ H₂O+CO₂. Оборотні реакції записують одним хімічним
рівнянням, у якому позначають дві стрілки у двох протилежних напрямках.
Утворення карбонатної кислоти можна назвати прямою реакцією, а її розклад – зворотною реакцією.
У загальному вигляді
оборотні реакції можна зобразити.
Реакцію, що протікає зліва направо, називають прямою реакцією. Реакцію, що
відбувається справа наліво – зворотною
реакцією. Хімічна рівновага. Оборотні реакції
ніколи не відбуваються до кінця. Оскільки пряма та зворотна реакції
відбуваються водночас, то в певний момент часу їхні швидкості зрівняються, і
настане хімічна рівновага. Водень із йодом взаємодіють з утворенням йодоводню, і
за певних умов ця реакція є оборотною:
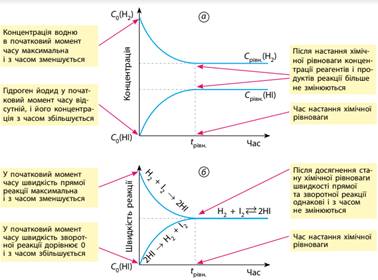
У початковий момент часу в посудині містяться лише
реагенти – водень та йод, і їхні концентрації максимальні (мал. 9.1а).
Молекули H2 і I2 починають взаємодіяти одна з одною – відбувається пряма реакція.
Швидкість цієї реакції в початковий момент часу максимальна і зменшується в
міру того, як реагенти витрачаються (мал. 9.1б).
Мал. 9.1.
Зміна концентрації реагентів і продуктів реакції (а) та швидкості реакції (б)
оборотних реакцій під час досягнення стану хімічної рівноваги І, навпаки, зворотна реакція в початковий момент часу
взагалі не відбувається, а зі збільшенням концентрації продукту реакції –
йодоводню – її швидкість підвищується. Нарешті, у певний момент часу швидкості
прямої і зворотної реакцій стають однаковими, а концентрації реагентів і
продукту реакції перестають змінюватися з часом. Такі концентрації називають рівноважними. Настає стан хімічної рівноваги.
Іноді, коли аналізують стан рівноваги, можуть дійти
помилкового висновку, що в системі нічого не відбувається, оскільки не
змінюються концентрації всіх компонентів. Але і пряма, і зворотна реакції
відбуваються водночас з однаковими швидкостями: скільки продуктів
утворюється за одиницю часу як результат прямої реакції, стільки ж і
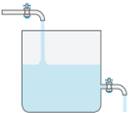
витрачається у зворотній. Хімічна рівновага має динамічний характер. Динамічний характер рівноваги можна проілюструвати на
простому прикладі: уявіть резервуар із водою, у який з одного боку вода
вливається, а з іншого – виливається (мал. 9.2). Якщо швидкість, із якою вода
вливається, дорівнює швидкості, із якою вода виливається, то рівень води в
резервуарі не змінюється.
Зміщення хімічної
рівноваги. На стан хімічної рівноваги впливають концентрації
речовин, що реагують, температура, а для газуватих речовин – ще й тиск. Якщо
змінюється один із цих параметрів, стан рівноваги порушується, і концентрації
всіх реагуючих речовин змінюються доти, доки не встановиться новий стан
рівноваги, але вже з іншими значеннями рівноважних концентрацій. Такий перехід реакційної системи з одного стану
рівноваги в інший називається зміщенням
хімічної рівноваги. Напрям зміщення хімічної рівноваги у процесі зміни
концентрації речовин, що реагують, температури і тиску визначається загальним
положенням, відомим як принцип Ле
Шательє (1884 р.). Якщо змінити одну з умов, за яких система перебуває у
стані рівноваги (температуру, тиск або концентрацію), то в системі
відбуватимуться процеси, що протидіють цій зміні. Принцип дає можливість
передбачати зміни в рівноважних системах під впливом зовнішніх умов, а також
керувати хімічно рівноважними системами. Наприклад, дуже важливий процес
взаємодії вільного азоту з воднем з утворенням амоніаку відбувається
відповідно до рівняння N₂+3H₂↔2NH₃. На підставі принципу Ле
Шательє робимо висновок, що рівновага зміниться на бік утворення амоніаку за
умови зниження температури та збільшення тиску. Тому синтез амоніаку
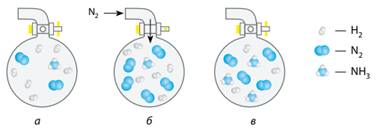
відбувається за температури 400-500°С та високого тиску (мал. 9.3).
Мал. 9.3. Зміщення стану
рівноваги в разі зміни концентрації речовин: а) початкова рівноважна суміш N2,
H2, та NH3; б) додавання N2; в) новий стан
рівноваги, за якого вміст азоту в суміші більший (внаслідок його додавання),
амоніаку – більший (внаслідок утворення), а водню – менший Зміна температури хімічної рівноваги. Нагрівання рівноважної суміші зміщує
рівновагу в бік ендотермічної реакції, а охолодження – у бік екзотермічної:
Розглянемо вплив температури на стан хімічної рівноваги
на прикладі реакції димеризації нітроген(IV) оксиду. Сам нітроген(IV) оксид NO2 – інтенсивно забарвлений
червоно-коричневий газ, під час його димеризації утворюється безбарвний N2O4 (динітроген тетраоксид):
Пряма
реакція димеризації є екзотермічною: теплота виділяється, і суміш
нагрівається, отже, для зміщення рівноваги в бік прямої реакції потрібно
рівноважну суміш охолоджувати (мал. 9.4б). Реакція розкладання димеру є
ендотермічною, тому для зміщення рівноваги в бік зворотної реакції необхідно
нагрівання рівноважної суміші (мал. 9.4а).
Мал. 9.4. Нагрівання рівноважної
суміші зміщує рівновагу в бік розкладання димеру, про що свідчить посилення
червоно-коричневого забарвлення (а), а під час охолодження рівновага
зміщується в бік утворення димеру, і суміш знебарвлюється (б) Зміна тиску хімічної рівноваги. Тиск безпосередньо не впливає на швидкість
хімічних реакцій. Але підвищення тиску спричиняє збільшення концентрації
газуватих речовин. Отже, зміна тиску зумовлює зміщення рівноваги тільки для
реакцій за участі газів, до того ж під час цих реакцій має змінюватися
загальне число молекул газуватих речовин. Згідно з
принципом Ле Шательє, підвищення тиску зміщує рівновагу в бік зниження тиску
в рівноважній суміші, тобто зменшення числа молекул газуватих речовин, а
зниження тиску зміщує рівновагу в бік збільшення числа молекул газуватих
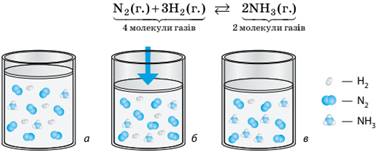
речовин. Наприклад, у реакції синтезу амоніаку число молекул
газуватих речовин зменшується (з 4 до 2), тобто під час прямої реакції
знижується тиск у системі:
Мал. 9.5.
Зміщення стану рівноваги в разі зміни тиску: а)
початкова рівноважна суміш N2, H2, та NH3; б)
зменшення об’єму суміші, що спричиняє підвищення тиску; в) новий Підвищення тиску зміщує рівновагу в бік зменшення числа
молекул газів, тому за підвищення тиску рівновага зміщується в бік продукту
реакції (мал. 9.5). Наявність каталізаторів
хімічної рівноваги. У разі додавання каталізатора до суміші, що перебуває
в стані хімічної рівноваги, прискорюються як пряма, так і зворотна реакції,
до того ж швидкості обох реакцій підвищуються однаково. Рівновага при цьому
зберігається. Отже, каталізатор не зміщує рівновагу, а тільки прискорює її
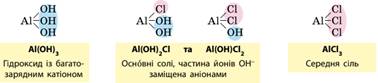
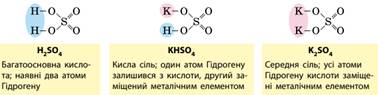
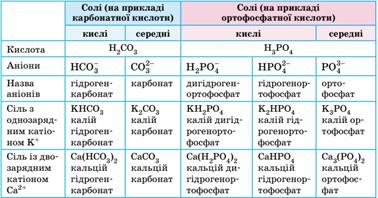
встановлення. 9.2. Гідроліз солей. Поняття гальванічний елемент Солі класифікують на середні, кислі та оснóвні
солі. ·
Середні солі складаються тільки з
катіонів металічних елементів та аніонів повністю дисоційованих кислот,
наприклад K2CO3 та Na2SO4. ·
Оснóвні солі відрізняються від
середніх наявністю гідроксид-іонів. Вони можуть бути утворені багатозарядним
катіоном та будь-яким аніоном:
· Кислі солі відрізняються від середніх наявністю
Гідрогену. Вони можуть бути утворені будь-яким катіоном, а аніон може бути
лише від багатоосновної кислоти, оскільки кислі солі є продуктом неповного
заміщення атомів Гідрогену в молекулі кислоти катіонами металічних елементів:
Складають формули кислих солей, ґрунтуючись на зарядах катіонів
та аніонів. У назвах кислих солей наявність H+ позначають префіксом «гідроген» у назві аніону.
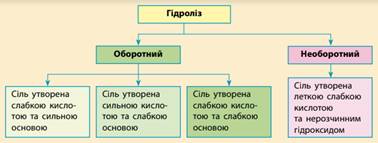
Можна виділити декілька видів
гідролізу. Насамперед – оборотний
та необоротний гідроліз. У разі
оборотного гідролізу з водою взаємодіє не більше декількох відсотків
розчиненої солі, а в разі необоротного майже вся речовина піддається
гідролізу. В оборотному гідролізі також можна виділити три види, залежно від
того, якою кислотою і якою основою утворена сіль.
Гідроліз неможливий. Сіль, утворена
сильною основою і сильною кислотою (KBr, NaCl, NaNO3), гідролізу піддаватися не буде, так як в цьому випадку слабкий
електроліт не утвориться. рН таких
розчинів=7. Реакція середовища
залишається нейтральною. Гідроліз по катіону (в реакцію з водою
вступає тільки катіон). У солі, утвореної слабкою основою і сильною кислотою (FeCl2, NH4Cl, Al2(SO4)3,
MgSO4) гідролізу піддається
катіон. Як результат гідролізу утворюється слабкий електроліт, іон H+ і інші іони. рН розчину <7 (розчин набуває кислу реакцію). FeCl2+HOH ®Fe(OH)Cl+HCl Fe2+2Cl–+H+OH®FeOH+2Cl–Н+ Гідроліз за аніоном (в реакцію з водою
вступає тільки аніон). Сіль, утворена сильною основою і слабкою кислотою (КClO, K2SiO3, Na2CO3, CH3COONa) піддається гідролізу
за аніоном, як результат утворюється слабкий електроліт, гідроксид-іон ОН- і інші іони. рН таких розчинів >7 (розчин набуває лужну реакцію). K2SiO3+НОH®KHSiO3+KОН 2K++SiO32–+Н++ОH–®НSiO3–+2K++ОН– Спільний гідроліз (в реакцію з водою
вступає і катіон і аніон). Сіль, утворена слабкою основою і слабкою кислотою
(СН3СООNН4, (NН4)2СО3,
Al2S3), гідролізується і по катіону, і по аніону. Як
результат утворюються малодисоціюючі основи і кислота. рН розчинів таких
солей залежить від відносної сили кислоти і підстави. Мірою сили кислоти і
підстави є константа дисоціації відповідного реактиву. Реакція середовища цих
розчинів може бути нейтральною, слабокислою. Al2S3+6H2O⇒2Al(OH)3↓+3H2S↑ Гідроліз – процес оборотний. Гідроліз протікає
необоротно, якщо в результаті реакції утворюється нерозчинна основа і (або)
летюча кислота. Процесом гідролізу солей можна керувати. 1. Щоб запобігти гідролізу або загальмувати його,
змістивши рівновагу ліворуч, до розчину необхідно додати одну з тих речовини,
які утворюються. Якщо утворюється кислота, додають НСl; або луг, КОН. 2. Щоб пришвидшити гідроліз, у розчин, де утворюється
кислота, додаються луг. І навпаки, додаються кислоту в розчин, де утворюється
луг. 3. Якщо розбавляти розчин, то підвищується концентрація
води та, згідно із законом діючих мас, відбувається зміщення рівновагі
праворуч. Це означає, що гідроліз пройде повніше. 4. Ступінь дисоціації води за підвищення температури
дуже збільшується, тобто підвищується концентрація іонів Н+ і ОН–, що збільшує
ймовірність утворення малодисоційованих молекул кислоти чи основи. Гідроліз
відбувається повніше. Отже, якщо необхідно уповільнити гідроліз, то потрібно
працювати з концентрованими розчинами на холоді (корисно також додати
надлишок одного з продуктів, що утворюються – лугу чи кислоти).
Гальванічний елемент – хімічне джерело
живлення, в якому використовують різниця електродних потенціалів двох
металів, занурених у електроліт. Гальванічний елемент є непідзарядним хімічним джерелом
електроенергії.
Історія. Явище виникнення
електричного струму у разі контакту різних металів було відкрито італійським
фізіологом, професором медицини Болонського університету Луїджі Гальвані у 1786
році. Гальвані описав скорочення м’язів задніх лапок жаби, закріплених на
мідних гачках, у разі дотику сталевого скальпеля. Спостереження
першовідкривач пояснив як прояв «тваринної електрики». Італійський фізик і
хімік Алессандро Вольта, зацікавившись дослідами Гальвані, побачив зовсім
нове явище – створення потоку електричних зарядів. Перевіряючи твердження
Гальвані, А.Вольта проробив серію дослідів і дійшов висновку, що причиною
скорочення м’язів служить не «тваринна електрика», а наявність ланцюга з
різних провідників в рідині. Щоб підтвердити це, А.Вольта замінив лапку жаби
електрометром і повторив дослід. У 1800 році А.Вольта вперше публічно заявляє
про свої відкриття на засіданні Лондонського королівського товариства, що
провідник другого класу (рідкий) знаходиться в середині і стикається з двома
провідниками першого класу з двох різних металів. Внаслідок цього виникає
електричний струм того чи іншого напрямку. Наприкінці XVIII ст. італійський фізик Алессандро Вольта винайшов оригінальний
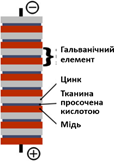
пристрій, що виробляв електричний струм. Це був немов товстий «бутерброд» iз металічних пластин (міді і цинку) i тканини, яка заздалегідь була просякнута
розчином сульфатної кислоти (мал. 9.6). До першої та останньої пластинок припаювали дротинки.
Якщо ix занурювали у воду, то
на поверхні кожної дротинки починалося виділення газу. Це відбувався
електроліз води. Отже, крізь воду проходив електричний струм. Винайдене
джерело струму було названо гальванічним елементом на честь Луїджі Гальвані (1737-1798) –
італійського лікаря, анатома і фізіолога, який є одним із засновників
електрофізіології. Перший гальванічний елемент був незручним у
користуванні i мав короткий час дії.
Поява на електроді бульбашок газу ускладнювала рух іонів біля електроду.
Англійський хімік Джон Фредерик Даніель та незалежно від нього
німецький і російський фізик-винахідник Б.С.Якобі у 1836 році запропонували інший елемент, що
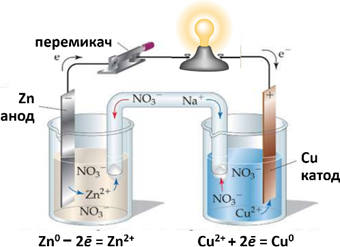
виробляв електричний струм протягом значно довшого часу. Гальванічний елемент Даніеля-Якобі
складається з двох посудин (мал. 9.7). В одній міститься розчин цинк
сульфату, у який занурено пластинку з цинку, в іншій – купрум(ІІ) сульфату у
який занурено пластинку з міді. Розчини з’єднано трубкою (сольовим містком),
що заповнена розчином електроліту, іони якого ʜе взаємодіють з іншими іонами в гальванічному
елементі, наприклад натрій нітрату. У такий спосіб забезпечується електричний
контакт між посудинами. Для того щоб розчин не виливався, кінці трубки
закривають скловатою чи гелем, просоченим електролітом. Якщо електроди
з’єднати дротинками з електричною лампочкою, то вона засвітиться.
Мал. 9.7. Гальванічний елемент
Даніеля-Якобі
Через деякий час в обох склянках можна спостерігати
хімічні перетворення: цинкова пластинка розчиняється, а на мідній пластинці з
розчину осаджується мідь (мал.9.8) зменшується, а мідної збільшується. Водночас
послаблюється забарвлення розчину купрум (ІІ) сульфату (концентрація іонів Сu2+ знижується). Ці хімічні зміни є результатом перенесення електронів з
однієї частини елемента до іншого, тобто це типовий електрохімічний процес.
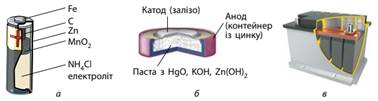
Найпоширенішим у побуті хімічним джерелом струму є елемент
Лекланше, який ми зазвичай називаємо батарейкою. Вони є різного розміру й
форми, з різною електричною ємністю, але внутрішня будова в них подібна (мал.
9.9а). Ртутні батарейки широко використовують у калькуляторах, наручних годинниках, як джерело струму
для материнських плат комп’ютерів (мал. 9.9б). Кислотний свинцевий акумулятор є в
будь-якому автомобілі й використовується для підпалювання
паливно-повітряної суміші у двигуні внутрішнього згоряння (мал. 9.9в).
Свинцеві електроди цього акумулятора занурені в 33%-й розчин сульфатної
кислоти. Генерація
струму відбувається внаслідок реакції:
Мал. 9.9.
Хімічні джерела струму: а) елемент Лекланше (батарейка); б) ртутна
батарейка; в) кислотний свинцевий акумулятор ЕРС зарядженого свинцевого акумулятора майже 2 В. Їх
також використовують у джерелах безперебійного живлення, тролейбусах та
трамваях, морських кораблях тощо. Найбільші недоліки таких акумуляторів:
необхідність періодично замінювати концентровану сульфатну кислоту,
громіздкість та велика маса. Лужні акумулятори позбавлені недоліків кислотних. Але
вони дають меншу напругу: ЕРС зарядженого нікель-кадмієвого акумулятора
дорівнює близько 1,36 В. Крім того, в них часто використовують метали,
потрапляння яких у довкілля є дуже небезпечним (зокрема ртуть, кадмій тощо).
Їх широко застосовують там, де потрібні акумулятори невеликого розміру
(побутові прилади), а також там, де маса й розміри є критичними параметрами
(літаки та підводні човни). Літій-іонні та літій-полімерні акумулятори дедалі
частіше застосовують в електронних пристроях: смартфонах, ноутбуках, фото- та
відеокамерах тощо. У них електродами зазвичай є алюмінієва та мідна фольга, а
носієм заряду – іони Літію Li+. У літій-іонних акумуляторів є значний недолік: протягом тривалої
експлуатації всередині них накопичується водень, унаслідок чого вони «розпухають»,
а також починають дуже нагріватися під час зарядження і стають
вогненебезпечними. Літій-полімерні акумулятори позбавлені цих недоліків, тому
їх використовують частіше. Останнім часом почали активно розробляти
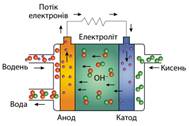
паливні елементи. Їх особливістю є те, що реагенти до них потрапляють ззовні:
паливо (водень, метан, метанол тощо) зберігається в окремому контейнері (і
його можна взяти із собою в запас), а кисень потрапляє до реактора із повітря
(мал. 9.10).
Компанія Panasonic 2006 року першою розпочала випуск портативних паливних
елементів, а сьогодні їх уже виготовляють декілька виробників. Як паливо в цих
елементах використовують метанол. Такі пристрої стануть у пригоді там, де
немає можливості підзарядити акумулятор від зовнішнього джерела струму,
наприклад у пустелі чи лісі. Виробники автомобілів активно розробляють моделі
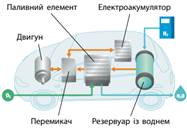
паливних елементів для використання в електромобілях (мал. 9.11).
Ефективність перетворення хімічної енергії пального на механічну енергію руху
набагато вища, якщо здійснювати це через електричну енергію (у паливному елементі),
ніж через теплову (у двигуні внутрішнього згоряння). Питання для самоконтролю 1. Які хімічні реакції називають оборотними? Наведіть приклади таких реакцій. 2. Що розуміють під
хімічною рівновагою? 3. Чому стан хімічної
рівноваги в оборотних реакціях дістав назву «динамічний стан»? 4. Сформулюйте принцип Ле
Шательє. 5. Дайте визначення
гідролізу. 6. Які види гідролізу
розрізняють? На чому ґрунтується така класифікація? 7. Охарактеризуйте різні
види гідролізу. 8. Що називають
гальванічним елементом? Що таке хімічні джерела струму? 10. Визначте особливості паливних елементів та
електричних акумуляторів. |
||||||||||||||||||||||||