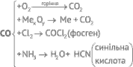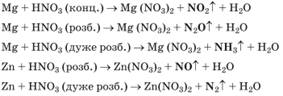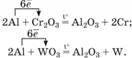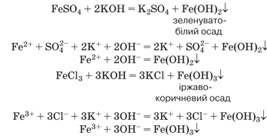|
|
ХІМІЯ Електронний посібник |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
10.1. Неметали. Загальна характеристика неметалів. Фізичні властивості 10.2. Алотропія. Явище адсорбції 10.3. Хімічні властивості та застосування неметалів 10.4. Сполуки неметалічних елементів з гідрогеном та оксигеном 10.6. Особливості
взаємодії металів з нітратною та концентрованою сульфатною кислотами 10.8. Основи, їхні властивості 10.9. Середні солі, фізичні та хімічні властивості 10.10. Сучасні силікатні матеріали. Мінеральні добрива. Поняття про кислотні та
лужні дощі 10.1.
Неметали. Загальна характеристика неметалів. Фізичні властивості Хімічні елементи можна умовно поділити на дві групи: металічні та неметалічні елементи. Загалом відомо 22
неметалічних хімічних елементи. Усі вони у природі здатні існувати у вільному
стані, тобто, у вигляді однієї або кількох простих речовин. У періодичній системі хімічних елементів неметалічні елементи розміщені в
кінці періодів (мал. 10.1).
Мал. 10.1. 1) металічні елементи; 2) елементи, прості речовини яких виявляють властивості, проміжні між металами й неметалами;3) неметалічні
елементи До них належать: Гідроген, Гелій, Бор, Карбон,
Нітроген, Оксиген, Флуор, Неон, Силіцій, Фосфор, Сульфур, Хлор, Аргон, Арсен,
Селен, Бром, Телур, Йод, Астат, та інші інертні елементи. Це p-елементи, за винятком
Н і Не, які належать до s – елементів (мал. 10.2).
Які ж ознаки за своєю сукупністю дають можливість найкраще пізнати хімічний
елемент з неметалічним характером? Типовою для них є здатність бути в реакціях окиснювачами.
Мал. 10.2. Будова атомів неметалів На зовнішньому енергетичному рівні атоми неметалічних
елементів мають, зазвичай, понад 4 електрони. Майже всі вони можуть
приєднувати певну кількість електронів і перетворюватися на негативно
заряджені іони – аніони. Здатність атомів неметалічних елементів приєднувати
електрони або зміщувати їх у свій бік зростає у групі знизу догори, а в
періоді – зліва направо. Тому найтиповіший неметалічний елемент перебуває у
правому верхньому куті періодичної системи. Це – Флуор. Кількість електронів
на зовнішньому енергетичному рівні збігається з номером групи. Неметалічні елементи
однієї групи головної підгрупи мають однакову будову зовнішнього
енергетичного рівня. Вищі оксиди неметалічних елементів є кислотними
оксидами. Сполуки неметалічних елементів з Гідрогеном за звичайних умов –
газоподібні речовини. До неметалів належать фосфор, сірка, графіт, бром, йод,
кисень, водень, кремній тощо (мал. 10.3).
Мал. 10.3. Назви найпоширеніших простих речовин та відповідних хімічних елементів, що їх утворюють За сучасною українською хімічною номенклатурою назви
неметалів пишуть з малої літери й вони не завжди збігаються з назвами
відповідних їм неметалічних елементів. Назви неметалів і
неметалічних елементів за сучасною українською хімічною номенклатурою
Поширення
неметалів у природі. Неметали більш поширені в природі,
аніж метали, проте у вільному стані трапляються не всі. Неметали азот,
кисень, інертні гази – це основні речовини у складі повітря. Поклади
самородної сірки в Передкарпатті – одні з найбільших у світі. Промисловим
родовищем графіту в Україні є Завалівське родовище, сировину якого
використовує Маріупольський графітовий комбінат. У деяких регіонах України виявлено поклади порід, які
можуть містити алмази (зокрема, у Житомирській області, на Волині), проте
промислові родовища поки що не розвідані. Значно більше неметалічних елементів існують у вигляді
складних речовин, серед яких домінують оксиди та солі. Фізичні
властивості неметалів. За нормальних умов неметали – водень Н2, фтор F2, хлор Cl2, кисень O2, озон О3, азот N2 і благородні гази
(гелій He, неон Ne, аргон Ar, криптон Kr, ксенон Xe, радон Rn) – перебувають у газоподібному агрегатному
стані, бром Вr2 – рідкому, решта неметалів
– тверді речовини. Неметали (мал. 10.4) відрізняються за кольором
і запахом. Так, водень, кисень, азот – безбарвні гази без запаху; фтор –
блідо-жовтий, а хлор – жовто-зелений (до того ж отруйні гази з різким
специфічним запахом). Бром – темно-червона отруйна рідина, жовто-бурі пари
якої мають різкий, подразливий запах. Фосфор червоний – тверда речовина
червоного кольору без запаху, фосфор білий – тверда отруйна речовина білого
кольору з характерним часниковим запахом. Серед неметалів твердими без запаху
речовинами є сірка (жовтий колір) і йод (чорно-фіолетова речовина з
металічним блиском).
Мал. 10.4. Зразки неметалів: а) хлор; б) червоний фосфор; в) бром; г) йод; д) кисень рідкий;
е) азот рідкий Оскільки неметали за нормальних умов можуть перебувати
в різних агрегатних станах, то й температури їх плавлення та кипіння мають
широкий діапазон. Газоподібні неметали (водень, кисень, азот) киплять за низьких
температур (майже 200 °С). Тверда речовина йод за нагрівання сублімується –
відразу переходить із твердого стану в газоподібний. (мал. 10.5). Для того щоб розплавити сірку, достатньо температури
полум’я спиртівки чи сухого пального (мал. 10.6), тоді як одна з алотропних
модифікацій Карбону – алмаз – має температуру плавлення понад 3000 °С.
Мал. 10.5. Сублімація йоду Мал.
10.6. Плавлення сірки Більшість неметалів не проводять електричний струм,
тобто є діелектриками. Кремній – напівпровідник, а графіт – провідник
електричного струму. Неметали погано проводять тепло, крихкі, деякі розчинні
у воді, багато з них добре розчинні в органічних розчинниках. 10.2.
Алотропія. Явище адсорбції Явище існування хімічного елемента у
вигляді двох або кількох простих речовин, різних за властивостями і будовою
називають алотропією, а самі прості речовини – алотропними модифікаціями. Термін
увів Я.Берцеліус у 1841 р., що з грецької означає «інші властивості». Розглянемо на прикладі оксисену. Оксиген утворює дві
алотропні видозміни – кисень та озон. Кисень – безбарвний
газ, трохи важчий за повітря, без запаху, дуже погано розчиняється у воді. Озон – це газ
синього кольору, майже в 1,7 рази важчий за повітря, має різкий дратівний
запах. Назва походить від грецького озейн – «запах». Значно краще, ніж
кисень, розчиняється у воді. Токсичний, надзвичайно сильний окисник. У
природі озон утворюється з кисню під час грозових розрядів, а на висоті 10 –
30 км – під дією ультрафіолетового випромінювання. 3О2 ® 2О3 Він затримує шкідливе для людини ультрафіолетове
випромінювання Сонця, поглинає інфрачервоні промені Землі, перешкоджаючи її
остиганню. Молекула озону нестійка, досить легко розпадається: 2О3 ® 3О2 Озон значно сильніший окисник, ніж навіть кисень. Він
окиснює чимало речовин, які не окиснює кисень, наприклад срібло та ртуть: 8Ag+2O3 ® 4Ag2O+O2 Виявляють озон за посинінням вологого йод крохмального
індикаторного папірця. Під дією озону калій йодид окиснюється з утворенням
йоду, який і дає синє забарвлення з крохмалем: 2KI+O3+H2O
®
2KOH+I2+O2 Озон використовують для очищення питної води,
дезінфекції повітря. Повітря хвойних лісів корисне, тому що озон утворюється
в процесі окиснення смоли хвойних дерев. Порівняльна
таблиця складу і властивостей кисню й озону
Алотропні модифікації карбону. Карбон утворює дві найбільш
відомі алотропні модифікації – алмаз і графіт.
(мал. 10.7а) і графіт (мал. 10.8а). Ці речовини відрізняються між собою не
кількісним складом молекул, як у кисню та озону, а будовою кристалів, тобто
розміщенням атомів у вузлах кристалічних ґраток.
Мал. 10.7. Алмаз (а) і модель його кристалічних ґраток (б) У кристалі алмазу щодо будь-якого атома Карбону чотири
сусідніх атоми розташовані в кутах правильного тетраедра (мал. 10.7б), усі
зв’язки між атомами у кристалічних ґратках рівноцінні, а відстані однакові.
Мал. 10.8. Графіт і вироби з нього (а), модель
кристалічних ґраток графіту (б) Алмаз –
найтвердіший з усіх мінералів. Густина ρ=3,5 г/см3.
Чисті алмази безбарвні та прозорі. Кристалічна гратка алмаза – атомна. Чотири
однакові електронні хмари спрямовані до вершин тетраедра. Алмаз крихкий і
розколюється від удару. Проводить тепло, але не проводить електричного
струму. Не діють на алмаз кислоти й луги. За нагрівання до 1200°С (без
доступу повітря) перетворюється на графіт. Графіт – сірий,
масний на дотик, крихкий, має металевий блиск, ρ=2,2 г/см3,
м’який, після тертя ним об папір залишає сірі смуги. Кристал графіту
побудований із плоских сіток атомів Карбону, розташованих один над одним.
Графіт добре проводить тепло, має близьку до металів електропровідність.
Деревне вугілля утворюється як результат нагрівання деревини без доступу
повітря. Рихлий чорний продукт, зберігає структуру деревини. Алотропні модифікації
Фосфору. Серед алотропних модифікацій Фосфору найбільш поширені: білий фосфор – (молекулярна будова
кристалічних ґраток), червоний і чорний фосфор (атомна будова
кристалічних ґраток). Усі вони – тверді речовини. Змінюючи температуру, одну
алотропну модифікацію Фосфору можна за кілька годин перетворити на іншу. Білий фосфор (мал. 10.9а) – м’яка,
безбарвна, воскоподібна, люмінесцентна, з часниковим запахом і дуже отруйна
речовина, легко окиснюється на повітрі з виділенням світлової енергії, тому
світиться в темряві. Через високу хімічну активність білого фосфору його
зберігають у воді і, якщо можна, у темряві. Утворюється як результат
інтенсивного охолодження пари червоного фосфору. Червоний фосфор (мал. 10.9б) порівняно
з білим стійкіший до нагрівання, без запаху, менш реакційно здатний, неотруйний,
не люмінесцентний, не розчиняється у воді та органічних розчинниках,
самозаймається на повітрі тільки за температури 240 – 260 °С. Його
використовують у виробництві сірників (входить до складу бічного покриття
сірникової коробки). Якщо кресати головкою сірника по цьому покриттю, фосфор
окиснюється наявною в головці сірника речовиною калій хлоратом KClO3. Від цього інша
речовина головки – сірка – загорається й підпалює дерев’яну частину сірника. Чорний фосфор (мал. 10.9в) має
металічний блиск, шарувату будову й напівпровідникові властивості. Добувають
його з білого фосфору за тривалого нагрівання під високим тиском.
Мал. 10.9. Алотропні модифікації Фосфору:
а) білий Фосфор; б) червоний фосфор; в) чорний фосфор Алотропні модифікації
Сульфуру. Природною алотропною модифікацією Сульфуру є ромбічна сірка. Це
лимонно-жовта, крихка, кристалічна речовина без запаху, нерозчинна у воді
(мал. 10.10). Назва пов’язана з тим, що її кристали мають форму октаедра зі
зрізаними кутами (мал. 10.10, а). Кожна молекула ромбічної сірки складається
з 8 атомів Сульфуру (у рівняннях реакцій послуговуються записом одного атома S). За температури 119,5 °С ромбічна сірка
плавиться й перетворюється на моноклінну сірку – майже білі кристалічні
пластинки (мал. 10.10, б). Ця алотропна модифікація Сульфуру нестійка і вже
за температури 95,6 °С знову перетворюється на ромбічну сірку. Якщо довести
ромбічну сірку до кипіння (температура кипіння 444,6 °С) і вилити її в
холодну воду, то під впливом різкого перепаду температур вона перетворюється
на пластичну сірку (мал. 10.10в). Пластична сірка має жовто-коричневий колір,
ріжеться ножем, еластична й витягується в нитки. На повітрі за нормальних
умов вона за кілька днів знову стає ромбічною сіркою.
Мал. 10.10. Алотропні модифікації
Сульфуру: а) ромбічна сірка; б)
моноклінна сірка; в) пластична сірка Явище
адсорбції. Ще наприкінці XVIII
ст. було відомо, що на поверхні твердих тіл здатні поглинатися гази, пари і
розчинені речовини. Явище це носить загальну назву адсорбції. Адсорбція – це здатність деяких
речовин (адсорбентів), зокрема вуглецю, утримувати на своїй поверхні частинки
газу або розчиненої речовини. До того ж адсорбент не змінюється, а лише
утримує на своїй поверхні газ чи рідину внаслідок притягувальних сил між
окремими частинками. Отже, концентрація утримуваної речовини в об’ємі, що
межує з адсорбентом, зростає.
На адсорбційній здатності вуглецю базується його
використання в медицині – це пігулки або капсули активованого вугілля. Їх
застосовують внутрішньо в разі отруєння. Ученим Національної академії наук
України В. В. Стрелко, В. Г. Ніколаєву, М. Т. Картелю належить створення
адсорбентів медичного призначення, зокрема вуглецевих гемосорбентів «КАРБОН».
Їх використовують для очищення крові поза організмом у разі отруєнь і різних
тяжких захворювань. В Україні створено Інститут сорбції та проблем
ендоекології НАН України, учені якого працюють над створенням сорбційних
матеріалів для медицини, захисту довкілля. Силу адсорбційного поля і його характер
визначають природою цього адсорбенту (поглинача) і розташуванням часток на
його поверхні. Крім того, адсорбційна здатність залежить і від величини
поверхні. Тому зрозуміло, що окремі адсорбенти можуть дуже сильно
відрізнятися один від одного за своєю поглинальної здатності як кількісно,
так і якісно (мал. 10.11).
Мал. 10.11. Адсорбенти Практичне значення адсорбційних явищ дуже
велике. Протигази тієї або іншої конструкції широко застосовують під час
роботи на різних шкідливих виробництвах. Адсорбцію безпосередньо
використовують під час вироблення цукру (для його очищення), в нафтовій
промисловості (для уловлювання бензину з природних газів. 10.3.
Хімічні властивості та застосування неметалів У межах одного періоду зі
збільшенням порядкового номера неметалічні властивості хімічних елементів
посилюються. У межах однієї підгрупи зі
збільшенням порядкового номера неметалічні властивості хімічних елементів
послаблюються. Розглянемо хімічні властивості неметалів які можуть
проявляти як окисні, так і відновні властивості. Окисні властивості неметалів. 1. Взаємодія
неметалів (сульфура, фосфора, нітрогена, карбона) з металами, наприклад:
сірка з металами утворює сульфіди. Взаємодіє з
усіма металами (виняток Аu, Pt). Реакції
протікають під час нагрівання, але в деяких випадках реакція відбувається за
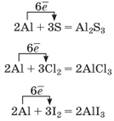
звичайних умов (Co, Hg). 2Al+3S=Al2S3 Zn+S=ZnS Hg+S=HgS 2.
У разі взаємодії неметалів( Азота та Фосфора) з металами утворюються нітриди, фосфіди. 2P+3Mg=Mg3P2 3Mg+N2=Mg3N2 3. Вуглець у
разі взаємодії з металами утворює карбіди. Ca+2C=CaC2 4Al+3C=Al4C3 4. Силіцій у
разі взаємодії з металами – силіциди. 2Mg+Si=Mg2Si 5. Взаємодія
неметалів (Сульфура, Азота та Вуглецю) з воднем, реакції відбувається за
нагрівання. H2+S=H2SΔН=-20,92Кдж N2+3H2=2NH3 6. Вуглець з
воднем за наявності нікелевого каталізатора і нагріваннія утворює метан. C+2H2=CH4 7. Взаємодія
неметалів (Сульфура, Карбона та Гідрогена) з галогенами (крім І2). S+Cl2=S2Cl2 2C+Cl2=C2Cl2 Н2+CI2 ® 2НCl Відновні властивості неметалів
проявляються у взаємодії з киснем і галогенами. 1. За нормальних умов сірка з киснем не взаємодіє. У
разі нагрівання на повітрі згоряє блакитним, а в чистому кисні – синім
полум’ям: S+О2→SО2 (утворюється
сульфур(IV) оксид, безбарвний
газ із різким запахом). 2. Взаємодія азоту з киснем відбувається за високої
температури в присутності каталізатора за схемою: N2+О2→2NО. Така
реакція в природі відбувається під час грозових розрядів. 3. Як результат взаємодії фосфору з O2 утворюються
різні продукти. У надлишку O2 (повітря) утворюється P2O5 – фосфорний
ангідрид, у разі нестачі O2–P2O3
(фосфористий). 4Р+5О2 ® 2Р2О5 4Р+3О2 ® 2Р2О3 2Р2О3+2О2 ® 2Р2О5 С+2CI2
®
CCI4 2S+Cl2=S2Cl2 Н2+CI2 ® 2НCl Відновні властивості водню й вуглецю
в реакціях з оксидами металічних елементів Усі реакції за участю
вуглецю є окисно-відновними. Карбон у них може виявляти відновну
(найхарактерніша властивість) або окиснювальну властивості. Як відновник
вуглець взаємодіє з киснем, вуглекислим газом, оксидами металічних елементів,
водою. Реакції вуглецю з оксидами металічних елементів використовують у
металургії для добування заліза, міді, цинку, свинцю та інших металів. С+СuО=С+СО 3C+Fe2O3=2Fe+3CO ZnO+C=Zn+C SiO2+C=Si+CO2 CaO+3C=CaC2+CO SiO2+3C=SiC+2CO Водень хімічно інертний і взаємодіє лише з
найактивнішим неметалом фтором, з іншими речовинами – за нагрівання,
освітлення або наявності каталізатора. У реакціях може бути
відновником або окисником. Відновні властивості
водень виявляє у реакціях з киснем, бромом, сіркою, селеном, азотом та іншими
неметалами, а також з оксидами металічних елементів (зазвичай, d-елементів). 2Н2+О2=2Н2О Н2+Br2=2НBr 3Н2+N2=2NH3 Н2+S=H2S Якщо над нагрітим
оксидом купруму (II) CuO пропускати струмінь водню, то відбувається реакція, в ході
якої Гідроген відбирає від оксиду купрума (II) Оксиген, утворюючи з ним воду, а мідь при цьому відновлюється: CuO+H2=Cu+H2O. Також водень взаємодіє з розчином солей
дє також відновлює мідь: CuCl2+H2=Cu+2HCl. Ці реакції використовують під час добування металів.
10.4. Сполуки
неметалічних елементів з Гідрогеном та Оксигеном Більшість неметалічних
елементів утворюють сполуки з Гідрогеном. Їх не утворюють лише інертні
елементи. Бінарні сполуки Гідрогену з неметалами назвали леткими тому, що за
звичайних умов вони газоподібні (HCl, NH3, H2S), або рідини, що легко переходять у
газоподібний стан (HF за температури 19,5°С і H2O). Ці сполуки складаються із молекул.
Атоми в них сполучені між собою ковалентними полярними зв’язками. Для сполук
неметалічних елементів з Гідрогеном найчастіше використовують тривіальні
назви, рідше – хімічні. Гідроген хлорид (HCl хлороводень) – безбарвний газ з різким характерним
задушливим запахом. Він у 1,26 разів важчий за повітря. За атмосферного тиску
і температури –84°С гідроген хлорид переходить у рідкий стан, а за
температури –112°С – твердне. Сухий гідроген хлорид не вступає у взаємодію з
металами, а за наявності слідів вологи реакція з активними металами
відбувається енергійно. В одному літрі води розчиняється до 500 л гідроген
хлориду утворюючи хлоридну кислоту. «Туман», що з’являється у разі
потрапляння гідроген хлориду у вологе повітря – це дрібненькі краплинки
хлоридної кислоти. Хлороводень сильно подразнює дихальні шляхи, тому досліди
з ним слід проводити у витяжній шафі. Хлоридна кислота належить до сильних
кислот і виявляє всі властивості кислот. Добування. У промисловості добувають гідроген хлорид спалюванням водню в атмосфері
хлору: Н2+Сl2=2HCl↑ У лабораторії – за
реакцією обміну між кухонною сіллю у твердому стані і концентрованою
сульфатною кислотою під час нагрівання: 2NaCl+H2SO4=2HCl+Na2SO4 Амоніак NH3 (аміак, гідроген нітрид) –
безбарвний газ із характерним різким запахом, майже вдвічі легший за повітря,
дуже добре розчиняється у воді. За звичайних умов в одному об’ємі води
розчиняється близько 700 об’ємів амоніаку. За підвищеного тиску або
охолодження до –33,6°С амоніак зріджується, а за –77,8°С твердне. Рідкий
амоніак має велику теплоту випаровування, тому його використовують у
холодильних установках. Відомий у медичній практиці нашатирний спирт (мал.
10.12) є водним розчином амоніаку з масовою часткою розчиненої речовини 10 %.
Добування. У промисловості добувають амоніак з повітря,
а також у разі взаємодії нітрогену з воднем у присутності каталізатора,
високого тиску та високої температури: N2+3H2=2NH3.
У лабораторних умовах добувають амоніак дією гашеного
вапна на солі амоніаку: NH4Cl+Ca(OH)2=CaCI2+2NH3↑+2H2O Фізіологічна дія. Вдихання малих
кількостей амоніаку стимулює роботу серця і нервової системи, тому нашатирний
спирт дають нюхати у разі втрати свідомості та отруєння чадним газом. Вдихання великих кількостей подразнює слизову оболонку очей і дихальних
шляхів. У разі потрапляння в організм викликає нудоту, пронос, смерть від
набряку гортані. У разі потрапляння в очі викликає сліпоту. Перша допомога за
отруєння амоніаком: свіже повітря, промити шлунок водою підкисленою оцтом або
лимонним соком, випити склянку молока. Очі промивають великою кількістю води. Застосування амоніаку. Амоніак – один із важливих продуктів хімічної промисловості. Він є
вихідною речовиною для виробництва нітратної кислоти, нітратних добрив,
вибухових речовин, барвників, лікарських речовин. Випаровування рідкого
амоніаку використовують у холодильних установках для створення штучного
холоду. Штучний холод дає можливість перевозити продукти, що швидко псуються
на будь-які відстані, зберігати їх на складах. У сільському господарстві
водний розчин амоніаку (нашатирний спирт) використовують як рідке азотне
добриво. У побуті нашатирний спирт використовують для виведення плям, чищення
ювелірних виробів, килимів. Використовують у лабораторній практиці та медицині.
Одержання оксидів
неметалічних і металічних елементів. Про утворення гідроген
оксиду (вода), карбон(ІV) оксиду (вуглекислий
газ), силіцій(ІV) оксиду (кварцовий пісок),
оксидів Феруму та деяких інших, подбала природа. Відомо три способи одержання оксидів. 1-й спосіб – окиснення
відповідних простих речовин киснем. С +
О2 ® СО2 Аl + O2 ® Аl2O3 Ca + O2 ® CaO 2-й спосіб – окиснення бінарних
сполук киснем. ZnS + O2 ® ZnO + SO2 CH4 + O2 ® CO2 + H2O 3-й спосіб – термічний розклад
деяких речовин (нерозчинних у воді карбонатів, нерозчинних основ, амфотерних
гідроксидів). MgCO3 ® MgO + CO2↑ Cu(OH)2 ® CuO + H2O Zn(OH)2 ® ZnO + H2O Природні
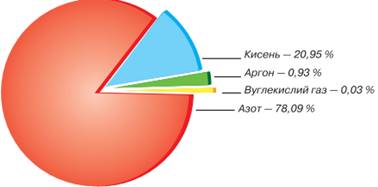
причини появи в атмосфері оксидів неметалічних елементів. Вам відомі об’ємні
частки газів у повітрі. Пригадати їх допоможе діаграма (мал. 10.13). Мал. 10.13. Діаграма
складу повітря Нині, в умовах стрімкої урбанізації, уміст в атмосфері вуглекислого
газу і води збільшується через антропогенні чинники
(спалювання пального у двигунах транспортних засобів, на теплових
електростанціях, заводах тощо). Окрім водяної пари й вуглекислого газу, в
атмосферу потрапляють сотні тисяч тонн інших речовин, зокрема й оксидів. Тобто до природних
джерел надходження в атмосферу оксидів неметалічних елементів додаються
антропогенні. Це створює загрозу природі через виникнення парникового ефекту
й кислотних дощів.
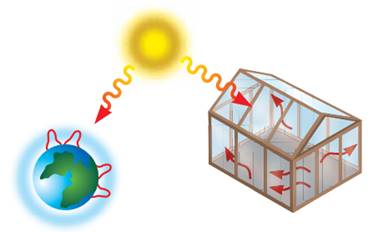
Мал. 10.14.
Парниковий ефект Парниковий ефект – явище в атмосфері Землі, зумовлене тим, що молекули наявних у ній
газів перешкоджають сонячним променям, що відбилися від поверхні Землі,
повертатися у Космос (мал. 10.14). Цим самим підтримується рівновага між
теплом Сонця, яке досягає поверхні Землі, і тепловим випромінюванням земної
поверхні. За оцінюванням вчених, без парникового ефекту температура Землі була б на
25 – 30 °С нижчою, аніж є насправді. Наявні в повітрі водяна пара,
вуглекислий газ, озон, метан впливають на цю рівновагу. Вони функціонують як
скло в теплицях, що дає змогу сонячним променям потрапляти в неї й затримує
інфрачервоні промені, забезпечуючи сприятливу для росту рослин температуру.
За таку дію вони дістали назву «парникові гази». Основними парниковими газами в атмосфері Землі є водяна
пара (H2O), вуглекислий газ (CO2), озон (O3), нітроген(І) оксид (N2O), метан (CH4). Помірний парниковий ефект створює сприятливі температурні умови для
життя на нашій планеті, не допускає її переохолодження. Збільшуючи викиди
парникових газів в атмосферу (робота транспорту, спалювання палива у великій
кількості, виробництво електроенергії тощо), вирубуючи ліси, люди порушують
тепловий баланс, що встановився впродовж віків. Лісові пожежі й виверження
вулканів теж призводять до збільшення кількості вуглекислого газу в
атмосфері. Зі збільшенням концентрації парникових газів посилюється
парниковий ефект і підвищується температура на нашій планеті. Потепління
загрожує таненням льодовиків і снігів у зоні вічної мерзлоти, що в подальшому
може спричинити небажане підняття рівня води у Світовому океані. Шляхи вирішення
проблеми парникового ефекту. Цю проблему можна розв’язати завдяки зменшенню
викидів парникових газів в атмосферу і збільшенню кількості поглиначів
вуглекислого газу – зелених рослин. Оксиди неметалічних
елементів поділяють на солетворні (їх більшість) і несолетворні (СО, N2O, NO). За агрегатним станом: а) газоподібні; б) тверді (P2O5), в) рідкі H2O, Cl2O7. Залежно від
валентності, один і той самий неметалічний елемент здатний утворювати оксиди
різного кількісного складу. Солетворні оксиди неметалічних елементів
проявляють кислотний характер. Більшість солетворних оксидів взаємодіють з
водою утворюючи кислоти; з основами чи основними оксидами з утворенням солі
тієї кислоти, яка відповідає оксиду. Гідратними формами оксидів неметалічних
елементів є оксигеновмісні кислоти. Сульфур утворює два
кислотні оксиди, які відрізняються складом молекул і властивостями. Порівняльна
характеристика SO2
і SO3
Згідно із теорією кислот та основ Арреніуса,
кислотам можна дати інше визначення, а саме: кислоти – це складні речовини,
які у водних розчинах піддаються електролітичній дисоціації з утворенням
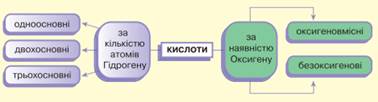
іонів Гідрогену. Класифікація кислот. За різними ознаками кислоти поділяють на різні групи.
До оксигеновмісних кислот належать сульфатна H2SO4, нітратна HNO3 та ін. Оксигеновмісні кислоти є гідратами кислотних оксидів, тобто
продуктами приєднання молекули води до молекули оксиду неметалічного
елемента. До безоксигенових кислот
належать розчини деяких газів у воді. Наприклад, хлоридна кислота – це розчин
газуватого хлороводню НСl у воді, фторидна – розчин фтороводню HF, сульфідна – розчин сірководню H2S тощо. За числом атомів
Гідрогену, здатних заміщатися на атоми металічного елемента (за основністю
кислоти), кислоти поділяють на одноосновні
(HCl, HNO3), двохосновні (H2S, H2SO4), трьохосновні (Н3РО4) тощо. За силою кислот, тобто
за здатністю дисоціюватися на іони, кислоти поділяють на сильні, кислоти середньої
сили та слабкі. До сильних кислот відносять кислоти, які в розчині з концентрацією
0,1 моль/л дисоціюють більш ніж на 30% (сульфатна, нітратна, хлоридна тощо). Слабкі кислоти в розчинах з такою самою
концентрацією дисоціюють менше ніж на 3% (карбонатна, сульфідна, оцтова
тощо). Якщо ступінь дисоціації кислоти в розчині перебуває в інтервалі 3 –
30%, то її відносять до кислот середньої сили (фторидна, нітритна тощо). Фізичні властивості
кислот. Кислоти – це речовини
молекулярної будови. Це обумовлює їхні фізичні властивості: кислоти є
рідинами або легкоплавкими твердими речовинами. Так, найпоширеніші кислоти –
сульфатна H2SО4 та нітратна HNO3 – за звичайних умов рідини. Фосфатна Н3РO4, боратна Н3ВO3, силікатна H2SiO3 – тверді речовини. Безоксигенові кислоти
– фторидна НF, хлоридна НСl, бромідна НВr, йодидна НІ, сульфідна H2S та ціанідна HCN – водні розчини газів, які мають ту саму формулу, що й
кислота. Сульфітна H2SO3 та карбонатна Н2СО3
кислоти є водними розчинами сірчистого SO2 й вуглекислого СO2 газів. Більшість неорганічних кислот
добре розчиняються у воді. З їхніми розчинами зазвичай і працюють у
лабораторіях. Винятком є силікатна кислота H2SiO3 – вона у воді не розчиняється. Хімічні властивості
кислот. 1. Взаємодіють із
металами, які розташовані в ряді активності лівіше водню. Zn+H2SO4 ® ZnSO4+Н2↑ 2. Взаємодіють із
основними оксидами з утворенням солі й води. СuО+H2SO4 ® CuSO4+Н2O 3. Взаємодіють із
основами з утворенням солі й води. 3NaOH+Н3РО4 ® Na3PO4+3H2O 4. Взаємодіють із
солями, якщо виконується хоча б одна умова протікання реакцій обміну. H2SO4+ВаСl2 ® BaSO4↓+2HCl 2НСl+Na2SiO3 ® H2SiO3↓+2NaCl 2HCl+FeS ® FeCl2+H2S↑ 2HNO3+CaCO3 ® Ca(NO3)2+CO2↑ Добування кислот безоксигенових. 1. Розчинення у воді летких сполук з
Гідрогеном (HF,HCl,НВr,HI,H2S). 2. Витіснення із солей
більш сильною кислотою. 2НСl+FeS ® FeCl2+H2S↑ H2SO4(конц.)+NaCl ®NaHSО4+HCl↑ 3. Витіснення із солей
з утворенням осаду. H2SО4+BaCl2 ®BaSО4↓+2НСl Оксигеновмісні кислоти
добувають: 1. Взаємодією
ангідридів кислот з водою. SO2+H2O ® H2SO3 P2O5+3H2O ® 2H3PO4 2. Витісненням із солей
більш сильною кислотою. Na3PO4+3HCl ® H3PO4+3NaCl 2HCl+Na2SiO3 ® H2SiO3↓+2NaCl NaNO3+H2SО4(конц.) ® NaHSО4+HNО3↑ Використання кислот. Кислоти є одними з
найважливіших речовин у промисловості, і не тільки в хімічній. Найбільшу
увагу приділяють сульфатній, нітратній, хлоридній та фосфатній кислотам. Їх
добувають на хімічних заводах у величезних кількостях, особливо сульфатну.
Незрідка про рівень промислового розвитку якої-небудь країни судять по тому,
скільки сульфатної кислоти вона виробляє. І це тому, що сульфатну кислоту (як
і інші кислоти) використовують майже у всіх галузях народного господарства.
Без цих кислот неможливо виготовляти метали, тканини, папір, мінеральні
добрива тощо. Величезні об’єми сульфатної кислоти витрачають для переробки
нафти у звичайне пальне, а також під час виробництва кольорових металів,
мийних засобів, ліків та барвників, вибухових матеріалів. Поняття
про кислотні дощі та причини їх виникнення. Чи доводилося вам
спостерігати, як після довгоочікуваного літнього дощу рослини, замість того,
щоб рости й плодоносити, жовкнуть, в’януть і навіть гинуть (досить часто це
трапляється з огірками)? З великою ймовірністю можна стверджувати, що дощ був
не звичайний, а кислотний, саме він і завдав шкоди рослинам. Кислотні дощі
пошкоджують листки, руйнують їхні захисні воскові покриви, через що ті стають
легкопроникними для комах, шкідливих грибів і мікроорганізмів. Змінюється
обмін речовин у клітинах рослин, що сповільнює їх ріст і розвиток, знижуються
врожаї. Під дією кислотних опадів істотно прискорюється корозія металів,
порушується цілісність лакофарбових покриттів і скла, руйнуються будівлі й
пам’ятники архітектури. Окрім рослин, кислотні дощі завдають шкоди тваринам,
водоймам і водоростям, збільшують кислотність ґрунтів, погіршуючи їх
родючість. Унаслідок контактування з кислотними дощами у людей підвищується
ризик захворювання на астму, алергію, онкологічні захворювання.
Оксиди Сульфуру й Нітрогену потрапляють в
атмосферу під час переробки нафти, спалювання викопного палива (теплові
електростанції) і вуглеводневого пального у двигунах внутрішнього згорання
(автомобільний транспорт, літаки), а також разом з викидними газами
металургійних і хімічних підприємств. Усе це – джерела кислотних дощів
антропогенного походження. Природними джерелами надходження сульфур (ІV) оксиду в атмосферу є виверження вулканів.
Природні надходження в атмосферу оксидів Нітрогену відбуваються під час
електричних розрядів (блискавок) за схемою: азот
повітря ® нітроген(ІІ) оксид ®
нітроген(ІV)
оксид Ґрунти теж потерпають
від кислотних дощів: знижується родючість ґрунту, змінюється склад ґрунтових
мікроорганізмів, погіршується доступність поживних речовин для рослин. Кислотність ґрунтів – властивість,
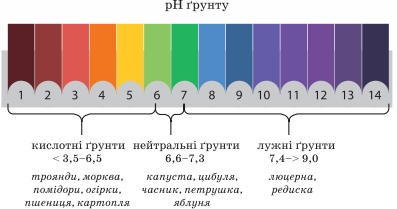
зумовлена наявністю в ґрунтовому розчині катіонів Гідрогену Н+. Кислотні
ґрунти – це ґрунти, рН яких менше від 7, нейтральні – близько 7, а лужні –
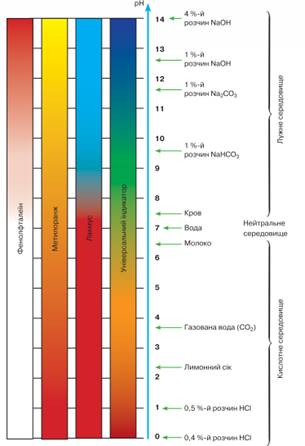
понад 7. Як вам відомо, для визначення точного показника кислотності
використовують рН-метри, а також спеціальні електронні прилади. Доступним для
вас є спосіб визначення кислотності за допомогою універсального індикаторного
папірця. Порівнюючи його колір у досліджуваному середовищі зі шкалою (мал.
10.15), з’ясовують, кислотним, лужним чи нейтральним воно є.
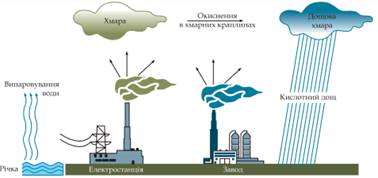
Мал. 10.15. Забарвлення індикаторів у рідинах з різним значенням pH Кислотний дощ утворюється в атмосфері як
результат реакції між водяною парою й такими забруднювальними речовинами, як
сульфур (ІV) оксид SO2, сульфур(VІ) оксид SO3, нітроген(ІV) оксид NO2. Це кислотні оксиди, тому продуктами
реакцій з водою є сульфатна, сульфітна, нітратна, нітритна кислоти. Механізм розглянутих процесів передають такі
рівняння реакцій: 1) Н2О + SO2 =
Н2SO3 (сульфітна кислота), 2H2SO3 + O2
= 2H2SO4 (сульфатна кислота); 2) у результаті
фотохімічного окиснення сульфур (ІV) оксид зазнає перетворення за схемою SO2
® SO3:
2SO2 + О2 = 2SO3; 3) Н2О + SO3 =
Н2SO4 (сульфатна кислота); 4) несолетворний нітроген (ІІ)
оксид у повітрі легко окиснюється до нітроген (ІV) оксиду, який є кислотним оксидом двох кислот: Н2О + 2NO2 =
НNO2 + НNO3 нітритна кислота
нітратна кислота Утворені кислоти в аерозольному вигляді перебувають
у хмарах, а разом з опадами потрапляють на землю (мал. 10.16). Аерозолі сульфітної й сульфатної кислот становлять близько
2/3 кислотних опадів, 1/3 – це аерозолі нітритної й нітратної кислот.
Мал. 10.16. Схема утворення кислотних дощів Дощова вода, що утворюється в результаті
конденсації водяної пари, повинна мати нейтральну реакцію середовища, тобто рН = 7. Проте до складу повітря входить
вуглекислий газ (об’ємний вміст близько 0,03 %) і дощова вода, яка розчиняє
його з утворенням карбонатної кислоти, ледь підкислюється. Тому рН дощової
води дещо нижче цього показника. Шляхи вирішення
проблеми кислотних дощів. Щоб запобігти кислотним дощам, потрібно
скорочувати викиди кислотоутворювальних речовин в атмосферу: установлювати
пиловловлювачі й фільтри для очищення газоподібних викидів, викликаних
антропогенними чинниками; користуватися високоякісним пальним для
автомобілів, застосовувати альтернативні джерела енергії, упроваджувати
безвідходні технології, застосовувати фізико-хімічні і хімічні методи
очищення викидів в атмосферу, і в перспективі – створення екологічно
безпечних виробництв. Якщо концентрація оксидів-забруднювачів у
повітрі збільшується, то кислотні дощі створюють реальну загрозу людині,
рослинному й тваринному світу. Дощова вода, що утворюється як результат
конденсації водяної пари, мала б нейтральне середовище. Проте і в дуже
чистому повітрі завжди є вуглекислий газ, і водневий показник дощової води, у
якій він розчиняється, дорівнює 5,6 – 5,7. Очищення промислових викидів не тільки захищає
атмосферу від забруднень, а й дає додаткову сировину підприємствам.
Наприклад, уловлювання сірки з газових відходів металургійних комбінатів
забезпечує санітарне очищення та здешевлює отримання додаткової кількості
сульфатної кислоти. У перспективі – створення екологічно безпечних
виробництв, загалом всі нові
технології слід впроваджувати тільки після оцінювання їх впливу на навколишнє
середовище. Поступовий перехід на екологічні електромобілі,
більш широке використання електротранспорту (тролейбусів, трамваїв,
метрополітену), також буде кроком на шляху до подолання проблеми виникнення
кислотних дощів. Проблема убезпечення Землі від кислотних дощів
є інтернаціональною. Адже повітряні течії розносять кислотні хмари й тумани
на тисячі кілометрів від місць їх виникнення. Тому всі люди мають дбати про
чистоту повітря. 10.6. Особливості
взаємодії металів з нітратною та концентрованою сульфатною кислотами Фізичні властивості
нітратної й сульфатної кислот. Стійкою у зберіганні є концентрована нітратна
кислота НNO3 з масовою часткою
розчиненої речовини 60 – 68 %. Нітратна кислота – безбарвна рідина з
різким характерним запахом. Перебуваючи під сонячними променями, набуває
бурого кольору внаслідок розкладу з виділенням нітроген (ІV) оксиду. У разі потрапляння на шкіру вона
зумовлює опіки, утворення жовтих плям. Під час проведення реакцій з нітратною
кислотою потрібно бути дуже обережними. Безводна сульфатна кислота
H2SO4 – важка оліїста
рідина, безбар на, без запаху. Ця дуже гігроскопічна речовина роз’їдає папір
і тканини, спричинює опіки шкіри. Працювати із сульфатною кислотою будь-якої
концентрації потрібно обережно. Ви вже знаєте, що внаслідок розчинення
сульфатної кислоти у воді розчин нагрівається настільки, що може закипіти. Це
є дуже небезпечним. Тому під час виготовлення розчину для більш рівномірного
змішування кислоти з водою її невеликими порціями ллють у воду, а не навпаки
і весь час перемішують. Хімічні властивості
нітратної кислоти. Нітратна кислота – сильний електроліт,
у воді повністю дисоціює на йони, тому реакції з її участю в розчинах
відбуваються швидко. Крім того, вона сильний окисник. У реакціях з металами
її окиснювальна дія пов’язана зі зміною ступеня окиснення Нітрогену, водень
не виділяється, а окиснюється з утворенням води. У кислоті Нітроген має максимальний ступінь окиснення,
що дорівнює +5. У реакціях нітратної кислоти з металами атоми Нітрогену
приєднують електрони, тобто виконують функцію окисника, а самі відновлюються.
Величина ступеня окиснення Нітрогену у продукті реакції залежить від
концентрації кислоти, активності металу, температури. Що менша концентрація
кислоти і що активніший метал, то більше Нітроген відновлюється. Під час взаємодії нітратної кислоти з металами серед
продуктів реакції буде один із зазначених газоподібних нітрогеновмісних
продуктів відновлення Нітрогену.
Крім нітрогеновмісного
продукту відновлення нітратної кислоти утворюється сіль (нітрат) і вода. Реагенти і продукти
взаємодії нітратної кислоти з металами відображено на схемі.
Концентрована
нітратна кислота під час нагрівання взаємодіє з більшістю металів, крім
найбільш хімічно інертних металів (їх ще називають металами платинової групи)
– золота, платини, родію та деяких інших. На холоді частина металів, зокрема
залізо, хром, алюміній, не взаємодіють з концентрованою нітратною кислотою,
тому що на їхній поверхні утворюється захисна плівка з оксидів. Малоактивні
метали – мідь, срібло, ртуть, паладій та інші – взаємодіють з безводною і
концентрованою нітратною кислотою з утворенням нітроген (ІV) оксиду NO2, наприклад:
Електронний баланс цієї реакції такий:
Ці самі метали з розбавленою нітратною кислотою
(реакцію прискорює нагрівання) утворюють нітроген (ІІ) оксид NO:
Напишемо електронний баланс цієї реакції й порівняємо
його з попереднім:
Як бачимо, в обох випадках Нітроген, а отже і нітратна
кислота, до складу якої він входить, є окисниками. На відміну від
малоактивних металів, хімічно активні метали, наприклад кальцій, залізо,
цинк, реагують з утворенням різних нітрогеновмісних продуктів відновлення
нітратної кислоти. Усе залежатиме від концентрації кислоти й температури.
Розглянемо приклади.
Примітка. Якщо кислота взаємодіє з металом, утворюючи амоніак, і взята з
надлишком, то кінцевим продуктом реакції будуть вода і дві солі – нітрат
металічного елемента й амоній нітрат:
Хімічні властивості
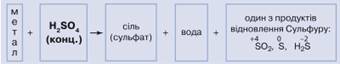
концентрованої сульфатної кислоти. Розбавлена сульфатна кислота не взаємодіє з
міддю, цим вона виявляє загальну властивість кислот відносно металів,
розташованих в ряді активності праворуч від водню. На відміну від
розбавленої, концентрована сульфатна кислота є сильним окисником і взаємодіє
з ними. Унаслідок взаємодії концентрованої сульфатної кислоти з
металами утворюється сіль сульфатної кислоти (сульфат), вода й один із
продуктів відновлення Сульфуру (мал. 10.17).
Мал. 10.17. Схема взаємодії
концентрованої сульфатної кислоти з металами У взаємодії концентрованої сульфатної кислоти з міддю
переконує такий дослід. У концентровану
сульфатну кислоту вносять мідні стружки. Через деякий час (реакцію можна
прискорити нагріванням) розчин у пробірці набуває блакитного забарвлення, а
простір над розчином заповнюється безбарвним газом сульфур (ІV) оксидом. Зверніть увагу: через шкідливість
сульфур(ІV) оксиду цю реакцію
проводять у витяжній шафі. Розглянемо окисно-відновні процеси в цій реакції.
Відбулася зміна ступенів окиснення Купруму й Сульфуру.
На підставі цього напишемо електронний баланс, установимо коефіцієнти за кількістю
відданих і приєднаних електронів, укажемо процеси окиснення і відновлення,
окисника і відновника.
Взаємодія розбавленої
сульфатної кислоти з металами, розташованими в ряді активності ліворуч від
водню, теж є окисно-відновним процесом, проте в ньому відновлюється Гідроген,
а не Сульфур, ступінь окиснення якого залишається без змін.
Нітратна кислота й
концентрована сульфатна кислота – сильні окисники. Під час їхньої взаємодії з
металами утворюється три продукти: сіль, вода й продукт відновлення кислоти. 10.7.
Загальна характеристика металів. Алюміній і залізо: фізичні і хімічні
властивості та застосування Зі 118 хімічних
елементів, відомих на сьогодні, близько 100 елементів є металічними. У
Періодичній системі вони розташовані від початку кожного періоду, а також у
двох родинах f-елементів: Лантаноїди та Актиноїди
(мал. 10.18).
Мал. 10.18. Металічні елементи в Періодичній системі В атомів металічних елементів на зовнішньому енергетичному рівні
міститься невелике число електронів: • у s-елементів – один або
два; • у d-елементів – два (як
виняток – один); • у p-елементів по-різному: в елементів 3 – 5 періодів – по 3 – 4 електрони, в
елементів 6 – 7 періодів значно більше, але через значне віддалення від ядра вони
слабко притягаються до нього. Атоми металічних
елементів у хімічних взаємодіях лише віддають електрони та, як наслідок,
набувають стійкої електронної конфігурації атомів найближчого інертного
елемента. Отже, метали в хімічних
реакціях є винятково відновниками. У цьому полягає їх принципова відмінність
від неметалів. Для металічних
елементів характерна невелика електронегативність – менша за 1,8. Найбільше
металічні властивості виявлені в елементів IA групи Періодичної
системи – лужних елементів. Їхні атоми настільки легко віддають валентні
електрони, що в природі ці елементи перебувають винятково у вигляді сполук. Поширеність металічних елементів у природі. Слово «метал» походить від грецького metallon, що означає «рудник» або «шахта». Дійсно, багато металічних елементів
трапляються в природі у вигляді руд, що складаються з одного або декількох
металовмісних мінералів. Мінерали й гірські породи, які містять сполуки
металічних елементів і придатні для добування металів промисловим способом,
називають рудами: залізна руда, алюмінієва, мідна, свинцева тощо. Найпоширеніший у земній
корі металічний елемент – Алюміній (7 %), він поступається лише двом неметалічним – Оксигену й Силіцію.
Друге місце серед металічних елементів посідає Ферум (4 %), третє – Кальцій (3 %), потім Натрій, Калій і Магній (близько 2 %), Титан (0,6 %). Набагато менше в земній корі Хрому (0,01 %), Купруму (0,005 %),
Урану, Стануму (близько 0,0002 %), Аргентуму (0,000007 %), Меркурію (0,000005
%), Ауруму (0,0000001 %). Усі радіоактивні металічні елементи (за винятком
Урану й Торію) у природі наявні в незначних кількостях або взагалі не виявлені. Загальні фізичні властивості металів. Для металів та їхніх сплавів характерні загальні
властивості, які зумовлені наявністю в них металічного зв'язку.
Наявністю вільних
відносно рухливих електронів пояснюються такі загальні властивості металів,
як електропровідність,
теплопровідність,
металічний блиск, пластичність.
Відмінності прояву цих властивостей спричинені розмірами структурних частинок
металів (атомів і йонів), кількістю спільних електронів, силою притягування
між структурними частинками, будовою кристалічних ґраток, атомними масами. У техніці метали прийнято поділяти на групи за окремими їх фізичними
властивостями. ·
За кольором метали
поділяють на чорні (залізо, хром, марганець) і кольорові (усі решта). ·
За густиною
розрізняють легкі (густина менше 5
г/см3) і важкі метали
(густина понад 5 г/см3). Найлегшими є лужні, лужноземельні метали,
алюміній. До важких належать олово, свинець, ртуть, залізо, осмій та ін. ·
За температурою плавлення
метали класифікують на легкоплавкі
(температура плавлення не вища 350 °С) і тугоплавкі
(температура плавлення понад 350 °С). Прикладами легкоплавких металів є
цезій, натрій, калій, олово, свинець, прикладами тугоплавких – залізо, хром,
вольфрам. ·
Агрегатний стан. За звичайних умов метали перебувають у твердому агрегатному стані, і
лише один з них – ртуть – у рідкому (мал. 10.19а).
Мал. 10.19. Зразки простих речовин металів: а) ртуть; б) мідь; в)
алюміній ·
Електропровідність металів. З фізики вам відомо,
що електричний струм – це впорядковний (напрямлений) рух заряджених частинок.
Такими частинками в металах є електрони. Срібло, мідь (мал. 10.19б) і
алюміній (мал. 10.19в) – «чемпіони» з електропровідності серед металів. ·
Теплопровідність металів. З природознавства та фізики
ви дізналися, що під час доторкання рукою до металевого й дерев’яного виробів
органи чуття людини сприймають їх температуру по-різному – металевий виріб
завжди видається набагато холоднішим. Це тому, що метали мають високу
теплопровідність й тепло долоні швидко передається до металу, він стає
теплішим, а долоня холоднішає. Деревина погано проводить тепло, тому,
торкаючись рукою до дерев’яного виробу, ми не відчуваємо холод настільки, як
у разі доторкання до металевих виробів.
·
Металічний блиск. У компактному вигляді
(пластинка, згусток з гладенькою поверхнею) металам властивий металічний
блиск. Він є наслідком відбиття світла від їх поверхні. Ця фізична
властивість найкраще проявляється в срібла. Блиск металів здебільшого
сріблястий, хоча в цезію і золота – жовтий, у міді – цегляно-червоний (мал.
10.20).
Мал. 10.20. Пластинки, виготовлені з різних металів: а) міді; б) алюмінію; в) золота;
г) цинку У порошкоподібному стані метали свій
блиск втрачають, за винятком алюмінію, який і в порошкоподібному стані має
чітко виражений металічний блиск. Метали не пропускають не лише світлові хвилі, а й
радіохвилі. ·
Густина і температура плавлення металів. За цими фізичними характеристиками
метали суттєво відрізняються між собою. Так, найлегший метал – літій – має
густину 0,53 г/см3, тоді як найважчий – осмій – 22,5 г/см3.
Найнижча температура
плавлення у ртуті – всього – 38,9 °С. Найвищу температуру плавлення має вольфрам
– 3380 °С. ·
Пластичність. Достатньо злегка
стукнути молотком по скляному виробу, щоб він зруйнувався. З металевими
виробами цього не трапляється. Завдяки металічному зв’язку структурні
частинки металу настільки міцно зв’язані між собою, що внаслідок ударів тіла
лише змінюють форму – деформуються. Шари іонів зміщуються, але вільні
електрони не дають їм відірватися від основної маси металу.
Найбільша пластичність у платини й золота.
Золотіння куполів храмів здійснюють золотом завтовшки 0,03 мм (мал. 10.21).
Золото можна витягнути в дріт, невидимий неозброєним оком. Металічний зв’язок забезпечує спільні фізичні властивості металів –
високу електро- й теплопровідність, металічний блиск, пластичність, твердий агрегатний
стан, проте кожний з металів наділений різним ступенем їх прояву. Алюміній. Металічний елемент Алюміній розташований у головній
підгрупі ІІІ групи (протонне число 13).
Покладів цього активного хімічного елемента у
вигляді простої речовини немає. Алюміній входить до складу гірських порід і
мінералів, серед яких найпоширенішими є польовий шпат, каолін, або біла глина
(мал. 10.22а), корунд (мал. 10.22б), боксит (мал. 10.22в).
Мал. 10.22. Природні
сполуки алюмінію: а) каолін; б) корунд; в) боксит Алюміній – сріблясто-білий
метал з виразним металевим блиском, що не втрачається в порошкоподібному
стані. Має густину 2,7 г/см3 і температуру плавлення 660 °С.
Легкий, м’який, ковкий, легко піддається обробці. Хімічні властивості
алюмінію. У ряді активності металів алюміній розташований відразу за лужними,
лужноземельними металами та магнієм, що вказує на його високу хімічну
активність. Для Алюмінію в усіх його
сполуках характерний ступінь окиснення +3. 1. Взаємодія
алюмінію з киснем. На повітрі алюміній
окиснюється, покривається тонкою оксидною плівкою Al2O3 і набуває матового кольору. Ця плівка завтовшки 5 – 10 нм, однак вона
надійно захищає метал від подальшої взаємодії з киснем і водою, що завжди є в
повітрі. Через цю плівку алюміній не взаємодіє на холоді з концентрованими
нітратною й сульфатною кислотами, тому їх можна зберігати і транспортувати в
алюмінієвих цистернах. У кисні порошок або стружка алюмінію згоряють з
утворенням оксиду: 4Al +
3O2 = 2Al2O3 2. Взаємодія алюмінію з іншими неметалами. За різних температурних умов у деяких випадках
із застосуванням каталізаторів, алюміній реагує з великою кількістю
неметалів.
Взаємодія алюмінію з йодом відбувається за кімнатної температури й
каталізується водою. Для її проведення порошок алюмінію змішують із
подрібненим йодом і додають кілька крапель води (мал. 23а). Відразу
розпочинається бурхлива реакція (мал. 10.23б). Дослід виконують із
застосуванням скляного дзвону або у витяжній шафі.
Мал. 10.23. Взаємодія алюмінію з йодом 3. Взаємодія алюмінію з кислотами. Алюміній, що не вкритий оксидною плівкою, активно реагує з хлоридною кислотою (мал. 10.24а) і дещо повільніше з розбавленою сульфатною кислотою з
виділенням водню (мал. 10.24б): 2Al + 6HCl = 2AlCl3 + H2↑
Мал. 10.24. Взаємодія
алюмінію з кислотами: а) хлоридною; б) сульфатною 4. Взаємодія алюмінію з оксидами металічних
елементів. Алюміній – сильний
відновник, відновлює багато металів з їх оксидів. Реакції екзотермічні, температура становить
1200 – 3000 °С:
Цю властивість алюмінію застосовують у
промисловості для добування деяких металів (мал. 10.25).
Мал. 10.25. Алюмотермія
– відновлення металів з їх оксидів за допомогою алюмінію Алюмотермія – добування металу
відновленням його оксиду алюмінієм. Відкриття алюмотермії, як і ряду активності
металів, належить Миколі Миколайовичу
Бекетову – видатному вченому, який був одним із
основоположників фізичної хімії. 5. Взаємодія
алюмінію з водою. Усі ви знаєте, що в алюмінієвому посуді можна
тримати воду, кип’ятити її. Для того щоб відбулася взаємодія алюмінію з
водою, треба спершу зняти з поверхні алюмінію захисну оксидну плівку. Це
можна зробити, наприклад, за допомогою наждачного паперу або потримавши
недовго алюміній у розчині лугу – і тоді алюміній за кімнатної температури
прореагує з водою: Алюміній – активний метал, що
легко вступає у взаємодію з простими і складними речовинами, проявляючи
відновні властивості:
6. Взаємодія
алюмінію з лугами. Алюміній легко розчиняється у водних розчинах лугів з утворенням
комплексної солі натрій тетрагідроксоалюмінату й водню: 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4]
+ 3H2↑ Цю реакцію застосовують для добування в
лабораторії водню й застерігає від зберігання лугів в алюмінієвій тарі.
Залежно від молярного співвідношення реагентів, може утворитися інша
комплексна сіль – натрій гексагідроксоалюмінат Na3[Al(OH)6]. Ферум як хімічний елемент. Металічний елемент Ферум Fe (протонне число 26) розташований у
побічній підгрупі VІІІ групи. У кожному періоді вона представлена не одним, а
трьома металічними елементами. У 4 періоді це металічні елементи Ферум Fe, Кобальт Со і Нікол (Нікель) Ni. Радіуси їх атомів,
температури плавлення й кипіння, густини близькі за значеннями, а утворені
ними прості речовини схожі за хімічними властивостями. Електронна формула
атома Феруму 26Fe 1s22s22p63s23p63d64s2 свідчить, що зовнішній
(четвертий) енергетичний рівень атома Феруму має типову для металічних
елементів будову – містить два s-електрони. В електронній оболонці атома Феруму на d-підрівні третього енергетичного рівня
перебуває шість електронів. А в сумі з двома електронами четвертого
енергетичного рівня їх вісім. Цим і пояснюється розташування Феруму у VІІІ групі. У сполуках Ферум проявляє здебільшого ступені
окиснення +2 і +3, хоча за певних умов можна добути речовини з вищими
ступенями окиснення. Поширення Феруму в природі. За поширенням у
природі йому належить четверте місце, а серед металічних елементів — друге.
Ферум міститься переважно у складі оксидів, сульфідів, карбонатів, що
становлять основу його мінералів і руд. Поклади залізних руд утворюють мінерали магнетит (магнітний залізняк) Fe3O4 (мал. 10.26а), лимоніт (бурий залізняк) Fe2O3 ´ nН2О, гематит (червоний залізняк) Fe2O3 (мал. 10.26б), сидерит (залізний шпат) FeСO3, пірит (залізний колчедан) FeS2 (мал. 10.26в).
Мал. 10.26. Залізорудні мінерали:
а) магнетит; б) гематит; в) пірит
Проста речовина залізо, утворена атомами
Феруму, у природі трапляється рідко, переважно в уламках метеоритів, що досягли
поверхні Землі. У незначній кількості Ферум входить до складу клітин
організмів. В організмі дорослої людини близько 4 – 5 г Феруму, з яких 65 %
перебуває у складі гемоглобіну крові.
Надра нашої держави містять великі запаси
залізних руд. Найбільші родовища, на базі яких здійснюють промислове
виробництво заліза і його сплавів, відкриті у Криворізькому, Кременчуцькому
та Білогірському залізорудних басейнах. Фізичні
властивості заліза. Залізо – сріблясто-білий із сіруватим
відтінком метал (у порошкоподібному стані блиск втрачається, колір стає
сірувато-чорним). Залізо має густину 7,87 г/см3 і температуру
плавлення 1539 °С. Під час накалювання метал легко прокатується, кується.
Наші прадіди використовували цю його властивість для виготовлення у кузнях
плугів, борін, коліс, сокир, підків, молотків, лопат тощо. Залізо та його сплави притягуються магнітом і
легко намагнічуються у магнітному полі, є добрими провідниками струму й
тепла. На підтвердження здатності заліза намагнічуватися піднесіть магніт до
купки заліз- них скріпок, і ви побачите, що скріпки прикріпилися не лише до
магніту, а й одна до одної на зразок гірлянди (мал. 10.27). На магнітних властивостях заліза і його сплавів
ґрунтується їхнє використання як матеріалу для виготовлення серцевин
трансформаторів, вантажопідіймачів, телефонних мембран тощо. Хімічні
властивості заліза. Залізо з високим ступенем чистоти не піддається
корозії – іржавінню. В Індії у м. Делі близько 16 століть стоїть монолітна
колона заввишки 7,21 м, виготовлена майже із чистого (99,72 %) заліза, і вона
практично не піддається іржавінню (мал. 10.28). Учені до цього часу не дійшли остаточної думки
про те, як в ті часи отримали залізо такого ступеня чистоти. Різні домішки збільшують активність заліза в
усіх хімічних реакціях. Подібно до більшості металів залізо окиснюється киснем та іншими неметалами, вступає у реакції заміщення з кислотами і солями
менш активних за Ферум металічних елементів, взаємодіє під час нагрівання з водою.
1. Взаємодія заліза з киснем. Вам відомий дослід зі згорання заліза в
кисні, у якому за лічені секунди тонка залізна голка згорала сліпучим
полум’ям, а утворений продукт реакції залізна окалина Fe3O4 поширювався в усі боки, нагадуючи
бенгальські вогні: 3Fe +
2O2 = Fe3O4,
Залізна окалина є подвійним оксидом, у ферум
(ІІ) оксиді зі ступенем окиснення +2 і +3 у ферум (ІІІ) оксиді.
2. Взаємодія з іншими неметалами. 2Fe + 3Cl2 = 2FeCl3 2Fe + N2 = 2FeN Fe + S = FeS
3. Взаємодія з кислотами. Взаємодія заліза з кислотами залежить від
температури та концентрації кислоти. Переконатися в цьому можна на такому
демонстраційному досліді. У 4 пробірки помістимо по одній ложці залізного
порошку. У першу пробірку доллємо 2 – 3 мл розбавленої хлоридної кислоти й
через невеликий проміжок часу спостерігатимемо появу пухирців газу. Для
прискорення реакції вміст пробірки можна підігріти. У другу пробірку наллємо
стільки ж розчину розбавленої сульфатної кислоти. Результати спостереження
будуть аналогічні з першою пробіркою. Складемо рівняння реакцій: Fe + 2HCl = FeCl2 + H2↑; Fe + H2SO4 = FeSO4
+ H2↑ Додавання до третьої пробірки концентрованої сульфатної кислоти H2SO4 і в четверту
пробірку – концентрованої нітратної кислоти HNO3, підтвердило – залізо не взаємодіє з
концентрованими нітратною й сульфатною кислотами.
4. Взаємодія з водою.
З власного досвіду кожен з вас знає, що залізо
з водою не взаємодіє. А інакше, навіщо тоді виготовляти з нього днища
кораблів, кухонне приладдя тощо? Та під час пропускання парів води над
нагрітим порошком заліза відбувається реакція, що супроводжується утворенням
залізної окалини Fe3O4 і водню:
5. Взаємодія заліза із солями. Атоми Феруму заміщують йони менш активного
металічного елемента в розчині його солі. Приклад такої реакції вам відомий:
у розчині мідного купоросу на залізні предмети (цвяхи, скріпки, кнопки тощо)
досить швидко осідає відновлена мідь, надаючи їм червоно-цегляного кольору
(мал. 10.29):
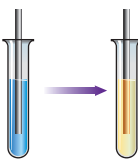
Якісні реакції. Розчинними у воді складними речовинами, що
дисоціюють з творенням катіонів Феруму(2+) і Феруму(3+), є їхні солі. Реакції між
представниками цих класів неорганічних сполук відбуваються за умови утворення
нерозчинного гідроксиду або солі. Ферум (ІІ) гідроксид і
ферум (ІІІ) гідроксид – нерозчинні у воді речовини. До того ж їхній
колір відмінний від кольору більшості гідроксидів. Ферум (ІІІ) гідроксид Fe (OH)3 – речовина
іржаво-коричневого кольору. Ферум (ІІ) гідроксид Fe (OH)2 – речовина
зеленувато-білого кольору, що після утворення поступово набуває
іржаво-коричневого забарвлення через подальше окиснення катіонів Феруму(2+)
киснем у присутності води до катіонів Феруму(3+): 4Fe(OH)2 + О2 + 2H2O
= 4Fe(OH)3
Знання цих якісних реакцій допоможе вам
розпізнавати сполуки Феруму (2+) і Феруму(3+) в розчинах. Застосування металів, як і інших
матеріалів, насамперед ґрунтується на їхніх фізичних властивостях. Завдяки
великій міцності метали є поширеними конструкційними матеріалами. А здатність
проводити електричний струм робить їх необхідним елементом різноманітних
електротехнічних приладів: від величезних електрогенераторів до
міні-комп'ютерів.
Чисті метали
використовують досить рідко. З дуже чистої міді виготовляють дроти (наявність
навіть десятих часток відсотка домішок суттєво зменшує електропровідність), а
чисті залізо та нікель застосовують для виготовлення вакуумної техніки. У
більшості випадків чисті метали або економічно не вигідні, або їхні
властивості не відповідають певним вимогам. Наприклад, чисте залізо
недостатньо міцне, а чисте золото занадто м'яке. Тому сьогодні застосовують
переважно сплави металів, до того ж дуже часто для певного використання
розробляють спеціальний сплав. Поняття про сплави. У розплавленому стані
метали зазвичай легко змішуються між собою, утворюючи однорідну суміш –
розчин. Під час охолодження такої суміші утворюється сплав. Властивості сплавів
можуть значно відрізнятися від властивостей чистих металів. Температура
плавлення сплаву здебільшого нижча за температуру плавлення його компонентів.
Це дуже добре ілюструє сплав Вуда, який містить вісмут, свинець, олово і
кадмій. Найбільш легкоплавкий із цих металів (олово) плавиться за 232 °С, а
температура плавлення сплаву Вуда становить 69 °С, що нижче за температуру
кипіння води (мал. 10.30).
Застосування сплавів. Банківські метали (золото, срібло тощо) для карбування обігових монет не використовують, а
лише для пам'ятних (ювілейних). Білі монети в Україні карбують із сталі,
алюмінію, мельхіору або нейзильберу (сплав міді, нікелю та цинку), а жовті –
з мідно-нікелевого сплаву. Золото, срібло, мідь, платину та паладій використовують для
виготовлення ювелірних сплавів. Сплав золота з паладієм за кольором нагадує
платину, тому його називають «білим золотом», домішки кадмію надають золотим
виробам зеленуватого відтінку. Бронза – твердий і стійкий до корозії сплав олова з міддю (75 –
90 % Сu). З неї виготовляють деталі машин, свічники, статуї. Під час удару
бронза дзенькає сильніше, ніж мідь або олово. Тому саме з бронзи відливали
дзвони. Латунь – це сплав міді (до 50 %) із цинком. Вона
набагато твердіша, ніж метали в її складі, тому цей сплав застосовують для
виготовлення деталей машин та сантехнічних виробів. Латунь має гарний
золотавий колір, тому з неї виробляють інтер'єрні прикраси, корпуси
годинників, дверні ручки тощо. Мельхіор – стійкий до корозії сплав міді з нікелем (до 30 % Ni). Із нього виготовляють деталі машин, високоякісні деталі морських
човнів, посуд, столові прибори. Ще більшу корозійну стійкість і стійкість до
стирання має сплав монель (33 % Cu і 66 % Ni), із нього виробляють частини двигунів, лопаті турбін, а також монети. Припій – легкоплавкий сплав із двох частин олова та однієї частини свинцю.
Добре відомий радіолюбителям, оскільки в розплавленому стані припій легко
прилипає до зачищеної металевої поверхні, його використовують для паяння
металів. Дюралюміній або дюраль (93,5 % Аl, 4,5 % Cu, 1,5 % Mg, 0,5 % Mn) – найвідоміший алюмінієвий сплав. Він трохи важчий за алюміній, але
набагато твердіший за нього (від латин. duros – «твердий, міцний»).
Із дюралюмінію виготовляють корпуси суден і літаків, балки для перекриття
будинків, корпуси годинників тощо. 10.8.
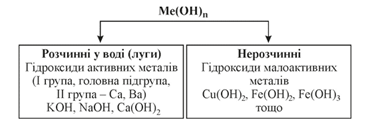
Основи, їхні властивості Основи – це сполуки, до
складу яких входять атом металічного елемента й одна або кілька гідроксильних
груп OH (залежно від валентності
металу). Загальна формула основ: Me(OH)n, де n – число груп OH, що відповідає валентності металічного
елемента.
Назва основ складається з двох слів, перше з яких –
назва металічного елемента, а друге – «гідроксид». Наприклад, KOH – калій гідроксид, Ba(OH)2 – барій гідроксид.
Якщо елемент має кілька значень валентностей, то це значення вказується у
назві гідроксиду: Fe(OH)2 – ферум(II) гідроксид, Fe(OH)3 – ферум(III) гідроксид. Основи мають так же тривіальні назви: NaOH – їдкий натр,
каустична сода; KOH – їдкий калі; Ba(OH)2 – баритова вода; Ca(OH)2 – гашене вапно,
вапняне молоко, вапняна вода; NH4OH – нашатирний спирт (мал.10.31).
Мал. 10.31.
Класифікація основ, фізичні властивості За звичайних
умов луги – це тверді кристалічні
речовини, милкі на дотик, роз`їдають багато матеріалів, шкіру, папір,
тканину, добре розчиняються у воді. Змінюють колір індикаторів: лакмус
(фіолетовий) змінюється на синій; метиловий оранжевий (оранжевий) – на
жовтий; фенолфталеїн (безбарвний) забарвлюється в малиновий колір. Нерозчинні основи – тверді речовини, не
милкі на дотик, не роз`їдають шкіру, не мають запаху, практично не
розчиняються у воді й не змінюють кольору індикаторів. Забарвлені вони
по-різному: купрум(II) гідроксид Cu(OH)2 – блакитний; Zn(OH)2,
Al(OH)3 – білі, Fe(OH)2 – зеленувато-білий, Fe(OH)3 – бурий.
Фізичні властивості. Натрій гідроксид NaOH (мал. 10.32) – біла непрозора тверда речовина,
гігроскопічна, добре розчиняється у воді (за 20 °С у 100 г води розчиняється
100 г натрій гідроксиду), розчинення супроводжується виділенням теплоти. Розчини милкі на дотик.
Фізичні властивості кальцій гідроксиду схожі з
властивостями натрій гідроксиду. Хоча він має порівняно малу розчинність (за
20 °С у 100 г води розчиняється 0,16 г кальцій гідроксиду). Тверді луги та їх
водні розчини зберігають у добре закритому посуді, бо вони реагують з
вуглекислим газом повітря і перетворюються на карбонати. І у твердому стані, і в розчинах натрій гідроксид у
разі потрапляння на шкіру спричинює опіки. Тому поводитися з ним необхідно
обережно, використовувати засоби індивідуального захисту (захисні окуляри й
гумові рукавички), а також дотримуватися загальних правил безпеки. У разі
потрапляння лугу на шкіру, потрібно ретельно промити її водою, після чого
нейтралізувати розчином етанової або борної кислот. Луги руйнують скло, порцеляну, вовну, шовк і шкіру.
Оскільки луги роз’їдають скло, їх зберігають у поліетиленовій тарі. Натрій гідроксид NaOH та
кальцій гідроксид Са(ОН)2 – тверді речовини
білого кольору, без запаху. Дисоціюють з утворенням гідроксид- аніонів ОН–. Роз’їдають шкіру, тканини, папір
й інші матеріали. Хімічні властивості
основ. Характерною властивістю основ є їх здатність реагувати з кислотами, а
характерною властивістю кислот – реагувати з основами, в обох випадках
утворюються сіль і вода. 1. Розчинні і нерозчинні основи мають спільну
властивість – реагують з кислотами, утворюючи сіль і воду. Тип реакції –
обміну, нейтралізації.
2. Під час
взаємодії багатоосновних кислот з гідроксидами можуть утворюватися кислі
солі.
3. Під час взаємодії
багатокислотних гідрооксидів з одноосновними кислотами можуть утворюватися
основні солі.
4. Луги реагують з кислотними оксидами, утворюючи
середню або кислу сіль за надлишку чи нестачі лугу відповідно. Для
нерозчинних основ такі реакції не характерні.
5. Луги взаємодіють із розчинними солями малоактивних
металічних елементів, утворюючи нову сіль і нерозчинну основу.
Луги можуть взаємодіяти із розчинними солями активних
металічних елементів, якщо як результат реакції утворюється нерозчинна сіль.
Луги взаємодіють з кислими солями утворюючи середні
солі. Для нерозчинних основ такі реакції не характерні.
6. Майже всі основи (крім гідроксидів Натрію і Калію,
лужних металів) як результат нагрівання легко розкладаються на оксиди і воду.
Добування й
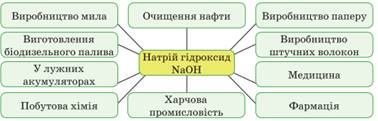
застосування натрій гідроксиду. Ця речовина в природі не трапляється.
Добувають її з природної сировини – кухонної солі, пропускаючи через водний
розчин цієї солі постійний струм. Між водою й сіллю відбувається
окисно-відновна реакція, серед продуктів якої є луг. З усіх лугів найбільше використовується
натрій гідроксид.
Добування й
застосування кальцій гідроксиду (гашеного вапна). Другу назву ця
речовина отримала через одержання з кальцій оксиду (негашеного вапна) і води:
СаО + Н2О =
Са(ОН)2 Реакція супроводжується виділенням теплоти, суміш
розігрівається й складається враження, що закипає. Гашене вапно використовують у будівництві. Його
змішують з піском, цементом (для зовнішніх робіт) або гіпсом (для внутрішніх
робіт) і водою. Ця суміш називається вапняний розчин. Зв’язувальні властивості гашеного вапна Са(ОН)2, ґрунтуються на
тому, що ця речовина поступово реагує з вуглекислим газом повітря і
перетворюється на кальцій карбонат: Са(ОН)2 + СО2
→ СаСО3 + Н2О Унаслідок цього вапняний розчин твердне і міцно
скріплює будівельні матеріали. Кальцій гідроксид входить до складу бордоської
рідини, якою обробляють сади від шкідників. На кислотних ґрунтах його вносять
для зниження їх кислотності. У харчовій промисловості гідроксид кальцію
використовують як харчову добавку Е 526
(загущувач, регулятор кислотності, затверджувач, емульгатор). Вапняне молоко (суміш води і кальцій
гідроксиду, взятого у значно більшій кількості, ніж потрібно для приготування
прозорого розчину вапняної води) використовують у виробництві цукру, для
побілки дерев і захисту від хвороб рослин, для пом’якшення жорсткої води. 10.9.
Середні солі, фізичні та хімічні властивості
Загальна формула солей – MexRy, де Me – атом металічного
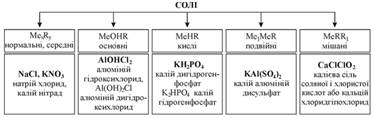
елемента, R – кислотний залишок (мал.10.33).
Мал.
10.33. Загальна схема класифікації солей Середня сіль – продукт повного
заміщення атомів Гідрогену в молекулі кислоти на атоми металічного елемента. Основна сіль – продукт неповного
заміщення гідроксогруп кислотними залишками. Основні солі походять від основ,
що містять більше, ніж одну гідроксогрупу. Кисла сіль – продукт неповного
заміщення атомів Гідрогену в молекулі кислоти на атоми металічного елемента.
Кислі солі можуть утворювати лише багатоосновні кислоти. Фізичні властивості
солей. Солі – тверді речовини, в основному йонної будови, але фізичні
властивості (температури кипіння, плавлення, густини, твердість) у них різні.
Зазвичай, це нелеткі речовини без запаху, крихкі, частіше білого кольору, але
серед них трапляються й забарвлені (мал. 10.34.). Так, водні розчини солей
Купруму – блакитного кольору, Fe – жовто-коричневого, Хрому – зеленого,
Кобальту – рожевого та інші. Часто солі утворюють гарні кристали.
Мал.
10.34. Забарвлення деяких солей 1. Взаємодія солей з металами. Кожний метал у ряді напруг здатний
витісняти всі метали, що стоять справа від нього, з розчинів їх солей з утворенням
нової солі та іншого металу. Якщо в пробірку з розчином CuCl2 опустили залізних
цвях, то через деякий час він вкривається шаром міді. Відбувається реакція заміщення.
2. Взаємодія солей з лугами. Водні
розчини солей можуть взаємодіяти з розчинами лугів, якщо як результат реакції
одна з новоутворених речовин (сіль, або основа) випадає осад. Нерозчинні солі
з лугами не взаємодіють.
3. Взаємодія солей з кислотами.
Солі (як розчинні так і нерозчинні) можуть взаємодіяти з кислотами, утворюючи
нову кислоту та сіль. Такі реакції часто супроводжуються виділенням газу або
осаду.
4. Взаємодія між солями. Реакція між
двома солями відбувається лише тоді, коли обидві солі розчинні у воді, а одна
з новоутворених солей випадає в осад.
5. Розкладання солей. Деякі солі під час нагрівання розкладається. Прикладом таких солей можуть служити
карбонати, нітрати, гідрогенкарбонати, сульфіти.
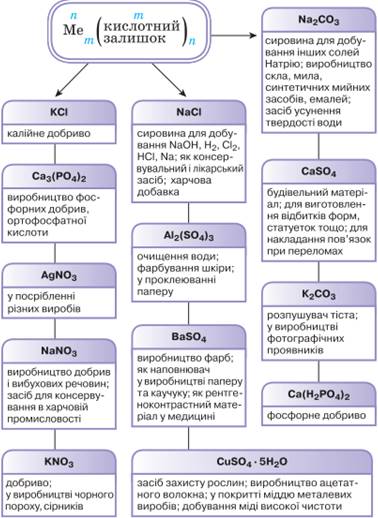
Поширення солей у
природі, застосування. Найбільше поширення у природі мають сульфати, карбонати, хлориди. Природні сульфати – це гіпс СаSO4 ´ 2Н2О; глауберова сіль Na2SO4 ´ 10H2О; гірка сіль MgSO4 ´ 7H2О. Із наведених формул стає зрозуміло, що вони
належать до кристалогідратів. Нагріванням
гіпсу зменшують вміст у ньому кристалізаційної води й одержують алебастр 2СаSO4 ´ Н2О. Саме з алебастру
накладають пов’язки у разі переломів кісток. Глауберову сіль Na2SO4 ´ 10H2О застосовують у
виробництві скла, соди, фарб, у медицині. Гірку
сіль MgSO4 ´ 7H2О використовують в
обробці тканин, дубінні шкіри, виготовленні медичних препаратів. Карбонати в природі. Карбонати існують у природі
переважно у вигляді кальцій карбонату СаСО3.
Крейда, мармур, вапняки, ракушняк – усе це кальцій карбонат
з певним умістом некарбонатних домішок. Чистий кальцій карбонат трапляється в
природі у вигляді мінералу кальциту (мал. 10.35, а). Ісландський шпат (кальцій карбонат
високої чистоти) (мал. 10.35, б) застосовують в оптиці.
Мал.
10.35. Мінерали: а) кальцит; б) ісландський шпат
Серед карбонатів найбільше застосовується вапняк (мал. 10.36). Вапняки різних
родовищ відрізняються кількістю домішок, тому мають різне забарвлення – від
білого або світло-жовтого до темного. Їх використовують у металургії,
будівництві, виробництві скла, цементу, кальцій карбіду, негашеного та
гашеного вапна тощо. Вапняками укріплюють дороги, вапнують кислотні ґрунти.
Знамениті одеські катакомби – це колишні каменярні, у яких добували ракушняк
– вапняк органічного походження (мал. 10.37).
Мал. 10.37. Ракушняк: а) зразок;
б) природні поклади До карбонатів органічного походження належить також
кальцій карбонат, що входить до складу кісток людини і тварин. Крейду використовують у паперовій
і гумовій промисловості як наповнювач, у будівництві та під час ремонту
приміщень для побілки. Також вона входить до складу зубного порошку, нею
роблять записи на класній дошці. До українських традицій належить вибілювання
хати крейдою, завдяки чому вона має ошатний привабливий вигляд, а проживання
в такому помешканні є безпечним. Природні запаси мармуру
(мал. 10.38а) значно менші, аніж вапняку та крейди. Колір мармуру – білий,
проте наявність різних домішок надає йому різного забарвлення. З мармуру
виготовляють скульптури (мал. 10.38б). У будівництві його використовують як
облицювальний матеріал, наприклад станції метрополітену (мал. 10.38в).
Мал.10.38. Мармур: а) зразок; б)
скульптура; в) облицьована мармуром станція метро Крім карбонатів Кальцію, у природі трапляються
карбонати інших металічних елементів: доломіт MgCO3 ´ CaCO3 (мал. 10.39а), сидерит FeCO3 (мал. 10.39б), малахіт Cu2(ОН)2CO3 (мал. 10.39в) та деякі
інші.
Мал. 10.39. Зразки
карбонатів: а) доломіт; б) сидерит; в) малахіт Поширення хлоридів у
природі. Україна багата запасами кам’яної солі NaCl, або галіту (мал.
10.40а). Ця незамінна харчова добавка та сповільнювач псування багатьох
продуктів є у кожній домівці (мал. 10.40б). Металічний елемент Калій утворює
природні поклади калійної солі, сильвініту, польового шпату, ортоклазу.
Мал. 10.40.
Кам’яна сіль: а) мінерал галіт; б) кухонна сіль Світовий океан містить чи не найбільшу кількість солей
на нашій планеті. Зважаючи на те, що Земля на 2/3 вкрита водою, вміст
металічних елементів у гідросфері не менший, ніж у літосфері. Вода морів та
океанів через вміст у ній різних солей солоногірка на смак. 100 г морської
води в середньому містять 3,5 г солей, серед яких на натрій хлорид припадає
майже 78 %. На схемі (мал. 10.41)
подано окремі приклади застосування солей.
Мал.
10.41. Використання солей Добування середніх
солей. У лабораторії солі можна добувати різними способами. Більшість із них вам відомі. 1. Взаємодія
металу з кислотою: Zn + H2SO4 = ZnSO4
+ H2↑ 2. Взаємодія основного або амфотерного оксиду з
кислотою: ZnО + H2SO4 = ZnSO4
+ H2О 3. Взаємодія
основи з кислотою: Са(ОН)2 + H2SO4
= СаSO4 + 2H2О 4. Взаємодія амфотерного гідроксиду з кислотою: Zn(ОН)2 + H2SO4
= ZnSO4 + 2H2О 5. Взаємодія
солі з кислотою: Na2SiO3 + H2SO4
= H2SiO3↓ + Na2SO4 6. Взаємодія основного або амфотерного оксиду з
кислотним оксидом: Na2O + SO3 = Na2SO4;
PbO + CO2 = PbCO3 7. Взаємодія металу з розчином солі іншого
металічного елемента: Fe +
CuSO4 = FeSO4 + Cu 8. Взаємодія металу з неметалом (добувають солі
безоксигенових кислот): 2Fe + 3Cl2 = 2FeCl3 Добування кислих солей. 1. Взаємодія кислот з недостачею основи: KOH + H2SO4 = KHSO4
+ H2O 1 моль 1 моль 2. Взаємодія основи з надлишком кислотного оксиду.: Ca(OH)2 + 2CO2 =
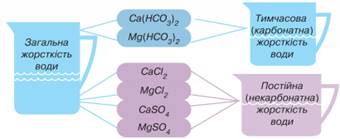
Ca(HCO3)2 1 моль 2 моль Жорсткість води та
способи її усунення. З наявністю у воді солей Кальцію і Магнію –
гідрогенкарбонатів, хлоридів та сульфатів – пов’язане поняття жорсткість води.
Ці іони входять до складу солей хлоридів, сульфатів,
гідрогенкарбонатів. Воду, 1 л якої містить до 2 ммоль/л іонів Са2+ і Mg2+, вважають м’якою. Вода із вмістом іонів Са2+ і Mg2+ понад 10 ммоль/л
вважають жорсткою. Прикладом м’якої
води є дощова вода, жорсткої – вода морів і океанів. Розрізняють тимчасову,
постійну та загальну жорсткість води (мал. 10.42)
Мал. 10.42. Види жорсткості
води
Са(НСО3)2
= СаСО3↓ + Н2О + СО2↑
Саме ця
реакція відбувається під час кип’ятіння води, що має тимчасову жорсткість.
Нерозчинні у воді карбонати, що утворюються з гідрогенкарбонатів, осідають на
внутрішній поверхні посудин у вигляді білого осаду, утворюючи накип. Якщо вода містить солі Феруму, то накип набуває коричневого відтінку.
Накип погіршує процес теплообміну в парових котлах і чайниках, призводить до
перевитрат палива і перегрівання металевих поверхонь. З часом чайники,
нагрівальні елементи пральних машин (мал. 10.43) виходять з ладу, просвіти
батарей опалення звужуються й тепловіддача погіршується. Крім кип’ятіння,
тимчасову жорсткість води усувають хімічним способом, додаючи до води кальцій
гідроксид (гашене вапно), натрій гідроксид або соду. Са(НСО3)2
+ Са(ОН)2= 2СаСО3↓ + 2Н2О Са(НСО3)2
+ 2NaОН = СаСО3↓ + Nа2СО3
+ 2Н2О Са(НСО3)2
+ Na2CO3 =
СаСО3↓ + 2NаHСО3 Вивчаючи органічні речовини, ви дізналися про натрій
стеариноат C17H35COONa – основну складову
твердого мила. Як і всі сполуки Натрію, мило добре розчиняється у воді, а розчин
виявляє мийну дію. Однак у жорсткій воді, замість усунення забруднень, мило
вступає в реакцію іонного обміну з наявними в ній солями Кальцію чи Магнію,
утворюються нерозчинні у воді стеариноати цих металічних елементів: 2С17Н35СОO- + Ca2+ =
(С17H35СОO)2Ca↓ кальцій стеариноат 2С17Н35СОO- + Mg2+ = (С17H35СОO)2Mg↓ магній стеариноат На відміну
від гідрогенкарбонатів Кальцію і Магнію, розчинені у воді хлориди і сульфати
не можна видалити з розчину кип’ятінням.
Постійну жорсткість води усувають хімічним способом за допомогою
натрій карбонату (кальцинована сода) Na2CO3,
натрій ортофосфату Na3РO4,
аніони яких утворюють з катіонами Кальцію і Магнію нерозчинні сполуки, або воду
пропускають через йонообмінні колонки. 10.10.
Сучасні силікатні матеріали. Мінеральні добрива. Поняття про кислотні та
лужні дощі Високі будинки й глибокі тунелі, мости через
ріки й багато інших споруд зведено з використанням цементу, бетону, цегли. Красивий і практичний
посуд, сучасні телевізори й медичну апаратуру, вікна будинків, салони
автомобілів, літаків, потягів тощо виготовляють із використанням скла. У
побуті використовують різні керамічні вироби.
Поняття про скло. Археологічні знахідки доводять,
що цей матеріал відомий людям понад 5 – 6 тис. років. Перше його застосування
було пов’язане з виготовленням жіночих прикрас. Нині скло широко
використовують у різних галузях промисловості й сільського господарства (мал.
10.44).
Мал. 10.44. Предмети,
виготовлені з різних видів скла Знадобився час, щоб люди навчилися виготовляти
різноманітні види скла та формувати вироби з нього – видувати скляні посудини,
прокатувати скло в тонкі пластини, витягувати в нитки. Виготовлення скляних
виробів можливе лише з гарячої розплавленої маси, а розм’якшуватися скло
починає за температури 900 °С, рідким скло стає за температури 1500 °С. Виготовляють (варять) звичайне віконне скло із
соди Na2СO3, вапняку CaСO3 та кварцового піску SiO2 за температури 1500 °С
у спеціальних печах безперервної дії. За добу з однієї печі одержують до 300
т продукції. Про розміри такої печі свідчить її варильний басейн завдовжки 40
м, завширшки 10 м і заввишки 1,5 м. Хімізм виготовлення скла ґрунтується на
властивостях карбонатів розкладатися під час нагрівання та властивостях
основних і кислотних оксидів взаємодіяти між собою: СаСО3
= СаСО + СО2↑, СаО + SiО2 = СаSiО3, Nа2CО3 + SiО2
= Nа2SiO3 + СО2↑, CаCО3 + SiО2
= CаSiO3 + СО2↑.
Особливим видом скла є кварцове скло. Це майже чистий кремній(ІV) оксид. На відміну від
звичайного кварцове скло нечутливе до різких коливань температури, тому з
нього виготовляють, зокрема, вітрове скло для автомобілів, хімічний посуд.
Інша його особливість – це здатність пропускати ультрафіолетові промені, тому
з нього виробляють кварцові лампи, які використовуються в медицині,
косметології. Добре зарекомендували
себе у новітній техніці скловолоконні
світловоди, або світлові хвилеводи (мал.
10.45), основою яких є також кварцове скло. Відтепер склонитки використовують
як світловоди для передавання зображень і звуків. Без цього не існувало б
кабельного телебачення, телефонного зв’язку, не було б приладів, що
діагностують стан внутрішніх органів людини. Кришталеве скло виготовляють з калій
карбонату, плюмбум(ІІ) оксиду, уміст якого дорівнює майже 24 %, і кварцового
піску. Це скло має високий коефіцієнт заломлення світла, тому його
використовують в оптиці (виготовлення лінз і призм). Оскільки кришталеве скло
має яскравий блиск, його гранують, щоб виготовити красиві вази й столовий
посуд. Емальований посуд вам добре відомий. Емаль – це матеріал, виготовлений із
звичайної скломаси шляхом додавання до неї стану (ІV) оксиду. Кольоровою емаллю оздоблюють прикраси
(мал. 10.46а), картини (мал. 10.46б), вази (мал. 10.47в) тощо.
Мал. 10.46.
Оздоблення емаллю За певних умов аморфну скломасу піддають частковій перекристалізації
з утворенням білого, непрозорого, термостійкого й міцного матеріалу, що
називається ситал. З нього виготовляють
побутовий вогнетривкий кухонний посуд: каструлі, форми для запікання,
жаровні, сковорідки тощо (мал. 10.47).
Мал. 10.47.
Вогнетривкий кухонний посуд із ситалу Цемент. Споруди високої
міцності й тривалого призначення (будинки, тунелі, мости) будують з
обов’язковим використанням цементу (за винятком дерев’яних будиночків і
невеликих містків місцевого значення). Цей матеріал має рідкісну властивість
– з роками його твердість збільшується. Є різні сорти цементу, серед найуживаніших – портландцемент. Як сировину для
виробництва цементу використовують вапняк і глину, рідше мергель – природну
суміш цих двох речовин. Формулу вапняку ви знаєте, склад глини передають
записом Al2О3 ´ 2SiO2 ´ 2Н2О. Якщо передати склад цементу формулами оксидів,
то виявиться, що він містить 62 – 76 % СаО,
20 – 24 % SiO2, 4 – 7 % Al2О3, незначну кількість Fe2О3 та MgО. На будівництві цемент змішують з піском і
водою. Утворену суміш називають цементним
або будівельним розчином, з часом
він стає кам’янистим. Цементний розчин є незамінним зв’язувальним матеріалом
для цегли, будівельних блоків тощо. Суміш щебеню (подрібненої гірської породи
гранітного походження), піску і цементу називається бетон, без якого
неможливе зведення мостів, будинків, гребель. Бетон, підсилений залізним
каркасом, називається залізобетоном. Силікатна
промисловість охоплює також керамічне виробництво. До керамічних виробів
належать будівельна цегла (мал. 10.48а) (її виробляють найбільше), кахлі,
облицювальні плитки, раковини умивальників, посуд із порцеляни і фаянсу тощо
(мал. 10.48б).
Мал. 10.48. Вироби з кераміки Особливістю керамічного виробництва є те, що вироби після формування
випалюють. З однорідної суміші глини, піску і води формують цеглини, а потім їх
висушують у призначених для цього печах. Глина, змочена водою,
стає схожою на пластилін і їй можна надати різної форми. На цій властивості
глини ґрунтується гончарство. Ще в давньому Китаї володіли технологією
виробництва порцеляни, з якої виготовляли красивий
порцеляновий посуд (чашки, блюдця, миски, художні вироби) (мал. 10.49), проте
рецепт тримали у великому секреті. Як
основну сировину для виготовлення порцеляни використовують білу глину каолін Al2O3 ´ 2SiO2 ´ 2H2O, у меншій кількості беруть польовий шпат K2O ´ Al2O3 ´ 6SiO2 і кварцовий пісок SiO2. Готові вироби
прикрашають малюнками. У техніці застосовують електроізоляційні
властивості порцеляни, її хімічну стійкість. З менш очищеної сировини, ніж
та, з якої виробляють порцеляну, одержують грубіший матеріал – фаянс, що
використовують так само, як порцеляну.
Мал. 10.49. Вироби з
порцеляни У рослинних організмах трапляється майже 70
хімічних елементів (їх ще називають елементами
живлення рослин). Такі елементи, як Нітроген, Калій, Фосфор надходять до
них з ґрунту в найбільшій кількості. Без Нітрогену не можуть утворюватися
білкові молекули, без Фосфору – нуклеїнові кислоти,
вітаміни. Завдяки Калію пришвидшується фотосинтез, поліпшується накопичення
сахарози в цукровому буряку і крохмалю в картоплі, зміцнюються стебла
злакових рослин тощо. Щоб природним способом відновити у ґрунті вміст
життєво необхідних рослинам хімічних елементів, потрібний тривалий час. Для
стабільного отримання високих урожаїв у ґрунт вносять мінеральні (мал. 10.50)
й органічні добрива.
Мал. 10.50. На складі з
мінеральними добривами З біології вам відомо, що
рослини засвоюють речовини з ґрунту лише в розчинах. Під впливом полярних
молекул води добрива дисоціюють на іони, які й всмоктуються кореневою
системою та транспортуються по стеблу до всіх органів рослини.
Для сільського господарства важливим є раціональне використання добрив. Під
ним розуміють внесення добрив у кількості, необхідній і достатній для досягнення
балансу поживних речовин у ґрунті, забезпечення вирощуваних рослин хімічними
елементами, підвищення врожайності сільськогосподарських культур без шкоди
довкіллю. Близько 30 років тому високими вважались урожаї,
якщо з 1 га поля збирали 35 ц пшениці, 12 ц соняшнику, 40 ц кукурудзи. Підбір
і внесення у ґрунт мінеральних добрив у поєднанні з новітніми технологіями
обробітку ґрунту, використання високоякісного посівного матеріалу і засобів
захисту рослин дають змогу сучасним аграріям отримувати значно вищі врожаї. Щоб добрива приносили найбільшу користь,
потрібно знати, коли та які з них найкраще використовувати, який спосіб
внесення обрати, як узгодити час внесення добрива з погодними умовами й
багато іншого. Це є предметом дослідження агрохімії. Агрохімія – наука, що вивчає
взаємопов’язані хімічні й біологічні процеси у ґрунті та рослинах, виявляє
шляхи підвищення врожайності сільськогосподарських культур. Знання цієї науки
особливо важливі для агрономів. Приклади мінеральних
добрив та їхні окремі характеристики
Виробництво
добрив в Україні. У нашій країні
найбільше виробляють азотних добрив. Як сировину використовують азот, що
входить
до складу повітря. Прикладом того, як
відходи одного виробництва можна використовувати для одержання цінної
продукції, є виробництво азотних добрив з амоніачної води, що утворюється під
час коксування вугілля. Сировиною для виробництва калійних добрив є природні
калієві солі вітчизняних родовищ. Промислове виробництво калійних добрив
сконцентроване в Західній Україні, оскільки там найбільші в нашій державі
родовища калійних солей (Калусько-Глинське, Стебницьке й Бориславське
родовища). Виробництво фосфорних
добрив ґрунтується переважно на імпортованій сировині. Поняття про кислотні та лужні ґрунти. Однією з характеристик
ґрунтів є їх кислотність, що характеризується вмістом у ґрунтовому розчині
або водній витяжці ґрунту катіонів Гідрогену й гідроксид-аніонів. Від
значення водневого показника ґрунтового розчину залежать доступність хімічних
елементів для рослин, процеси ґрунтоутворення, а також розвиток рослин.
Більшість культурних рослин найкраще розвиваються в ґрунтах з pH від 5,5 до 7,5. Характерною особливістю
кислотних ґрунтів є пригнічення
мікробіологічної активності мікроорганізмів, що беруть участь у розкладанні
гною, торфу, компостів й інших органічних решток, недостатній поживний режим,
зниження посухостійкості і зимостійкості озимих культур. Підвищена
кислотність ґрунту різко позначається на врожайності культурних рослин. Поділ
ґрунтів за кислотністю та приклади сільськогосподарських рослин, які найкраще
на них розвиваються, відображено на малюнку 10.52.
Мал. 10.52. Поділ ґрунтів за значенням рН та приклади сільськогосподарських
рослин, які найкраще на них розвиваються
Агрономічні служби проводять
лабораторні аналізи ґрунтів, стежать за величиною показника рН ґрунту. У разі
відчутного збільшення чи зменшення кислотності ґрунту вживаються заходи щодо
її врегулювання, зокрема вапнування.
Вапнують ґрунти з рН нижче 5,5. Оскільки у складі
кальциту, доломіту, вапняку наявні карбонати – солі дуже слабкої карбонатної
кислоти, а гашене вапно – луг, то відбувається нейтралізація ґрунтового
розчину, кислотність ґрунту зменшується. Кислотність лужних ґрунтів регулюють гіпсуванням
– внесенням гіпсу та деяких інших речовин. В індивідуальних
господарствах, на дачних ділянках індикаторами кислотності ґрунту можуть
служити деякі дикорослі рослини, здебільшого бур’яни, які виявились краще
пристосованими до проростання на кислотних або лужних ґрунтах, деякі кущі,
наприклад калина і глід. Так, наявність серед бур’янів польового хвоща
свідчить про підвищену кислотність ґрунту. Біологічне значення
металічних елементів. Іони Натрію Na+ беруть активну участь
у водно-сольовому обміні та підтриманні кислотно-лужної рівноваги в організмі
тварин і людини. Вони є в еритроцитах і плазмі крові, травних соках. Масова
частка натрій хлориду в крові людини дорівнює 0,9 %. Із таким вмістом цієї
речовини фармацевти готують фізіологічний розчин, який використовують як
тимчасову заміну плазми крові і вводять хворим за допомогою крапельниці
внутрішньовенно. Добова потреба людини у цій речовині (якщо немає
протипоказань) становить 1 – 3 г. Як нестача, так і надлишок натрій хлориду в
харчуванні людини шкідливі для її здоров’я. Основне джерело йонів Натрію для
організму людини – кухонна сіль, у незначній кількості вони є в молоці,
твердих сортах сиру, моркві. Роль Натрію для рослин до кінця не встановлена. Іони Калію K+ необхідні для живлення
рослин, а також завжди присутні у клітинах тваринного організму та людини.
Організм дорослої людини містить близько 175 г іонів Калію, а добова потреба
в них дорівнює близько 4 г. Іони Калію позитивно впливають на роботу
серцево-судинної системи, забезпечують нормальне функціонування м’яких тканин
(наприклад, клітин мозку і печінки), підвищують тонус гладеньких м’язів.
Важливе значення йони Калію відіграють у підтримці автоматизму скорочення
серцевого м’яза – міокарда. Низький рівень Калію може викликати втому, спазм
м’язів.
Основні джерела Калію для людини подано на малюнку
10.53. Нестача іонів цього елемента у ґрунті негативно впливає
на розвиток рослин. Ріст сповільнюється, листки жовтіють, плоди стають менш
солодкими, а насіння гірше проростає. Іони Кальцію Са2+ містяться в усіх
тканинах і рідинах організму людини, вони потрібні для нормальної роботи
м’язів та зсідання крові. Скелет хребетних, тверді покриви ракоподібних
черепах, молюсків, корали утворені кальцій ортофосфатом і кальцій карбонатом.
Таким чином, однією з біологічних функцій, що потребує належного вмісту
катіонів Кальцію в організмі, є опорна функція. Найважливіша функція Кальцію
– участь в утворенні кісткової тканини, що для вашого молодого організму
вкрай важливо. Добова доза Кальцію дорослої людини становить 450 – 800
мг. Без іонів Магнію Mg2+ не існував би зелений
пігмент рослин хлорофіл, а отже, припинився б фотосинтез на Землі. В
організмі людини іони Магнію – універсальний регулятор біохімічних і
фізіологічних процесів. Він входить до складу ферментів, які каталізують
численні біохімічні реакції. Катіони Магнію життєво необхідні для нормального
функціонування нервової системи людини, забезпечення стресостійкості її
організму, попередження депресивних станів. Загальний вміст Магнію в організмі дорослої людини
близько 21 – 24 г. Потреба організму в Магнії суттєво збільшується у людей
похилого віку, а також у разі фізичних навантажень, у спортсменів під час
тривалих й інтенсивних тренувань.
Щоденна потреба в Магнії дорослої людини становить 300 –
400 мг. Для її організму основне джерело Магнію – жорстка вода і харчові
продукти (мал. 10.54). Серед них найбільший вміст іонів цього хімічного
елемента у продуктах рослинного походження (горіхи, пшеничні висівки, борошно
грубого помелу, курага, сливи (чорнослив), фініки, какао (порошок), хліб,
зелень (шпинат, петрушка, салат, кріп), лимони, грейпфрути, соя, свіжі фрукти
(особливо банани) та кавуни, крупи (вівсяна, пшоняна, гречана), бобові
(квасоля, горох), морська капуста, мигдаль, халва (соняшникова і тахінна),
яблука, ревінь, капуста броколі). Багаті на Магній кальмари і риба
(оселедець, скумбрія та представники родини лососевих), яйця і м’ясо. Біологічне значення іонів Феруму Fe2+ полягає в тому, що цей іон входить до складу гемоглобіну, дихальних ферментів
– цитохромів, бере участь у перенесенні кисню від органів дихання до тканин,
а вуглекислого газу – у зворотному напрямку. Добова потреба людини у цьому
елементі становить всього 15 – 20 мг. Нестача Феруму викликає недокрів’я (анемію) – зменшення
кількості еритроцитів і гемоглобіну в крові. Як наслідок – кисневе
голодування всіх органів і тканин організму, що негативно впливає на розумову
діяльність і фізичну активність.
Багатими на йони Феруму Fe2+ є продукти, зображено на мал. 10.55. Біологічне значення неметалічних елементів. До неметалічних елементів, вміст яких в
організмах вищий, ніж металічних, належать Оксиген, Гідроген, Карбон,
Нітроген. Ці хімічні елементи входять до складу біологічно важливих органічних
сполук. О, Н, С, N – елементи-органогени. Біологічна роль
Оксигену. З-поміж різних хімічних елементів Оксигену у живій природі найбільше,
адже він входить і до складу життєво важливих органічних сполук, і до складу
найпоширенішої неорганічної речовини організмів – води. Для більшості живих
істот життєво необхідною сполукою Оксигену є кисень, який бере участь у
різних видах обміну речовин у клітинах. Завдяки кисню в організмах
відбувається окиснення білків, жирів, вуглеводів, яке супроводжується
вивільненням енергії для забезпечення життєдіяльності організмів. У спокої організм
дорослої людини споживає 1,8 – 2,4 г кисню за хвилину. Людина протягом однієї
доби споживає 720 дм3, а протягом року – близько 262,8 м3
кисню. Біологічна роль
Карбону. Карбон – структурний компонент усіх органічних сполук, з яких
складаються живі організми. Для рослин він є також елементом живлення, адже
вуглекислий газ – реагент фотосинтезу. В організмі людини карбон(ІV) оксид, що утворюється під час окиснення
органічних сполук, стимулює дихальний центр, регулює значення рН крові. В організмі людини на Карбон припадає 18 % від маси
тіла. Основне джерело Карбону – їжа, до складу якої входять білки, жири,
вуглеводи. Добова потреба в Карбоні не нормується, але існують норми
споживання органічних сполук, до складу яких входить Карбон. Біологічна роль Нітрогену. Організми не можуть
існувати без Нітрогену. Він входить до складу амінокислот і білків, які
виконують різноманітні функції. Дефіцит Нітрогену може призвести до значних
розладів у структурі і функціях організму людини, зокрема дистрофії. Основне джерело Нітрогену для людини – продукти
рослинного і тваринного походження, що містять білки. Біологічна роль
Фосфору. Фосфор бере участь у багатьох фізіологічних процесах. Він входить до
складу нуклеїнових кислот, які, як вам відомо, регулюють ріст і розвиток
клітин, забезпечують зберігання і використання генетичної інформації. Подібно
до Кальцію, Фосфор незамінний в утворенні кісткової тканини, а ще Фосфор
забезпечує здоров’я ясен і зубів, впливає на роботу нирок і серця, бере
участь у процесах накопичення та вивільнення енергії в клітинах. Біологічна роль
галогенів. Галогени є життєво важливими мікроелементами організму людини, проте
відхилення їхнього вмісту від норми викликає різні захворювання. Флуор входить до складу
зубної емалі, кісток, нігтів, волосся. Його іони надходять до організму з
питною водою, у разі їх недостачі виникає захворювання зубів – карієс. У
нормі 1 л води містить близько 2 мг Флуору. Воду з нижчим вмістом фторують,
для профілактики карієсу користуються спеціальними флуоровмісними зубними
пастами. Хімічний елемент Хлор присутній в організмах
у формі хлорид-аніонів Сl–. Вони беруть участь у
підтриманні рН у клітинах і біологічних рідинах, проведенні нервових
імпульсів, утворенні шлункового соку, масова частка гідроген хлориду у якому
дорівнює приблизно 0,3 %. У разі недостатнього вмісту його у шлунковому соці
людина може захворіти на гастрит. Разом з йонами Калію і Натрію аніони Хлору
підтримують осмотичний тиск і регулюють водно-сольовий обмін. Основні джерела Йоду і Хлору ілюструє малюнок 90.
Мал. 10.56. Джерела
Йоду й Хлору для людини В організмі людини Бром міститься у крові,
нирках, печінці, найбільше його в клітинах мозку. Він регулює нервову
діяльність. Від нестачі Брому виникають підвищена дратівливість, безсоння,
неврози. В організмі людини міститься від 12 до 20 мг Йоду, до того ж більша його частина
сконцентрована в щитоподібній залозі у складі гормонів тироксину і трийодотироніну.
Це високоактивні йодовмісні гормони щитоподібної залози, які на клітинному
рівні впливають на мембранні процеси, мітохондрії, і ядро, обмін білків і
ліпідів, нервову систему. Унаслідок нестачі Йоду в дітей і дорослих
розвиваються важкі захворювання, зокрема базедова хвороба. Щоб уникнути цього
в місцевостях з низьким вмістом Йоду в ґрунті та повітрі, споживають йодовану
кухонну сіль, що містить добавки калій йодиду KI або калій йодату KIO3, а також різні
харчові добавки (пивні дріжджі, висівки). Питання для самоконтролю 2. Які елементи називають неметалічними?
3. Охарактеризуйте загальні фізичні властивості
неметалів. 4. Поясніть суть явища алотропії. 6. Дати визначення що таке адсорбція? 8. Які існують природні причини появи в
атмосфері оксидів неметалічних елементів? 9. Назвіть відомі антропогенні причини появи в атмосфері оксидів неметалічних
елементів. 10. Який склад повітря? Яких речовин у ньому найбільше? 11. У чому полягає суть парникового ефекту? 12. Зробити порівняльну характеристику карбон (II) оксиду та карбон
(IV) оксиду. 13. Дайте визначення кислотам? Як їх класифікують? 14. Поясніть суть кислотних дощів. 15. Чим небезпечні кислотні дощі? 17. У чому полягають особливості хімічних
властивостей нітратної кислоти? 18. Які характерні особливості металічних елементів? 19. Охарактеризуйте поширеність металічних елементів у природі. 20. Охарактеризуйте загальні властивості металів. Чим вони зумовлені? 21. Наведіть приклади металів із високими і низькими значеннями
тепло- й електропровідності. 22. Назвіть фізичні властивості металів, наведіть приклади.
23. Охарактеризуйте хімічну активність алюмінію. 24. Де в промисловості застосовують відновні властивості алюмінію? 26. Поясніть, на підставі чого Ферум помістили у VІІІ групу
періодичної системи. 27. Охарактеризуйте фізичні властивості заліза.
28. Назвіть хімічні властивості заліза.
29. Що називають сплавом? Наведіть приклади сплавів. 30. Охарактеризуйте застосування чистих
металів та їхніх сплавів. 31. Дайте визначення основ, наведіть класифікацію і приклади.
32. Назвіть хімічні властивості лугів.
33. Охарактеризуйте фізичні властивості натрій
гідроксиду й кальцій гідроксиду. 34. Назвіть галузі застосування натрій
гідроксиду й кальцій гідроксиду. 35. Дайте визначення й наведіть приклади кислих і
середніх солей. 36. Назвіть хімічні властивості середніх солей. 37. Наведіть приклади використання солей. 38. Чим зумовлено жорсткість води? На які види її поділяють?
39. Яку загрозу побутовим приладам становить жорстка вода?
40. Назвіть солі, що зумовлюють тимчасову жорсткість води.
41. Назвіть солі, що зумовлюють постійну жорсткість води 42. Назвіть відомі вам будівельні матеріали, наведіть приклади.
43. Дайте визначення мінеральних добрив, назвіть їх класифікацію,
наведіть приклади. 44. Обґрунтуйте роль мінеральних добрив як джерела живлення рослин. 45. Проаналізуйте
джерела біологічно важливих хімічних елементів. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
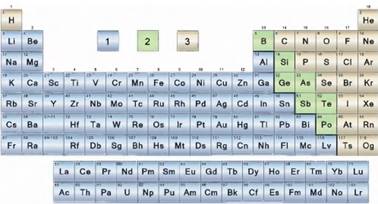
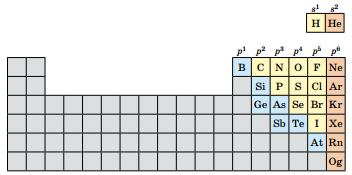










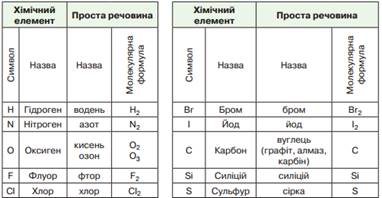


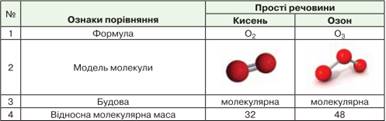
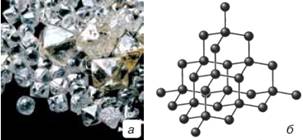
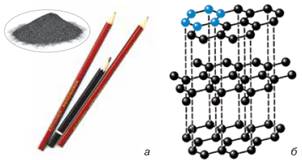


![Описание: Описание: Описание: C:\Users\user\Desktop\-1[1].jpg](10.files/image050.jpg)