|
|
ХІМІЯ Електронний посібник |
|||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||
|
8.1. Іонний, ковалентний,
металічний, водневий хімічні зв’язки 8.2. Залежність
фізичних властивостей від їхньої будови 8.1.
Іонний, ковалентний, металічний, водневий хімічні зв’язки
Електронну теорію
хімічного зв’язку запропонував 1916 року американський хімік Джилберт Льюїс.
Іонний
зв’язок: ·
виникає між протилежно зарядженими іонами; ·
існує між одно- та багатоатомними іонами в
солях, гідроксидах та деяких оксидахметалічних елементів. Іонний зв’язок існує в речовинах, утворених
металічними та неметалічними елементами. Така речовина може утворитися,
наприклад, під час взаємодії металу з неметалом. Іонний зв’язок зумовлений наявністю в речовині вільних
іонів (катіонів та аніонів). Катіони можуть утворитися з атомів металічних
елементів у разі втрачання електронів, а аніони – з атомів неметалічних, що
приймають електрони. Аніони також можуть утворитися з молекул кислот під час
електролітичної дисоціації. Між різнойменно зарядженими іонами виникає
електростатичне притягання, до того ж сила притягання залежить від зарядів
іонів та їхніх радіусів. Класичним прикладом утворення речовини з іонним
зв’язком є хімічна взаємодія натрію та хлору, під час якої утворюються
катіони Натрію Na+ та
хлорид-іони Cl–:
Атом натрію віддає електрон атому Хлору. При цьому
обидва атоми перетворюються на іони з електронною конфігурацією атомів
інертного елемента. У натрій хлориді, що утворився, містяться катіони
натрію та хлорид-аніони. У кристалі вони між собою не зв’язані жорстко, а
утримуються разом завдяки притяганню між протилежно зарядженими іонами (мал.
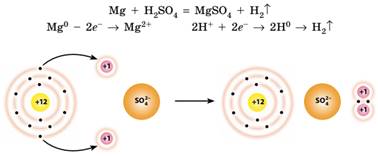
8.1). Розглянемо інший приклад: взаємодію магнію з
розбавленою сульфатною кислотою. Під час реакції атоми магнію віддають два
електрони і перетворюються на іони Магнію Mg2+. Окисником у цій реакції є іони Гідрогену, які приймають електрони і
перетворюються на атоми Гідрогену, а сульфат-іони змін не зазнають:
Під час реакції магнію із сульфатною кислотою частинки обмінюються
електронами.
Якщо випарити воду
після проведення такого досліду, то залишиться кристалічна речовина – магній
сульфат, що складається з іонів Магнію та сульфат-іонів, сполучених іонним
зв’язком (мал. 8.2). Отже, іонний
зв’язок характерний для солей, а також для інших сполук, у яких існують іони:
оснóвних оксидів та лугів. Утворення ковалентного зв’язку. Ковалентний зв’язок виникає переважно між атомами
неметалічних елементів. Для таких елементів характерне те, що вони прагнуть не віддати електрони із зовнішнього
енергетичного рівня, а, навпаки, доповнити
його до октету. А якщо два атоми не віддають один
одному електрони, а намагаються їх
забрати, то вони обидва починають притягуватися до цих електронів та
«усуспільнюють» їх, тобто утворюють спільну електронну пару.
Існує два способи утворення ковалентного зв’язку:
рекомбінаційний (обмінний) та донорно-акцепторний. Рекомбінаційний, або обмінний,
механізм утворення ковалентного зв’язку полягає в тому, що для утворення
спільної електронної пари кожний з атомів надає у спільне користування по
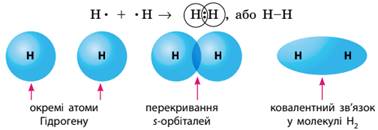
одному електрону. Наприклад, під час утворення молекули водню з атомів
Гідрогену (мал. 8.3):
Мал. 8.3.
Електронні орбіталі (1s) окремих атомів гідрогену та в
молекулі водню Електрони спільної електронної пари однаковою мірою
належать обом атомам Гідрогену, завдяки чому кожен із них набуває електронної
конфігурації атома інертного елемента (Гелію), що зумовлює стійкість молекули
водню. Аналогічно утворюється зв’язок між атомами інших
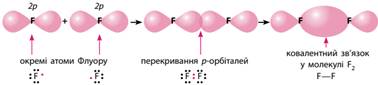
неметалічних елементів, наприклад між атомами Флуору в молекулі фтору F2:
У такому випадку спільна електронна пара утворюється
перекриванням р-орбіталей (мал. 8.4). Як результат кожен з атомів на
зовнішньому рівні має по вісім електронів (октет), із яких два перебувають у
«спільному користуванні», а шість (три пари) не беруть участі в утворенні
хімічного зв’язку і належать самому атому (неподілені електронні пари).
Мал. 8.4.
Ковалентний зв’язок у молекулі фтору У молекулі гідроген флуориду зв’язок утворюється
електроном на 1s-орбіталі атома
Гідрогену та р-електроном атома Флуору (мал. 8.5), завдяки чому кожен з
атомів також здобуває повністю заповнену електронну оболонку:
Мал. 8.5.
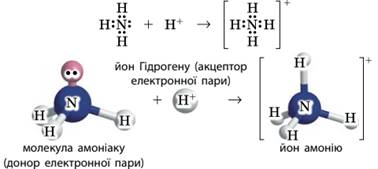
Ковалентний зв’язок у молекулі гідроген флуориду Донорно-акцепторний механізм утворення ковалентного
зв’язку принципово інший. Для утворення зв’язку за цим механізмом один атом —
донор — надає неподілену електронну
пару, а інший — акцептор — надає в
користування вільну орбіталь. У такий спосіб для обох атомів ця електронна
пара стає спільною, а отже, утворюється ковалентний
зв’язок. Класичним прикладом утворення ковалентного зв’язку за
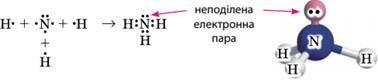
донорно-акцепторним механізмом є утворення іона амонію NH4+. У молекулі амоніаку NH3 атому Нітрогену
належать чотири електронні пари: три з них є спільними з трьома атомами
Гідрогену, а четверта – неподілена:
За участі неподіленої пари атом Нітрогену може утворити
четвертий зв’язок за донорно-акцепторним механізмом із іоном Гідрогену Н+,
на орбіталях якого взагалі немає електронів:
Позитивний заряд тепер належить усьому іону амонію, а
всі утворені атомом Нітрогену чотири зв’язки однакові й не відрізняються один
від одного. Тобто немає різниці, за яким механізмом утворюється ковалентний
зв’язок, головне – що утворюється спільна електронна пара. Донорно-акцепторний механізм є досить поширеним і
реалізується під час утворення багатьох сполук та частинок. Одним із
найвідоміших учених, хто досліджував такі сполуки, був А. Вернер. Види ковалентного
зв’язку. Від утворення спільних електронних пар виникає область з відносно високою
електронною густиною й між нею та атомними центрами діють сили притягання. Якщо
молекула утворена атомами елементів з однаковим значенням
електронегативності, то електронна густина спільної пари електронів не
зміщується в бік одного з них, бо кожен атом діє на неї з однаковою силою. Такий ковалентний зв’язок називають неполярним.
Розглянемо будову
атомів Гідрогену і Хлору, щоб з’ясувати хімічний зв’язок у двохатомних
молекулах простих речовин водню Н2 і хлору Сl2. Розглянемо електронні формули молекул цих речовин:
Вони свідчать про
утворення ковалентного неполярного
зв’язку. Електронна формула молекули – це запис складу речовини за
допомогою символів хімічних елементів і крапок, що позначають електрони зовнішнього
енергетичного рівня. Якщо ж ковалентний
зв’язок утворюють атоми з різною електронегативністю, то ймовірність
перебування електронів хімічного зв’язку поблизу зв’язаних атомів буде різною.
Для більш електронегативного атома вона більша. І це показано на схемі
утворення ковалентного зв’язку в молекулі гідроген хлориду (мал. 8.6).
Мал. 8.6. Модель утворення молекули
гідроген хлориду
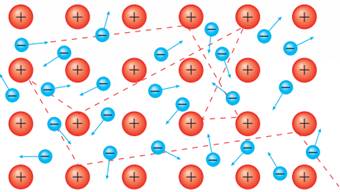
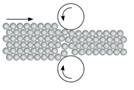
Металічний зв’язок. Утворення металічного зв’язку також пов’язане
з дією сил електростатичного притягання, що діють між іонізованими атомами
металу й делокалізованими валентними електронами, що дістали назву
«електронний газ». Справа в тому, що в більшості металів на зовнішньому
енергетичному рівні атомів мало валентних електронів (1 – 2, рідше 3), і вони
слабко притягуються до ядра, тому на певний час втрачають зв’язок з ним.
Віддавши електрони, такі атоми перетворюються на катіони. Електрони, що втратили зв’язок зі своїми атомами, вільно
переміщуються у кристалі металу. Такі електрони стають спільними, бо не належать якомусь конкретному атому (мал. 8.7).
Мал. 8.7.
Схема утворення металічного зв’язку Металічний зв’язок
міцний. Як і сполуки з іонним типом зв’язку, метали тверді (виняток становить
ртуть), кристалічні, здебільшого тугоплавкі речовини. Металічний
зв’язок у чистому вигляді реалізується тільки у лужних і лужноземельних
металах, тоді як інші метали поряд із металічним утворюють ковалентний
зв’язок. У металічних
р-елементів й особливо у d-елементів тільки невелика частина електронів стають спільними.
Наприклад, у металу ніобію на один атом в середньому припадає 1,2 спільних
делокалізованих електрони. Інші валентні електрони утворюють ковалентні
зв’язки із сусідніми атомами ніобію. Цим пояснюються висока температура
плавлення та велика механічна міцність металів, утворених d-елементами. Водневий
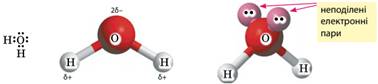
зв’язок. Розглянемо утворення водневого зв’язку на прикладі молекул води. У молекулі
води між атомами Оксигену та Гідрогену зв’язок ковалентний. Через значну
різницю електронегативностей (∆ЕН=3,44–2,20=1,24)
цей зв’язок дуже полярний. Внаслідок цього на атомах Гідрогену наявний
позитивний заряд і дефіцит електронної густини, а в атома
Оксигену заряд негативний і є дві неподілені електронні пари:
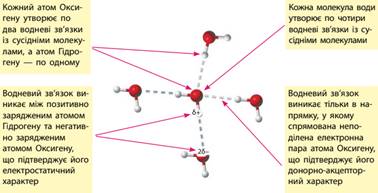
Неподіленими електронними парами атом
Оксигену притягується до атомів Гідрогену інших молекул води, і між молекулами
води виникає додаткова взаємодія — водневий
зв’язок, який позначають крапками:
Водневий зв’язок має частково електростатичний
характер, а частково – донорно-акцепторний:
Водневий зв’язок
утворюється атомами Гідрогену переважно з атомами Оксигену, Флуору та
Нітрогену. Атоми цих елементів мають велику електронегативність і невеликі
розміри. Водневий зв’язок атомів Гідрогену з атомами більшого розміру, як,
наприклад, з атомами Хлору або Сульфуру, значно слабший, хоча за
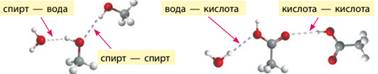
електронегативністю ці елементи близькі до Нітрогену. Водневі зв’язки в різних речовинах. Водневі зв’язки утворюються не тільки між молекулами
води, а й між молекулами інших речовин. Відрізнити такі речовини можна за
їхньою хімічною формулою. Якщо в молекулі речовини є групи –ОН або –NH2, то з великою
ймовірністю такі молекули утворюють водневі зв’язки. Так, молекули спиртів та
карбонових кислот, у яких наявна група –ОН,
утворюють водневі зв’язки між собою, а також із молекулами води (мал. 8.8).
Мал. 8.8. Водневі зв’язки можуть утворюватися як між молекулами однієї речовини так і між молекулами різних
речовин Водневий зв’язок може існувати не тільки між
молекулами, а й усередині однієї молекули між різними її частинами.
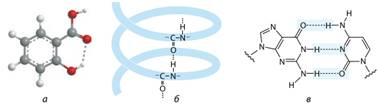
Наприклад, у молекулі саліцилової кислоти (з якої синтезують аспірин)
водневий зв’язок утворюється між гідроксильною та карбоксильною групами
однієї молекули (мал. 8.9а). Також наявність водневих зв’язків характерна для
білків та нуклеїнових кислот. Завдяки утворенню водневих зв’язків
стабілізується вторинна структура білків (мал. 8.9б) та реалізується
можливість існування молекул ДНК у вигляді подвійної спіралі (мал. 8.9в).
Мал. 8.9. Водневі зв’язки в
саліциловій кислоті (а), білку (б) та нуклеїновій кислоті (в)
Вплив водневого зв’язку
на властивості речовин: ·
є міжмолекулярним і значно посилює притягання
молекул; · зумовлює підвищення температури кипіння; ·
зумовлює підвищення розчинності речовин у воді Утворення водневих зв’язків у напрямку неподіленої
електронної пари зумовлює чітку структуру молекул води у твердому агрегатному
стані (мал. 8.10). У рідкій воді водневі зв’язки частково руйнуються, тому
під час плавлення вода дещо стискається, бо густина рідкої води трохи більша
за густину льоду (мал. 8.11).
Мал. 8.11. У рідкій воді молекули води
розташовані невпорядковано та близько одна до одної; у льоду молекули
розташовані впорядковано й на більшій відстані, тому лід легший за воду (а).
Під час замерзання вода розширюється, внаслідок чого закрита скляна пляшка з
водою в морозилці тріскається (б) Наявність водневих
зв’язків зумовлює сильний поверхневий натяг води, завдяки чому багато комах
здатні переміщатися по воді (мал. 8.12). Наявність додаткового зв’язування
молекул водневими зв’язками також зумовлює аномально високу теплоємність
води: щоб пришвидшити тепловий рух, молекулам необхідно надати значно більше
теплоти. Така особливість води має велике значення для формування клімату на
Землі. Поблизу морів та океанів клімат м’якший, ніж у центрі континентів.
Мал. 8.12. Комахи ходять по воді завдяки
її поверхневому натягу, що зумовлений міцними водневими зв’язками
між молекулами води 8.2.
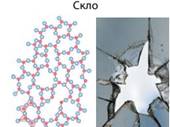
Залежність фізичних властивостей від їхньої будови За внутрішньою будовою і фізичними властивостями
розрізняють два стани твердих речовин: аморфний
і кристалічний.
Кристалічні
речовини: · структурні одиниці
розташовані в чіткому порядку – утворюють кристалічні ґратки; · мають певну температуру плавлення; · утворюють кристали певної форми; · у разі руйнування
кристалічної речовини кристали розпадаються на окремі шматочки, кожен із яких
зберігає хоча б частково форму початкового кристала; · приклади речовин:
природні мінерали, кухонна сіль, цукор. Аморфні речовини: · не мають чіткої
просторової структури – структурні одиниці розташовані невпорядковано; · плавляться в певному
діапазоні температур; · за нагрівання спочатку розм’якшуються; · у разі руйнування
утворюються уламки неправильної форми, зазвичай із нерівною поверхнею країв
сколу; · приклади речовин: скло,
смоли, бурштин, застиглі лаки, клеї, каучук. Аморфні речовини за внутрішньою будовою
нагадують рідини, тільки не можуть текти. Під час нагрівання вони поступово
розм’якшуються і нарешті стають рідкими. Аморфним речовинам, як і рідинам,
можна надати будь-якої форми. За певних умов речовина може з кристалічної
перетворюватися на аморфну, і навпаки. Звичайне скло – аморфна речовина, але
з часом силіцій(IV) оксид у його складі
набуває кристалічної форми. Через це старі склянки під час наливання в них окропу
лопаються набагато частіше, ніж нові. Цукор – кристалічна речовина. Але якщо його
розплавити та швидко охолодити, то він застигає в аморфному стані. З такого цукру можна виготовляти льодяники,
карамельки тощо (мал. 8.13).
Мал.
8.13. Кристалічний цукор (а) після розплавляння та швидкого охолодження стає
аморфною речовиною, з якої легко виготовляти льодяники (б) та карамельки (в) Залежність
фізичних властивостей. У металах існує металічний зв’язок, який
зумовлює загальні фізичні властивості металів та сплавів. Розміри всіх іонів
однакові, тому катіони в металах упаковані максимально щільно й утворюють
найпростіші кристалічні ґратки. Металічні структури утворюють як метали, так
і деякі сполуки з металічним зв’язком, наприклад нітриди Титану та Хрому. Завдяки вільному пересуванню електронів для металів
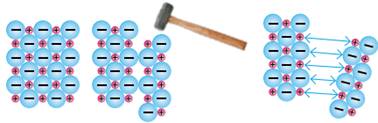
характерні електропровідність та теплопровідність. Окремі шари іонів можна без наслідків пересувати один
відносно одного, тому що в усіх вузлах кристалічних ґраток містяться катіони,
які утримуються разом через притягання до «електронного газу». Цим зумовлена пластичність (ковкість) металів (мал.
8.14). Особливості взаємодії світла з вільними електронами на
поверхні металічного кристала надають металічний
блиск металам (мал. 8.15). Зазвичай що більше валентних електронів в атомів
металічних елементів, то міцніші кристалічні ґратки, то міцніший та твердіший
метал, то вища його температура плавлення (кипіння).
Іонні речовини мають кристалічні ґратки,
у вузлах яких розташовані різнойменно заряджені іони. Іонні кристалічні
ґратки характерні для речовин із іонним зв’язком – cолей, лугів, основних та амфотерних оксидів (NaCl, NaNO3, K2SO4, KOH, NaOH, CaO). Іонні сполуки за кімнатної температури тверді, а
плавляться і киплять лише за високої температури. Це пояснюється тим, що іони
в кристалі сильно притягуються один до одного, і, щоб зрушити їх, необхідно
багато енергії. Утім, незважаючи на твердість, іонні речовини крихкі.
Це зумовлене будовою кристала: навіть незначний зсув наближає один до одного
однойменно заряджені іони, і вони починають відштовхуватися. Наслідком цього
є тріщини в кристалі й навіть його руйнування (мал. 8.16).
Мал.
8.16. У іонних речовинах зміщення шарів призводить до відштовхування
однойменно заряджених іонів та руйнування кристала
Через те що іони в кристалічних ґратках закріплені на
певному місці й утримуються разом силами електростатичного притягання, іонні
речовини не проводять електричний струм. Але якщо розплавити такі речовини
або розчинити у воді, то іони стають рухливими, і тому розплави та розчини
іонних сполук добре проводять електричний струм. Молекулярні речовини: · у вузлах ґраток – молекули; · слабка міжмолекулярна взаємодія; · крихкі, леткі; · легкоплавкі; ·
розчиняються у воді та в інших розчинниках. Наприклад, лід складається з молекул води, а кристали
брому – з двохатомних молекул брому – (мал. 8.17). За звичайних умов багато речовин із молекулярними
кристалічними ґратками перебувають у рідкому (вода, сульфатна кислота,
органічні розчинники тощо) або газуватому станах (озон, хлороводень, водень
тощо). Деякі молекулярні речовини за нагрівання сублімують – переходять із
твердого в газуватий стан, минаючи рідкий, наприклад, йод, вуглекислий газ,
нафталін. Речовини молекулярної будови здатні розчинятися. Деякі
з них розчиняються у воді, інші – в органічних розчинниках. Молекули не містять вільних носіїв електричного заряду,
тому ані в рідкому, ані у твердому стані молекулярні речовини електричний
струм зазвичай не проводять. Речовини атомної будови: ·
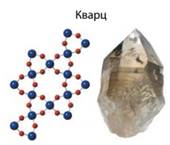
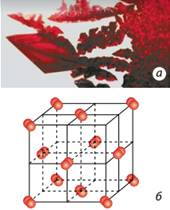
у вузлах ґраток – окремі атоми; · тип зв’язку – ковалентний; · надзвичайно тверді, нелеткі; · тугоплавкі; · не розчиняються в жодному розчиннику Класичним прикладом речовини атомної будови є алмаз –
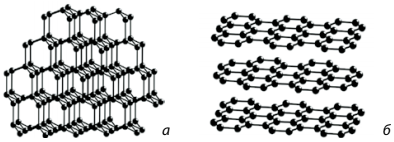
найтвердіша речовина з усіх відомих (мал. 8.18а). Графіт також має атомні кристалічні ґратки, але, на
відміну від алмазу, у графіті атоми карбону розташовані шарами, що слабко
сполучені один з одним (мал. 8.18б). Завдяки цьому шари легко зсунути один
відносно одного. Цим пояснюються «писальні» властивості графіту. Речовинами атомної будови є також германій, бор, кварц SiO2, карборунд SiC.
Мал.
8.18. Атомні кристалічні ґратки: а) алмазу; б) графіту Будова простих речовин і
місце елементів у Періодичній системі. Тип хімічного зв’язку
в речовинах зумовлює будову і фізичні властивості твердих речовин. Оскільки
тип хімічного зв’язку залежить від електронної конфігурації атомів, то
закономірності в будові атомів елементів позначаються на будові й фізичних
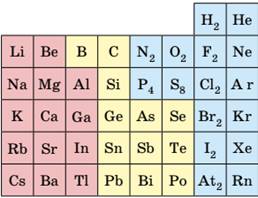
властивостях простих речовин, утворених ними. З малюнка 8.19 бачимо, що на початку
періодів розташовані металічні елементи, які утворюють прості речовини з
металічними кристалічними ґратками. Завершують кожний період неметалічні
елементи, які утворюють прості речовини з молекулярними кристалічними
ґратками. Елементи, що розташовані в середині періоду (як металічні, так і
неметалічні), утворюють прості речовини з атомними кристалічними ґратками.
Мал.
8.19. Місце s- і p-елементів
у Періодичній системі та типи кристалічних ґраток простих
речовин, які вони утворюють ( Питання для
самоконтролю 1. У чому виявляється електронна природа хімічного зв’язку?
2. Дайте визначення іонному зв’язку.
3. Для яких сполук характерний іонний зв’язок?
4. Дайте визначення ковалентному зв’язку.
5. Який ковалентний зв’язок називають полярним, а який – неполярним?
6. Охарактеризуйте рекомбінаційний та донорно-акцепторний механізми утворення
ковалентного зв’язку.
7. Дайте визначення металічного зв’язку.
8. У яких сполуках існує металічний зв’язок?
9. Дайте визначення водневому зв’язку. Завдяки чому він утворюється?
10. Як впливає наявність водневого зв’язку у воді та спиртах на їхні фізичні
властивості?
11. Які речовини називають кристалічними, а які – аморфними?
12. Охарактеризуйте фізичні властивості речовин із кристалічними ґратками: а)
металічними; б) іонними; в) молекулярними; г) атомними.
13. Охарактеризуйте місце в Періодичній системі s- та p-елементів, прості
речовини яких мають кристалічні ґратки: а) металічні; б) атомні; в) молекулярні.
|
||||||||||||||||||||||||||