|
|
ХІМІЯ Електронний посібник |
|||||||||||||||||||||||
|
|
7. ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА
ХІМІЧНИХ ЕЛЕМЕНТІВ |
|||||||||||||||||||||||
|
7.1. Явище періодичної зміни
властивостей та їхніх сполук на основі уявлень про будову атомів 7.2. Можливі ступені окиснення
неметалічних елементів 2 і 3 періодів 7.1. Явище періодичної
зміни властивостей та
їхніх сполук на основі уявлень про будову атомів
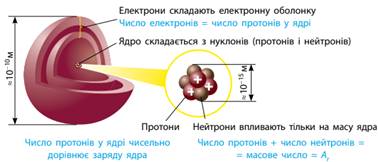
Сучасні уявлення про будову атома ґрунтуються на планетарній моделі атома, запропонованій Ернестом Резерфордом, згідно з якою позитивно заряджене ядро оточене негативно зарядженими електронами (мал. 7.1). Модель атома
Резерфорда доповнив його учень Нільс Бор, який довів, що електрони можуть перебувати не
на будь-якій орбіті, а тільки на певних відстанях від ядра, утворюючи концентричні сфери з електронів. Тому
планетарну модель атома також називають моделлю Бора-Резерфорда.
Мал. 7.1.
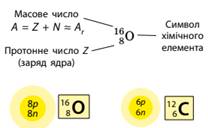
Склад атома
Нуклід – це різновид атомів із певним числом
протонів і нейтронів у ядрі. Нукліди позначають символом хімічного елемента
із зазначенням протонного та масового чисел:
Хімічний елемент – це нукліди з однаковим зарядом ядра. Протонів в атомах міститься таке число, що дорівнює
порядковому номеру хімічного елемента в Періодичній системі. Отже, і заряд ядра атома також дорівнює
порядковому номеру:
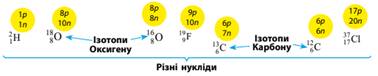
Ізотопи — це різні нукліди одного хімічного
елемента. Ізотопами є нукліди, що мають однаковий заряд (протонне
число) і різне нейтронне число:
Рух електрона в атомі.
Орбіталі. Для електрона можна визначити тільки ймовірність його перебування в
певній точці простору навколо ядра. Ту частину електронної хмари, у якій електрон перебуває
найбільше часу, називають атомною орбіталлю.
Атомні орбіталі всіх електронів у атомі разом утворюють
спільну електронну хмару атома – електронну оболонку атома. Серед орбіталей, що заповнюються електронами в атомі,
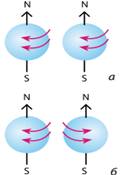
виділяють чотири типи: s, р, d і f (мал. 7.2).
Мал. 7.2. Атомні орбіталі: а)
s-орбіталь; б) p-орбіталь; в,г)
різні види d-орбіталей; д,е) різні види f-орбіталей Структура електронної
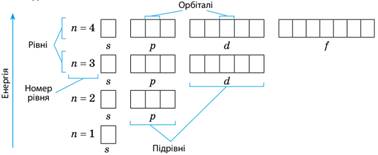
оболонки атомів. В електронних оболонках атомні орбіталі утворюють
чіткі структури, що різняться числом і типом орбіталей. Орбіталі з приблизно однаковою енергією утворюють
енергетичні рівні (електронні шари), їх позначають числом n (n = 1, 2, 3, ...). Кожний
рівень із номером n містить n2 орбіталей Кожна орбіталь може містити максимально два електрони,
тому максимальна місткість енергетичного рівня 2n2. Кожний
рівень із номером n може містити максимум 2n2 електронів Кожний енергетичний рівень складається з енергетичних підрівнів. Енергетичні
підрівні об’єднують орбіталі одного типу (s, р, d і f), тому їх позначають так само, як і орбіталі. Число
енергетичних підрівнів на енергетичному рівні дорівнює номеру цього рівня Графічно орбіталь позначають квадратом. Отже, будова
електронної оболонки атома на прикладі перших чотирьох енергетичних рівнів
виглядатиме так:
Розподіл електронів в електронній
оболонці атомів s-, p- та d-елементів. На кожній орбіталі
максимально можуть розміститися два електрони, що мають однакову енергію, але
які відрізняються особливою властивістю – спіном. Спін електрона – це його внутрішня
властивість, що характеризує відношення електрона до магнітного поля. Наочно
цю властивість можна уявити як можливість обертання електрона навколо своєї
осі (мал. 7.3). Графічно електрони зображують у вигляді стрілок,
спрямованих догори або донизу, що наочно показують напрямок спіну електрона:
Одна орбіталь може містити лише два такі електрони,
спіни яких є антипаралельними. Це правило називають принципом заборони Паулі:
Розподіл електронів за
орбіталями. Принцип «мінімальної енергії». Електрони займають
орбіталі послідовно, починаючи з першого
енергетичного рівня за порядком збільшення енергії рівня та підрівня. Спочатку «заселяється» перший
енергетичний рівень, потім – другий, третій
тощо. Це правило називають принципом найменшої енергії:
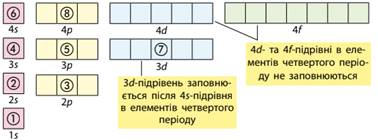
Порівнювати
енергії підрівнів слід з урахуванням такого: · енергія s-підрівня завжди менша за енергію p-підрівня
того самого енергетичного рівня, тобто s-підрівень заповнюється електронами
раніше за p-підрівень; ·
енергія d-підрівня більша навіть за енергію s-підрівня наступного енергетичного рівня. Порядок заповнення електронами енергетичних підрівнів
можна ілюструвати так:
Якщо підрівень складається з кількох орбіталей та містить більше
одного електрона, то за можливості електрони займають вільні орбіталі, а за відсутності
вільної утворюють пару з іншим електроном у напівзаповненій орбіталі. Це
правило називають правилом Хунда:
Електронні та графічні
формули атомів s-, p-, d-елементів.
Пригадаємо
основні принципи розподілу електронів за орбіталями в атомах s- та p-елементів перших трьох періодів: ·
число енергетичних рівнів, що заповнюються в
атомі певного елемента, визначають за номером періоду Періодичної системи, у
якому розташований цей хімічний елемент; ·
число електронів на зовнішньому енергетичному
рівні s- та p-елементів дорівнює номеру групи Періодичної системи, у якій розміщений
елемент (за коротким варіантом), окрім Гелію; ·
в атомах s-елементів останньою заповнюється електронами орбіталь s-підрівня, в атомів p-елементів — орбіталі p-підрівня тощо. В атомів Гелію (1 період, VIIIА група, № 2) в електронній оболонці міститься
два електрони, які перебувають на першому енергетичному рівні на єдиній s-орбіталі (s-елемент):
Атоми Літію (2 період, ІА група, № 3) містять три електрони:
перший рівень вміщує два електрони, а на другому міститься тільки один
електрон на 2s-орбіталі (s-елемент):
В атомів
Бору (2 період, ІІІА група, № 5) в електронній оболонці 5 електронів, їх
вистачає для заповнення 1s- та 2s-орбіталей, і ще один з’являється на
2р-орбіталі (р-елемент):
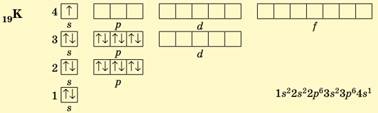
В атомах
Калію (4 період, ІА група, № 19) заповнюється чотири енергетичних рівні,
останньою – 4s-орбіталь (s-елемент). Оскільки енергія 4s-підрівня менша за
енергію 3d-підрівня, то остання лишається вільною:
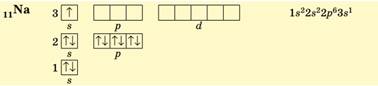
В атомів Натрію (3 період, ІА група, № 11) заповнюється три
енергетичних рівні, останньою – 3s-орбіталь (s-елемент):
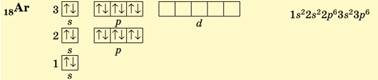
В атомах
Аргону (3 період, VIIIА група, № 18) – останнього елемента третього періоду –
повністю зайняті всі s- і p-орбіталі, останнім заповнювався р-підрівень
(р-елемент):
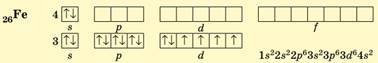
Ферум (4
період, VIIIВ група, № 26) розташований приблизно посередині d-елементів 4
періоду, його 3d-підрівень містить 6 електронів:
Для d-елементів електронну
формулу атома складають по-різному:
Ці принципи є універсальними і виконують для всіх
елементів. Основним називають такий стан
атома (молекули), у якому енергія атома (молекули) мінімальна. Здебільшого ця
енергія визначається розподілом електронів в електронній оболонці атома
згідно з принципом мінімальної енергії. Будь-який енергетичний стан, що відрізняється від
основного, називають збудженим. У такий стан атоми
(молекули) можуть переходити за певних умов: під час нагрівання, за умови поглинання електромагнітного
випромінювання (видимого, ультрафіолетового тощо). Під час збудження атомів відбувається перехід
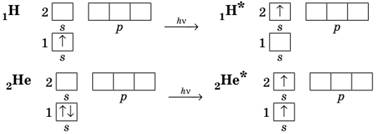
електронів на інші, менш енергетично вигідні орбіталі. Наприклад, під час
збудження атомів Гідрогену та Гелію електрони переходять на наступні
енергетичні рівні (збуджений стан позначають зірочкою):
Валентні стани елементів. Валентністю називають число
хімічних зв’язків, які атом утворює з іншими атомами в молекулі, тобто
валентність дорівнює числу спільних електронних пар, утворених атомом. Але спільні електронні
пари характерні тільки для ковалентного зв’язку, тому про валентність атомів
коректно говорити лише щодо ковалентних сполук. Здебільшого валентність визначається числом неспарених
електронів у атомі. Наприклад, атоми Оксигену на зовнішньому енергетичному
рівні містять два неспарені електрони, тому виявляють валентність II. Число неспарених електронів в атомах може змінюватися
внаслідок збудження атомів, завдяки чому атоми багатьох елементів виявляють
змінну валентність. Атом Хлору в основному стані на зовнішньому рівні
містить один неспарений електрон, за допомогою якого він утворює один
хімічний зв’язок, отже, виявляє валентність I. Поглинаючи енергію, одна з електронних пар розпаровується:
Унаслідок
цього в атомі Хлору є вже три неспарені електрони, отже, він виявляє валентність
III. Але і в цьому випадку на зовнішньому енергетичному рівні атома Хлору
залишаються дві електронні пари і вільні d-орбіталі. Тому за умови поглинання
додаткової енергії можливий перехід інших електронів на вільні орбіталі,
завдяки чому Хлор може виявляти валентність V, а також і свою вищу
валентність — VII.
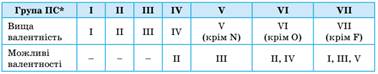
Таким чином можна визначити всі можливі валентності для
більшості елементів. Можливі валентності s- та p-елементів,
визначені за будовою атома
Слід
зауважити, що на зовнішньому енергетичному рівні атомів Нітрогену, Оксигену
та Флуору вільні орбіталі відсутні, тому збільшення числа неспарених
електронів для них неможливе. 7.2. Можливі ступені окиснення неметалічних
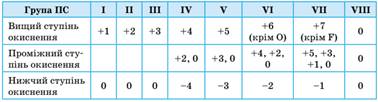
елементів 2 і 3 періодів Для всіх елементів у неорганічних речовинах незалежно від типу
хімічних зв’язків застосовують універсальне поняття – ступінь окиснення,
що характеризує число прийнятих або відданих атомом електронів. Ступені окиснення, які елементи здатні виявляти в
різних сполуках, здебільшого можна визначити за будовою зовнішнього
енергетичного рівня їх атомів. Атоми металічних елементів тільки
віддають електрони, тому в сполуках вони виявляють позитивний ступінь
окиснення. Його значення в багатьох випадках (за винятком d-елементів) дорівнює числу електронів на
зовнішньому рівні, а отже, і номеру групи в Періодичній системі (короткому
варіанті). Атоми неметалічних елементів можуть
виявляти як позитивний, так і негативний ступінь окиснення залежно від того,
з атомом якого елемента вони утворюють зв’язок. Якщо елемент більш
електронегативний, то його атоми приймають електрони від інших атомів, і він
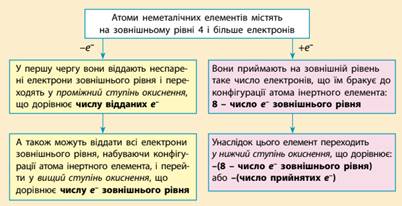
виявляє негативний ступінь окиснення, і навпаки. Ступені окиснення
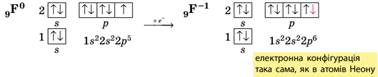
неметалічних елементів у разі прийому електронів. Атоми неметалічних
елементів на зовнішньому енергетичному рівні містять 4 і більше електронів, тому вони насамперед прагнуть
прийняти електрони на зовнішній рівень, щоб здобути електронну конфігурацію
атома інертного елемента. Наприклад, у атома Флуору на зовнішньому рівні 7 електронів, він може прийняти до октету
тільки 1 електрон, унаслідок чого
він переходить у ступінь окиснення –1,
що є нижчим для Флуору:
Отже, для визначення можливих ступенів
окиснення неметалічних елементів можна скористатися загальною схемою:
Оскільки
число електронів на зовнішньому рівні збігається з номером групи (короткого
варіанта ПС), то вищий ступінь окиснення неметалічних елементів дорівнює
номеру групи (за винятком Флуору та ОКСИГЕНУ). Певна річ,
для всякого правила є винятки, але в розглянутий спосіб можна визначити майже всі можливі
ступені окиснення для
будь-яких s- та p-елементів. Можливі ступені окиснення s- і
p-елементів
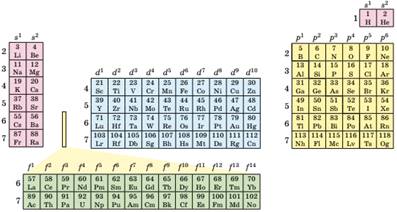
Періодичність у зміні будови
електронних оболонок атомів. Будова
зовнішнього енергетичного рівня атомів хімічних елементів однієї підгрупи є
подібною (мал. 7.4), вони є електронними аналогами і внаслідок цього мають
подібні хімічні властивості.
Мал. 7.4. Електронна конфігурація підрівня, що заповнюється останнім в атомів
елементів різних підгруп Періодичної системи (довгий варіант)
Звертаючи увагу
на будову електронних оболонок атомів, ми бачимо, що зі збільшенням заряду
ядра атомів періодично повторюються електронні формули зовнішніх
енергетичних рівнів атомів. Оскільки саме від зовнішнього рівня
насамперед залежать властивості елементів та їхніх сполук, то така
періодичність зміни електронної конфігурації атомів пояснює
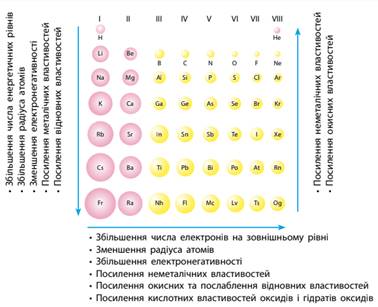
справедливість Періодичного закону. Радіус атома ·
Зі збільшенням порядкового номера елемента в
головних підгрупах збільшується число енергетичних рівнів, що заповнюється
електронами, тому радіус атомів
хімічних елементів однієї групи збільшується. ·
В атомів
хімічних елементів одного періоду число енергетичних рівнів, що заповнюються,
однакове. Але зі збільшенням порядкового номера хімічного елемента заряд ядра
поступово збільшується, що спричиняє сильніше притягання електронів до ядра,
і тому в періоді радіус атомів
поступово зменшується (мал. 7.5). Електронегативність
елементів ·
У періодах
число електронів на зовнішньому енергетичному рівні атомів поступово
збільшується. Унаслідок цього зменшується здатність віддавати електрони і
збільшується здатність їх приймати, а отже, збільшується притягання спільних
електронних пар, тобто в періодах
електронегативність збільшується. ·
В елементів
однієї групи електронна конфігурація атомів подібна, але число заповнених
електронних шарів поступово збільшується. І що далі від ядра перебуває
зовнішній електронний шар, то важче ядру притягувати спільні електронні пари.
Унаслідок цього у групах
електронегативність зменшується (мал. 7.5).
Мал. 7.5. Періодичність у зміні властивостей хімічних елементів та їхніх
атомів Металічні й
неметалічні властивості ·
У періоді зі збільшенням порядкового номера металічні властивості елементів
послаблюються, а неметалічні – посилюються. ·
Зі
збільшенням радіуса зовнішні електрони легше втрачати, тому в групах металічні властивості посилюються.
Разом із цим зі збільшенням радіуса в
групах атомів неметалічні властивості елементів послаблюються. Металічні
властивості елементів однієї підгрупи найсильніше виражені в елементів із
найбільшим радіусом (найбільшим порядковим номером), а неметалічні – в
елементів із найменшим радіусом (найменшим порядковим номером) (мал. 7.5). Окисно-відновні властивості простих речовин. Оскільки металічні властивості пов’язані зі здатністю атомів віддавати
електрони, то що активніший метал, то сильнішим відновником він є. Так само
щодо неметалічних властивостей, що пов’язані зі здатністю приймати електрони.
Що активніші неметалічні властивості, то сильнішим окисником є речовина. ·
Зі збільшенням порядкового номера в періодах відновні властивості
послаблюються, а окисні – посилюються. ·
У групах відновні властивості посилюються, а окисні послаблюються. Кислотно-основні
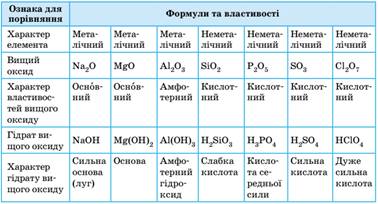
властивості оксидів та гідратів оксидів. З послабленням металічних та посиленням неметалічних властивостей
хімічних елементів характерно змінюються властивості їхніх оксидів та
гідратів оксидів (табл. 20). Кислотно-основні
властивості оксидів та їхніх гідратів елементів третього періоду
Елементи на початку періоду утворюють основні речовини (оксиди та
гідроксиди). Потім основні властивості послаблюються: алюміній утворює вже
амфотерні сполуки, які виявляють і кислотні, і основні властивості. А
неметалічні елементи утворюють кислотні речовини, до того ж на прикладі
гідратів оксидів добре видно, як вони змінюються: від слабкої силікатної
кислоти до дуже сильної перхлоратної кислоти (HClO4 – одна з найсильніших кислот). Отже, властивості хімічних
елементів та їхніх сполук
періодично змінюються, що
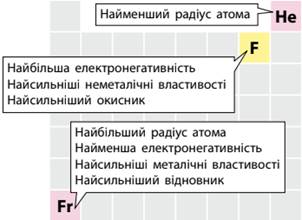
значною мірою зумовлено періодичністю змін у будові електронних оболонок атомів. А Францій та Флуор – рекордсмени за
багатьма властивостями (мал. 7.6).
Мал. 7.6. Хімічні елементи з рекордними
властивостями Питання для
самоконтролю 1. Дайте визначення принципу найменшої енергії, правила Хунда, принципу
Паулі. 2. Що називають «неспареним електроном», «електронною парою»? 3. Чому перший енергетичний рівень заповнюється раніше за другий? 4. Наведіть порядок заповнення електронами підрівнів для перших чотирьох
енергетичних рівнів. 5. Скільки енергетичних рівнів зайнято електронами в атомах: а) Натрію; б)
Кальцію; в) Брому? 6. Поясніть, що називають основним та збудженим станами атомів. 7. Дайте визначення поняття «ступінь окиснення»? 8. Охарактеризуйте, які ступені окиснення є можливими для металічних та
неметалічних елементів. 9. Чим зумовлені металічні та неметалічні властивості елементів? 11. Чому атоми приймають або віддають електрони в
хімічних реакціях? |
||||||||||||||||||||||||