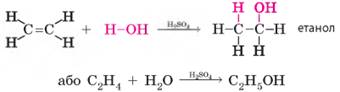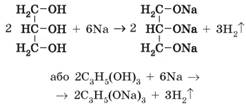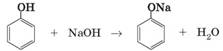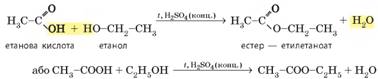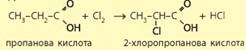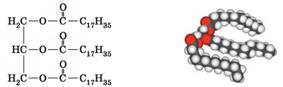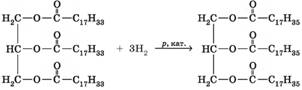|
|
ХІМІЯ Електронний посібник |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
3.1 Спирти: класифікація, номенклатура 3.2 Поняття про багатоатомні спирти на прикладі
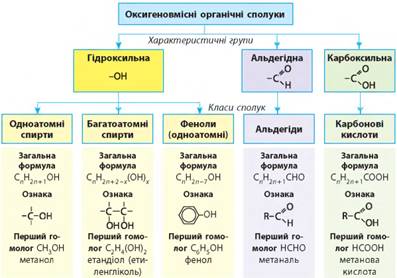
гліцеролу. Фенол 3.3 Альдегіди. Карбонові кислоти 3.1. Спирти: класифікація, номенклатура До кисневмісних
органічних сполук, які складаються з атомів вуглецю (карбону), водню
(гідрогену) і кисню (оксигену), належать спирти, феноли, альдегіди, кетони,
карбонові кислоти, прості і складні ефіри (етери і естери), вуглеводи тощо.
Їх хімічні властивості визначаються наявністю в молекулах різних
функціональних груп.
Гідроксильна група
-ОН є характеристичною групою
спиртів. Загальну формулу спиртів можна записати по-різному. Якщо немає
значення похідним якого вуглеводню є спирт, тобто з яким вуглеводневим
залишком сполучена група -ОН, то
спирт можна позначити загальною формулою: R-OH Залишок R може бути утворений будь-яким вуглеводнем (алканом,
алкеном, алкіном, а також ареном). У цьому курсі ми вивчатимемо тільки
насичені спирти, отже, матимемо справу тільки із залишками, що є похідними
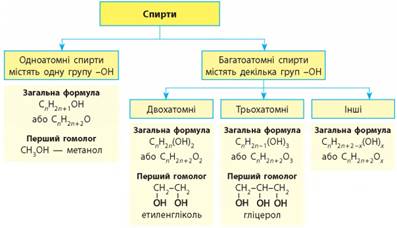
алканів. За числом груп -ОН у молекулах
серед спиртів виділяють: Для насичених одноатомних
спиртів загальна формула гомологічного ряду СnН2n+1ОН (n > 1). Окрім
неї також справедлива загальна емпірична формула СnН2n+2O.
Уявлення про
спирти як про
клас органічних сполук
уперше сформував видатний французький хімік Ж. Б. Дюма 1835 року. Він також детально дослідив склад і будову природних спиртів
камфори й ментолу. Назви спиртів
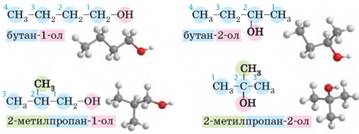
складають подібно до назв алканів:
Але існують певні
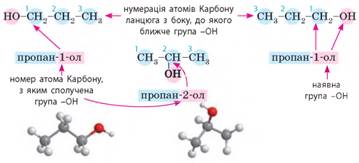
особливості: • нумерацію
головного ланцюга починають з боку, до якого ближче характеристична група
(навіть якщо в ланцюзі є подвійний або потрійний зв’язок); • у назвах спиртів
наявність групи -О Н позначають
суфіксом -ол- та вказують
номер атома Карбону, з яким сполучена група -ОН.
Ізомерія
насичених одноатомних спиртів. Як і для алканів, за
наявності чотирьох атомів Карбону в молекулах для насичених одноатомних
спиртів характерна ізомерія
карбонового ланцюга. Крім того, внаслідок наявності групи -ОН для цих
спиртів характерна ізомерія положення
характеристичної групи. Так, для спирту складу С3Н7ОН існують два ізомери: пропан-1-ол та
пропан-2-ол. А для спирту складу С4Н9ОН існують
уже чотири ізомери з різним головним ланцюгом та різним положенням
характеристичної групи:
Якщо в молекулі
спирту карбоновий ланцюг не розгалужений, а гідроксильна група сполучена з
першим атомом Карбону, то такі спирти називають нормальними, що в назві позначають буквою «н». Так, бутан-1-ол можна також назвати нормальним бутанолом,
або н-бутанолом. У насичених
одноатомних спиртів також існує міжкласова ізомерія з етерами.
Тобто з однаковим складом можуть існувати дві речовини з різними
характеристичними групами (саме тому її називають ізомерією характеристичної
групи). Ці речовини належать до різних класів, зокрема, якщо один ізомер є
спиртом, то інший – етером. Наприклад,
для спирту:
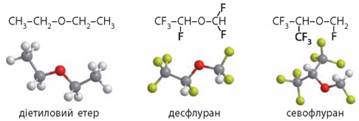
Етери
для загальної анестезії. Нітроген(І) оксид N2О, який також називають звеселяючим газом, уперше
застосували для інгаляційної анестезії (знеболювання, або наркозу) 1799 року
і застосовують до сьогодні. Однак він не забезпечує глибокого наркозу. Для глибокої інгаляційної
анестезії 1842 року вперше використали діетиловий етер. Видатний український
хірург М. І. Пирогов уперше в історії медицини застосував діетиловий етер під
час хірургічних операцій у польових умовах, провівши з ним майже 10 тисяч
операцій. Однак діетиловий етер має певні недоліки: він дуже займистий, а в
разі зберігання понад шести місяців стає вибухонебезпечним. Сьогодні для
інгаляційного наркозу в медицині використовують галогеновані етери десфлуран та севофлуран.
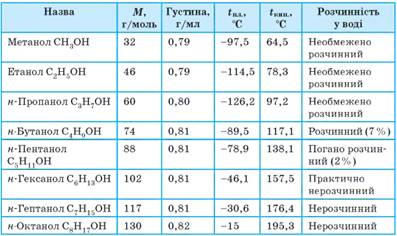
Фізичні властивості спиртів. Серед спиртів немає газуватих речовин. Перші члени
гомологічного ряду насичених одноатомних спиртів – це рідини, а вищі спирти
(від С15) – тверді
речовини. У гомологічному ряду нормальних (нерозгалужених) спиртів зі
збільшенням молекулярної маси підвищуються температури плавлення й кипіння
(як і в алканів), а густина
спиртів майже не змінюється. Перші три члени гомологічного ряду змішуються з
водою необмежено, а далі розчинність суттєво зменшується. Тверді спирти не
мають запаху, тоді як рідким властиві специфічні запахи. При цьому метанол та
етанол за запахом дуже схожі й відрізнити їх майже неможливо. Фізичні властивості насичених одноатомних спиртів
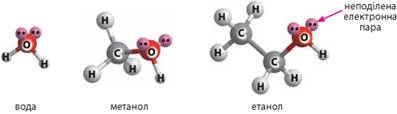
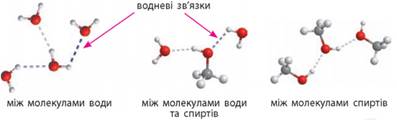
Вплив водневого зв'язку на фізичні властивості спиртів.
Зверніть увагу, що в ряду насичених
одноатомних спиртів, на відміну від насичених і ненасичених вуглеводнів,
немає газуватих речовин, хоча перші члени ряду мало відрізняються від них за
молекулярною масою. Це пояснюється тим, що атоми Оксигену в молекулах спиртів
сполучені з атомами Гідрогену, і в них є неподілена електронна пара (як у
молекул води). Тобто у спиртів та води подібна електронна будова молекул:
Це зумовлює
можливість утворення водневого зв’язку між молекулами спиртів. Завдяки
водневому зв’язку молекули спиртів, так само як і молекули води, асоційовані:
між ними існує додаткова міжмолекулярна взаємодія:
Утворенням
водневих зв’язків між молекулами спиртів і молекулами води пояснюється розчинність нижчих
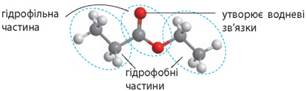
спиртів. Молекули спиртів
складаються ніби з двох частин – розчинної у воді (гідрофільної), що містить гідроксильну
групу, та нерозчинної (гідрофобної), що складається з вуглеводневого залишки.
Якщо вуглеводневий залишок невеликий, то водневі зв’язки гідроксильної групи
з молекулами води спроможні втримати молекулу спирту в розчині. Якщо ж молекула
спирту має довгий вуглеводневий ланцюг, який «чинить опір» розчиненню, то
гідроксильна група вже не в змозі розчинити речовину. Тому вищі спирти –
нерозчинні. Хімічні властивості насичених одноатомних спиртів Для спиртів найбільш характерні реакції за участі групи – ОН: – окиснення до
альдегідів або карбонових кислот; – дегідратація
(внутрішньо- або міжмолекулярна); –
гідрогенгалогенування; – взаємодія з дуже
активними металами. 1. Окиснення. Для спиртів, як і для вуглеводнів, характерне повне та часткове
окиснення. Повне окиснення – горіння – відбувається під час взаємодії з киснем, як результат
утворюються вуглекислий газ і вода:
Як і вищі
вуглеводні, вищі спирти горять кіптявим полум’ям унаслідок неповного
згоряння, під час якого утворюється чадний газ або вуглець (сажа). Під час часткового окиснення спиртів утворюються
альдегіди або карбонові кислоти залежно від реагентів та каталізаторів, які
застосовують для взаємодії. Під час пропускання спиртів над розпеченим мідним або
мідно-срібним каталізатором спирти втрачають водень та перетворюються на
альдегіди:
Також спирти перетворюються на
альдегіди або карбонові кислоти під час взаємодії з різними окисниками (калій
дихромат, калій перманганат, кисень тощо).
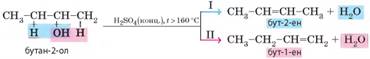
2. Дегідратація. Процес
відщеплення молекули води називають дегідратацією.
Під час нагрівання спиртів з концентрованою сульфатною кислотою відбувається
відщеплення молекул води від молекул спиртів. Але залежно від температури, за
якої відбувається реакція, можлива внутрішньомолекулярна або міжмолекулярна
дегідратація. Внутрішньомолекулярна дегідратація. Під час нагрівання вище за 160 °С молекула води відщеплюється від однієї
молекули спирту й утворюється алкен (мал. 3.1).
Мал. 3.1. Дегідратація спиртів: нагрівання етанолу із
сульфатною кислотою (а). Знебарвлення бромної води під час
пропускання утвореного газу доводить, що одержана речовина є ненасиченою (б) У загальному
вигляді схема реакції:
Для етанолу:
Під час
дегідратації спиртів, у яких група -О Н приєднана не до першого атома
Карбону, можливі два напрямки реакції:
У таких випадках
реакція відбувається переважно за напрямом І: атом Гідрогену відщеплюється
від найменш гідрогенізованого атома Карбону (з яким сполучено менше атомів
Гідрогену). Таку закономірність помітив учень Бутлерова О. М. Зайцев (правило
Зайцева). Міжмолекулярна гідратація. Якщо температура близько 140 °С, молекула води відщеплюється від двох
молекул спирту з утворенням етерів. Наприклад, діетиловий етер, або медичний
ефір, добувають за такою схемою:
У цьому випадку
концентрована сульфатна кислота є не тільки каталізатором, але й
водовідіймаючим засобом – речовиною, що активно поглинає воду в ході хімічних
або фізико-хімічних процесів. Діетиловий етер
уперше було добуто за цією реакцією ще в XVI столітті. Тоді вважали, що в його складі міститься
сульфур, тому його назвали сірчаним ефіром. Цю назву іноді застосовують і
сьогодні. 3. Взаємодія з гідроген галогенідами. За наявності концентрованої сульфатної кислоти спирти
взаємодіють з гідрогенгалогенідами (НСl, НВr, НІ). У загальному
вигляді схема реакції:
Для
етанолу:
У цій реакції сульфатна кислота також є
не тільки каталізатором, а й сприяє відщепленню води, тобто є водовідіймаючим
засобом. За таких умов реакція відбувається тільки зі спиртами, в яких група -ОН з’єднана з кінцевим атомом
Карбону (такі спирти називають первинними).
4. Взаємодія з лужними металами. За звичайних умов спирти вступають у реакцію заміщення з активними металами, зокрема лужними, з
утворенням солей (алконолятів) та водню (мал. 3.2). У загальному вигляді схема реакції:
Для метанолу:
Ця реакція є
прикладом виявлення кислотних властивостей спиртів. Але дисоціація спиртів у
водному розчині настільки незначна (менша за дисоціацію води), що кислотами
спирти назвати не можна. Спирти не змінюють забарвлення індикаторів і не
взаємодіють з лугами. Одержання етанолу 1. Спиртове бродіння глюкози. Більшу частину
етанолу одержують з глюкози або інших вуглеводів. Дією ферментів, що
виділяють дріжджі, молекули глюкози розщеплюються на молекули етанолу та
вуглекислого газу:
Цей процес дуже
поширений у природі, його широко використовує людина. Вуглекислий газ, що
виділяється під час бродіння, розпушує дріжджове тісто. Під час бродіння соку
ягід чи фруктів утворюється етиловий спирт, який використовують для
виготовлення вина та інших напоїв. В Україні виробництво
спирту є державною монополією і відбувається на близько 40 заводах концерну
«Укрспирт» в усіх регіонах України. Загальна потужність усіх заводів ДП
«Укрспирт» становить понад 360 мли л на рік, а найбільше його виробляють у
Вінницькій області. 2. Гідратація етену. Гідратацію етену ви вже вивчали як хімічну властивість етену:
Зверніть увагу, що і для гідратації, і
для дегідратації потрібна сульфатна кислота. Але гідратація відбувається за
наявності порівняно розбавленого розчину кислоти, і кислота є тільки
каталізатором, а дегідратація – за наявності концентрованого розчину, і
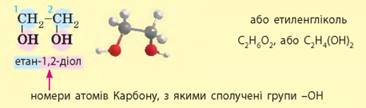
кислота також є водовідіймаючим засобом. 3.2.
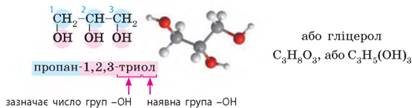
Поняття про багатоатомні спирти на прикладі гліцеролу. Фенол
У назвах таких
спиртів перед суфіксом -ол-, яким
позначають групу -ОН, ще
зазначають число цих груп. Двохатомні спирти за традицією також називають
гліколями. Промислово
важливими багатоатомними спиртами є гліцерол і етиленгліколь:
Фізичні властивості гліцеролу. У молекулах багатоатомних спиртів є декілька
груп -ОН, тому вони утворюють
значно більше водневих зв’язків. Унаслідок цього молекули багатоатомних
спиртів настільки сильно притягуються одна до одної, що такі спирти зазвичай
є або рідинами з дуже високими температурами кипіння, або твердими
речовинами. Молекули цих спиртів також значно важче пересуваються одна
відносно одної, унаслідок чого багатоатомні спирти дуже в’язкі.
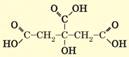
Гліцерол: • безбарвна сиропоподібна рідина; • дуже в’язкий; • дуже гігроскопічний; • необмежено розчиняється у воді; • tпл =18,2 °С; tкип =290 °С; • густина 1,26 г/мл; • солодкуватий; • не отруйний. Етиленгліколь: • безбарвна сиропоподібна рідина; • необмежено розчиняється у воді й етанолі, не
розчиняється у вуглеводнях; • tпл =–12,6 °С, tкип = 197,9 °С; • густина 1,12 г/мл; • солодкуватий; • отруйний. Хімічні властивості гліцеролу Повне окиснення. Як і більшість органічних речовин, багатоатомні спирти горять (мал. 3.3).
Продуктами реакції є вуглекислий газ та вода:
У разі нагрівання вище 300 °С гліцерол спалахує. Здатність гліцерилу
горіти використовують у прозорих свічках (мал. 3.4). Взаємодія з активними металами. Як і одноатомні, багатоатомні спирти виявляють слабкі кислотні
властивості. Гліцерол активно взаємодіє з активними металами,
зокрема з натрієм:
Взаємодія гліцеролу з натрієм
відбувається дуже бурхливо, з виділенням великої кількості теплоти, унаслідок
чого водень, який виділяється, може зайнятися.
Також проявом
кислотних властивостей гліцеролу є його взаємодія з купрум(ІІ) гідроксидом,
що використовують для виявлення його в розчині. У разі додавання до
свіжоосадженого купрум(ІІ) гідроксиду гліцеролу або його розчину блакитний
осад зникає, а розчин набуває темно-синього забарвлення (мал. 3.5) – це якісна
реакція на багатоатомні спирти: С3Н8О3 + Сu(ОН)2 ® сполука темно-синього кольору Аналогічно з
купрум(ІІ) гідроксидом взаємодіють й інші багатоатомні спирти. Це демонструє,
що багатоатомні спирти мають трохи сильніші кислотні властивості, ніж
одноатомні, внаслідок більшого числа груп -ОН у молекулах. В Україні
виробництво гліцеролу налагодило ТОВ «Укрхімресурс» (м. Калинівка Вінницької
обл.), яке є одним з потужних виробників гліцеролу в Європі та єдиним в
Україні. На цьому підприємстві гліцерол добувають як побічний продукт
виробництва біодизельного пального. Поняття
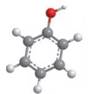
про феноли
Найпростішою
сполукою цього класу, в якій з бензеновим ядром сполучена тільки одна група
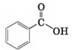
-ОН, є фенол:
Структурна формула:
Модель молекули:
Молекулярна формула фенолу С6Н5ОН. Традиційна назва – карболова кислота. Фенол відкрили у
складі кам’яновугільної смоли. Першим хімічну будову фенолу та метод його
синтезу із саліцилової кислоти запропонував французький хімік Ш.-Ф. Жерар.
Фізичні властивості фенолу • Свіжодобутий фенол – безбарвна кристалічна речовина; • під час зберігання набуває рожевого забарвлення
внаслідок часткового окиснення; • tпл= 42 °С; tкип. = 181,8 °С, але за нагрівання близько 90 °С займається; • леткий, має специфічний стійкий запах (запах гуаші,
або так званий «карболовий запах»); • обмежено розчинний у холодній воді (6,5 г на 100 мл),
але необмежено розчиняється в гарячій воді; • отруйний! У
разі потрапляння на шкіру спричиняє хімічні опіки. Хімічні властивості фенолу. Фенол активно взаємодіє: • з лужними
металами (як і спирти); • лугами (на
відміну від спиртів); • бромом (набагато
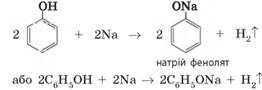
активніше за бензен). 1. Взаємодія з лужними металами. Феноли виявляють кислотні властивості і за звичайних
умов взаємодіють з активними металами. Реакція відбувається так само, як і у
спиртів: атоми металічних елементів заміщують атоми Гідрогену гідроксильної
групи:
2.
Взаємодія з лугами. Феноли виявляють сильніші кислотні
властивості, ніж спирти, і на відміну від них взаємодіють з лугами:
Здатність фенолу
взаємодіяти з лугами зумовлена впливом бензенового ядра на зв’язок О -Н у гідроксильній групі. Завдяки
цьому впливу зв’язок О -Н більш полярний, ніж у
спиртах, і легше розривається. Унаслідок цього фенол хоч і незначною мірою,
але дисоціює у водному розчині:
Але кислотні властивості фенолу
настільки слабкі, що навіть така слабка кислота, як карбонатна, витісняє фенол із розчину його солей:
Виявлення фенолом
кислотних властивостей надихнуло Ф. Рунге назвати фенол карболовою кислотою.
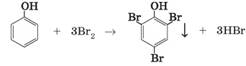
Ця назва до наших часів збереглася у медицині. 3. Взаємодія з бромом. Фенол активно взаємодіє з бромом. Під час змішування
розчину фенолу з бромною водою за звичайних умов утворюється нерозчинний білий
осад 2,4,6-трибромофенолу:
Реакцію з бромом використовують для виявлення фенолу в
розчині – це якісна реакція на фенол (мал. 3.6). Ця хімічна
властивість фенолу характеризує вплив гідроксильної групи на бензенове ядро.
Пригадайте, бензен взаємодіє з бромом за досить жорстких умов. Якщо в
молекулі бензену замістити атом Гідрогену на групу -ОН, то реакційна
здатність бензенового ядра суттєво зростає: у фенолу
хімічна активність набагато вища за бензен. Хімічні реакції заміщення атомів
Гідрогену в бензеновому ядрі фенолу відбуваються набагато активніше. Зокрема,
фенол бромується за звичайних умов навіть з розчином брому (бромною водою) із
заміщенням одразу трьох атомів Гідрогену в бензеновому ядрі. Застосування фенолу. Раніше фенол (карболова кислота) був одним з
найважливіших антисептиків і його широко використовували для дезінфекції
приміщень, меблів, хірургічних інструментів. Сьогодні фенол рідко
застосовують як антисептик, його замінили іншими речовинами. Але значно
збільшується роль фенолу в синтетичній промисловості. Світове виробництво
фенолу сягає понад 8 млн тонн на рік, він посідає 17 місце за обсягом
органічних речовин, що виробляє світова хімічна промисловість. Майже половина
одержаного фенолу йде на виробництво полікарбонатів та епоксидних смол.
Завдяки механічним та оптичним властивостям полікарбонатів їх використовують
для виготовлення лінз, фар, компакт-дисків, а також прозорих матеріалів для
крівлі й фасадів будівель, шумових загороджень доріг тощо. Значні обсяги
фенолу витрачають на виробництво фенолоформальдегідних смол. Ці смоли є
в’яжучим компонентом деревоволокнистих та деревостружкових плит (ДВП та ДСП).
Із пластмас на основі цих смол виготовляють східці для ескалаторів метро,
електролічильники, вимикачі, корпуси телефонів та інших апаратів, а також
шахи, шашки, доміно тощо.
Фенол є сировиною для виробництва синтетичних волокон –
нейлону та капрону. Також фенол необхідний у виробництві деяких
поверхнево-активних речовин (ПАР). У фармацевтичній
промисловості фенол використовують для синтезу
різноманітних лікарських препаратів, зокрема аспірину. Розбавлені розчини
фенолу (1 – 4 %) використовують як антисептичні та знеболювальні засоби в
лікуванні деяких захворювань та у стоматології («Орасепт», «Фукорцин»). Природоохоронні аспекти застосування фенолу. Фенол дуже отруйний, він належить до високонебезпечних
речовин (2-й клас небезпеки), гранично допустима концентрація (ГДК) фенолу у
воді становить 1• 10-6 г/л,
а смертельна доза для людини – 1 г. У разі вдихання фенол спричиняє порушення
роботи нервової системи, подразнення слизов их
оболонок, хімічні опіки шкіри. Просочуючись крізь навіть неушкоджену шкіру,
фенол уже через кілька хвилин діє на тканини головного мозку і згодом
спричиняє параліч дихального центру. Оскільки фенол
використовують на багатьох різних підприємствах, то він може міститися в
промислових виливах. Тому дуже важливою є проблема охорони природних вод від
потрапляння феноловмісних речовин. Для цього необхідно ретельно контролювати
та очищувати всі промислові води від фенолу. Хоча фенол
отруйний сам по собі, але потрапляння його у водойми є причиною ще більшої
небезпеки. Перед потраплянням у водопровідну мережу воду з відкритих водоймищ
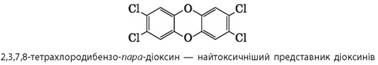
знезаражують хлором. Якщо до водойми потрапив фенол, то із хлором він утворює
набагато токсичніші речовини – хлорофеноли та діоксини, токсичність яких у
100 – 300 разів перевищує токсичність самого фенолу:
3.3. Альдегіди. Карбонові кислоти
Загальна
структурна формула альдегідів:
Для гомологічного ряду насичених альдегідів загальна
молекулярна формула CnH2n+1OСНО (n>0). Також для них
можна вивести загальну емпіричну
формулу CnH2nO (n > 1). Порівняйте загальні емпіричні формули альдегідів (СпН2пО) та
одноатомних спиртів (CnH2n+2O), вони відрізняються на два атоми Гідрогену. Звідси й
пішла назва класу сполук, яку 1835 року дав Ю. Лібіх, альдегіди – скорочення від латинських слів alkohol dehydrogenatus, тобто дегідрогенізований спирт. Внаслідок того, що в молекулах альдегідів на два атоми
Гідрогену менше, ніж у молекулах відповідних
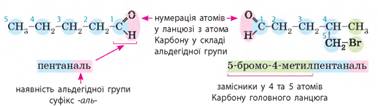
спиртів, у них є подвійний зв’язок. Номенклатура насичених альдегідів. Назви альдегідів складають подібно до назв вуглеводнів
та спиртів:
Але існують певні особливості: • за родоначальну структуру в альдегідів обирають таку,
що містить альдегідну групу; • альдегідна група може утворюватися тільки кінцевим
атомом Карбону, тому її положення вказувати не має сенсу; • альдегідна група є старшою за гідроксильну, тому
карбоновий ланцюг нумерують з атома карбону альдегідної групи, навіть якщо в
ланцюзі є група -ОН, подвійний чи
потрійний зв’язок; • у назвах альдегідів наявність групи -СНО позначають суфіксом -аль-.
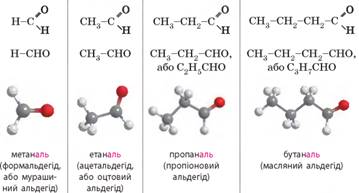
Крім того, багато альдегідів мають традиційні назви. Гомологічний ряд насичених альдегідів. Якщо застосовувати загальну формулу альдегідів СnН2n+1СНО, то в найпростішого альдегіду n дорівнюватиме 0, тобто альдегідна група сполучається
лише з атомом Гідрогену. Отже, перший член гомологічного ряду альдегідів має
формулу НСНО. У наступного члена гомологічного ряду n дорівнюватиме 1, і з альдегідною групою сполучається
метильна група -СН3, і
так далі:
Ізомерія насичених альдегідів. Для альдегідів характерна ізомерія: • карбонового ланцюга; • міжкласова. Наприклад, для альдегіду:
Фізичні властивості альдегідів. Альдегіди – безбарвні речовини з характерним запахом.
Перший член гомологічного ряду альдегідів – метаналь – за звичайних умов
газуватий. Інші альдегіди – рідини, а вищі альдегіди – тверді речовини. Нижчі
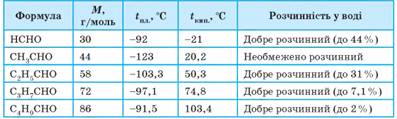
альдегіди досить добре розчиняються у воді, зі збільшенням вуглеводневого
ланцюга розчинність у воді зменшується. Фізичні
властивості альдегідів
Нижчі альдегіди мають різкий запах. Наприклад, запах етаналю подібний до запаху оцтової кислоти. Вищі альдегіди мають приємний
запах, завдяки чому їх використовують у парфумерії (мал. 3.7). Такі фізичні властивості альдегідів зумовлено можливістю утворення
водневого зв’язку: • атоми Гідрогену в молекулах альдегідів не утворюють водневих зв’язків,
тому між молекулами альдегідів водневий зв’язок не утворюється, що зумовлює
нижчі температури кипіння та плавлення порівняно з аналогічними спиртами; • однак за рахунок атомів Оксигену молекули альдегідів утворюють водневі
зв’язки з молекулами води, що зумовлює добру (хоча й меншу порівняно зі
спиртами) розчинність у воді (табл.9).
Мал. 3.7. Коричний альдегід зумовлює
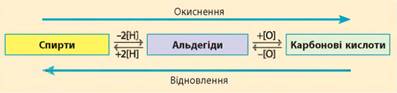
запах кориці Хімічні властивості етаналю. Ю. Лібіх одним із перших почав досліджувати альдегіди
й першим синтезував етаналь. Він вважав альдегіди проміжним продуктом процесу
окиснення етанолу до етанової кислоти. І його позиція не позбавлена сенсу.
Наведена схема ілюструє проміжне положення альдегідів:
Ця схема також відображає
окисно-відновні властивості та методи одержання альдегідів: альдегіди можна
одержати зі спиртів (окисненням) та з карбонових кислот (відновленням). Отже, хімічними властивостями альдегідів є окиснення (до карбонових кислот) та відновлення (до спиртів). 1. Окиснення. Дією різних окисників альдегіди легко окиснюються до карбонових кислот.
Як і у випадку зі спиртами, в рівняннях реакцій простіше замість формули
окисника записувати схематично атом Оксигену. У загальному вигляді:
Для етаналю:
Як окисники
застосовують калій перманганат КМnO4,
калій дихромат К2Сr2О7,
селен (ІV) оксид SeO2,
арґентум (І) оксид Ag2O
(амоніачний розчин), купрум (ІІ) гідроксид Сu(ОН)2. 2.
Відновлення. Під час пропускання суміші випарів
альдегідів з воднем над каталізатором (Ni)
відбувається приєднання молекули водню з розірванням подвійного зв’язку, як в
алкенів. Як результат
реакції утворюються спирти:
На прикладі етаналю:
Попри все це альдегіди – клас сполук з найрізноманітнішими хімічними
властивостями, яких налічується кілька десятків. Дослідженню цих властивостей
присвячені роботи таких видатних учених, як Ш. А. Вюрц, М. Г. Кучеров, Л.
Кляйзен, О. П. Бородін тощо. Методи одержання етаналю 1. Окиснення спиртів. Із цією реакцією ви вже детально ознайомилися під час
вивчення хімічних властивостей спиртів. Тут зазначимо тільки рівняння реакції
окиснення етанолу купрум(ІІ) оксидом:
2. Гідратація етину (реакція Кучерова). Цей метод ви
також уже вивчали як хімічну властивість етину. За наявності солей
Меркурію(ІІ) молекула етину приєднує молекулу води й перетворюється на
вініловий спирт, який одразу перетворюється на етаналь:
Ця реакція є одним із промислових способів добування етаналю.
Загальна структурна формула карбонових кислот:
Органічні кислоти класифікують за основністю. У
неорганічних кислот основність визначається числом атомів гідрогену, які
можна замістити атомами металічних елементів. В органічних кислот так само.
Але в карбонових кислот атомами металічних елементів можна замістити атоми
гідрогену тільки у складі карбоксильної групи. Отже, основність визначається
числом карбоксильних груп у молекулах.
Гомологічний ряд насичених одноосновних карбонових кислот. Загальна формула насичених одноосновних карбонових
кислот:
Загальна емпірична
формула одноосновних карбонових кислот СnН2nO2 (n>1). Порівняйте
загальні емпіричні формули кислот (СnН2nO2) та альдегідів (СnН2nO). Молекули кислот містять на один атом оксигену
більше, ніж відповідні альдегіди, що характеризує їх як продукт окиснення
альдегідів. У найпростішої карбонової кислоти з карбоксильною групою
сполучений тільки атом Гідрогену. Отже, перший член гомологічного ряду кислот
має формулу НСООН і структурну
формулу:
За систематичною номенклатурою назви карбонових кислот
походять від назв алканів із таким самим числом атомів Карбону. Наявність
карбоксильної групи вказують закінченням -ова
кислота. Крім того, багато карбонових кислот мають власні історично
сформовані (традиційні) назви. За назвами кислот формуються й назви кислотних
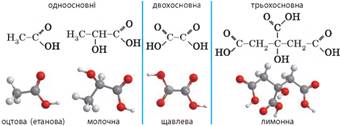
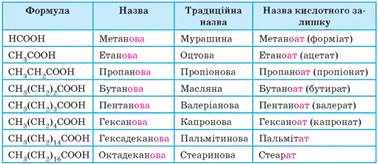
залишків, що використовують для називання солей, утворених цими кислотами. Назви карбонових кислот та їхніх солей
Кислоти із числом атомів карбону більше 12 називають вищими карбоновими кислотами (ВКК). Ізомерія та номенклатура насичених одноосновних карбонових кислот. Як і в альдегідів, карбоксильна група утворюється
тільки кінцевим атомом карбону і розташовується тільки з краю карбонового
ланцюга. Нумерацію атомів Карбону також починають із цієї групи. Для
карбонових кислот характерна ізомерія
карбонового ланцюга. Наприклад, для карбонової кислоти:
Для карбонових кислот характерна міжкласова ізомерія з естерами. Складу СnН2nO2 відповідають два класи сполук з різними
характеристичними групами – карбонові кислоти та естери. Отже,
естери є міжкласовими ізомерами для карбонових кислот:
Фізичні властивості насичених одноосновних карбонових кислот. На відміну від альдегідів, уже перший член ряду –
метанова кислота – є рідиною з досить високою температурою кипіння. Перші
члени ряду – нижчі карбонові кислоти – мають різкий запах: пропіонова має
запах поту, запах масляної кислоти відчувається під час підгоряння їж і на
сковороді, запах інших рідких кислот також неприємний. Карбонові кислоти з
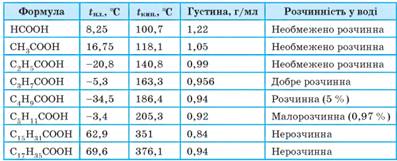
числом атомів Карбону більше 10 – тверді речовини. Фізичні властивості деяких карбонових кислот
На
фізичні властивості карбонових кислот суттєво впливає можливість утворення
водневих зв’язків. Карбоксильна група
утворює їх як атомом Оксигену, так і гідроксильною групою. Тому притягання
молекул карбонових кислот одна до одної та до молекул води набагато сильніше,
ніж у спиртів. Енергія водневих зв’язків у карбонових кислот настільки
велика, що вони утворюються навіть у газоподібному стані (під час
випарювання), і у випарах кислоти існують у вигляді димерів:
Через це в карбонових кислот температури кипіння й
плавлення значно вищі, ніж у відповідних їм спиртів та альдегідів. Поширеність карбонових кислот у природі. Карбонові кислоти дуже поширені в природі. Вони
містяться у складі багатьох овочів, фруктів та інших харчових продуктів. Про
це свідчать традиційні назви кислот: вони вказують на те, звідки ці кислоти
було вперше виділено.
Хімічні властивості карбонових кислот. Хімічні властивості карбонових кислот багато в чому
подібні до властивостей неорганічних кислот. Усі органічні кислоти – слабкі,
а більшість не розчиняються у воді.
Мал. 3.8. Колір індикаторів за наявності
кислот 1. Електролітична дисоціація. Розчинні у воді карбонові кислоти дисоціюють з
утворенням іонів Гідрогену, змінюючи забарвлення індикаторів, як і слабкі
неорганічні кислоти (мал. 3.8). Але під час дисоціації від молекули
карбонових кислот відщеплюється тільки Гідроген карбоксильної групи. Тому
основність органічних кислот не збігається з числом атомів Гідрогену, що
міститься в її молекулі, а дорівнює числу карбоксильних груп. Схема дисоціації карбонових кислот:
Зі збільшенням вуглеводневого залишку
сила карбонових кислот зменшується (ступінь дисоціації знижується). 2. Кислотно-основні реакції. Для карбонових кислот характерні всі загальні хімічні
властивості кислот. Вони реагують:
3.
Реакція естерифікації. Естерифікація
– реакція утворення естерів під час кип’ятіння карбонових кислот зі
спиртами за наявності концентрованої сульфатної кислоти:
Наведені
властивості є лише частиною можливих реакцій для карбонових кислот.
Різноманітні властивості карбонових досліджували багато вчених, зокрема наш
співвітчизник С. М. Реформатський. Реакція галогенування. Карбонові кислоти виявляють певні хімічні властивості
й за участі вуглеводневого залишку, що споріднює їх з алканами. Вони
взаємодіють з хлором та бромом за наявності фосфор(ІІІ) хлориду чи броміду,
до того ж реакція відбувається за атомом Карбону, найближчим до карбоксильної
групи:
Одержання етанової кислоти. Хімічні реакції, у ході яких утворюються кислоти, вам
уже добре відомі. Пригадаємо їх на прикладі етанової кислоти. 1. Витіснення із солей сильнішими кислотами. Сильні неорганічні кислоти (H2SО4, НСl, HNO3) витісняють
карбонові кислоти з їхніх солей:
Якщо реакційну суміш нагрівати, то
етанова кислота, яка більш летка, ніж сульфатна, випаровуватиметься, і її
можна зібрати в окрему посудину (мал. 3.9). Цю реакцію часто використовують як лабораторний метод
добування чистої етанової кислоти.
Мал. 3.9. Добування етанової кислоти в
лабораторії 2. Окиснення спиртів. Під час кип’ятіння етанолу з окисником (концентрована
нітратна кислота або суміш калій перманганату з лугом) спирт окиснюється до
карбонової кислоти:
3. Окиснення альдегідів. Альдегіди досить легко окиснюються звичайними
лабораторними окисниками. У промисловості етанову кислоту добувають з
етаналю, окиснюючи його киснем повітря за наявності манган(ІІ) етаноату:
За цією реакцією
етанова кислота також утворюється в природі під час скисання різних солодких
сумішей (фруктові соки, вино) за наявності рослинних ферментів. 4. Окиснення алканів. У промисловості етанову кислоту можна також добувати
окисненням н-бутану за наявності каталізатора:
Цей метод є
економічно вигідним за умови наявності дешевих нафтопродуктів. В Україні
етанову кислоту для технічних цілей виробляють переважно на Сєвєродонецькому
об’єднанні «Азот» (150 тис.т/рік), а також на
Перечинському лісохімічному комбінаті (Закарпатська обл.). Для харчових цілей
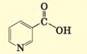
етанову кислоту виробляють на підприємствах ДП «Укрспирт». Мурашину (метанову) кислоту – найпростішу з карбонових кислот – вперше виділив із
залоз лісових мурах Джон Рей 1670 року. Вона міститься також у листках жалкої кропиви. Якщо доторкнутися до листка,
можна «обпектися»: гострі ворсинки, що містять мурашину кислоту,
встромляються в шкіру, спричиняючи її подразнення. У промисловості мурашину
кислоту добувають з карбон(ІІ) оксиду і використовують для фарбування тканин,
обробки (дублення) шкір і консервування кормів. Під час нагрівання мурашиної
кислоти з концентрованою сульфатною кислотою вона розкладається з утворенням
чадного газу:
У такий спосіб у
лабораторії добувають чадний газ. У медицині мурашину кислоту у вигляді 1%-го
розчину в спирті (мурашиний спирт) застосовують як розтирання для лікування
невралгії, міозитів тощо.
Загальна формула:
де R, R1 – будь-які вуглеводневі залишки. Характеристичну групу естерів -СОО- називають естерною.
Естери є міжкласовими ізомерами карбонових кислот,
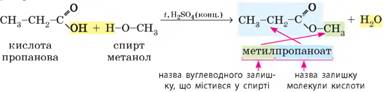
отже, загальна молекулярна формула естерів така сама, як у кислот – СnН2nO2. Ізомерія та номенклатура. Естери утворюються під час реакції естерифікації, що відбувається між
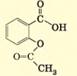
карбоновими кислотами та спиртами. Назви естерів походять від назв кислоти та спирту, з
яких вони утворені:
У назвах естерів часто використовують традиційні назви
кислотних залишків (ацетат, бутират тощо). У нашому випадку метилпропаноат
також можна назвати метилпропіонат. Часто використовують застарілі назви, для
нашого прикладу – метиловий естер пропанової кислоти. Для
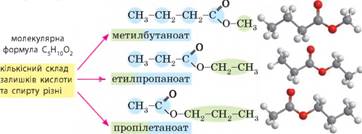
естерів також характерна ізомерія
карбонового ланцюга:
Фізичні властивості естерів зумовлені кількома чинниками: • як і у
вуглеводнів, у молекулах естерів переважають
гідрофобні частини, внаслідок чого вони набагато гірше розчиняються у воді,
ніж кислоти з таким самим складом; • як і альдегіди,
естери можуть утворювати водневі зв’язки за рахунок атома Оксигену в групі С=О, але ці зв’язки не настільки
міцні внаслідок двох вуглеводневих залишків поряд.
Отже,
молекули естерів здебільшого гідрофобні, не утворюють водневих зв’язків між
собою і майже не утворюють їх з молекулами води.
Мал. 3.10. Естери надають запаху багатьом
природним об'єктам
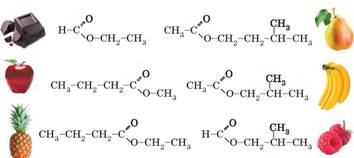
Естери, утворені нижчими карбоновими кислотами: • леткі безбарвні рідини, малорозчинні або практично
нерозчинні у воді; • багато таких естерів мають приємний запах, переважно
фруктовий. Аромат багатьох квітів і плодів зумовлений наявністю саме естерів
(мал. 3.10). Завдяки цьому естери застосовують у харчовій промисловості для
приготування напоїв, цукерок, кондитерських виробів, фруктових есенцій,
парфумів тощо; • добре розчиняють неполярні органічні речовини,
зокрема жири, завдяки чому їх застосовують для знежирення та як розчинники
для лаків, клеїв і фарб (мал. 3.11). Естери, утворені вищими карбоновими кислотами: • нелеткі, безбарвні, воскоподібні, тверді речовини; • нерозчинні у воді, жирні на дотик. Такі естери
містяться у складі бджоли ного воску. Хімічні властивості естерів. Характерною хімічною властивістю естерів є гідроліз – реакція, зворотна до
реакції естерифікації. За наявності каталізаторів естери взаємодіють з водою,
перетворюючись на кислоту і спирт. Залежно від середовища, в якому
відбувається реакція (каталізатора), розрізняють два види гідролізу. 1. Кислотний гідроліз. Відбувається під час кип’ятіння естерів за наявності
розбавленої сульфатної кислоти: •
у загальному вигляді:
•
для метилпропаноату:
Оскільки
сульфатна кислота є також каталізатором зворотної реакції – естерифікації, то
реакція кислотного гідролізу є оборотною, отже, неможливо весь естер
перетворити на продукти реакції. 2. Лужний гідроліз.
Відбувається під час кип’ятіння естерів з розчинами лугів. Оскільки кислоти в лужному середовищі нейтралізуються,
то продуктами реакції є сіль карбонової кислоти та спирт: •
у загальному вигляді:
•
для метилпропаноату:
Лужний гідроліз необоротний, тому що утворюється не
кислота, а її сіль. До того ж, луг не є каталізатором зворотної реакції
(естерифікації). Реакцію лужного гідролізу естерів часто
називають омиленням естерів. Загальна
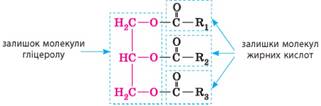
формула жиру:
де R1, R2, R3 – вуглеводневі
залишки у складі жирних кислот; залежно від жиру вони можуть бути однаковими,
а можуть бути й різними. Жирними є одноосновні нерозгалужені карбонові кислоти з числом атомів карбону в
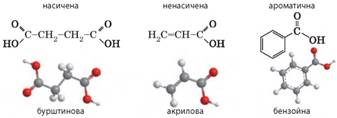
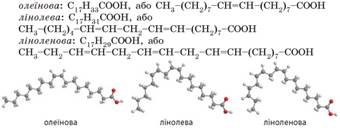
молекулах від 4 до 24. Серед жирних кислот у природних жирах найчастіше
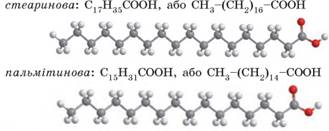
трапляються: • насичені кислоти:
•
ненасичені кислоти:
Скорочено формулу жиру можна записати так: C3H5О3(RCО)3. Наприклад, гліцерол тристеарат – це жир, молекули якого
складаються із залишку молекули гліцеролу і трьох залишків молекул стеаринової
кислоти С17Н35СООН.
У стеаринової кислоти вуглеводневий залишок – це група атомів С17Н35. Отже, у
формулі гліцерол тристеарату R1 = R2 = R3 = С17Н35:
Фізичні властивості та класифікація жирів. Жири –
безбарвні в’язкі рідини або тверді речовини, легші за воду (їхня густина 0,9
– 0,95 г/см3), нерозчинні у воді, але розчинні в багатьох
органічних розчинниках. Агрегатний стан жирів за звичайних умов залежить від
їхнього складу (мал. 3.12). Що більше залишків молекул насичених кислот у
молекулі жиру, то вища його температура плавлення. Тверді жири: • містять переважно залишки молекул насичених кислот; • мають тваринне походження (виняток – кокосове та
какао масло). Рідкі жири: • містять переважно залишки молекул ненасичених кислот;
• мають рослинне походження (виняток – риб’ячий жир). До твердих жирів часто застосовують слово «масло», наприклад
«вершкове масло». Тверді жири – це жири
тваринного походження (яловичий, баранячий, свинячий тощо), за винятком
кокосового та какао масла. До рідких жирів частіше застосовують слово «олія». Рідкі жири – це жири рослинного
походження (лляна, соняшникова, оливкова олії тощо), за винятком риб’ячого
жиру. Хімічні властивості жирів. З одного боку, жири є естерами, отже, для них мають бути характерними
хімічні властивості естерів. З іншого боку, деякі жири містять залишки
молекул ненасичених карбонових кислот, що зумовлює здатність жирів виявляти
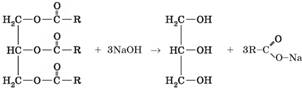
хімічні властивості ненасичених сполук. 1. Лужний гідроліз (омилення). Як і естери, жири під час кип’ятіння з лугами
піддаються гідролізу, як результат утворюються спирт (гліцерол) та солі
жирних кислот:
У
складі більшості жирів містяться залишки молекул жирних кислот із числом
атомів карбону більше 12, а солі таких кислот є милом. Саме тому гідроліз жирів, а також і естерів, у лужному
середовищі називають омиленням. Цю
властивість ж ирів використовують для виробництва мила. 2. Гідрування (гідрогенізація). Якщо у складі жиру містяться залишки молекул
ненасичених кислот, то, як і всі ненасичені сполуки, вони вступають у реакції
приєднання, зокрема приєднання водню (гідрування, або
гідрогенізація жирів):
Оскільки залишки молекул ненасичених кислот трапляються
більше в рідких рослинних жирах, то під час гідрування з рідкого жиру
добувають твердий. Цей процес використовують для добування комбінованих жирів
і маргаринів з рідкої олії (мал. 3.13), а отримані жири називають гідрогенізованими. Наявність залишків
молекул ненасичених кислот в оліях і маслах за тривалого зберігання спричиняє
їх прогіркнення: ненасичені сполуки окиснюються киснем повітря, утворюють
щільну плівку і надають специфічного гіркого присмаку. Біологічне значення жирів. Кількість жиру в організмі залежить від режиму харчування і способу
життя. Якщо з вуглеводами і жирами в організм надходить більше енергії, чим
витрачається, надлишкові жири відкладаються в м’яких тканинах. У разі
недостатнього харчування організм одержує енергію, окиснюючи жири, накопичені
раніше. Частка жирів становить у середньому 10 – 20 % від загальної маси тіла
людини. Надлишкове вживання жирів може спричинити надмірну масу тіла. Для
підлітків рекомендують уживати на добу близько 100 – 110 г жирів (для юнаків)
та 70 – 80 г (для дівчат). Жири – цінне джерело
поліненасичених жирних кислот (із двома чи трьома кратними зв’язками в
молекулах). Наш організм не синтезує такі кислоти (наприклад, лінолеву, ліноленову
тощо), і тому ненасичені жири обов’язково мають бути в нашому раціоні. Функції жирів: – харчова; – запасна; – джерело вітамінів А, Е та D; – структурна; – захисна. Надлишок насичених жирів сприяє розвитку хвороб
серцево-судинної системи. Оптимальним є добовий раціон, що містить 20 – 30 %
рослинних жирів та 70 – 80 % тваринних, до того ж 40 г з яких рекомендують
уживати в натуральному вигляді (переважно вершкове масло), а інші – у складі
страв. Жири дуже енергоємні речовини, під час розщеплення
жирів організмом виділяється набагато більше енергії, ніж від розщеплення
такої самої маси білків чи вуглеводів. Під час окиснення 1 г жиру виділяється
39 кДж (9,3 ккал) енергії. Жири розчиняють деякі вітаміни: A, D, Е тощо. Тому, вживаючи в їжу жири, ми отримуємо необхідні нам вітаміни.
Але зверніть увагу, що під час термічної обробки жирів значна кількість
вітамінів руйнується.
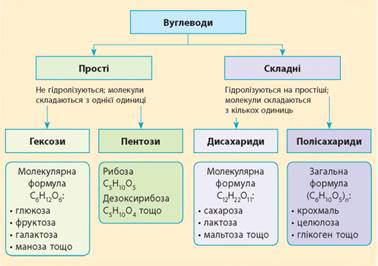
Загальна
формула вуглеводів:
Молекули вуглеводів складаються з певних «одиниць» (мономерів), які
називають сахаридами. За числом
таких одиниць вуглеводи поділяють на прості
та складні. Молекули простих вуглеводів
складаються з однієї одиниці й не гідролізуються на простіші вуглеводи. Складні вуглеводи гідролізуються на
прості, і їх молекули складаються з кількох одиниць: § з
двох одиниць – дисахариди; §
від двох до десяти одиниць – олігосахариди; § більше
десяти одиниць – полісахариди.
Вуглеводи в природі. Вуглеводи – найпоширеніші органічні сполуки в природі.
Вони становлять близько 80 % від сухої маси рослин і 2 – 3 % від сухої маси
тварин. Єдине джерело вуглеводів у
природі – це рослини, саме вони синтезують вуглеводи в процесі фотосинтезу. У
такий спосіб рослини запасають енергію Сонця у вигляді енергії хімічних
зв’язків у сполуках. Функції вуглеводів досить різноманітні, головними серед
яких є: • енергетична
(глюкоза, фруктоза, сахароза, лактоза, крохмаль, глікоген тощо); • структурна
(целобіоза, целюлоза, хітин тощо).
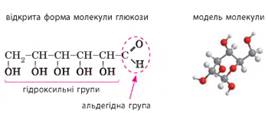
Глюкоза є моносахаридом. Її молекулярна формула С6Н12О6.
Зі
структурної формули відкритої форми бачимо, що глюкоза є біфункціональною
сполукою: у її молекулі наявні характеристичні групи двох класів сполук –
альдегідів та багатоатомних спиртів. Отже, глюкоза є альдегідоспиртом.
• Безбарвна кристалічна речовина; • без запаху; • густина 1,54 г/см3; • tпп=146°С, у разі нагрівання вище за цю температуру починає розкладатися, не
доходячи до кипіння; • добре розчиняється у воді: у 100 г води за 0 °С
розчиняється 32 г глюкози, а за 25 °С – 82 г, погано розчиняється в
органічних розчинниках; • солодка на смак. Хімічні властивості глюкози. Оскільки молекули глюкози містять альдегідну та кілька гідроксильних
груп, то вона має виявляти хімічні властивості і альдегідів, і багатоатомних
спиртів. 1. Якісна реакція на багатоатомні спирти. Для виявлення багатоатомних спиртів у розчинах використовують
реакцію зі свіжодобутим купрум(ІІ) гідроксидом. Оскільки глюкоза є
багатоатомним спиртом, то за її наявності в розчині так само зникає блакитний
осад купрум(ІІ) гідроксиду і розчин набуває темно-синього забарвлення:
Оскільки
за цією реакцією виявляють будь-які розчинні багатоатомні спирти, то
відрізнити один багатоатомний спирт від іншого, а також від моно- та
дисахаридів неможливо. 2. Окиснення. Як і альдегіди,
глюкоза вступає в реакції окиснення. Можна використовувати різні окисники. У
разі використання амоніачного розчину арґентум (І) оксиду виділяється срібло
(реакція срібного дзеркала):
Продукт реакції – глюконова кислота – у молекулах містить карбоксильну групу:
Глюконову кислоту використовують для приготування
поширеного фармацевтичного препарату «Глюконат кальцію», який застосовують
для поповнення Кальцію в організмі в разі його нестачі. Альдегідна група
глюкози також окиснюється купрум (ІІ) гідроксидом, під час реакції з яким
утворюється морквяно-червоний осад купрум (І) оксиду:
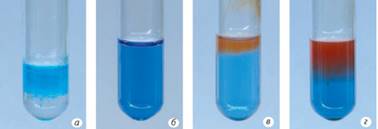
Хоча рівняння цієї реакції таке саме, як і для
альдегідів, але спостереження трохи різняться. Після додавання розчину
глюкози до осаду свіжодобутого купрум (ІІ)
гідроксиду спочатку ми спостерігаємо зникнення осаду та зміну забарвлення
розчину на темно-синє (мал. 3.14а, б) – у цій реакції глюкоза виявляє
властивість багатоатомного спирту. У разі нагрівання спостерігаємо виділення
червоного осаду купрум (І) оксиду внаслідок окиснення глюкози (мал. 3.14 в,
г). Завдяки цій особливості можна відрізнити глюкозу від багатоатомних
спиртів та фруктози й сахарози, оскільки останні в реакцію окиснення не
вступають.
Мал. 3.14. Якісна реакція на глюкозу: а)
свіжоосаджений купрум (ІІ) гідроксид; б) за наявності глюкози осад зникає,
утворюється синьо-фіолетовий розчин; в) виділення жовтого осаду купрум (І)
гідроксиду; г) морквяно-червоний осад купрум (І)
оксиду 3. Відновлення. Для глюкози також характерна реакція відновлення. Водень за наявності
каталізаторів (нікель, паладій) відновлює альдегідну групу до гідроксильної:
Продукт реакції – шестиатомний спирт сорбіт – дуже
цінна речовина, з якої в промисловості добувають аскорбінову кислоту. Також
сорбіт використовують як підсолоджувач. Хоча його солодкість на третину
менша, ніж солодкість сахарози, але він майже не засвоюється організмом, тому
його можна вживати людям із цукровим діабетом. Утім є одне «але»: у дозах понад 50 г він виявляє проносну дію.
4. Бродіння. Бродіння – це біохімічний процес, що
відбувається під дією ферментів, які виділяють живі організми. Залежно від
організмів розрізняють: • спиртове бродіння: одноклітинні гриби дріжджі живляться вуглеводами,
зокрема глюкозою, а продуктами їхнього травлення є етанол та вуглекислий газ:
Цей процес відбувається під час бродіння ягід та
фруктів, його використовують для виготовлення вина. А ефект виділення
вуглекислого газу використовують для приготування пухкого здобного тіста; • молочнокисле бродіння відбувається під час
перероблення вуглеводів молочнокислими бактеріями. Продуктом
цього процесу є молочна кислота:
Ця
реакція відбувається під час скисання молока і є основою виготовлення
різноманітних молочнокислих продуктів – кисляку, йогуртів, сиру, сметани тощо
(мал. 3.15). Молочнокисле бродіння також відбувається під час квашення
силосу, капусти та інших овочів, що запобігає розвитку гнильних бактерій і
сприяє тривалому зберіганню продуктів. Цей процес також відбувається в ротовій порожнині, але це спричиняє
карієс зубів. Глюкоза в природі. Глюкоза – один з основних продуктів обміну речовин у живих організмах. Вона
утворюється в зелених частинах рослин у процесі фотосинтезу, що відбувається
з поглинанням сонячного світла:
У рослинах глюкоза перетворюється на складні вуглеводи
– крохмаль і целюлозу:
У
тваринних організмах відбувається зворотний процес: тварини вдихають кисень,
з їжею отримують глюкозу (та інші складні вуглеводи), а в організмі
відбувається повне окиснення глюкози. Продукт реакції – вуглекислий газ – ми
видихаємо:
Отже,
фактично тварини живуть за рахунок енергії Сонця, а засвоювати її допомагають
рослини, які акумулюють цю енергію у вигляді глюкози. Першим у світі процеси
окиснення глюкози під час клітинного дихання дослідив наш співвітчизник В. О.
Беліцер. Процес фотосинтезу
дуже поширений у природі: щороку рослини синтезують майже 130 млрд тонн
глюкози. Отже, проблеми її штучного синтезу не існує. Але звичайними методами
органічної хімії синтезувати глюкозу та інші вуглеводи також можливо. Уперше
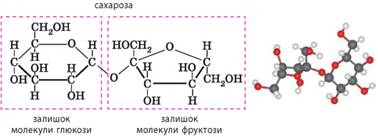
глюкозу з метаналю синтезував Еміль Фішер. Складні вуглеводи: сахароза, крохмаль, целюлоза. Сахароза – дуже поширений дисахарид у природі. Молекулярна формула сахарози С12Н22О11.
У природі трапляється в нектарі квітів, а найбільший її вміст у цукровому
буряку, цукровій тростині та клені. Сахароза – безбарвна кристалічна речовина без запаху, густина 1,59 г/см3,
температура плавлення 186°С. Так само як і глюкоза, під час нагрівання
розкладається. Сахароза солодка на смак і в півтора рази солодша за глюкозу.
Дуже добре розчиняється у воді: в 100 г води за 0 °С розчиняється 179 г
сахарози, а за 100 °С – 487 г. Сахароза є дисахаридом, оскільки молекула сахарози
складається з двох одиниць – залишків молекул двох моносахаридів: глюкози та
фруктози, сполучених між собою:
У природі сахароза утворюється в рослинах сполученням
залишків молекул глюкози та фруктози:
глюкоза + фруктоза ® сахароза + вода Оскільки сахароза є складним вуглеводом, то вона
гідролізується на прості. Під час гідролізу сахарози в кислому середовищі або
під дією ферментів зв’язок між залишками молекул розривається й утворюються
окремі молекули глюкози й фруктози:
Таке перетворення відбувається в організмах бджіл:
збираючи нектар з квіток, вони споживають сахарозу, яка потім гідролізується.
Тому мед – це суміш однакових кількостей глюкози і фруктози, зазвичай з
домішками інших речовин (мал. 3.16). Крохмаль та целюлоза. Найважливішими природними полісахаридами є крохмаль і целюлоза. Обидві речовини є полімерами з однаковою хімічною формулою: [С6Н10О5]п
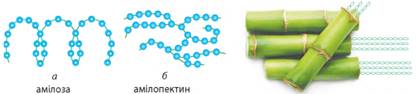
і утворені одним моносахаридом – глюкозою. Відрізняються
вони будовою молекул (мал. 3.17 і 3.18). Порівняння
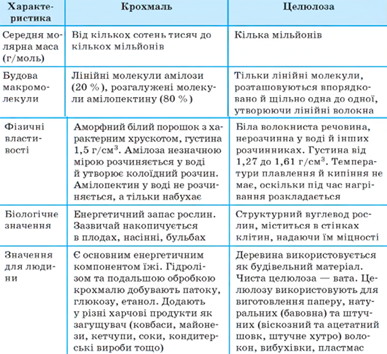
характеристик крохмалю та целюлози
Гідроліз крохмалю та целюлози. Під час тривалого нагрівання з розчином кислоти або під дією ферментів
крохмаль гідролізується і зв’язки між залишками молекул глюкози розриваються.
Гідроліз крохмалю відбувається постадійно. Спочатку молекули крохмалю
розриваються на менші молекули олігосахаридів – декстрини – із числом
залишків молекул глюкози від 10 до 30. Олігосахариди гідролізуються до дисахариду мальтози, яка вже гідролізується до глюкози:
Ця реакція відбувається під час перетравлення харчових
продуктів, що містять крохмаль. Процес починається в ротовій порожнині і
закінчується в кишківнику, де відбувається всмоктування утвореної глюкози в
кров.
Гідроліз крохмалю використовують у промисловості для
виготовлення патоки та добування харчового етилового спирту. Під час
виготовлення патоки гідроліз не доводять до кінця: основним компонентом
патоки є глюкоза, але залишаються домішки декстринів та мальтози. Целюлоза
взаємодіє з водою, піддаючись гідролізу за значно жорсткіших умов порівняно з
крохмалем – за тривалого кип’ятіння з кислотою. Певна річ, продуктом
гідролізу також є глюкоза, але проміжні продукти гідролізу целюлози не мають
особливого значення, тому їх не вказують:
Гідроліз целюлози використовують для добування глюкози,
яку потім піддають спиртовому бродінню. У такий спосіб добувають спирт для
технічних цілей, зокрема як домішку до бензину. Питання для
самоконтролю: 1. Наведіть загальну формулу, що відображає хімічну
будову насичених одноатомних спиртів. 2. Які спирти відносять до одноатомних, а які – до
багатоатомних? 3. Які види ізомерії характерні для спиртів? 4. Охарактеризуйте фізичні властивості спиртів. 5. Наведіть загальні молекулярну та структурну
формули альдегідів. 6. Охарактеризуйте фізичні властивості альдегідів. 7. Охарактеризуйте хімічні властивості та методи
одержання альдегідів на прикладі етаналю. 9. Як утворюються назви карбонових кислот за
систематичною номенклатурою? 10. Охарактеризуйте фізичні властивості насичених
одноосновних карбонових кислот. 11. Де карбонові кислоти трапляються в природі? 12. Охарактеризуйте хімічні властивості насичених
одноосновних карбонових кислот. 13. Охарактеризуйте методи одержання етанової
кислоти. 14. Які речовини відносять до естерів? 15. Охарактеризуйте фізичні та хімічні властивості
естерів. 16. Які речовини відносять до жирів? 17. Що таке жирні кислоти? Які жирні кислоти вам
відомі? 18. Наведіть приклади різних галузей застосування
жирів. 19. Які речовини називають вуглеводами? 20. Охарактеризуйте класифікацію вуглеводів. 21. Охарактеризуйте поширеність вуглеводів у природі,
їх біологічну роль та застосування. 22. Охарактеризуйте фізичні властивості глюкози. 23. Як результат якого процесу в природі утворюється
глюкоза? 24. За якою ознакою сахарозу, крохмаль та целюлозу
відносять до ди- чи полісахаридів? 25. Назвіть та охарактеризуйте проміжні продукти гідролізу крохмалю. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||