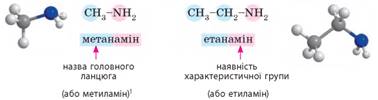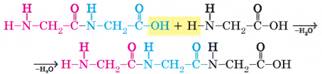|
|
ХІМІЯ Електронний посібник |
||||||||||||||||||||||
|
|
|||||||||||||||||||||||
|
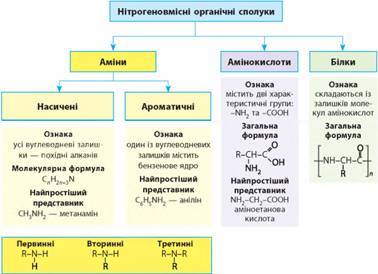
4.1. Насичені й ароматичні аміни. Амінокислоти 4.2. Білки як високомолекулярні
сполуки 4.1. Насичені
й ароматичні аміни. Амінокислоти
Загальна формула цих сполук R-NO2. Їх можна
розглядати як похідні вуглеводнів, які утворюються заміщенням атома водню на
нітрогрупу. За числом нітрогруп розрізняють моно-, ди- і полінітросполуки.
Назви нітросполук утворюють від назв вихідних вуглеводнів з додаванням
префікса нітро. СН3–NO2 (нітрометан) СН3–СН2–СН2NO2–СН–СН3 (3 нітропентан) С6Н5NO2
(нітробензол)
Залежно від вуглеводневого залишки аміни можуть бути насиченими, ненасиченими та ароматичними. За числом атомів Гідрогену, що заміщено на
вуглеводневий залишок у молекулі амоніаку, розрізняють аміни:
де R, R1, R2 та R3 – вуглеводневі залиш ки; вони можуть бути однаковими
або різними. Молекулярна формула всіх насичених амінів однакова
-CnH2n+3N. Уперше існування амінів відкрив 1839 року видатний
французький хімік Ш. Вюрц, а наступного
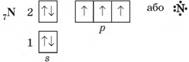
року А. Гофман розробив методи їх синтезу. В атомі нітрогену
на зовнішньому енергетичному рівні п ’ять електронів: одна електронна пара та
три неспарені електрони:
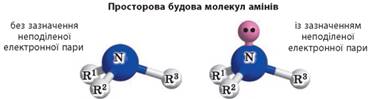
У молекулах амінів
ці три неспарені електрони утворюють три спільні електронні пари з
електронами атомів Гідрогену або вуглеводневого залишку, а одна електронна
пара лишається неподіленою:
Наприклад,
молекула найпростішого аміну має вигляд:
Номенклатура насичених амінів. Складання назв амінів ґрунтується
на тих самих принципах, що і для інших класів сполук, з урахуванням певних
особливостей: ·
як назву родоначальної структури обирають назву алкану, що відповідає
головному ланцюгу; ·
наявність характеристичної групи позначають у назві суфіксом -амін-; ·
у назвах вторинних та
третинних амінів за родоначальну структуру обирають
тільки один (найдовший) ланцюг, інші називають як замісники. Отже, схематична назва амінів:
У навчальній та науковій літературі для
амінів частіше використовують застарілу номенклатуру, за якої вуглеводневі
залишки, що сполучені з атомом нітрогену, називають як замісники (метил, етил
тощо). Первинні
аміни:
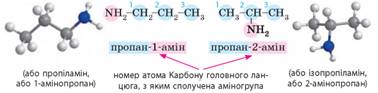
Якщо у
вуглеводневому залишку більше двох атомів карбону, то в назві необхідно
зазначати номер атома КАРБОНУ, з яким сполучена аміногрупа:
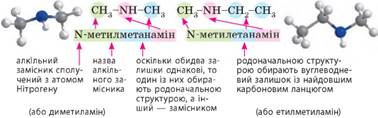
У вторинних та
третинних амінів також необхідно префіксом позначити алкільні замісники, які
сполучені з атомом Нітрогену. До того ж в цьому випадку положення замісника
позначають не цифрою, а літерою N, що означає сполучення замісника не з карбоновим
ланцюгом, а з атомом нітрогену аміногрупи. Вторинні
аміни:
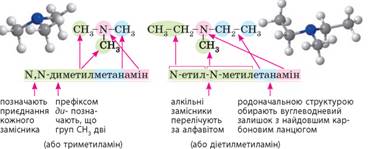
Третинні
аміни:
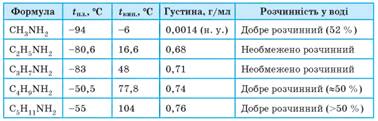
Фізичні
властивості насичених амінів. Аміни –
леткі безбарвні речовини, добре розчинні у воді. Зі збільшенням молярної маси підвищуються температури
кипіння та плавлення, знижується розчинність у воді. Як і амоніак, газуваті
та рідкі аміни мають неприємний запах, отруйні. Тверді аміни запаху не мають.
Фізичні властивості амінів зумовлені наявністю в їхніх молекулах аміногрупи.
Атоми Гідрогену та Нітрогену аміногрупи утворюють водневі зв’язки, але значно
слабші, ніж водневі зв’язки гідроксильної групи -ОН (мал. 4.1). Тому міжмолекулярна взаємодія між молекулами
амінів значно слабша, ніж у відповідних спиртів. Це пояснює менші температури
кипіння та плавлення амінів порівняно з відповідними спиртами. Наприклад, у
метанолу температура кипіння 63 °С, а в метан аміну – -6 °С. Аміни є
вогненебезпечними речовинами, як і багато інших органічних сполук. Фізичні
властивості деяких амінів
Мал. 4.1. Водневі
зв'язки між молекулами амінів (ліворуч) та між
молекулами амінів та води (праворуч) Хімічні властивості насичених
амінів. Хімічні властивості
амінів насамперед зумовлені наявністю в їхніх
молекулах характеристичної групи.
До того ж властивості амінів багато в чому подібні
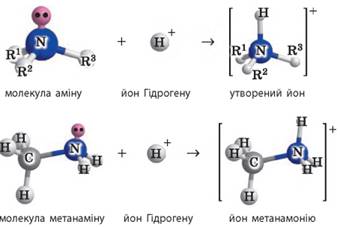
до властивостей амоніаку, який виявляє властивості слабкої основи. 1. Взаємодія з водою. Багато нижчих амінів досить добре розчинні у воді, їхні розчини мають
лужне середовище і змінюють забарвлення індикаторів:
Для метанаміну:
Завдяки неподіленій електронній парі
атом нітрогену утворює ще один ковалентний зв’язок з атомом Гідрогену,
утворюючи іон:
2. Взаємодія з кислотами. Як
слабкі основи, аміни добре взаємодіють із сильними кислотами з утворенням
солей: · у
загальному вигляді:
· для
метанаміну:
Назви солей амінів за номенклатурою утворюють заміною суфікса амін- на суфікс -амоній-. Але в багатьох випадках це занадто складно. Особливо це
стосується амінів природного походження зі складною хімічною будовою. У
такому разі назву солі утворюють додаванням слова «гідрохлорид (у разі солі
хлоридної кислоти), що означає «продукт приєднання гідроген хлориду».
Наприклад, піри- доксин – амін природного походження, більш відомий як вітамін
Bg. Сіль, що утворена його взаємодією з хлоридною
кислотою, називають піридоксин гідрохлоридом. Саме таку назву ви можете
побачити в інструкціях до лікарських препаратів (мал. 4.2). 3. Горіння. Як і більшість органічних речовин, аміни горять на повітрі з утворенням
вуглекислого газу та води. Особливістю горіння амінів є те, що одним із
продуктів реакції є азот, а не оксиди нітрогену: · у
загальному вигляді:
· для
метанаміну:
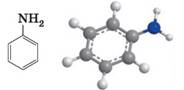
Анілін – найважливіший
серед ароматичних амінів. Його молекулярна формула C6H5NH2. У молекулах аніліну бензенове ядро сполучене з
аміногрупою:
Фізичні
властивості аніліну: ·
безбарвна олієподібна речовина з характерним запахом; ·
на повітрі швидко окиснюється й набуває червоно-бурого забарвлення; ·
обмежено розчинний у воді (3,6 г на 100 мл), добре розчиняється в
органічних розчинниках; ·
трохи важчий за воду, густина 1,022 г/мл; · tпл.= - 6 ,3 °С,
tкип = 184,1 °С; ·
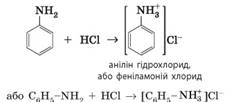
отруйний, у разі потрапляння на шкіру спричиняє хімічні опіки. Хімічні властивості аніліну: 1. Взаємодія з хлоридною кислотою. Як і всі аміни, анілін виявляє основні властивості й
реагує з кислотами:
На відміну від аніліну, його сіль
(анілін гідрохлорид) у воді розчиняється набагато краще й окиснюється
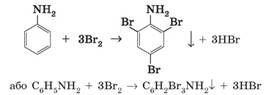
повітрям значно важче. Тому в лабораторіях анілін часто зберігають у вигляді гідрохлориду. 2. Взаємодія з бромом. Анілін за звичайних
умов активно взаємодіє з бромом – заміщуються три атоми Гідрогену в бензеновому ядрі:
Під час реакції
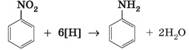
спостерігається утворення білого осаду 2,4,6-три- бромоаніліну. Добування та застосування аніліну. Основний спосіб добування
аніліну – відновлення нітробензену:
Нітробензен для
цього синтезують нітруванням бензену. Для його відновлення можна
використовувати різні відновники. У лабораторній практиці використовують
амоній сульфід, цинк або залізо за наявності хлоридної кислоти. У
промисловості нітробензен відновлюють воднем за високої температури за
наявності каталізаторів:
Першим відновлення нітробензену 1842
року здійснив видатний хімік М. М. Зінін, за що здобув всесвітню славу. У ті часи анілін у великих обсягах
був вкрай необхідний для добування різноманітних штучних барвників,
виробництво яких на той час було дуже затребуваним, але дорогим. Завдяки
відкриттю Зініна 1856 року Вільям Перкін організував промислове виробництво
фіолетового барвника мовеїну. Із часом було налагоджено виробництво дешевих
анілінових барвників з яскравим і різноманітним забарвленням, придатних для
фарбування тканин. В Україні
анілінофарбова промисловість виготовляє барвники для текстильної, взуттєвої
та поліграфічної промисловостей. Підприємства зосереджено поблизу
коксохімічного виробництва. Найбільшим підприємством галузі є «Рубіжанський
барвник». Сьогодні великі обсяги аніліну також витрачають на виробництво
поліуретанів, штучних каучуків та гербіцидів.
Вони містять дві характеристичні групи – карбоксильну й
аміногрупу, тому їхні властивості зумовлені цими двома групами. Загальна формула амінокислот
NH2-R-СООН. Вуглеводневий залишок може бути будь-яким: насиченим,
ненасиченим, ароматичним тощо. Для амінокислот, що є похідними насичених
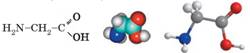
одноосновних карбонових кислот, загальна формула – NH2CnH2nCOOH. Найпростіша амінокислота
– амінооцтова
кислота, або гліцин:
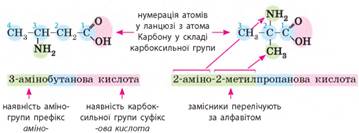
Номенклатура амінокислот. Принцип утворення назв амінокислот
такий самий, як і для карбонових кислот:
Але існують певні
особливості, зумовлені наявністю двох характеристичних груп. Із
них карбоксильна група є старшою, тому: ·
за родоначальну структуру обирають ланцюг, що містить карбоксильну групу;
·
нумерацію атомів головного ланцюга починають з атома Карбону у складі
карбоксильної групи; ·
наявність аміногрупи позначають у назві префіксом аміно-, тобто її
називають, як звичайний замісник.
Фізичні
властивості. Амінокислоти
–
тверді безбарвні кристалічні речовини, добре розчинні у воді й погано – в
органічних розчинниках. Розчинність амінокислот у воді пояснюється можливістю
утворення водневих зв’язків карбоксильною групою (як у карбонових кислот) та аміногрупою (як у амінів).
Деякі амінокислоти солодкі на смак. Водні розчини більшості амінокислот мають
нейтральне середовище. Хімічні властивості амінокислот: 1. Взаємодія з лугами відбувається за участі карбоксильної групи:
Назва солі
утворюється аналогічно назвам солей карбонових кислот. Якщо
кислота аміноетанова, то її сіль називають аміноетаноат. 2. Взаємодія з кислотами відбувається за участі аміногрупи:
Назва цієї солі
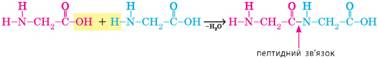
утворюється подібно до назв амінів: аміноетанова кислота гідрохлорид. 3. Утворення поліпептидів. Ди-, три- та поліпептиди утворюються в реакції поліконденсації. За
певних умов група -СООН однієї молекули може реагувати з групою -NH2 іншої молекули,
при цьому відщеплюється молекула води й утворюється продукт, у якому залишки амінокислот
сполучені так званим пептидним
зв’язком:
Продукт цієї реакції називають
дипептидом, наприклад дипептид аміноетанової кислоти. Як і амінокислоти, він
також містить дві різні функціональні групи (-NH2 і -COOH), а отже, може реагувати ще з однією
молекулою амінокислоти, утворюючи трипептид:
Біологічне значення амінокислот. Амінокислоти – це цеглинки, з яких побудовані білки, а
отже, вони є основою життя на нашій планеті. Амінокислоти добувають
гідролізом білків або синтезують із відповідних карбонових кислот. їх
використовують як поживні речовини в медицині та як харчові добавки до
продуктів і сільськогосподарських кормів, щоб готувати коктейлі для
спортивного харчування. Добування амінокислот. Амінокислоти добувають подібно до амінів: із
хлоропохідних карбонових кислот нагріванням їх з амоніаком:
4.2. Білки як високомолекулярні сполуки
Білки є полімерами, мономерами яких є амінокислоти. Зазвичай білки
містять 100 і більше залишків молекул амінокислот. Більшість білків людського
організму містять кілька сотень амінокислотних залишків. Отже, молекулярна
маса білків коливається від декількох тисяч до декількох мільйонів. За складом білки поділяють на протеїни
– прості білки, що складаються із залишків молекул амінокислот, і протеїди – складні білки, що
складаються із залишків молекул амінокислот і різних небілкових речовин,
зокрема іонів металічних елементів. Хімічні властивості
білків: 1. Денатурація білків. Під дією різних чинників білки можуть
розкладатися, втрачаючи свою специфічну просторову будову. Руйнування
просторової структури білка зі збереженням його первинної структури називають
денатурацією. Вона відбувається під
час нагрівання, зміни кислотності середовища, дії випромінювання або розчинів
солей важких металічних елементів та органічних розчинників. Прикладами денатурації
є згортання яєчних білків під час варіння яєць або ущільнення білків молока
під час скисання. 2. Гідроліз білків. Інша хімічна властивість білків – здатність до
гідролізу в кислому або лужному середовищі. Під час гідролізу розриваються
пептидні зв’язки і відбувається розщеплення поліпептидного ланцюга. Повний
гідроліз до окремих амінокислот відбувається під час тривалого нагрівання
білків з концентрованою хлоридною кислотою:
Після потрапляння
білкових речовин у шлунок під дією хлоридної кислоти і ферменту пепсину
відбувається їх гідроліз. Організм людини засвоює білкові речовини тільки у
вигляді суміші амінокислот.
3. Кольорові реакції білків. Для виявлення
білків або окремих амінокислот у їхньому складі використовують спеціальні якісні реакції, які називають кольоровими реакціями білків. Так, у разі дії на слаболужний розчин білка розчину купрум (ІІ) сульфату розчин набуває фіолетово-синього забарвлення, що зумовлене зв’язуванням іонів Купруму Си2+
поліпептидами (мал. 4.3). Цю
реакцію називають біуретовою, вона є універсальною для всіх білків, оскільки виявляє наявність пептидних зв’язків. За допомогою ксантопротеїнової реакції можна виявити
ароматичні амінокислоти у
складі білків, наприклад тирозин, триптофан, фенілаланін
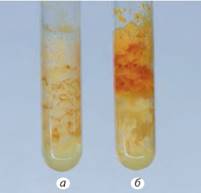
тощо. Для проведення цієї реакції на білок або його
розчин діють концентрованою нітратною кислотою. За наявності залишків
ароматичних амінокислот білок забарвлюється у жовтий колір (мал. 4.4а). Після
додавання в реакційну суміш розчину амоніаку колір білка поглиблюється і стає
жовтогарячим (мал. 4.4б). Біологічне значення білків. Усі без винятку хімічні реакції в організмі відбуваються за наявності спеціальних каталізаторів
– ферментів (або ензимів),
що являють собою білкові молекули. Вони прискорюють реакції в мільйони разів, до
того ж кожну реакцію каталізує певний фермент. Деякі білки виконують транспортну
функцію – переносять молекули або іони в місця синтезу або накопичення
речовин. Наприклад, білок гемоглобін у складі еритроцитів переносить кисень
до тканин і вуглекислий газ від них, а білок міоглобін запасає кисень у
м’язах. Білки – це будівельний матеріал
клітин, із них побудовані тканини організму. Білки-рецептори сприймають і
передають сигнали, що надходять від сусідніх клітин або з навколишнього
середовища. Наприклад, дію світла на сітківку ока сприймає білок родопсин. Білки життєво необхідні будь-якому організму і тому є найважливішою
складовою частиною харчових продуктів. У процесі травлення вони
гідролізуються до амінокислот, що є сировиною для синтезу інших білків,
необхідних організму. Питання для самоконтролю 1. Які речовини називають
амінами? Наведіть приклади. 2. За якими ознаками
класифікують аміни? 3. Які особливості складання
назв амінів? 4. Запишіть молекулярну,
розгорнуту та скорочену структурні формули аніліну. 5. Охарактеризуйте хімічні
властивості аніліну. 6. Які сполуки є
амінокислотами? 7. Які особливості складання
назв амінокислот у порівнянні з карбоновими кислотами? 8. Охарактеризуйте фізичні
властивості та поширеність амінокислот. 9. Охарактеризуйте хімічні
властивості амінокислот. 10. Який зв'язок
називають пептидним? 12. За яких умов
відбувається денатурація та гідроліз білків? 13. Охарактеризуйте біологічну
роль білків. 14. Які реакції називають кольоровими та для чого їх
застосовують? |
|||||||||||||||||||||||