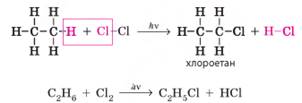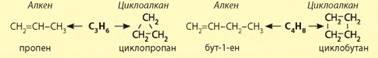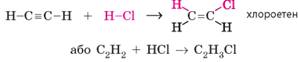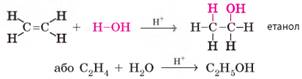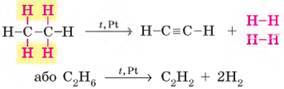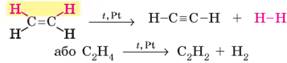|
|
ХІМІЯ Електронний посібник |
||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||
|
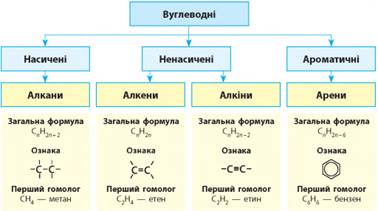
2.1 Класифікація вуглеводнів. Алкани 2.3. Арени.
Методи одержання та застосування вуглеводнів 2.1. Класифікація вуглеводнів. Алкани
Як
ви пам’ятаєте, існування ізомерів серед алканів передбачав ще О. М. Бутлеров.
Зі всіх різновидів структурної ізомерії для алканів характерна тільки
ізомерія карбонового ланцюга. Цей вид ізомерії пов’язаний лише з тим, що
атоми Карбону можуть по-різному сполучатися один з одним: утворювати
карбонові ланцюги розгалужені чи нерозгалужені (нормальної будови).
Перші три представники гомологічного ряду алканів –
метан, етан, пропан – не мають ізомерів. Хоча іноді пропану
приписують дві ізомерні структури:
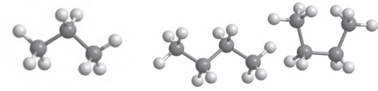
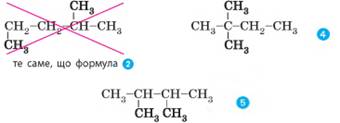
Мал. 2.1. Модель молекули пропану Мал. 2.2. Різні форми молекули бутану Але обидві ці структурні формули однакові й
відображають будову однієї молекули – молекули пропану (мал. 2.1). Як ви пам’ятаєте, хімічні зв’язки від атома карбону в
молекулах алканів спрямовані до вершин тетраедра під кутом 109,5°. Але на
папері зв’язки в структурних формулах для зручності зазначають під кутом 180°
або 90°. Наприклад, для бутану наведені нижче формули є абсолютно однаковими,
оскільки в усіх них порядок сполучення атомів Карбону однаковий (мал. 2.2).
Бутан є найпростішим алканом, у якого є ізомер. Так, зі
складом С4Н10 існують дві речовини з різними
структурними формулами:
Це дві різні речовини з різними властивостями. Що більше атомів Карбону в ланцюзі, то більше може існувати можливих
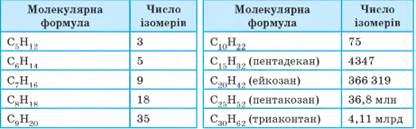
комбінацій сполучення атомів, а отже, і більше ізомерів. Число структурних ізомерів алканів
Складаючи
всі можливі структурні формули ізомерів, необхідно враховувати всі можливі
комбінації сполучення атомів. Пам’ятайте, що до одного атома Карбону в ланцюзі можуть
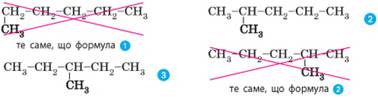
приєднуватися максимум чотири інші атоми. Наприклад, складемо формули всіх можливих структурних
ізомерів алканів з молекулярною формулою С6Н14.
Найпростіше
скласти структурну формулу нерозгалуженого алкану:
На наступному етапі з ланцюга прибираємо один атом
Карбону і з’єднуємо його з іншими атомами карбону:
Далі
змінюємо положення ще одного атома Карбону й отримуємо ще дві комбінації:
У такий спосіб можна скласти всі можливі комбінації
сполучення атомів Карбону. Структурні формули можна записувати в інший
спосіб. Наприклад, формули
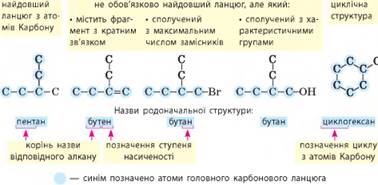
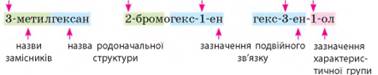
Систематична номенклатура. Дуже важливо, щоб кожна хімічна речовина мала своє власне «ім’я». Із
цією метою хіміки розробили спеціальну систему правил – номенклатуру. Ці правила називають систематичною номенклатурою, їх розробило товариство IUРАС (українською
«юпак») і ними користуються хіміки всього світу (мал. 2.3). Поряд із
систематичними назвами сполук часто використовують і традиційні назви – такі,
що склалися історично. Згідно із систематичною номенклатурою назви всіх
органічних сполук складають за однаковою загальною схемою:
Родоначальна структура – це частина молекули, що містить головний карбоновий ланцюг.
Головним ланцюгом зазвичай є:
Назву родоначальної структури утворюють від назви
відповідного алкану та суфікса, що позначає ступінь насиченості. 1. Префікс. У більшості
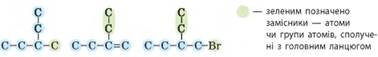
сполук з головним ланцюгом сполучені певні атоми чи групи атомів (атоми
Гідрогену не враховують). Ці атоми та групи атомів називають замісниками, оскільки, щоб приєднатися до головного ланцюга, вони замістили в ньому
атом Гідрогену.
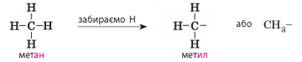
У префіксах перелічують назви замісників. Якщо замісник складається з
одного атома, то його називають за назвою хімічного елемента (Хлор, Бром
тощо). Назви замісників, утворених з алканів, утворюються від назв
відповідних їм алканів заміною суфікса -ан- на суфікс -іл-
(-ил-):
Разом із назвою замісника зазначають локант – цифру, що позначає номер атома Карбону головного ланцюга, з яким
сполучений замісник. Локантами також зазначають положення кратного зв’язку та
характеристичної групи:
2. Суфікс. Суфіксом зазвичай
позначають наявність характеристичних
груп. Ви вже знаєте, що в назвах спиртів до назв родоначальної структури
додають суфікс -ол-, яким позначають наявність групи -ОН.
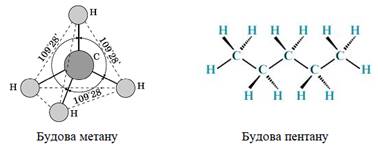
Будова алканів. Кожен атом карбону в алканах перебуває в стані sp3-гібридизації й утворює чотири σ-зв’язки С-С
або С-Н, кути між якими дорівнюють
109,5°. Завдяки такій орієнтації зв’язки від одного атома Карбону в алканах
спрямовані до вершин тетраедра. Довжина зв’язку С-С в алканах дорівнює 0,154 нм, енергія зв’язку – 354 кДж/моль.
Атом
Карбону утворює σ-зв’язок через перекривання гібридних орбіталей (sр3-, sр2- або sр-атомних
орбіталей) з гібридними орбіталями іншого атома Карбону або будь-якими
орбіталями атомів інших елементів. Перекривання здійснюється таким чином, що область максимальної
електронної густини зосереджується в просторі між ядрами на прямій, що
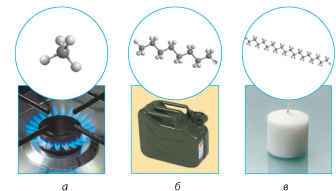
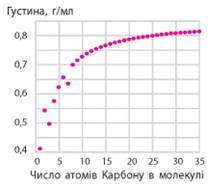
з’єднує центри атомів. Таке перекривання виявляється найбільш ефективним, а α-зв’язки, які при цьому виникають, – найбільш міцними. Фізичні властивості алканів. За звичайних умов перші чотири члени гомологічного ряду метану (від СН4 до С4Н10)
– гази, наступні (від С5Н12
до С16Н34) – рідини, сполуки з більшим числом
атомів Карбону – тверді речовини (мал. 2.4). Це пояснюється тим, що зі
збільшенням довжини карбонового ланцюга збільшується молекулярна маса
речовин, відповідно, збільшується й кількість енергії, необхідна для
плавлення або випаровування речовин.
Мал. 2.4. Залежність фізичних
властивостей алканів від довжини карбонового ланцюга: а) газ; б) рідина; в) тверда речовина Отже, для будь-якого гомологічного ряду справедливим є
твердження, що зі збільшенням числа атомів Карбону в молекулі підвищуються
температури плавлення й кипіння речовин (мал. 2.5).
Газуваті та рідкі алкани – безбарвні речовини, а тверді
алкани – білого кольору (парафін). Рідкі алкани мають специфічні вуглеводневі
або квіткові запахи. Усі алкани – неполярні сполуки, тому вони майже
нерозчинні у воді, а тверді – жирні на дотик алкани належать до аліфатичних
сполук (від грец. aleiphar – жир).
Рідкі алкани легші за воду (мал. 2.6), у разі змішування з водою суміш
розшаровується. Оскільки алкани є неполярними речовинами, вони добре
змішуються один з одним і розчиняють інші неполярні сполуки, тому алкани та
їхні суміші часто використовують як органічні розчинники. Хімічні властивості алканів. Алкани є хімічно неактивними речовинами, завдяки чому до початку XX ст. для них не було відомо жодної хімічної реакції,
окрім горіння, тому алкани отримали назву парафіни
(від латин, раrum – мало, незначно та affinis – споріднений). Алкани – насичені
вуглеводні, тому вступають у реакції заміщення та розкладання. 1. Горіння. У 9 класі ви вже
вивчали реакцію горіння метану та його гомологів. Нижчі алкани займаються
легко (іноді з вибухом) і згоряють блідо-синім полум’ям з утворенням
вуглекислого газу та води: СН4 + 2O2 ® СO2 + 2Н2O Вищі алкани на повітрі згоряють кіптявим полум’ям,
оскільки відбувається неповне окиснення та виділяється не тільки вуглекислий
газ, а й чадний газ і вуглець (сажа): 2С8Н18 + 17O2 ® 16СО + 18Н2O, або 2С8Н18
+ 9O2 ® 16С + 18Н2O (за нестачі кисню) Утім за умови
достатньої кількості кисню можливе повне згоряння: 2С8Н18
+ 25O2 ® 16СO2 + 18Н2O (за достатньої кількості кисню) Вищі алкани настільки важко займаються, що, наприклад,
парафін сам по собі підпалити дуже складно. Тому з парафіну виготовляють свічки,
у середину яких вставляють ґніт. Завдяки горінню ґнота парафін легше
плавиться й випаровується, а отже, легше займається. На холоді вищі алкани
майже не випаровуються, тому їх важко підпалити. Наприклад, звичайний гас
(або дизельне пальне) на сильному морозі не спалахує, навіть якщо в посудину
кинути запалений сірник. Щоб запалити гас, його необхідно заздалегідь
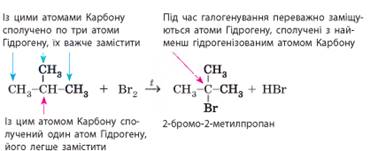
підігріти. 2. Галогенування – це взаємодія речовин з галогенами (із хлором або
бромом). Галогенування алканів відбувається за умов освітлення чи нагрівання.
Під час цієї реакції відбувається заміщення атомів Гідрогену на атоми
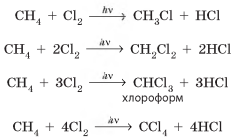
галогену. Метан з галогенами може реагувати з утворенням різних
речовин залежно від співвідношення кількостей метану та галогену:
Подібно до метану
з галогенами взаємодіють й інші алкани:
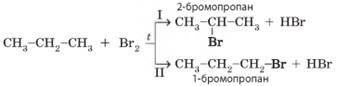
Під час бромування
пропану можуть утворитися два ізомерні продукти:
У
реакціях галогенування алканів можна виявити закономірність: що менше атомів
Гідрогену сполучено з певним атомом Карбону, то легше ці атоми Гідрогену
замістити на інший, зокрема атом галогену. Наприклад, під час галогенування
2-метилпропану:
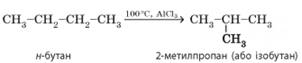
3. Ізомеризація. Алкани нормальної
будови під час нагрівання за наявності каталізатора перетворюються на
розгалужені алкани. Наприклад, для бутану:
Ця властивість є яскравим прикладом органічних реакцій,
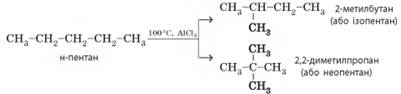
у яких утворюється багато побічних продуктів. У н-пентану тільки два
структурні ізомери й два продукти реакції в кінцевій суміші:
Ізомеризацію використовують тільки в промислових масштабах
для підвищення октанового числа бензину (цей процес називають риформінгом). У цьому процесі головне
– позбутися нерозгалужених алканів, оскільки їх наявність суттєво знижує
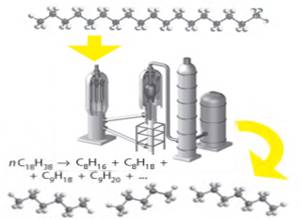
якість бензину. 4. Термічний розклад (крекінг). Під час крекінгу (від англ. to crack – розщеплювати,
ламати) відбувається розщеплення карбонових ланцюгів, завдяки чому з вищих
алканів утворюються алкани з коротшим ланцюгом. На цій хімічній властивості
алканів ґрунтується один зі способів переробки нафти. Оскільки сира нафта
містить значну кількість вищих алканів, а в бензині містяться алкани з
довжиною ланцюга переважно 5 – 10 атомів, то крекінг сприяє збільшенню виходу
бензину під час переробки нафти (крекінг-бензин). Крекінг проводять зазвичай за температури 500 °С за
наявності спеціальних каталізаторів (суміш алюмосилікатів з оксидами
металічних елементів). Під час крекінгу карбоновий ланцюг може розірватися в
будь-якому місці, тому в продуктах реакції міститься суміш багатьох сполук.
Але загальне правило: з насичених вуглеводнів утворюється суміш легших
насичених і ненасичених вуглеводнів (мал. 2.7). Наприклад,
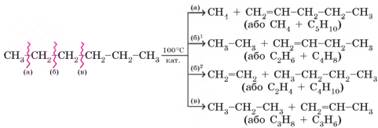
під час крекінгу гексану можливі такі реакції:
Мал. 2.7. Під час крекінгу відбувається розривання карбонових
ланцюгів вуглеводнів
У загальному вигляді рівняння крекінгу алканів можна
описати так:
У разі нагрівання нафти до 700 – 900 °С у продуктах
реакції переважають нижчі алкани, наприклад:
У суміші залишаються тільки найпростіші вуглеводні,
переважно ненасичені. Основоположником сучасних методів переробки нафти є
видатний хімік В. М. Іпатьєв. Застосування. Насичені вуглеводні широко використовують в органічному синтезі. З них
добувають багато органічних речовин: ненасичені вуглеводні, хлорпохідні,
органічні кислоти. Багато вуглеводнів входить до складу різних видів палива:
горючого газу, бензину, гасу. З вищих алканів виготовляють такі речовини, як
парафін і вазелін, мастила, електроізолятори. Вищі алкани є сировиною для
добування синтетичних миючих засобів. 2.2. Алкени
і алкіни
З ненасичених
вуглеводнів вам уже відомі етен та етин. Ще 1862 року Еміль Ерленмейер висловив
ідею про те, що в молекулі етену наявний подвійний зв’язок між атомами
Карбону, а в молекулі етину – потрійний. Після становлення теорії валентного
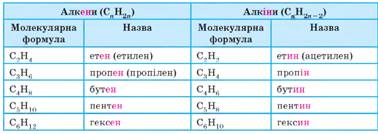
зв’язку в наступному столітті цю ідею блискуче підтверджено. Етен та етин – найпростіші ненасичені вуглеводні, вони є
першими представниками двох гомологічних рядів – алкенів і алкінів.
У молекулі етину
наявний потрійний зв’язок С=С, який у назві за номенклатурою IUPAC
позначають суфіксом -ин- (-ін-).
Назви алкенів та
алкінів складати дуже легко. Назви цих вуглеводнів походять від назв
відповідних алканів заміною суфіксу -ан-
на суфікс -єн- (-єн-) для алкенів
та на суфікс -ин- (-ін-) для алкінів. Гомологічні
ряди алкенів і алкінів
Структурні формули алкенів та алкінів
складають так само, як і алканів, але під час складання карбонового ланцюга
слід зазначити подвійний (потрійний) зв’язок, а також
ураховувати його під час додавання атомів Гідрогену. Розгляньмо
складання структурних формул на прикладі пропену та пропіну. 1. Зображуємо
карбоновий ланцюг: для обох сполук він складається з трьох атомів
Карбону. Позначаємо кратні зв’язки
(між будь-якими атомами карбону, якщо не вказано його положення):
2. Від кожного атома Карбону зображуємо риски хімічних
зв’язків так, щоб у кожного атома їх було по чотири:
3.
Дописуємо атоми Гідрогену:
Скорочені структурні формули та моделі молекул,
відповідно, виглядатимуть так:
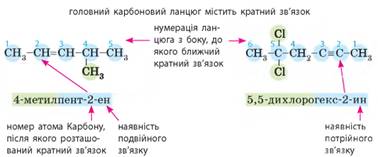
Ізомерія та номенклатура. Для алкенів та алкінів характерна структурна ізомерія,
а саме ізомерія карбонового ланцюга.
Разом із цим для них також характерний ще один вид ізомерії – ізомерія положення кратного зв’язку, що
обов’язково відображають у назвах сполук. Принцип складання назв алкінів та їхніх похідних має
певні особливості:
Для алкенів
характерний ще один вид структурної ізомерії – міжкласова ізомерія. Цей різновид ізомерії характерний тим, що
два ізомери належать до різних класів органічних сполук. Для алкенів
характерна міжкласова ізомерія з циклоалканами, тобто з формулою СnН2n. може існувати
алкен та циклоалкан. Наприклад:
Хімічні властивості. Для алкенів та алкінів характерними є реакції
приєднання: • водню – гідрогенізація; • галогеноводнів (HF, НСl, НВr, НІ) –
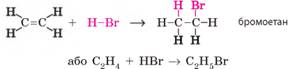
гідрогенгалогенування; • води – гідратація. 1. Гідрогенгалогенування.
Процес приєднання молекул галогеноводнів (HF, НСl, НВr, НІ) називають гідрогенгалогенуванням. Реакція
відбувається так само, як і приєднання водню або галогенів: кратний зв’язок
між атомами Карбону розривається (перетворюється на одинарний), а за місцем
розриву зв’язку приєднуються атоми Гідрогену й галогену. Для етену:
Етин у цю реакцію вступає в один або два етапи залежно від співвідношення
реагентів. У разі співвідношення 1:1 одна молекула етину приєднує одну молекулу
галогеноводню, і реакція відбувається в один етап:
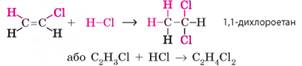
Якщо хлороводню у
два рази більше за етин, то на другому етапі до утвореного хлороетену
приєднується ще одна молекула галогеноводню:
Сумарне рівняння: С2Н2 + 2НСl ® С2Н4Сl2 Реакція
гідрогенгалогенування відбувається за звичайних умов і лише з хлороводнем –
за незначного нагрівання. 2. Гідратація. Процес приєднання молекули води називають гідратацією. Якщо
попередні властивості етену й етину принципово не відрізнялися, то гідратація
цих сполук відбувається по-різному. Гідратація етену відбувається під час пропускання його крізь розчин кислот (сульфатної чи
ортофосфатної). При цьому до одного атома Карбону приєднується атом
Гідрогену, а до іншого – група -ОН.
Продуктом реакції є спирт:
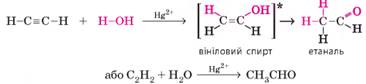
Гідратація етину (реакція Кучерова) відбувається за наявності солей Меркурію(ІІ).
Спочатку утворюється нестійкий ненасичений спирт (вініловий спирт, його
нестійкість позначено квадратними дужками із зірочкою), який одразу
перетворюється на етаналь (оцтовий альдегід):
Цю реакцію відкрив
та детально дослідив М. Г. Кучеров, тому її називають його ім’ям.
Неможливість існування ненасичених
спиртів, у яких група -ОН приєднана до карбонового ланцюга поряд із подвійним
зв’язком, довів український учений О. П. Ельтеков і сформулював правило, що
назване його ім’ям. 3. Часткове окиснення. Під частковим окисненням часто
розуміють неповне згоряння. І етен, і етин за умови нестачі кисню згоряють
кіптявим полум’ям унаслідок утворення вуглецю:
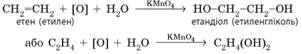
Часткове окиснення етену відбувається
під час пропускання етену крізь розчин
калій перманганату з утворенням
етиленгліколю (реакція
Вагнера):
В органічній хімії
у схемах реакцій окиснення часто не пишуть хімічну формулу окисника, а
замінюють її символом [О]. Тим
самим позначають процес додавання атомів Оксигену. В іншому випадку в
рівняннях реакцій було б досить складно добирати коефіцієнти. Під час реакції
відбувається знебарвлення розчину калій перманганату, тому цю реакцію разом
зі знебарвленням бромної води використовують як якісну для виявлення
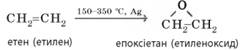
ненасичених сполук. Промислове
значення має часткове окиснення етену киснем за наявності срібла як
каталізатора. Продуктом є цінна для промисловості речовина – етиленоксид, що
є сировиною для добування етиленгліколю та поліетиленгліколю.
2.3. Арени. Методи одержання та застосування
вуглеводнів Ароматичними є сполуки, молекули яких містять бензенове ядро – цикл із шести атомів
карбону з особливим типом зв’язку між ними (ароматичним зв’язком). Ця назва
склалася історично, тому що перші відомі речовини цього класу мали приємний
запах. Найпростіший ароматичний вуглеводень – бензен (часто також
використовують назву «бензол»). Це перший представник гомологічного ряду ароматичних вуглеводнів – аренів. Загальна
формула аренів СnН2n-6 (n³6). Молекула бензену
утворена шістьма атомами Карбону (бензенове ядро), що у просторі розташовані
в кутах правильного шестикутника. Кожний атом Карбону сполучений з одним
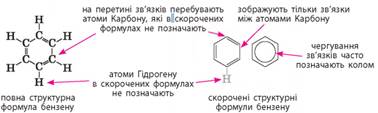
атомом Гідрогену. Молекулярна формула бензену С6Н6. Структурну
будову молекули бензену зображують по-різному:
Будову молекули
бензену запропонував німецький хімік Ф. Кекуле 1865 року, як і термін «ароматичні сполуки». Ароматичний зв’язок
у молекулі бензену зображують за допомогою одинарних та подвійних зв’язків,
що чергуються, або кола всередні шестичленного карбонового цикла. Інші
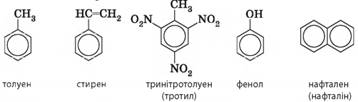
сполуки, що містять фрагмент молекули бензену, також називають ароматичними,
наприклад:
Нафталін. Напевно, ви бачили вдома невеличку комаху – міль. Самі по собі ці комахи
не шкідливі, але їхні гусениці є шкідниками. Існують різні види молі, які
можуть пошкодити і хутряну шубу, і вовняний одяг, і меблі, і крупи. Першим
хімічним засобом захисту від молі (інсектицидом) була ароматична сполука
нафтален (або нафталін). Нафтален за звичайних умов є твердою речовиною, але
він дуже леткий і має специфічний запах. Він є отрутою для молі, тому ним
прошаровували одяг у шафах. За тривалого зберігання речі набували
нафталенового запаху, звідки пішов вираз «пахне нафталіном» для позначення дуже
старих речей. Фізичні властивості бензену • безбарвна рідина
зі специфічним «солодкуватим» запахом; • tпл = 5,5°С, tкип = 80,1°С, r = 0,88 г/см3; • не розчиняється
у воді (0,08 г у 100 г води), добре розчиняється в органічних розчинниках і
сам є добрим розчинником для багатьох органічних речовин; • токсичний:
вдихання випарів бензену спричиняє головний біль і запаморочення, за високих
концентрацій бензену в повітрі можна знепритомніти. Випари бензену
подразнюють очі й слизові оболонки; • канцерогенний:
підвищує ймовірність виникнення злоякісних пухлин, є ксенобіотиком –
речовиною, що чужорідна для живих організмів. Хімічні властивості бензену 1. Горіння. Як і всі вуглеводні, бензен добре горить. У надлишку кисню він згоряє безбарвним
полум’ям з утворенням вуглекислого газу і води: 2С6Н6 + 15О2 ® 12СО2 + 6Н2О Але здебільшого
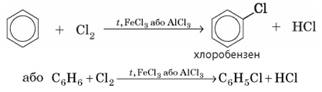
бензен горить кіптявим полум’ям (мал. 2.8). 2. Галогенування. Хоча бензен не є насиченим вуглеводнем, але завдяки ароматичному зв’язку
він є хімічно дуже малоактивною речовиною і вступає переважно в реакції
заміщення як насичені вуглеводні. Бензен взаємодіє з галогенами (Сl2 та Вr2) за наявності
каталізаторів (галогенідів Алюмінію чи Феруму(ІІІ)). При цьому заміщується
один атом Гідрогену при будь-якому атомі Карбону:
Для реакції бензену з хлором
використовують хлориди Алюмінію чи Феруму(ІІІ), а для реакції з бромом –
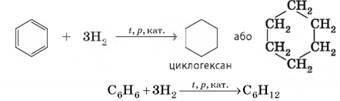
броміди. 3. Гідрування. Незважаючи на те що для бензену більш характерні реакції заміщення, він
вступає в реакції приєднання. Зокрема, він приєднує водень за умов сильного
нагрівання, високого тиску й наявності каталізаторів (Ni, Pd або Pt). Продуктом реакції гідрування бензену є
циклічний вуглеводень циклогексан:
За тривалого
нагрівання продуктом цієї реакції є к-гексан:
Реакція
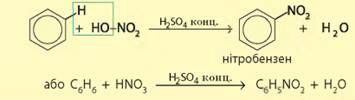
нітрування. Дуже важливою для промисловості є
хімічна властивість бензену та інших аренів взаємодіяти з нітратною кислотою.
Це перша стадія в технології виробництва вибухових речовин і штучних
анілінових барвників. Під час нагрівання
бензену з концентрованою нітратною кислотою у суміші з концентрованою
сульфатною (цю суміш називають нітрувальною) відбувається заміщення атома
Гідрогену нітрогрупою -NО2.
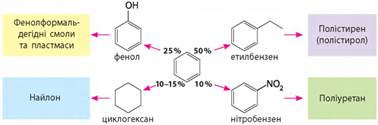
Застосування бензену. Чистий бензен використовують мало, переважно як
органічний розчинник. Але бензен є найважливішою сировиною для хімічної
промисловості, оскільки на його основі добувають багато похідних, що мають
широке застосування. Бензен – сировина для
виробництва ліків, барвників, полімерів, пестицидів, інсектицидів тощо (мал.
2.9). Продукти нітрування бензену і його похідних використовують для
виготовлення вибухівки. Продукти його взаємодії із сульфатною кислотою є
основою для виготовлення синтетичних мийних засобів.
Мал. 2.9. Основні напрями переробки
бензену Методи одержання вуглеводнів. Взаємозв'язок між вуглеводнями Одержання алканів. Алкани є досить поширеними в природі сполуками. З алканів
переважно складаються природний газ та нафта, тому алкани зазвичай виділяють
з відповідних природних копалин. Але одержати алкани можна також як результат
хімічних реакцій. Ізомеризація та крекінг – хімічні властивості алканів. Але під час цих процесів із одних алканів
утворюються інші, отже, вони також є методами добування алканів. Це
характерна особливість органічної хімії: хімічні властивості речовин одного
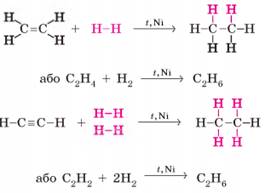
класу сполук є методом добування речовин іншого класу. Ще один метод одержання алканів – гідрування (гідрогенізація) ненасичених
вуглеводнів – приєднання водню до етену й етину та
їхніх гомологів під час нагрівання за наявності каталізатора:
Уперше
каталітичне гідрування етену здійснив П. Сабатьє спільно з Ж. Б.
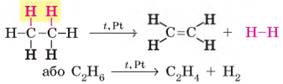
Сандераном (реакція Сабатьє – Сандерана). Одержання етену та етину 1. Дегідрування алканів. Процес відщеплення водню називають дегідруванням,
або дегідрогенізацією. Етен, як і інш і алкени, утворюється під час відщеплення водню від
насичених вуглеводнів:
Для одержання алкінів необхідно від алкану відщепити
дві молекули водню:
Також для добування алкінів можна використовувати й алкени. Одержати етин
можна дегідруванням етену:
Значний
внесок у дослідження реакцій дегідрування вуглеводнів зробив наш
співвітчизник М. Д. Зелінський. 2. Піроліз метану. Піроліз –
розкладання речовин під час нагрівання. Основний промисловий спосіб добування
етину – нагрівання метану до 1500 °С:
3. Карбідний спосіб одержання етину.
Етин утворюється під час гідролізу кальцій ацетиленіду СаС2, який також називають кальцій карбідом:
У промислових масштабах цей спосіб буде дуже дорогим
через вартість сировини. Його переважно використовують для зварювання металів
(ацетиленове зварювання). Етин (ацетилен) добувають безпосередньо перед
спалюванням у пальнику в спеціальних балонах – генераторах ацетилену (мал.
2.10). В Україні найбільші обсяги етену, пропену та етину
добувають на ТОВ «Карпатнафтохім» (м. Калуш, Івано-Франківська обл.) і
використовують переважно для синтезу полімерів
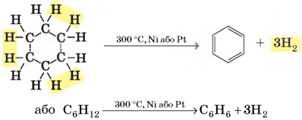
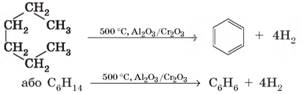
Одержання бензену 1. Дегідрування (ароматизація) вуглеводнів. Більшу частину (40 – 60%) бензену у світі добувають із
бензинових фракцій нафти. Під час пропускання алканів або циклоалканів над
каталізаторами від їх молекул відщеплюється водень з утворенням ароматичних
сполук. Бензен утворюється під час дегідрування циклогексану:
а також під час
дегідроциклізації (дегідрування з одночасним замкненням циклу) гексану:
2. Тримеризація етину (реакція Зелінського). Також бензен у промисловості добувають з етину. Під
час пропускання етину над розпеченим активованим вугіллям три молекули етину сполучаються
в одну молекулу бензену:
В
Україні бензен виробляють на хімічних підприємствах
Лисичансько-Сєвєродонецької агломерації (Луганська обл.) та ТОВ
«Карпатнафтохім» (м. Калуш, Івано-Франківська обл.) обсягом майже 30 – 40
тис. т на рік. До того ж цей
бензен не синтетичний, а виділений з кам’яновугільної смоли (побічний продукт
коксування вугілля) або одержаний дистиляцією певних фракцій від перегонки
нафти. Цей бензен використовують для виробництва аніліну та промислових
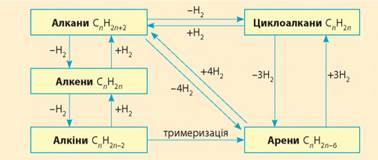
вибухових речовин. Взаємозв'язок між вуглеводнями. Ви вже помітили, що, маючи сполуку одного класу, можна
одержати сполуки іншого класу. Так, між вуглеводнями існує взаємозв’язок
(генетичний ланцюг), який зображено на схемі. Ґрунтуючись на ньому, можна
здійснювати різні перетворення.
Питання для самоконтролю 1. За якими
ознаками класифікують вуглеводні? 2. Яка ізомерія
характерна для алканів? Наведіть приклади ізомерів серед алканів. 3. Як називають
замісник, утворений: а) з метану; б)
етану; в) пропану? 4. Які вуглеводні
називають насиченими? 6. Які типи реакцій
характерні для алканів? Чим це зумовлено? Відповідь проілюструйте прикладами. 7. Які хімічні
зв'язки в молекулах алканів розриваються під час; а) галогенування; б)
крекінгу? 10. Які види структурної ізомерії характерні для алкенів та алкінів? Наведіть приклади ізомерів. 11. Які хімічні властивості
характерні для ненасичених вуглеводнів? |
|||||||||||||||||||||||||||||||||||||