|
|
ХІМІЯ Електронний посібник |
|||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||
|
Органічна хімія
та органічні речовини. На початку становлення органічної хімії як науки органічними вважали ті речовини, що утворювалися в живих організмах. Саме звідси й пішла назва «органічні». Але сьогодні відомо багато органічних речовин, що не належать до живої
природи, наприклад, поліетилен, більшість ліків тощо. У ході вивчення органічних речовин виявилося, що між ними та неорганічними речовинами немає чіткої межі. Однією із суттєвих ознак
органічних речовин є те,
що вони обов’язково містять
атоми Карбону, тому найбільш
поширеним визначенням органічної хімії є:
Головне завдання органічної хімії
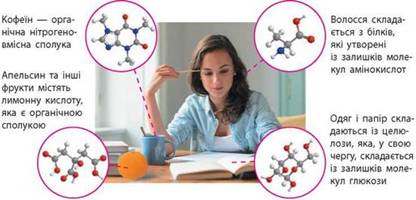
сформулював ще 1853 року Ш. Жерар: добування органічних речовин поза життєдіяльності організмів. Так, сьогодні не можна уявити наше життя без органічних сполук: майже все навколо нас і ми самі складаємося з численних різноманітних речовин (мал.
1.1). Основні ознаки органічних сполук: · складаються
з атомів Карбону, Гідрогену, часто містять Нітроген, Оксиген (елементи-органогени), хоча можуть містити атоми й інших елементів; ·
атоми Карбону в молекулах сполучені між собою в карбонові ланцюги; ·
між атомами в молекулах переважно неполярні або слабополярні ковалентні зв’язки; ·
більшість органічних речовин мають молекулярну будову, тому для них характерні
порівняно низькі температури плавлення й кипіння; ·
більшість не розчиняються у воді,
є леткими рідинами або
легкоплавкими твердими речовинами,
багато з них газуваті за звичайних умов; ·
розчинні у воді сполуки зазвичай є неелектролітами; · переважно
є горючими речовинами; ·
під час нагрівання вище
за 300°С зазвичай розкладаються.
Мал. 1.1. Органічні
сполуки навколо нас Серед органічних речовин виділяють багато різних груп та класів, тому їх класифікація є досить складною, детальніше це питання ми розглянемо в параграфі 3. Але за елементним
складом серед органічних сполук можна виділити три великі групи: ·
вуглеводні – речовини, що складаються
тільки з атомів Карбону й
Гідрогену; ·
оксигеновмісні сполуки – речовини, молекули яких окрім Карбону й Гідрогену містять атоми Оксигену; ·
нітрогеновмісні сполуки – органічні речовини, у молекулах яких наявні атоми Нітрогену. Метан та його
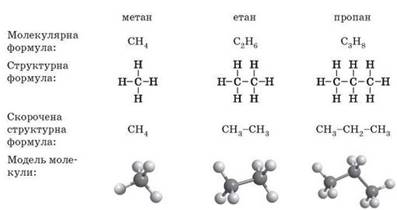
гомологи – насичені вуглеводні.
Найпростішою органічною речовиною
є метан СН4. Він також є першим членом гомологічного ряду алканів із загальною формулою СnНn+2, де n – число атомів Карбону в молекулі. У попередніх класах ви ознайомилися
з десятьма першими представниками
цього ряду. Назви гомологів метану є основою систематичної
номенклатури органічних сполук, тому важливо їх добре пам’ятати. Перші десять представників алканів
Молекулярні формули відображають тільки якісний і кількісний склад речовин. Для органічних сполук набагато важливіше знати не молекулярні формули, а структурні, оскільки саме будова молекули
речовини визначає її властивості. Під час складання структурних формул алканів спочатку зображують ланцюг з атомів Карбону. Потім дописують атоми Гідрогену так, щоб кожний атом Карбону утворював
по чотири хімічні зв’язки (оскільки Карбон в органічних сполуках завжди чотиривалентний).
Фізичні й хімічні властивості метану та його гомологів
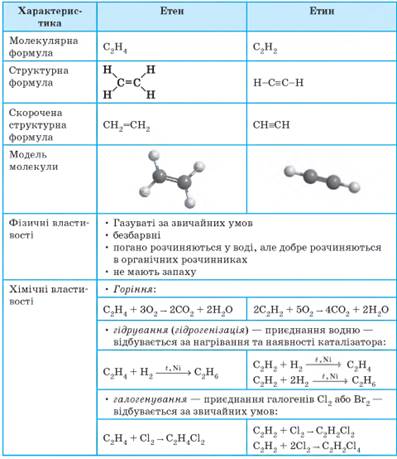
Етен та етин – ненасичені вуглеводні. Етен та етин
– ненасичені вуглеводні завдяки наявності в їхніх
молекулах кратних зв’язків
(подвійного або потрійного),
унаслідок чого вони приєднують молекули інших речовин (насичуються). Характеристики та властивості
етену й етину
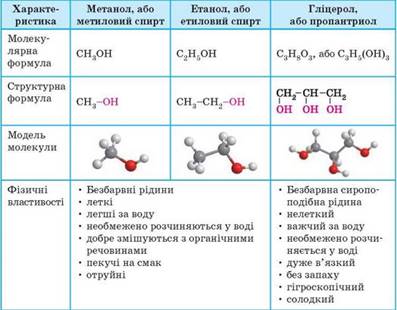
Етанол, метанол, гліцерол – представники спиртів.
Спирти – це органічні сполуки, що містять одну або декілька гідроксильних груп -О Н, сполучених з насиченим атомом Карбону. Ц я гідроксильна група наявна в молекулах усіх спиртів. У назвах спиртів наявність гідроксильної групи -О Н позначають суфіксом -ол-. Таблиця 4 Характеристика та фізичні властивості деяких спиртів
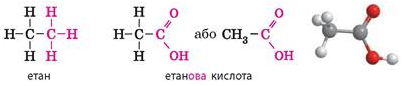
Етанова кислота – представник карбонових
кислот. Етанову кислоту відносять до класу карбонових кислот завдяки наявності у складі її молекули карбоксильної групи -СООН:
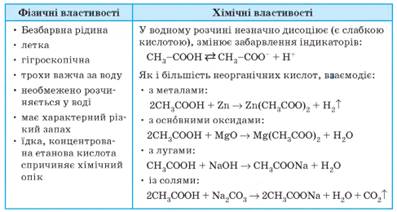
Фізичні
й хімічні властивості етанової кислоти
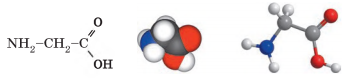
Аміноетанова кислота. Величезне значення для життя на Землі
мають органічні кислоти, у молекулах яких окрім карбоксильної
групи -СООН є аміногрупа
-NH2. Такі сполуки називають амінокислотами. Найпростіша амінокислота – аміноетанова, її також називають
амінооцтовою кислотою, або гліцином:
Більшість амінокислот є розчинними у воді безбарвними кристалічними речовинами, трохи солодкими на смак. Певна група амінокислот
(протеїногенні амінокислоти)
є «будівельним матеріалом»
для синтезу білків у живих організмах.
Застосування деяких органічних сполук.
Великі обсяги вуглеводнів використовують як пальне:
бензин, гас, дизельне пальне,
авіаційний бензин, мазут. Із
насичених вуглеводнів
шляхом хімічних перетворень
добувають багато цінних речовин: синтетичні мийні засоби, розчинники, холодоагенти для холодильників,
пластмаси, каучуки тощо. Етен використовують для добування інших цінних продуктів хімічної промисловості: поліетилену, вибухових речовин, антифризів, етанолу тощо. Етин використовують в ацетиленових пальниках, а також для добування
синтетичного каучуку, лакофарбових матеріалів, синтетичних барвників, етанової кислоти тощо. У побуті використовують не чистий етанол, а спиртовмісні засоби: рідини для миття вікон, склоочисні рідини, антифризи для автомобілів, лосьйони, парфуми тощо. Метанол
у побуті взагалі не використовують через його отруйність. Застосування гліцеролу
насамперед ґрунтується на
його гігроскопічності. Завдяки їй він
пом’якшує шкіру, що її використовують у шкіряному
виробництві та для виготовлення косметичних
засобів. Гліцерол додають до кондитерських виробів, щоб вони довше не черствіли, та до газованих напоїв як підсолоджувач. Через в’язкість
та низьку температуру плавлення
гліцерол використовують
для виготовлення гальмівних
рідин та антифризів. Розбавлену етанову кислоту
використовують у харчовій
промисловості та побуті (столовий оцет). Концентрований розчин і безводну кислоту використовують у промисловості
для виготовлення штучних
волокон, лікарських препаратів,
синтетичних барвників тощо. Питання для самоконтролю: 1. Назвіть спільні
властивості органічних речовин. 2. Які вуглеводні
називають насиченими, а які – ненасиченими? Наведіть приклади. 4. Схарактеризуйте фізичні властивості й застосування перелічених у
параграфі сполук. |
||||||||||||||||||||||||||||||||||||||||