|
|
МІКРОБІОЛОГІЯ Електронний посібник |
||||||||||||||||||
|
|
1. ЗАГАЛЬНА МІКРОБІОЛОГІЯ |
||||||||||||||||||
|
1.3. Культивування мікроорганізмів 1.3.1. Культуральні
властивості мікроорганізмів 1.3.2. Класифікація
живильних середовищ Культивування
(від лат. cultus – вирощування) – це
вирощування мікроорганізмів на поживних середовищах. Мікроорганізми, що
розвинулись на поживному середовищі називають культурами. https://www.youtube.com/watch?v=_gfRFpSmiVw
1.3.1.
Культуральні властивості мікроорганізмів
З’ясування систематичного положення
мікроорганізмів це досить складне та клопітке завдання, яка включає вивчення
цілої сукупності ознак: морфології клітин, характеру росту на різних поживних
середовищах, способів отримання енергії, потреб у певних сполуках для
конструктивного обміну та ін. Проте, в деяких випадках, достатнім виявляється
визначення лише окремих ознак. До таких ознак можуть бути віднесені
макроморфологічні (культуральні) особливості та форма клітин бактерій. До макроморфологічних особливостей відносять
характер росту мікроорганізмів на рідких і твердих поживних середовищах. На поверхні щільного поживного середовища
мікроорганізми можуть рости у вигляді окремих колоній, суцільно за штрихом та
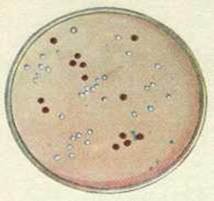
газоном. Колонія – це ізольоване скупчення клітин одного виду,
які виросли, як правило, з однієї клітини. Залежно від того, де розвинулись клітини
розрізняють: поверхневі, глибинні та донні колонії.
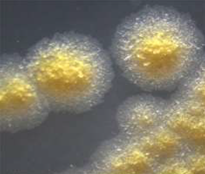
Рис. 34. Характеристика колоній Колонії, що розвинулись на поверхні
відрізняються великою різноманітністю. Під час їх опису враховують такі
ознаки: – форму колоній – кругла, амебоподібна,
неправильна, ризоїдна та інші; – розмір (діаметр) колонії, який вимірюють у
міліметрах; – поверхню колонії – гладенька, шершава,
борозниста, складчаста, зморщена, із концентричними кільцями та інші; – профіль колонії – плоский, випуклий,
кратероподібний, конусоподібниц та інші; – блискучість і прозорість – колонія блискуча,
матова, тьмяна, борошниста, прозора; – колір колонії – незабарвлені (колонії
грязно-білого кольору відносять до незабарвлених) або пігментовані: білі,
жовті, золотисті, оранжеві, бузкові, червоні, чорні. Окремо звертають увагу
на виділення пігменту в середовище. – край колонії – рівний, хвилястий, зубчастий,
бахромчастий та інші; – структуру колонії – однорідна, дрібно- або
великозернисті, волокнисті та інші. Край та структуру колонії визначають за
допомогою лупи; – консистенцію колонії визначають під час
доторканнядо її поверхні петлею. Колонія може легко відділятись від
середовища або вростати в агаризоване середовище, бути твердою, м’якою,
слизистою, тягучою, крихкою.
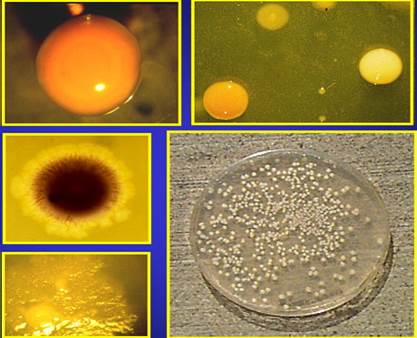
Рис. 35. Різні види
колоній Глибинні колонії, навпаки, досить одноманітні.
Найчастіше вони мають вигляд сплющених чечевичок. Лише деякі можуть мати
вигляд пучечків вати з нитчастими виростами у поживне середовище. Утворення
глибинних колоній часто супроводжується розривом щільного середовища, якщо
мікроорганізми виділяють вуглекислоту або інші гази. Донні колонії мають, як правило, вигляд
прозорих плівок, що стеляться дном. Розміри та деякі інші особливості колоній
мікроорганізмів змінюються з віком, залежать від складу середовища та
температури вирощування, тому під час опису колонії, вказують ці критерії. Ріст у рідкому поживному середовищі більш
одноманітний і супроводжується помутнінням середовища, утворенням плівки або
осаду. При цьому відмічають ступінь помутніння (слабка, помірна або сильна),
особливості плівки (тонка, щільна або пухка, гладенька або складчаста), а під
час утворення осаду вказують – бідний він чи суттєвий, щільний, пухкий,
слизистий або пластівцевий. 1.3.2. Класифікація живильних середовищ
У лабораторних умовах мікроорганізми вирощують
на поживних середовищах, які повинні відповідати певним
вимогам: – бути поживними, тобто задовольняти всі
необхідні харчові потреби мікроорганізмів; – містити необхідну кількість води; – мати певні значення pH та Eh; – бути ізотонічними; стерильними; прозорими. Середовища, які використовуються у
мікробіологічній практиці, класифікуються за походженням, консистенцією та
призначенням. За походженням поживні середовища поділяють на
натуральні (природні) та штучні. До натуральних середовищ відносять овочі,
фрукти, рештки тварин чи рослин, молоко, води морів і річок, відвари тваринного
та рослинного походження, ґрунт та ін. На натуральних середовищах добре
розвивається більшість груп мікроорганізмів, бо вони містять всі компоненти,
які необхідні для їх росту та розвитку. Штучні поживні середовища виготовляють у лабораторних умовах за певною рецептурою (наприклад, м’ясо-пептонний
бульйон (МПБ), м’ясо-пептонний
агар (МПА), середовище
Чапека, середовище Ешбі, середовище Ендо та ін.). У межах штучних поживних середовищ виділяють синтетичні,
до складу яких входять хімічно чисті речовини, взяті у певних концентраціях;
та напівсинтетичні – виготовлені на основі натуральних середовищ із
додаванням, деяких хімічних сполук.
За консистенцією середовища поділяють на
рідкі, щільні та напіврідкі. Для виготовлення рідких поживних середовищ
поживні субстрати розчиняють у воді (наприклад, МПБ, пептонна вода,
середовище Гісса). Щільні середовища готують на основі рідких, шляхом
внесення ущільнювача. Як ущільнювач часто використовують агар-агар або інколи
желатин. Напіврідкі середовища отримують під час внесення половинної
концентрації ущільнювача. Агар-агар – складний гетерополісахарид, до складу якого входить агароза й агаропектин. Агар-агар
отримують із деяких морських водоростей і випускають у вигляді пластинок або
порошку. У воді він утворює гель, який плавиться за температури 100 оС
і ущільнюється за температури 40 оС. Для ущільнення вносять у
середовище 1,5–2,0% агар-агару. За
призначенням поживні середовища поділяють на: – загальновживані, на яких ростуть і розвиваються представники
різних груп мікроорганізмів (наприклад, МПА, МПБ, пептонна вода). Вони
використовуються для культивування мікроорганізмів та накопичення біомаси; – середовища спеціального призначення, серед яких виділяють: 1. Елективні – які забезпечують розвиток
певних груп мікроорганізмів (наприклад, середовища, які не містять зв’язаних
форм азоту – для виділення азотфіксувальних бактерій). 2. Селективні – призначені для селекції
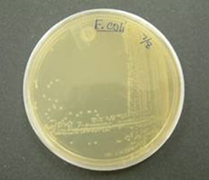
мікроорганізмів за певною ознакою (наприклад, стійкість до антибіотика). 3. Диференційно-діагностичні поживні
середовища (індикаторні) дають можливість швидко відрізнити одні види
мікроорганізмів від інших або виявити деякі їх особливості. Наприклад,
середовище Ендо, яке дозволяє виявити наявність клітин Escherichia coli у
природних субстратах, бо лише E. coli на цьому середовищі утворює колонії
рожевого кольору з металевим блиском. 1.3.3. Способи культивування та техніка посіву
У лабораторних умовах мікроорганізми вирощують
у рідких або на щільних поживних середовищах. Посіви проводять так, щоб у
середовище не потрапили з повітря сторонні мікроорганізми. З цією метою
посіви проводять поблизу газового пальника, в полум’ї якого стерилізують
петлю, кінці піпеток, обпалюють краї пробок і пробірок під час їх відкривання
та закривання. Пробірки з посівами тримають у лівій руці між
великим і вказівним пальцями. Ватні пробки із пробірок виймають затискуючи їх
між безіменним пальцем і мізинцем правої руки. Краї відкритих пробірок і
пробки тримають поблизу полум’я пальника. Посів у рідке
середовище проводять петлею, пастерівською або градуйованою піпеткою.
Суспензію закапують безпосередньо у середовище, матеріал розтирають петлею на
стінці пробірки біля поверхні середовища, а потім пробірку струшують,
змиваючи посівний матеріал у середовище. Після посіву петлю обов’язково
фламбують у полум’ї пальника, а піпетки занурюють у дезінфікувальний розчин.
Перед посівом на щільне поживне середовище
його необхідно розплавити на водяній бані, охолодити до 50–60 оС і
розлити у стерильні пробірки (стовпчиком або у вигляді скошеної поверхні) та
чашки Петрі. Потім середовище охолоджують (ущільнюють) і підсушують. Посіви
роблять бактеріальною петлею, голкою або шпателем. У першому випадку матеріал набирають
стерильною петлею і зигзагоподібно наносять на поверхню скошеного
агаризованого середовища. В середовище, яке розлите стовпчиком, досліджуваний
матеріал засівають уколом бактеріальної голки. Під час посіву шпателем на
поверхню середовища в чашку Петрі наносять краплю мікробної суспензії, а
потім рівномірно розтирають її по всій поверхні. Для успішного вирощування мікроорганізмів
необхідно забезпечити оптимальні умови культивування, які залежать від їх
фізіологічних особливостей. До таких умов відносять: склад поживного
середовища, аерацію, температуру та інші специфічні фактори. У лабораторних умовах
температурний оптимум для мікроорганізмів забезпечується їх культивуванням у термостатах. Температура у термостаті автоматично
регулюється за допомогою спеціального обладнання – терморегулятора, який
підтримує її на постійному рівні. Термостат – це металевий ящик із подвійними
стінками, між якими знаходиться повітря або вода. В отворі верхньої стінки
знаходиться термометр, який показує температуру в середині термостата, і
терморегулятор. Роль терморегулятора полягає в тому, що під час перевищення
встановленого рівня температури, обігрів автоматично вимикається або
зменшується. Обігрів термостата забезпечується електричними тенами. Способи культивування аеробних
та анаеробних мікроорганізмів у лабораторних умовах Культивування на
поверхні рідкого та щільного поживного середовища. В цьому випадку
мікроорганізми отримують кисень безпосередньо з повітря. Під час поверхневого
культивування важливо збільшити площу дотику середовища з повітрям. Для цього
середовище наливають тонким шаром у посуд із широким дном – чашки Петрі,
матраци, скошені поверхні у пробірках, колби. Глибинне культивування
у рідкому середовищі. Під час глибинного культивування мікроорганізми використовують
кисень, розчинений у воді. Розчинність кисню у воді не досить велика, тому
щоб забезпечити ріст аеробів у товщі рідкого середовища, його необхідно
штучно аерувати. Найпростіший спосіб аерації – це струшування колб або
пробірок на спеціальних качалках. При цьому відбувається збільшення поверхні
дотику поживного середовища з киснем. У промисловості, під час вирощування
мікроорганізмів у ферментерах, досить часто разом із
механічним перемішуванням використовують ще й продування через середовище
стерильного кисню. Вирощування у високому
шарі середовища. Рідке середовище наливають до країв пробірок чи колб. Перед
використанням середовище прогрівають на водяній бані 30–40 хвилин, і швидко
охолоджують, щоб не встиг розчинитись кисень. Посівний матеріал вносять на
дно пробірки, яку закривають гумовими або скляними пробками. Якщо ріст
мікроорганізмів не супроводжується виділенням газів, поверхню середовища
заливають стерильним вазеліном або парафіном. Культивування у
в’язкому середовищі. Дифузія кисню у рідину зменшується зі збільшенням її в’язкості.
Готують середовище з додаванням 0,5% агар-агару
(ущільнювача). Вирощування у шарі
щільного середовища. Посівний матеріал вносять у розплавлене та охолоджене до 45–50 оС
агаризоване середовище. У пробірках поверхню заливають стерильною вазеліновою
олією. Вирощування в анаеростатах. З анаеростатів
відкачують повітря, а потім заповнюють сумішшю азоту (80–90%) та вуглекислого
газу (10–20%), за рахунок якої створюється надлишковий тиск, який перешкоджає
проникненню кисню з повітря. Щодо відношення мікроорганізмів до світла, то
більшості мікроорганізмів воно не потрібно, за винятком фототрофних бактерій. Питання для самоконтролю 1. Розшифруйте поняття «культивування мікробів», «культура»? 2. Яким вимогам повинні відповідати поживні середовища? 3. Класифікація поживних середовищ за призначенням. 4. Як проводиться посів на рідкому живильному середовищі? 5. Як забезпечується температурний оптимум для мікроорганізмів під час їх
культивування? 6. Які речовини служать для ущільнення поживного
середовища? |
|||||||||||||||||||