|
|
|
ТЕОРЕТИЧНІ ОСНОВИ ХОЛОДИЛЬНОЇ ТЕХНІКИ частина I Електронний посібник |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
РОЗДІЛ 2. ТЕРМОДИНАМІЧНІ
ОСНОВИ ШТУЧНОГО ОХОЛОДЖЕННЯ |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Слово «термодинаміка» грецького походження: «терме»
означає тепло, жар, вогонь,
«динамікос» – силу, рух, а все разом – «рушійну силу тепла». Сам термін
«термодинаміка» з’явився
в статті В. Томсона в 1845 році,
що означало «теплота – робота». Термодинаміка як загальне
вчення про енергію є
фундаментальною загальноінженерною наукою. Перетворення енергії визначає основне завдання галузі науки, названої енергетикою, до якої належить й виробництво холоду.
Поняття про енергію
спочатку було застосовано в теоретичній механіці. Де розрізняли потенційну (енергія піднятого вантажу, розтягнутої пружини) і кінетичну (енергія тіла, що рухається)
енергію.
Енергію вимірюють
роботою, яку здатне зробити тіло. Так, кінетичну енергію вимірюють роботою, яку тіло здатне зробити
під час його гальмування до повної зупинки. Отже, енергія – властивість тіла за певних умов виконувати роботу. Таким чином, енергія
є кількісною (кількість зробленої роботи) та якісною (характеристика стану тіла
перед здійсненням роботи)
мірою руху матерії, вона,
як і маса речовини, не може створюватися або знищуватися, а лише перетворюється з однієї форми в іншу. Серед різних
форм енергії нас, як фахівців
з холодильних установок, найбільш
цікавлять механічна і теплова енергія, які називають роботою та теплотою, хоча ці два поняття
визначають не форми енергії, а, скоріше, засоби її передачі (рис. 2.8).
Зупинимося більш докладно на визначенні роботи. Важливо вміти обчислювати кількість роботи, що може бути зроблена або яка потрібна, незалежно від того, яким засобом та якою ціною вона виконана. Для нас з
вами – холодильщиків – важливо
інше, обчислення роботи під час стиснення пари у компресорі. Для більшості
з нас робота, у найпримітивнішому змісті цього слова, є все те, що викликає в нас втому. З досвіду ми знаємо, що ступінь
втоми й, отже, кількість зробленої нами роботи залежить від того, яку м’язову силу й на
якому шляху ми додаємо,
коли тягнемо, штовхаємо або піднімаємо вантаж.
Для того, щоб
була зроблена робота, мають існувати як сила, так і переміщення. Якщо одна з
величин, F або L, дорівнює
нулю, то, відповідно до співвідношення
(2.2), робота А також дорівнює
нулю. З якою б завзятістю
ви не штовхали стіл викладача та як би ви при цьому не втомилися, ви не зробите ніякої роботи, якщо стіл не зрушив з місця. Таким чином, робота є кількісним способом впливу навколишнього середовища на тіло. У механіці роботу вимірюють добутком сили, що діє
на тіло в напрямку переміщення, на величину переміщення
точки додатка сили. У термодинаміці механічною роботою називають роботу витрачену не тільки на зміну положення тіла, але й на зміну його форми. Якщо
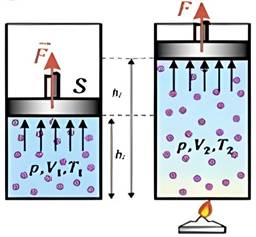
відомо, на яку відстань змістився поршень, то неважко обчислити роботу, зроблену над ним. Щоб була зроблена робота, об’єм має змінитися.
Буквами ΔV скорочено позначено зміну об’єму – різниця між кінцевим
Vкін і початковим
Vпоч об’ємами
(рис. 2.9).
Поняття теплоти
спочатку виникло з відчуття «тепле-холодне». Джозеф Блек (1728‒1799 рр.) вперше встановив
розходження між
температурою, як мірою нагріву
тіла, і теплотою, кількість якої для цього тіла визначає
ступінь нагрівання. Крім цього він
встановив залежність ступеня нагріву від властивостей тіла, тобто ввів
поняття про теплоємність. Блек першим усвідомив
розходження між
температурою тіла і його теплоємністю. Теплоємність – це міра кількості
теплоти, що потрібна для зміни температури на один градус у деякій
шкалі. Теплоємність лежить в основі кількісного виміру теплоти. Він встановив також розходження між звичайною кількістю теплоти, що супроводжується
зміною температури в процесі теплової взаємодії та є основою для виміру
теплоємності, і «схованою»
теплотою, пов’язаною з фазовими переходами, що мають місце під
час теплової взаємодії
без зміни температури.
Тому кількість теплоти, необхідну для випару одиниці маси якоїсь речовини, називають теплотою випару цієї речовини. Будь-які енергетичні
процеси зводяться до перетворення однієї форми енергії в іншу з чітким дотриманням закону збереження енергії.
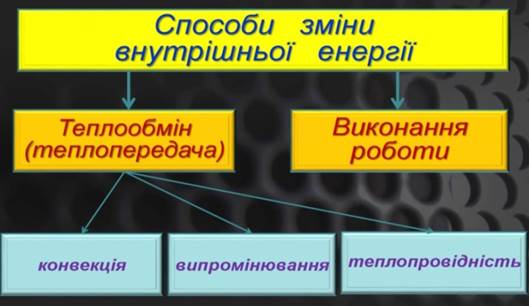
Передача енергії
від одного тіла до іншого відбувається двома шляхами: теплотою і роботою. За своєю сутністю ці поняття
близькі, одиницею їхнього виміру є джоуль. Розходження між ними полягає в тому, що вони є різними формами передачі енергії. Передача енергії у формі теплоти здійснюється або під час безпосереднього
контакту тіл, що мають різну температуру, або за допомогою випромінювання. Кількість переданої енергії називається теплотою й дорівнює зменшенню внутрішньої молекулярної (теплової) енергії більш нагрітого тіла й збільшенню внутрішньої молекулярної енергії менш нагрітого тіла. Передача енергії
у формі роботи ‒ це процес силового впливу одного тіла на інше, що супроводжується
наочним переміщенням
одного тіла щодо іншого, або зміною
об’єму. Кількість переданої енергії називається роботою, величина якої дорівнює збитку запасу енергії одного тіла й збільшенні його в іншого.
У процесі
здійснення роботи над
системою відбувається зміна
параметрів, що характеризують її стан, наприклад, тиск, об'єм, температура. Змінити параметри
стану системи можна під час теплообміну за рахунок передачі тепла від одного нагрітого тіла до іншого. Теплота ‒ це кількість енергії, що передається
від гарячого тіла до холодного. Таким чином, теплота і робота є не
особливими видами енергії,
а тільки різними формами передачі частини внутрішньої енергії в термодинамічному процесі.
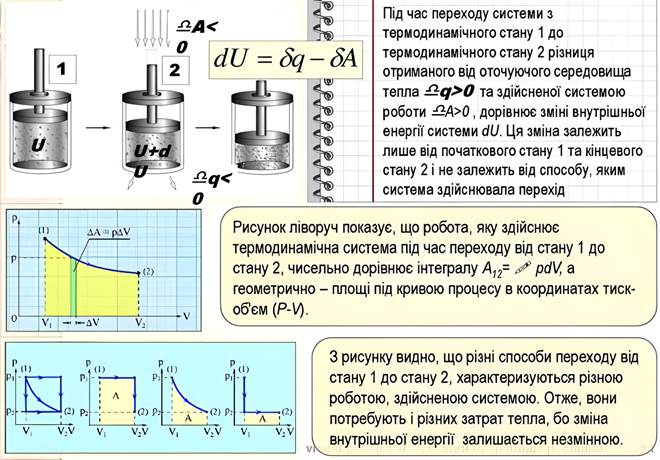
Оскільки тепло є частиною
внутрішньої енергії, яка передається в термоди-
який означає,
що теплота δQ, яка поглинається системою з зовнішнього
середовища, йде на збільшення внутрішньої енергії dU системи
і здійснення роботи δA проти зовнішніх сил. Основний аспект першого
закону, який стверджує, що енергія ізольованої
системи є консервативною, полягає
в тому, що тепло та робота розглядаються
як еквівалентні форми енергії. Енергетичний рівень системи може бути змінений шляхом збільшення або зменшення механічної роботи (δA), що здійснюється силою (F) або тиском (P) і діє відповідно на відстань dx або
елемент об'єму dV, або тепло (dQ) передається через градієнт температури (рис.
2.11).
Перший закон не обмежує можливості перетворення енергії з однієї форми в іншу, зокрема перетворення теплової енергії на роботу. Перший закон не передбачає напрямок реакцій, що виникають
внаслідок теплового руху, зокрема,
напрямку відносно рівноважного стану. Хоча теплова і механічна енергія є еквівалентними у своїй основній природі формами енергії, існують обмеження на здатність перетворювати теплову енергію в роботу. Відповідно до другого закону термодинаміки ‒ незворотні
(I) переходи пов'язані зі
збільшенням ентропійної функції, а зворотні (R)
переходи відбуваються без зміни
ентропії.
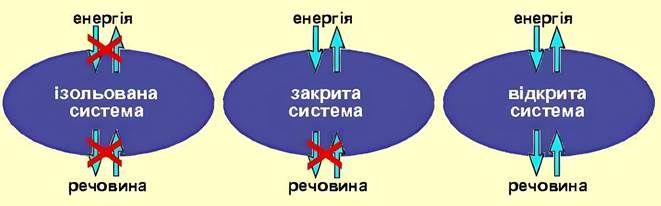
В ізольованих
системах (рис. 2.12) ентропія залишається
незмінною в рівноважних і
зростає в нерівноважних процесах. Це і є критерієм спрямованості перетворень в ізольованій системі. Таким чином, мимовільний
нерівноважний процес, що протікає в ізольованій системі, завжди викликає збільшення ентропії до її максимальних значень під час закінчення процесу і встановлення термодинамічної рівноваги.
Аналіз дії теплової або холодильної машини виконується на підставі принципу еквівалентності
та принципу Карно. Цикл Карно є найефективнішим
термодинамічним циклом. Цей
цикл, розроблено Карно у 1824 році,
має особливе значення в теорії термодинаміки як для порівняння
роботи дійсних теплових двигунів з роботою ідеального двигуна, так і для встановлення
основних положень другого
закону термодинаміки. Карно перший зрозумів,
що аналіз дії реальних теплових машин необхідно робити, використовуючи ідеальну машину, що відтворює розглянутий процес у чистому, незалежному, неспотвореному вигляді. Що ж таке ідеальна теплова машина Карно? За принципом Карно, теплова машина може виконувати роботу тільки за наявності двох джерел теплоти. Розміри нагрівача й
холодильника і їхня природа такі,
що їх температури
залишаються постійними під час віддачі й одержання теплоти. Якщо температура тіла не залежить від інтенсивності теплової взаємодії, то таке тіло називають термостатом. Це поняття є ідеалізацією, але можна уявити собі системи,
які здатні віддавати теплоту, залишаючись
за постійної температури.
Наприклад, посудина з парою, що
перебуває в рівновазі з гарячою водою, може віддавати й поглинати теплоту
без зміни температури.
Коли теплота відбирається, частина
пари переходить у рідину за тієї
ж температури. Цей процес називається конденсацією. Він постійно відбувається в холодильній установці під час перетворення пари холодоагента в киплячу рідину. Коли теплота поглинається,
частина рідини випаровується, що так само має місце в холодильній
установці під час відбору тепла від охолоджуваних речовин. Поки одночасно існує пара й рідина, причому тиск залишається постійним,
температура не буде змінюватися, незважаючи на теплову взаємодію. Під час виробництва
тепловою машиною певної кількості
роботи, рівна кількість теплоти зникає, а інша її кількість переходить від нагрівача до холодильника.
Існує єдина можливість не порушити ідеальності машини: здійснити перехід теплоти від нагрівача
до машини без «падіння» теплоти, тобто за сталості їхніх
температур. Для цього необхідно,
щоб машина одержувала
тепло за
рівності температур нагрівача
й машини, допускаючи, що температура машини на нескінченно малу величину менше
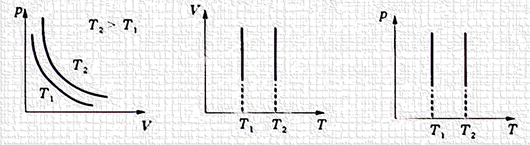
температури нагрівача. У іншому випадку (рівність температур машини й нагрівача) перехід теплоти неможливий. Аналогічно теплова машина віддає тепло холодильнику. Таким чином, машина має сприймати й віддавати теплоту тільки в ізотермічному процесі, коли dq = dА, тобто все тепло йде на здійснення роботи. Ізотермічний процес протікає
за Т = const або dТ = 0. При цьому необхідно пам’ятати, що для здійснення процесу (виводу робочого тіла зі стану рівноваги) необхідно підвести або відвести певну кількість теплоти, підтримуючи
температуру тіла постійною. Такий теоретичний
ізотермічний процес може протікати в циліндрі поршневої машини, якщо в міру підведення теплоти до робочого тіла поршень машини переміщається, збільшуючи об’єм настільки, що температура робочого тіла залишається постійною. У цьому процесі підведення теплоти миттєво компенсується зниженням температури робочого тіла за рахунок розрідження, що створюється під час переміщення поршня. Отже, у процесі за постійної температури з підведенням теплоти тиск падає, а під час відведення – зростає (рис.
2.13).
Для замикання
кругового процесу, температура робочої
речовини машини має змінюватися від температури нагрівача до температури
холодильника, а потім від
температури холодильника знову
до температури нагрівача.
При цьому необхідно виключити контакт машини з нагрівачем і холодильником. Тому що
в іншому випадку «падіння» теплоти буде відбуватися без здійснення роботи. Отже, для збереження ідеальності машини, обидва ці етапи доцільно
здійснювати в адіабатному
процесі, коли dА = - du, тобто перехід
на більш низький або більш високий
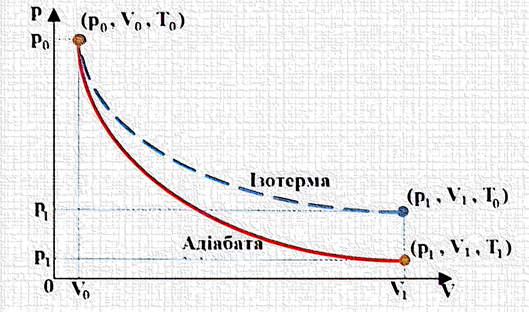
рівень температури відбувається зі здійсненням роботи за рахунок внутрішньої енергії робочого тіла на першому етапі та з витратою її на другому. Адіабатний процес (рис. 2.14) може
протікати в циліндрі ізольованому від навколишнього середовища ідеальною тепловою ізоляцією. Під час адіабатного процесу зміна стану робочого тіла відбувається без теплообміну з зовнішнім середовищем. У цьому випадку dq = 0, q = 0.
Умова q = 0 для адіабатного
процесу є необхідною, але
недостатньою. Дійсно, на початку стиснення газу в циліндрі, наприклад, автомобіля, температура стінок циліндра буде вищою за
температуру робочого тіла,
тому що упорскування нової порції робочого тіла здійснюється тільки після завершення попереднього циклу, у якому стінки циліндра одержали певну кількість теплоти. У цьому випадку теплота буде передаватися
від стінок циліндра до робочого тіла. У міру стиснення газу, температура його
підвищується настільки, що наприкінці стиснення стінки циліндра виявляються холодніші за газ, у зв’язку з чим тепловий потік змінить свій напрямок – робоче тіло віддаватиме
теплоту стінкам циліндра.
В окремому випадку, кількість теплоти, отримана газом від стінок циліндра на початку стиснення, може виявитися рівною кількості теплоти, відданої газом стінкам циліндра наприкінці стиснення. Отже, сумарний теплообмін робочого тіла із зовнішнім
середовищем виявиться рівним нулю, хоча процес стиснення був відверто не адіабатним. Таким чином, необхідним
та достатнім для адіабатного
процесу є не умова q = 0,
а умова dq = 0.
З цього рівняння видно, що робота адіабатного процесу розширення відбувається внаслідок зменшення внутрішньої енергії газу а, отже, температура газу зменшується.
Робота адіабатного стиснення
повністю йде на збільшення внутрішньої енергії газу, тобто на підвищення його температури. Таким чином, зміна
внутрішньої енергії й
робота в адіабатному процесі
еквівалентні за величиною та протилежні
за знаком. Розглянемо ідеальний цикл Карно у викладі самого Карно та у
графічній формі, запропонованій Клапейроном
(рис. 2.15).
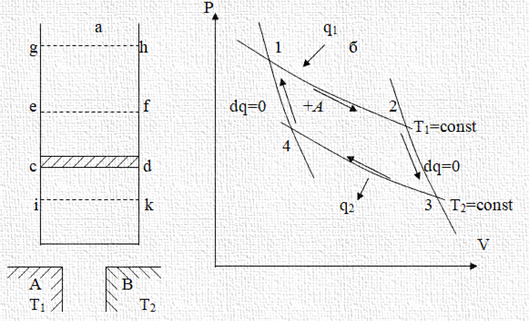
Нехай у циліндрі
під поршнем (рис. 2.15 а), що
займає в початковий
момент положення сd, у стані рівноваги перебуває повітря. Два тіла А і В мають постійну температуру (термостати),
причому температура Т1
> Т2. Теплообмін між газом і стінками відсутній, у той час як дно циліндра
має бути гарним провідником тепла. Приведемо в зіткнення
тіло А з дном циліндра, що легко проводить теплоту. Повітря
прийме температуру Т1 тіла А, яке передасть повітрю деяку кількість теплоти, в міру його розширення.
Температура повітря буде підтримуватися
постійною, незалежно від того, скільки теплоти «втікає» у циліндр або «витікає» з нього. Поршень безупинно піднімається й
переходить з положення cd
у положення ef. На Pv – діаграмі ізотермічне розширення відбувається по лінії 1‒2
(рис. 2.15 б). Уся підведена
до повітря теплота перетворюється
в цьому процесі повністю в роботу. Що може бути краще – одержуй скільки завгодно роботи з максимальним ККД. Однак, зрозуміло,
що процес розширення по ізотермі не може тривати необмежений час і не тільки
тому, що хід поршня не можна влаштувати як завгодно протяжним, але й тому,
що розширення припиниться, як тільки тиск з обох боків
поршня зрівняється. Тобто,
підведення теплоти за сталості внутрішньої енергії придатне тільки для одноразово діючих пристроїв, але аж ніяк не для двигуна, що покликаний
виконувати роботу безупинно.
Для одержання необмеженої
кількості роботи, необхідно забезпечити оборотний круговий процес. Це значить, що необхідно перейти на більш низький температурний рівень, якого економічно можна досягти лише під час продовження розширення по адіабаті. Видалимо тіло А.
Поршень продовжить свій
рух і займе положення gh.
Повітря, будучи ізольованим
від навколишнього середовища, не одержує теплоти. Тиск у циліндрі продовжує знижуватися з одночасним зниженням температури його по адіабаті 2‒3. Припустимо, що після зупинки поршня
температура повітря знизиться
від Т1 до Т2, прийнявши значення температури тіла В. Приведемо повітря
в зіткнення з тілом В і здійснимо зворотне переміщення поршня, приклавши
до нього певне зусилля, тобто виконавши роботу. Завдяки
контакту з тілом В, температура повітря
підтримується постійною з
віддачею теплоти q2
тілу В. Відбувається стиснення по ізотермі 3‒4. Видалимо тіло В,
коли поршень займе положення ef,
і продовжимо стиснення повітря по адіабаті 4‒1 доти, поки повітря
не досягне температури тіла А. Поршень перейде з положення ef у положення ik. Відновимо контакт із
тілом А і поршень повернеться
в положення ef за незмінної температури тощо. Розглянемо сумарний
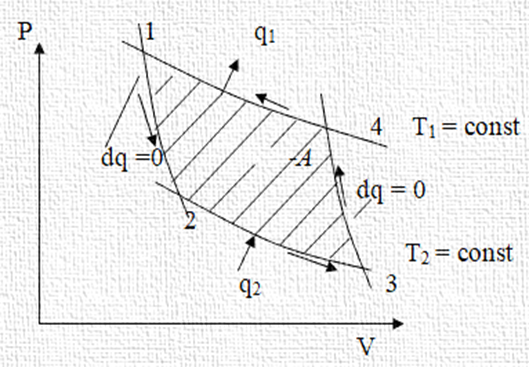
результат наведеного циклічного
процесу. На етапах стиснення відбувається робота
над газом; на етапах розширення
газ виконує роботу. Яка робота більше
наочно видно з рис. 2.15 б. Площа
під кривими 1‒2 й 2‒3
від точки 1 до точки 3 є робота, виконана системою над навколишнім
середовищем у процесі розширення. У процесі стиснення вздовж шляху 3‒4‒1
відбувається робота над системою з боку навколишнього середовища. Зрозуміло, що різниця між повною
роботою, виконаною
системою, і повною роботою,
виконаною навколишнім середовищем над системою, дорівнює
остаточній кількості роботи, що виконана
системою за повний цикл. Ця
різниця чисельно дорівнює площі, обмеженій замкнутою кривою, що складається з ділянок 1‒2,
2‒3, 3‒4 й 4‒1. Якщо розглянуті
операції провести у зворотному
напрямку (рис. 2.16), то теплова
машина перетвориться в холодильну.
Приведемо повітря
в зіткнення з тілом В, доклавши зусилля до поршня, почнемо переміщати його нагору. Переходячи з положення cd у положення gf, повітря буде розширюватися, створюючи розрідження в циліндрі. Однак, спад температури повітря не відбудеться, тому що він буде отримувати теплоту q2
від тіла В (у холодильній установці ця теплота надходить від охолоджуваних тіл). Процес розширення буде відбуватися по ізотермі 2–3 за Т2 = const. Після видалення
тіла В, повітря продовжують стискати по адіабаті 3–4 доти, поки
воно не досягне температури тіла А, зайнявши положення ef. Завдяки подальшому
контакту з тілом А, повітря
продовжує стискатися по ізотермі 4‒1, віддаючи
теплоту, що виділяється під час стиснення, у кількості q1 (у холодильній
установці цей процес відбувається в конденсаторі). Після приходу поршня в положення ik, тіло А віддаляється й повітря розширюється зі зниженням температури по адіабаті 1‒2.
Розширення триває доти, поки повітря
не досягне температури тіла В, переводячи поршень з положення ik в ef. Цикл закінчений і може бути повторений безліч разів.
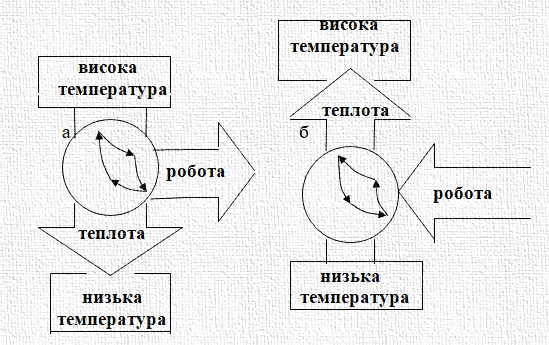
Отже, результат циклу, що відбувається за годинниковою стрілкою (рис. 2.8
а), полягає в передачі теплоти від високотемпературного
джерела, віддачі теплоти низькотемпературному джерелу й здійсненні роботи над середовищем. У випадку
циклу, що відбувається проти годинної стрілки, теплота від низькотемпературного джерела передається високотемпературному,
а кінцева робота відбувається
над системою (рис. 2.17 б).
Економічну ефективність
циклів оцінюють термічним коефіцієнтом корисної дії (ККД) і холодильним коефіцієнтом.
Відзначимо ще одну
особливість циклу Карно. Томсон вперше
звернув увагу на можливість використання властивостей циклу Карно для побудови
абсолютної шкали
температур.
Отже, здійснивши
цикл Карно й вимірявши q1 й q2,
а також вибравши одну реперну точку з температурою Т2 на основі рівності (2.10) можна визначити температуру Т1
будь-якого тіла. Побудована в такий спосіб температурна шкала, що не залежить від властивостей робочого тіла, називається абсолютною термодинамічною
шкалою, або шкалою Кельвіна.
Важливою властивістю цієї шкали є однаковість знака температури всіх тіл; це
означає, що існує гранична температура,
названа абсолютним нулем. З рівняння
(2.10) видно, що найменша
з можливих температур відповідає
випадку, коли q2 = 0. Ця температура і є абсолютний
нуль.
Експлуатація холодильної
установки неможлива без розуміння
термодинамічних процесів,
що відбуваються в ній. Вивчення окремих процесів, що входять у
цикл парової компресійної
машини, а також зв'язків між ними, їхнього впливу один на одного, може
бути значно спрощене, під час використання термодинамічних діаграм холодильних агентів. Уміння користуватися діаграмами необхідно також для контролю й аналізу параметрів діючих холодильних установок; настроювання приладів
автоматичного контролю й регулювання; розрахунку й підбору
холодильного устаткування під
час реконструкції й розширення
діючих установок. Для кожного холодильного агента існують свої діаграми, які наведені в додатках, але
принцип їхньої побудови й
користування ними однаковий. Штучне охолодження
в парових холодильних
машинах засновано на процесі кипіння
холодильних агентів за низьких температур, у результаті
чого вони переходять із рідкого стану в пару, поглинаючи певну кількість теплоти. Щоб процес штучного охолодження був замкнутий та повторювався, пара
холодильного агента стискається, а потім конденсується шляхом охолодження. Таким чином, у холодильній
машині відбуваються два процеси фазового переходу холодоагенту:
з рідини – в пару та з пари – в рідину.
Ці два процеси й відображені на всіх діаграмах. Ми вже ознайомилися з діаграмами P-V (тиск
– питомий об‘єм) та T-S (температура – ентропія), які дозволяють графічно визначати роботу й кількість тепла
в термодинамічному процесі
шляхом виміру площ.
Холодильщикам користуватися цими
діаграмами не завжди зручно: по перше, вони дають значення тільки роботи, або тільки
теплоти; по друге, щоб визначити ці значення, необхідно вимірювати площі. Тому, холодильщики віддають
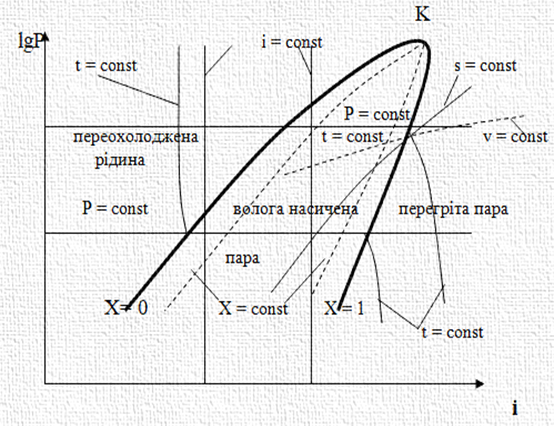
перевагу ентальпійній діаграмі (тиск – ентальпія), яка дозволяє безпосередньо визначати кількість теплоти й роботи, що беруть
участь у виробництві холоду. Для зручності зображення й користування діаграмою lgP-i тиск відкладений по логарифмічній шкалі. Для порівняння
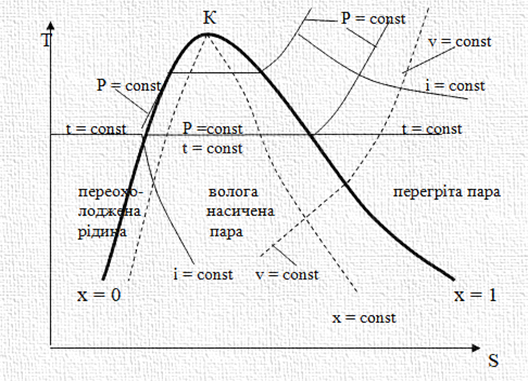
розглянемо діаграми Т-S
(рис. 2.18) і lgP-i (рис. 2.19).
На діаграмах
зображено області різного стану робочого тіла та наведено значення параметрів стану: тиску, Р
(мПа); температури, t (оС); питомого об’єму, v (м3/кг);
ентропії, S (кДж/кг К); ентальпії,
I (кДж/кг). Критична точка К діаграми характеризує
такий стан, вище якого тіло може
бути тільки в стані газу.
Нижче критичної точки тіло може перебувати
одночасно у двох станах: рідкому й пароподібному, а за певних параметрів – у трьох
станах: твердому, рідкому й пароподібному
(потрійна точка). Нижче потрійної точки тіло може перебувати одночасно тільки у двох станах: твердому й пароподібному. Для більшості
холодильних агентів
критична точка характеризується високою
температурою й тиском, а потрійна
точка – дуже низькою
температурою й тиском, наприклад,
фреон-12 має tкр
=111,5 оС, а tтр
= - 155 °С. Для таких холодильних
агентів діаграма викреслюється тільки для того інтервалу температур, у якому використовується холодильний
агент. Вуглекислий газ (С02) має низьку критичну
точку (tкр= 31 °С) та високу потрійну точку (Pтр = 0,515 мПа, tтр
= - 56,6 °С), й діаграма для цієї
речовини викреслюється повністю. На діаграмах
лінії, що відходять від критичної точки К, є граничними
кривими, які розділяють діаграму на окремі області. Ліва гранична крива розділяє області переохолодженої рідини та насиченого вологого
пару. Точки, що лежать на ній,
характеризують стан насиченої
рідини. Права гранична крива розділяє
області вологої насиченої пари й пари перегрітої.
Точки, що лежать на правій
граничній кривій характеризують стан насиченої сухої пари. Вміст (частку)
пари в суміші пари та рідини
відображають лінії постійного паровмісту – X. Вони
показують масову частку пари в суміші пари та рідини. Перетворення рідини в пару (або пари в рідину) за незмінного тиску протікає без зміни температури, тому в діаграмах лінії постійних тисків в області вологої пари збігаються з лініями постійних температур. Лінії постійних
тисків ‒ ізобари (р
= соnst) ‒ у діаграмі
lgР-і зображуються горизонтальними прямими, паралельними вісі абсцис, а в діаграмі Т-S ‒
ламаними лініями. В області вологого пару Т-S-діаграми лінії тисків зображуються горизонтальними прямими, що збігаються з лініями постійних температур, в
області перегрітого пару ‒
це висхідні криві лінії, (на діаграмі суцільні криві), в області рідини – спадаючі криві, які практично збігаються з лівою граничною
кривою, та тільки поблизу
до критичної точки ізобари,
проходять на деякій відстані
від неї. Тому в Т-S-діаграмі,
лінії тиску в області рідини не наносяться, ця область
практично зливається з лівою
граничною кривою.
Параметри точок, що лежать на пограничних кривих, можуть бути визначені як за діаграмами, так
і за таблицями насичених
пар холодильних агентів (відповідно до температури або тиску насичення),
а параметри точок, що лежать в області перегрітої пари, можуть бути визначені також за таблицями перегрітих пар. Абсолютні значення
калоричних параметрів
стану (ентропії й ентальпії)
у розрахунках не використовують.
Характерним є тільки зміна цих параметрів
у процесах. Тому ентропію
й ентальпію відраховують від умовного початку, що відповідає
стану насиченої рідини
при 0 °С. У літературі зустрічаються
таблиці й діаграми з іншим початком відліку ентропії й ентальпії. Це необхідно пам'ятати під час використання діаграм і таблиць із різних
джерел. Калоричні параметри
зручні під час наочного графічного зображення й для теплових розрахунків. Так, змінення ентропії робочого тіла ds = dq/T – показує напрямок теплоти в процесі. Зростання ентропії характеризує підведення тепла до робочого тіла в даному процесі, убування ентропії – відвід тепла, а постійність ентропії – характеризує адіабатичний процес, що протікає
без підводу й відводу
тепла ззовні. Зростання ентропії в реальних процесах (процесах теплообміну) є мірою необоротності процесів. У Т-S-діаграмі
площа під процесом, спроєктованим на вісь абсцис, виражає кількість підведеного або відведеного тепла або роботу в цьому процесі Tds =dq. У lgP-і-діаграмі тепло або роботу можна виразити відрізком на осі абсцис, що відповідає
різниці ентальпій на межах
даного процесу.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||