|
|
ФІЗИЧНА І КОЛОЇДНА ХІМІЯ Електронний посібник |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
КОЛОЇДНІ СИСТЕМИ,
ЇХ ВЛАСТИВОСТІ |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
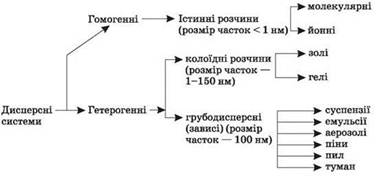
7.1. Класифікація та загальні властивості
дисперсних систем. 7.2. Методи одержання колоїдно-дисперсних
систем. Будова колоїдних частинок. 7.3. Методи очищення колоїдних розчинів. 7.4. Молекулярно-кінетичні властивості
колоїдних систем. 7.5. Оптичні властивості колоїдних
систем. 7.6. Електрокінетичні властивості
колоїдних систем. 7.7. Стійкість і коагуляція колоїдних
систем. 7.1. Класифікація та загальні властивості
дисперсних систем Дисперсними
називаються системи, в яких
частинки однієї речовини розподілені в іншій. Подрібнена речовина називається
дисперсною фазою. Та речовина, в якій розподіляються частинки,
називається дисперсійним середовищем (рис 7.1.1). Наприклад, повітря, туман, пил, піна,
плазма крові, грунт. Неодмінною умовою існування таких систем є
нерозчинність фази в середовищі.
Рис. 7.1.1.
Дисперсна система Прикладами
дисперсних систем є колоїдні розчини та розчини високомолекулярних сполук. Залежно від
розмірів частинок дисперсної фази системи поділяють на гомогенні та
гетерогенні.
Якщо диспергована речовина не має поверхні поділу
із дисперсійним середовищем, то таку систему називають гомогенною.
Рис. 7.1.2. Розчин цукру у воді,
гомогенна система До
таких систем належать істинні розчини (молекулярно-іонні системи). Розміри
молекул і йонів менші за 1·10-9 м, тобто співмірні з молекулами
розчинника, тому такі системи є гомогенними, термодинамічно стійкими, і до
них поняття дисперсності не поширюється. Система,
в якій частинки диспергованої речовини мають розмір більший 1·10-9 м і складають окрему фазу
щодо дисперсійного середовища, є гетерогенною.
Рис. 7.1.3. Гетерогенна система Головними
ознаками дисперсних систем є дисперсність (роздрібненість) і гетерогенність
(наявність між фазної поверхні поділу). Дисперсність (D)
– це величина обернено пропорційна лінійному розміру частинок:
де а
– діаметр сферичної частинки, або довжина ребра частинки із формою куба. Розмірність D[D]= м-1 Отже, що менший
розмір частинок, то більша дисперсність системи. У дисперсних
системах легко відбуваються процеси, які знижують вільну енергію, а саме:
адсорбція, коагуляція (злипання дисперсних частинок), утворення макроструктур
та ін. Різноманітні
дисперсні системи широко розповсюджені у природі і часто відзначаються в
різних галузях промисловості та сільського господарства. Складові частини
Землі та її атмосфери, рослинні та тваринні організми і продукти їх
життєдіяльності – це дисперсні системи. Утворення та
руйнування дисперсних систем відіграє вирішальну роль у генезисі землі,
розвитку живих організмів, в одержанні речовин і продуктів їх перероблення.
Тверді матеріали сучасної техніки (метали і сплави, бетон, матеріали на основі
полімерів), як і природні (дерево, шкіра, рослинні й тваринні волокна і
тканини на їх основі), є твердими дисперсними системами (дисперсними
структурами). У фармації як лікарські форми використовують емульсії, мазі,
піни, порошки та ін. Класифікація дисперсних систем за різними ознаками Дисперсні системи класифікують
за різними ознаками: ступенем дисперсності, агрегатним станом дисперсної фази
і дисперсійного середовища, між фазною взаємодією, ступенем структурованості
тощо. 1. За
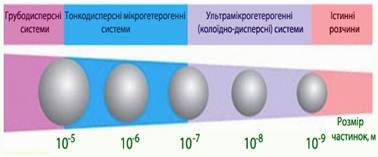
ступенем дисперсності. Залежно від розмірів частинок дисперсної фази
дисперсні системи умовно поділяються на три групи (рис. 7.1.4):
Рис.7.1.4. Класифікація дисперсних систем за розміром частинок 2. За агрегатним станом. Залежно
від агрегатного стану дисперсної фази і дисперсійного середовища
(газоподібний – Г; рідкий – Р; твердий – Т) можна виділити
дев’ять типів дисперсних систем Таблиця 1 Класифікація
дисперсних систем за агрегатним станом дисперсної
фази і дисперсійного середовища
Необхідною умовою
утворення дисперсної системи є обмежена розчинність речовини дисперсної фази
у дисперсійному середовищі. Золі з газоподібним
дисперсійним середовищем називають аерозолями; з рідким – ліозолями або
просто
золями;
з твердим – солідозолями. У свою чергу, ліозолі поділяють на гідрозолі, етерозолі, алкозолі, бензозолі тощо, в яких дисперсійним середовищем відповідно
є вода, ефір (діетиловий етер), спирт, бензен. Дисперсні системи з рідким або
газоподібним дисперсійним середовищем, у якому частинки дисперсної фази
можуть вільно переміщуватись, називають вільнодисперсними (емульсії, суспензії, ліозолі, аерозолі). Системи з твердим дисперсійним
середовищем, у якому частинки дисперсної фази не можуть вільно
переміщуватись, називають зв'язанодисперсними
(капілярно-поруваті тіла,
полімерні плівки, гелі та драглі, тверді розчини). 3.
За міжфазовою взаємодією. У
дисперсних системах на межі поділу фаз діють сили взаємодії між частинками
дисперсної фази і дисперсійного середовища. Залежно від їх інтенсивності
системи поділяють на ліофобні та ліофільні. Ліофобними (від
грецьк. phobos – страх)
є системи, в яких спорідненість
дисперсної фази і дисперсійного середовища мала, а тому сили міжмолекулярної
взаємодії на межі поділу фаз слабкі. Такі системи термодинамічно нестійкі та
вимагають спеціальних методів стабілізації. До них належить більшість дисперсних систем
– ліозолі, аерозолі, емульсії, піни. Ліофобні золі (у випадку води – гідрофобні) називають власне колоїдними розчинами. До них
належать гідрозолі золота, срібла, ферум гідроксиду, аргентум хлориду тощо.
Стійкість таких систем зумовлена, головним чином, однойменним зарядом
частинок золю. Ліофобні системи називають міцелярними або суспензоїдами. Ліофільними (грецьк.
lyo – розчиняю і phileo – люблю) є системи, які характеризуються інтенсивною
взаємодією речовин фази і середовища з утворенням сольватних (гідратних, у
випадку води) оболонок із молекул дисперсійного середовища навколо частинок
дисперсної фази. Тому такі системи утворюються самочинно і є термодинамічно
стійкими, гомогенними. Прикладом таких систем є розчини білків, нуклеїнових
кислот, мил, алкалоїдів у воді, каучуку у бензені тощо.
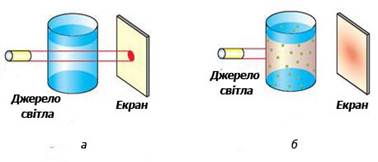
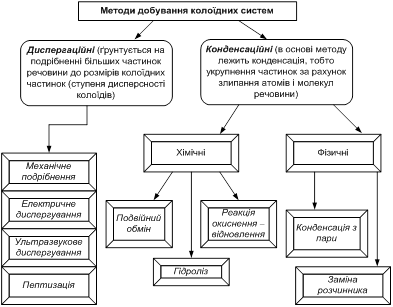
7.2. Методи одержання колоїдно-дисперсних систем. Будова колоїдних частинок Колоїдний розчин (золь) – ультрамікрогетерогенна система, в якій
дисперсійним середовищем є рідина, а дисперсною фазою – тверді частинки
розміром 10-7–10-9 м (рис. 7.2.1).
Рис.7.2.1. Розпізнавання істинних (а) і колоїдних (б) розчинів Умовами
утворення колоїдних розчинів є:
Як
показано вище, колоїдні розчини за ступенем дисперсності займають проміжне
місце між грубодисперсними та молекулярно-іонними системами (істинними
розчинами). Тому золі можна одержати або шляхом подрібнення відносно великих
частинок до колоїдних розмірів, або внаслідок об'єднання окремих молекул чи
атомів розчиненої речовини істинних розчинів. Відповідно до цього методи
одержання колоїдно-дисперсних систем поділяють на диспергаційні та конденсаційні
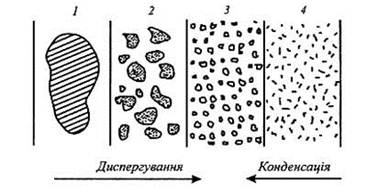
(рис. 7.2.2.): Грубодисперсні
системи → Колоїдний
розчин ← Істинні
розчини d
>10-7м
d =10-7- 10 -9м d <10-9м Методи
диспергування
Методи конденсації
Рис. 7.2.2. Диспергаційні та конденсаційні методи одержання колоїдних розчинів: 1 – речовина; 2 – частинки грубої суспензії; 3 – міцели (колоїдний
розчин); 4 – молекули та йони (істинний розчин) В окрему групу виділено метод одержання колоїдних
розчинів за допомогою пептизації.
Конденсаційні методи
вигідні з енергетичної точки зору, адже укрупнення частинок шляхом об'єднання
атомів або молекул під дією ван-дер-ваальсових сил відбувається без витрати енергії
ззовні. При цьому залежно від
умов конденсації можна одержати системи будь-якого ступеня дисперсності. В
основі конденсаційних методів лежить утворення частинок дисперсної фази з
пересиченого розчину або з пари за певних фізичних і хімічних умов.
Метод
фізичної конденсації ґрунтується тільки на фізичних явищах
без перебігу хімічних реакцій ( конденсація пари, заміна розчинника тощо).
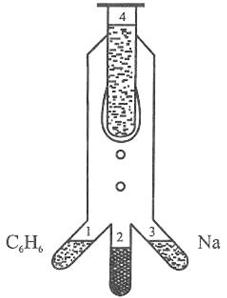
Рис.7.2.3. Схема приладу Рогінського та Шальнікова: 1 – дисперсійне середовище
(бензен); 2 – золь; 3 – диспергована речовина (Na); 4 – посудина з рідким повітрям та
азотом Суть
методу полягає в тому, що у відростках (1) і (3) одночасно у вакуумі
випаровують дисперсну фазу (наприклад, натрій) і дисперсійне середовище
(наприклад, бензен). Змішана пара конденсується на поверхні посудини (4), яка
охолоджується рідким повітрям (або азотом). Після видалення з посудини (4)
рідкого повітря (чи азоту), суміш поступово розморожується і стікає у
відросток (2) у вигляді бензозолю натрію. Цим методом одержують органозолі
сірки, селену, фосфору, кадмію, ртуті, калію, натрію та ін.
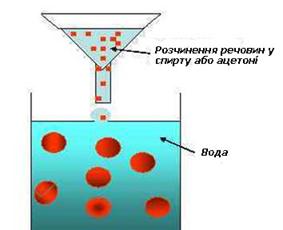
Рис.
7.2.4. Одержання колоїдних розчинів методом заміни розчинника Методи хімічної
конденсації. В основі цих методів
лежать хімічні реакції, що супроводжуються утворенням малорозчинних речовин.
З цією метою головним чином використовують реакції подвійного обміну,
відновлення, окиснення та гідролізу. Незважаючи на
велику різноманітність запропонованих для цієї теми хімічних реакцій,
загальним для них є те, що в результаті реакції утворюється тверда фаза.
Умови проведення реакції (зокрема, концентрації реагентів) підбираються таким
чином, щоб вони максимально сприяли виникненню саме високодисперсної
(ультрамікрогетерогенної) системи, але не призводили до випадання твердої
фази в осад (або до її спливання у “вершки”). Розглянемо на
конкретних прикладах основні типи хімічних реакцій, що використовуються для
одержання дисперсних систем способом хімічної конденсації. Реакції подвійного обміну. Цей метод найчастіше зустрічається на практиці.
Наприклад, золь BaSО4
утворюється за реакцією: Ba(NO3)2 + K2SO4 → BaSO4↓ +2КNOз. Слід
відзначити, що для одержання золів за реакціями обміну один з реагентів треба
брати в надлишку, тому що він буде стабілізатором. Цим методом можна одержати
золі галогенідів срібла, золь берлінської лазурі, сульфіду миш'яку та ін.
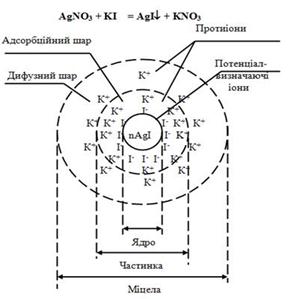
Реакції обміну дають можливість отримувати також органозолі. Будова колоїдних частинок Згідно з міцелярною теорією будови колоїдних розчинів, золь
складається із структурних частинок дисперсної фази – міцел і міжміцелярної рідини. Міцела
має значно складнішу будову за молекулу і є високоорганізованішою структурною
одиницею матерії. У міжміцелярній рідині (дисперсійному середовищі) розчинені
електроліти, неелектроліти, поверхнево-активні речовини, які стабілізують
колоїдну систему. У першому наближенні в структурі міцели можна виділити три основні
частини: ядро,
адсорбційний і дифузний
шари йонів. Розглянемо будову міцели,
утвореної під час хімічної взаємодії AgNO3 і KJ
(останній взятий у надлишку). Основу колоїдних частинок золю аргентум йодиду складають молекули
(мікрокристали) малорозчинного AgJ, сукупність яких (mмолекул) утворює агрегат: (mAgJ) – агрегат. На поверхні агрегату, за правилом
Панета-Фаянса (на агрегаті адсорбуються іони, які входять до
його складу.),
вибірково адсорбуються ті йони стабілізатора, які можуть добудовувати кристалічну
ґратку твердої фази. Ці йони визначають знак і величину потенціалу поверхні і
тому їх називають потенціалвизначальними
йонами (ПВЙ).
Якщо реакція відбувається за надлишку KJ, то на поверхні агрегату (mAgJ) виникає
негативно заряджений шар з n йонів J- (потенціалвизначальні йони). Агрегат з ПВЙ, які увійшли до його
складу, називають ядром: [(mAgJ) nJ-]n- – ядро. Під дією електростатичних сил до поверхні ядра притягуються йони
стабілізатора протилежного знаку (у цьому випадку, K+), які називають протиіонами.
Частина протиіонів (n-x)K+, яка
зазнає дії як електростатичних, так і Ван дер Ваальсових сил ядра,
утримується на досить близькій відстані від нього і утворює адсорбційний шар протиіонів.
Ядро разом з адсорбційним шаром протиіонів утворює колоїдну частинку – гранулу, знак
заряду якої визначається знаком заряду потенціалвизначальних йонів: {[(mAgJ) nJ-]n-
(n-x)K+}x- – гранула. Решта х
протиіонів K+, яка необхідна для повної компенсації
заряду поверхні, слабше зв'язана з ядром (діють тільки сили електростатичного
притягання), поступово дифундує у напрямку розчину і утворює дифузний шар. Сумарний
заряд усіх протиіонів дорівнює за величиною заряду поверхні ядра, тобто
сумарному заряду потенціалвизначальних йонів. Гранула разом із дифузним шаром
утворює електронейтральну міцелу, будову
якої загалом зручно представляти у вигляді формули. У наведеному прикладі,
коли стабілізатором є KJ, гранула
має негативний заряд і будова міцели має такий вигляд: {[(m AgJ) n J-]n-
(n-x) K+}x- х К+. б)
якщо стабілізатором є AgNO3, то одержимо золь AgJ з позитивним зарядом гранули: {[(m AgJ) n Ag+]n+(n-x) NO3-}x+ х NO3-. Отже, змінюючи співвідношення між кількостями
реагуючих речовин, можна одержати золь з позитивним або негативним зарядом
гранул. Будову міцели золю арґентум йодиду з негативним зарядом гранул
зображено на (рис. 7.2.5).
Рис.7.2.5. Будова міцели арґентум йодиду з негативним зарядом гранул Приклад Для одержання
золю хлориду срібла змішали 15 см3 0,025 М KCl та 85 см3 0,005 М AgNO3. Написати формулу міцели одержаного золю. Розв’язок: Записуємо
рівняння реакції: KCl + AgNO3 → AgCl↓ + KNO3 Визначаємо,
який з розчинів взятий в надлишку: ν (KCl)
= 15 см3 · 0,025ммоль/см3 = 0,3 ммоль; ν (AgNO3) = 85 см3 · 0,005ммоль/см3
= 0,4 ммоль. Таким чином,
стабілізатором є AgNO3,
оскільки він є у надлишку. AgNO3 → Ag+ + NO3-; Агрегатом буде
малорозчинний AgCl.
На ньому будуть адсорбуватись йони Ag+ (за правилом Фаянса-Панета), які визначатимуть позитивний заряд
гранули. Протийонами є йони NO3-. Формула міцели золю буде така:
У випадку, якщо розчини калій йодиду та арґентум
(І) нітрату взяті у стехіометричних кількостях, то електрокінетичний
потенціал дорівнюватиме нулю. Такий стан колоїдної системи, при якому
електрокінетичний потенціал частинок дорівнює нулю, називається ізоелектричним. Досягти ізоелектричного стану
ліофобного золю можна додаванням до нього розчину електролітів. Реакції гідролізу. Широко
застосовуються для одержання золів гідроксидів металів. З цією метою розчин
солі відповідного металу доливають до киплячої води. Наприклад, у гарячій
воді гідроліз FeCl3 відбувається до кінця: FeCI3+3H2O→ Fe(OH)3 +3HCl. Проте утворення
осаду не спостерігається. Під час перебігу паралельної реакції: Fe (OH)3 + HCl → FeOCl + 2 H2O утворюється
електроліт FeOCl,
який виконує функцію стабілізатора. Будова міцели: {[(m Fe(OH)3) n FeO+]n+ (n-х) Cl-}x+ х Cl-. Одночасно
утворюється золь феруму(ІІІ) гідроксиду, міцела якого має таку будову
(стабілізатор – надлишок FeCl3): {[(m Fe(OH)3) n Fe3+]3n+ 3(n-х) Cl-}3x+ 3х Cl-. Гідролізом
можна одержати також золі кремнієвої, вольфрамової та інших нерозчинних у
воді кислот. Реакції відновлення. Під час додавання до розчину солі відновника іони
металу втрачають заряд, а атоми металу агрегують до колоїдних розмірів: 2KAuO2+ ЗНСОH + К2СО3 → 2Au + ЗНСООК + КНСО3 + Н2O. Стабілізатором
у цьому випадку є надлишок калій аурату – KAuO2 Будова міцели
золю така: {[(m Au) n AuO2-]n- (n-х) K+}x- х K+. У деяких
випадках процес відновлення ведуть у присутності ліофільних колоїдів, які,
адсорбуючись на поверхні частинок дисперсної фази, захищають їх від злипання.
Прикладом застосування захисних колоїдів є одержання лікарських препаратів
коларголу і протарголу. Реакції окислення. Прикладом може бути одержання золю сірки під
час окиснення сірководню за реакцією: H2S+½O2 → S+H2O. Будова міцели
золю сірки така: {[(m S) n HS-]n-
(n-х) H+}x-
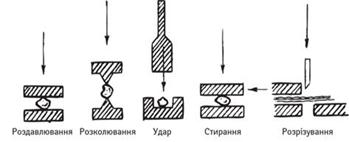
х H+. Диспергаційні
методи одержання колоїдних систем Суть
цих методів зводиться до подрібнення більших частинок до колоїдного ступеня
дисперсності. Під час диспергування речовини витрачається робота на створення
нової поверхні, що супроводжується збільшенням вільної поверхневої енергії.
Залежно від виду витраченої енергії, ці методи поділяють на механічні,
електричні.
Рис. 7.2.6. Основні принципи
подрібнення твердих речовин
Рис. 7.2.7. Схема роботи
планетарного млинка: 1 – система загрузки; 2 – розмол; 3
– крупнозернова фракція, дрібнозернова фракція; 4 – фільтр;
5 – вентилятор; 6 – металічні шарики; 7 – готова
продукція Електричні методи диспергування ґрунтуються на тому, що
крізь рідке дисперсійне середовище, наприклад воду, пропускають електричний
струм між електродами, які виготовлені з металу, колоїдний розчин якого
хочуть одержати. Ці методи поєднують процеси диспергування і конденсації: за
температури вольтової дуги (метод Бредіга), або в іскровому високочастотному
розряді (метод
Свердберга) матеріал
електродів диспергується і випаровується, а потім пара конденсується в охолодженому
дисперсійному середовищі з утворенням колоїдного розчину (рис. 7.2.8).
Стабілізаторами таких дисперсій є оксиди металів, які утворюються як побічні
продукти процесу диспергування. Адсорбуючись на частинках металу, вони
створюють захисний шар і запобігають укрупненню частинок. Цими методами можна
одержати гідрозолі благородних металів (золота, срібла, платини та ін.).
Рис 7.2.8. Одержання колоїдних розчинів
електричним диспергуванням 1 – механічні електроди; 2 –
охолоджене дисперсійне середовище Ультразвукове
диспергування ґрунтується на
використанні спрямованого ультразвукового поля, тобто коливань високої
частоти (105 – 106 Гц), які утворюються за допомогою
спеціальних приладів. Диспергування відбувається внаслідок кавітаційного
руйнування, тобто швидкого чергування стиснень і розріджень,
і великого імпульсного тиску (порядку тисяч атмосфер). Під час проходження
ультразвуку в рідині утворюються розриви (кавітаційні порожнини), які у
момент стиснення закриваються дрібними бульбашками газу або твердих частинок.
У цей час тиск у бульбашках може досягнути кількох тисяч атмосфер. Таким
способом вдається диспергувати не тільки рідини, але й тверді частинки. Так
одержують високодисперсні емульсії і суспензії, придатні для
внутрішньовенного введення. Крім того, під дією ультразвуку відбувається
стерилізація колоїдних розчинів, суспензій, емульсій, тому що кавітація
викликає руйнування мікроорганізмів та їх спор. Пептизацію
тільки умовно можна віднести до диспергаційних методів одержання колоїдних
розчинів, оскільки в цьому методі відсутній процес подрібнення частинок
великого розміру до колоїдного ступеня дисперсності.
Рис. 7.2.9. Ультразвукова ванна для
очищення деталей
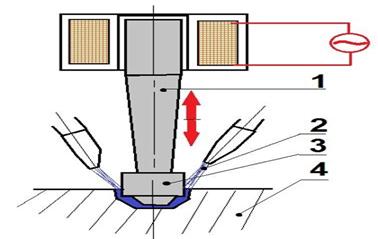
Рис.7.2.10. Ультразвукова
абразивно-імпульсна обробка: 1 – концентратор ультразвукових
коливань; 2 – сопло подачі абразиву; 3 – робоча частина; 4 – деталь Часто спостерігається процес, протилежний коагуляції, – перехід
коагуляту в золь. Називають цей процес пептизацією, або дезагрегацією.
Якщо під час коагуляції часточки золю збільшуються і випадають в осад, то під
час пептизації часточки осаду переходять у розчин, утворюючи золь. При цьому
роль ядер виконують часточки осаду.
Рис.7.2.11. Пептизація під дією пептизатора
заряд частинок збільшується – утворюється золь Пептизацією називають перехід у колоїдний розчин осадів, що
утворилися під час коагуляції. Пептизація відбувається під впливом дисперсійного
середовища, в якому є той чи інший пептизатор. Під час промивання осаду
вилучаються йони, що зумовили коагуляцію, а колоїдні часточки адсорбують йони
пептизатора. На поверхні часточок
утворюється подвійний електричний шар, який стабілізує дисперсну
систему, при цьому сили відштовхування між часточками починають переважати
над силами притягання. Формуючись, колоїдні частки під впливом теплового руху
розподіляються рівномірно по всьому об’єму рідини, утворюючи колоїдний
розчин. Проте не всі
осади піддаються пептизації. Пухкі та свіжі осади легко переходять у золь, а
осади, що зазнали старіння, як правило, не пептизуються. Пептизацію можна
спостерігати під час «відновлення» сухого молока, де пептизатором є білок. На пептизацію впливає механічна дія. Так, перемішування сприяє
пептизації. Швидкість пептизації збільшується і з підвищенням температури. З
пептизацією, наприклад, пов'язане очищення поверхонь від забруднення.
Часточки бруду за допомогою мила (пептизатор) відриваються від поверхні
(пептизують), переходячи в стан золю. Пептизацію
використовують у різних технологічних процесах для одержання рідких
дисперсних систем з паст і порошків. Пептизація – часто небажаний процес,
наприклад, за взаємодії бурового розчину з глинистими породами, що складають
стінки стовбура бурової свердловини, під час очищення води коагулянтами.
Пептизація відіграє важливу роль у природних процесах: генезисі
осадових порід, зміні складу та структури ґрунтів, перерозподілі в земній
корі речовин біогенного й абіогенного походження. 7.3. Методи
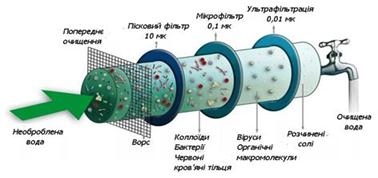
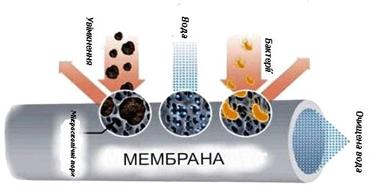
очищення колоїдних розчинів Одержані
будь-яким способом дисперсні системи набувають стійкості після очищення їх
від домішок молекул низькомолекулярних речовин та йонів електролітів. З цією
метою використовують різницю у розмірах колоїдних частинок, молекул та йонів.
Молекули та йони проходять крізь пори напівпроникних мембран (колодій,
пергамент, целофан, тваринний міхур тощо), а більші за розмірами колоїдні
частинки затримуються ними. На цьому ґрунтуються такі методи
очищення золів, як діаліз, електродіаліз та ультрафільтрація.
Недолік – тривалість процесу до кількох діб.
Рис. 7.3.1. Схема діалізатора: 1 – посудина з золем; 2 – посудина з розчинником
(водою); 3 – напівпроникна мембрана
Рис. 7.3.2. Діаліз
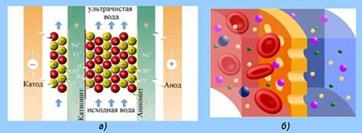
Ефективність процесу електродіалізу може бути
істотно підвищена завдяки застосуванню так званих електрохімічно-активних
мембран. Вони є мембранами, попередньо обробленими таким чином, що мають
стійкий позитивний чи негативний заряд. Розміщуючи негативно заряджену
мембрану в катодній зоні електродіалізатора, а позитивну – в анодній, можна
досягти істотного збільшення кількості перенесення відповідних іонів. У
граничному випадку діафрагми з відповідними зарядами можуть бути проникними
тільки для одного виду частинок (катіонів чи аніонів). Такі діафрагми
називаються ідеальними електрохімічно-активними. Різниця між кількістю
перенесень під час використання таких діафрагм доходить до одиниці, а вихід
за струмом досягає 100 %.
Рис. 7.3.3. Принцип роботи прцесів: а) електродіаліз; б) діаліз Практичне застосування методу
електродіалізу не обмежується лабораторними дослідженнями. Наприклад,
електродіаліз застосовується для усунення солей з молочної сироватки.
Отримана таким шляхом сироватка містить велику кількість цінної лактози і
протеїнів; її використовують для одержання продуктів харчування. Застосування
звичайного діалізу призводить до втрати цінної лактози.
Якщо використовувати
ультрафільтри різної пористості, то можна застосувати метод ультрафільтрації
для поділу колоїдних систем на більш монодисперсні фракції. Одночасно
підвищується можливість визначення дисперсності цих фракцій.
Рис.7.3.4. Ультрафільтрація води 7.4. Молекулярно-кінетичні
властивості колоїдних систем До молекулярно-кінетичних властивостей золів відносяться броунівський рух,
дифузія, осмотичний тиск. Броунівський рух виявляється
в тому, що частинки дисперсної фази під впливом ударів молекул розчинника
весь час перебувають у хаотичному рухові.
Рис 7.4.1.
Броунівський рух Броунівський
рух
Уперше це явище виявив у 1827 році англійський ботанік Р. Броун у
мікроскопічних часточок квіткового пилку рослин, що перебувають у воді. Броунівський рух властивий часточкам будь-яких речовин малих розмірів. Що
менший розмір часточок, то інтенсивніший їх броунівський рух. Особливо
помітним броунівський рух стає в часточок колоїдного ступеня дисперсності.
Крім того, інтенсивність броунівського руху зростає з підвищенням температури
і зменшенням в'язкості середовища. Броунівський рух не припиняється з часом,
тобто він не залежить від тривалості існування системи. Вивчення
броунівського руху підтвердило, що молекули реально існують. Вивчаючи броунівський рух, А.
Енштейн і М. Смолуховський доказали, що квадрат середнього зміщення прямо
пропорційний коефіцієнту дифузії (D):
Тому, спостерігаючи експериментально за зміщенням частинок під
ультрамікроскопом, можна обчислити величину коефіцієнта дифузії. Броунівський
рух є причиною дифузії. Дифузія – самочинний процес
вирівнювання концентрацій йонів, молекул або колоїдних часточок внаслідок
їхнього безладного теплового руху (в колоїдних часточок – броунівського руху).
Дифузія закінчується після того, як часточки рівномірно розподіляються по
всьому об'єму. Отже, дифузія можлива лише в системах з неоднаковими
концентраціями.
Рис. 7.4.2.
Дифузія: а) в рідинах;
б) в газах Швидкість дифузії пропорційна ступеню невирівняності концентрації
(закон Фіка). Вона залежить також від величини і форми часточок, температури
і в'язкості дисперсійного середовища. Цю залежність установив А. Ейнштейн у
1906 році. Значить швидкість дифузії прямо пропорційна температурі, тобто зростає
з підвищенням температури. Швидкість дифузії обернено пропорційна розмірові
часточок і в'язкості дисперсійного середовища, тобто що більший розмір
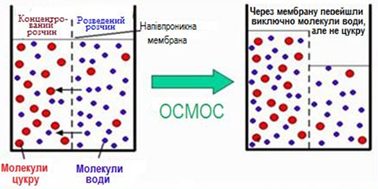
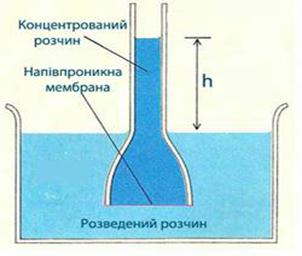
часточок і вища в'язкість середовища, то менша швидкість дифузії. Колоїдні розчини мають осмотичний тиск (однобічний перехід розчинника через
напівпроникну мембрану з розчину з меншою концентрацією у розчин з більшою
концентрацією), хоч для золей він має неважливе значення.
Рис. 7.4.3.
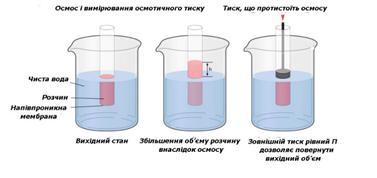
Осмос Осмотичний тиск залежить тільки від кількості частинок в одиниці
об’єму. Осмотичний тиск прямо пропорційний кількості молекул чи йонів, що містяться
в одиниці об'єму істинного розчину, або кількості колоїдних часточок в
одиниці об'єму колоїдного розчину. Він також прямо пропорційний температурі.
Коли взяти до уваги, що колоїдні часточки порівняно з молекулами
низькомолекулярних речовин мають більші розміри і більшу масу, то при тій
самій масовій частці (в %) колоїдного й істинного розчинів в одиниці об'єму
колоїду часточок є набагато менше, ніж в одиниці об'єму істинного розчину
(молярна концентрація). Тому осмотичний тиск у золях дуже малий порівняно з
осмотичним тиском істинних розчинів.
Рис.7.4.4.
Осмос і вимірювання осмотичного тиску
Рис. 7.4.5.
Осмометр – прилад для визначення осмотичного тиску Відносно малі часткові концентрації колоїдних розчинів зумовлюють також
мізерно малі значення всіх інших величин, що залежать від кількості часточок у
розчині. Так, для колоїдних розчинів характерне надзвичайно мале зниження
пружності пари, мізерні (не підлягають вимірюванню) зниження температури
замерзання і підвищення температури кипіння. На дисперговані в рідкому або газоподібному середовищі часточки
речовини впливають протилежно напрямлені сили: сила тяжіння і дифузія. У грубодисперсних системах, де розмір часточок досить значний, сили
ваги набувають важливого значення, вони змушують часточки седиментувати
(осідати) і концентруватися на дні посудини. Прикладом може бути утворення
осаду під час розшаровування суспензії крохмалю в холодній воді. Отже,
грубодисперсні системи кінетично нестійкі та досить легко седиментують. Істинні розчини мають високу кінетичну стійкість, бо часточки їх досить
легкі, тому дифузія переважає над силами ваги і відбувається вирівнювання
концентрацій в усьому об'ємі системи. Колоїдні системи за ступенем дисперсності займають проміжне положення.
Дія сили ваги для колоїдних часточок невелика і зрівноважується дифузією,
тобто настає седиментаційна рівновага. Через це колоїдні часточки не осідають
під дією сили ваги і можуть бути як завгодно довго в завислому стані. Отже,
колоїди – седиментаційно стійкі системи, бо їхні часточки знаходяться в
активному броунівському русі. Седиментаційна стійкість колоїдних систем залежить від розміру їх
часток, що менший розмір часток, то колоїдний розчин стійкіший. Під дією сили тяжіння частинки прагнуть осісти на дно, тобто
седиментувати. Седиментація – це процес осідання часток дисперсної фази під
дією сили тяжіння. Ще більші розміри часток, то з більшою швидкістю вони
осідають.
Рис. 7.4.6.
Седиментація під дією сили тяжіння Седиментаційна рівновага характеризується постійним зменшуванням
концентрації часточок у напрямі від нижніх шарів до верхніх. Це спадання
концентрації підлягає закону Лапласа: за збільшення стовпа золю в
арифметичній прогресії концентрація часточок спадає в геометричній прогресії. Отже, седиментаційна рівновага – це рівноважний розподіл часточок по
висоті в полі земного тяжіння. Для систем з більшими, ніж колоїдні,
часточками спостерігається седиментація, тобто вільне осідання їх під дією
сили ваги. У кулінарній практиці, щоб зменшити швидкість седиментації, значно
збільшують в'язкість середовища і зменшують радіус часточок, ретельно
подрібнюючи харчові продукти (виготовлення протертих супів). Колоїдні часточки під дією сил ваги не осідають або осідають дуже повільно.
Проте виявилося, що можна прискорити седиментацію в колоїдних системах. Для
цього А.В. Думанський запропонував застосувати центрифугування, а пізніше
Сведберг сконструював ультрацентрифугу. Ультрацентрифуги можуть давати тисячі
обертів на хвилину і розвивати відцентрову силу, що в тисячі разів перевищує
силу земного тяжіння. За допомогою центрифуг було визначено розміри часточок
у деяких колоїдах, а також молекулярні маси ряду полімерів.
Рис.7.4.7. Ультрацентрифуга Sorvall MTX 150 Прилад, здатний створювати в пробірках з
біоматеріалом великі навантаження – до 1 000 000 g. У такому відцентровому
полі можна осадити навіть іони, не кажучи вже про великі білки або органели клітини.
Центрифужний ротор зроблений з особливо міцного матеріалу (титану), камера
охолоджується точним холодильником (для виключення конвекції зразка), ротор
обертається в глибокому вакуумі (для запобігання розігріву через тертя об
молекули повітря). Можна сказати, що зразок летить на штучному метеориті. Можливість збільшувати швидкість седиментації внаслідок дії
відцентрової сили дістала практичне застосування під час сепарування молока.
У молочному сепараторі жир, емульгований у молоці, під дією відцентрової сили
концентрується у вигляді вершків набагато швидше, ніж під час природного
відстою молока. Центрифуги застосовують і під час визначення жирності молока. 7.5. Оптичні
властивості колоїдних систем Своїми оптичними властивостями колоїдні розчини істотно відрізняються
від істинних розчинів низькомолекулярних речовин, а також від грубодисперсних
систем. Найхарактерніші оптичні властивості колоїдних розчинів –
опалесценція, ефект Фарадея – Тіндаля та забарвлення. В основі цих
властивостей лежить розсіяння і поглинання світла колоїдними часточками.
Рис. 7.5.1.
Оптичні властивості колоїдних систем В істинних розчинах і чистих рідинах світлорозсіюваня мізерне, тому що
розчинена речовина роздрібнена до молекул або йонів і немає перешкод для
проходження променів видимого світла (розчини оптично порожні). У
грубодисперсних системах розмір часточок більший за довжину хвиль видимого
світла (рис. 7.5.1). Тому світлові промені, що проходять крізь грубодисперсну
систему, не можуть обійти часточок суспензій чи емульсій. Вони безладно
відбиваються і заломлюються на межі поділу часточок з середовищем, зумовлюючи
каламутність суспензій і емульсій, що видно неозброєним оком. Ефект Фарадея-Тиндаля. Якщо в темряві світловий промінь пропустити крізь
прозорий колоїдний розчин, то в золі помітно буде конус світлового пучка.
Подібне явище спостерігається, коли промінь світла проходить у темному запорошеному
приміщенні або промінь прожектора – на нічному небі, а також під час світіння
автомобільних фар у туманну погоду і в багатьох інших випадках. Уперше в 1857
році явище розсіювання світла колоїдними часточками спостерігав М. Фарадей.
Пізніше М. Тіндаль дослідив це явище докладніше. Тому світний слід світлового
пучка в колоїдних системах називають ефектом (конусом) Фарадея-Тиндаля.
Рис. 7.5.2.
Ефект Фарадея-Тіндаля В істинних розчинах або чистих рідинах це явище не спостерігається. Тож
ефектом Фарадея-Тиндаля часто користуються, щоб вирішити питання, чи належить
система до колоїдів. Іноді за зовнішнім виглядом колоїдний розчин важко відрізнити
від істинного (наприклад, золь берлінської лазурі від істинного розчину
мідного купоросу), лише явище Фарадея-Тиндаля дає змогу переконатися, що це
справді колоїдна система. Ефект Фарадея-Тиндаля пов'язаний з тим, що хвилі світла, натрапляючи на
дрібні часточки колоїдів, огинають їх і розсіюються в усіх напрямах. Згідно з рівнянням Релея інтенсивність розсіювання
світла залежить від розмірів колоїдних часточок, прямо пропорційна
концентрації часточок золю і квадратові їхнього об'єму й обернено пропорційна
довжині хвилі падаючого світла в четвертому степені.
де Ір –
інтенсивність розсіяного світла; І0 –
інтенсивність падаючого світла; ν –
число частинок в одиниці об’єму (концентрація частинок); V – об’єм однієї частинки; λ
–
довжина хвилі падаючого світла; k – коефіцієнт пропорційності Отже, якщо джерело падаючого світла випромінює хвилі різної довжини
(біле світло), то найбільше будуть розсіюватися найкоротші хвилі. Тому
розсіяне світло від джерела білого світла повинно мати блакитний відтінок.
Справді, цілий ряд колоїдних систем, якщо спостерігати їх під кутом до
напряму падаючих променів, має блакитнувате забарвлення, тимчасом як у
прохідному світлі вони можуть бути забарвлені інакше. З явищем розсіювання світла колоїдними часточками пов'язана
опалесценція. Виявляється вона в тому, що виникає деяка каламутність і
змінюється забарвлення золю в прохідному і відбитому світлі.
Рис. 7.5.3. Опалесценція Так, водні золі сірки, каніфолі і аргентум хлориду в прохідному світлі
мають червонувато-жовтий відтінок, а у відбитому (тобто, коли спостерігають
збоку) – блакитнуватий. Колір опалесценції золів переважно блакитний (голубий
колір розбавленого водою молока, синій колір морської хвилі, тютюнового
диму). Пояснюється це тим, що жовті й червоні промені (з великою довжиною
хвиль) мало розсіюються і проходять крізь систему, а блакитні й сині (з
меншою довжиною хвиль) добре розсіюються. 7.6.
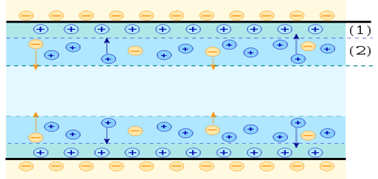
Електрокінетичні властивості колоїдних систем Електричні
властивості колоїдних частинок зумовлені адсорбцією йонів і утворенням подвійного електричного шару
(ПЕШ).
Рис. 7.6.1. Схематичне зображення
подвійного шару: 1 шар Гуї-Чепмена, 2 – шар Штерна Таким
чином, на частинках виникає два стрибки потенціалу. Один
із потенціалів, більший за величиною, виникає між потенціалвизначаючими
йонами і протийонами. Цей стрибок потенціалу називається електричним або термодинамічним
потенціалам і
позначається літерою φ. Другий
потенціал виникає на межі між дифузним і адсорбційним шаром та позначається ζ.
Цей потенціал визначає швидкість переміщення фаз і має назву електрокінетичний
потенціал або
дзета-потенціал
(ζ-потенціал).
Дзета-потенціал має знак заряду твердої поверхні, він менший φ
потенціалу. Протийони
дифузного шару можуть обмінюватись на інші йони того ж знаку. За підвищення
концентрації розчину протийони з дифузного шару витискуються в адсорбційний
шар, внаслідок чого дзега-потенціал може стати рівним нулю. В такому випадку
вважається, що міцела знаходиться в ізо-електричному стані. Електрокінетичний
потенціал залежить не тільки від природи речовини, як термодинамічний
потенціал, але й від температури. Електрокінетичний потенціал має більше
значення за характеристики колоїдних систем і, зокрема, відображає стійкість
системи. Для
встановлення знаку заряду потенціалу і для кількісних вимірювань можна
скористуватись двома електрокінетичними явищами – електрофорезом та електроосмосом. Електрокінетичними називають явища, які полягають у тому, що частинки або рідина рухаються під дією різниці потенціалів, або, навпаки, різниця потенціалів виникає внаслідок руху частинок або рідини. Подвійний іонний шар є причиною електрокінетичних
явищ, тобто явищ відносного переміщення фаз в електричному полі або, навпаки,
виникнення електричного поля в результаті переміщення фаз. Якщо в золь або
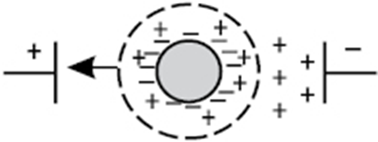
суспензію помістити два електроди і пропустити постійний струм, заряджені часточки будуть
рухатися до потрібного полюса. Таке спрямування руху твердих
часточок у колоїдному розчині називається електрофорезом. У
результаті електрофорезу виникає осідання часточок на електроді.
Рис.7.6.2. Схема руху частинок під час електрофорезу
Рис. 7.6.3. Апарат для електрофорезу (припускає введення лікарських
препаратів за допомогою постійного струму, що
впливає на організм) Рух іонів дифузного шару в електричному полі
крізь пористу систему з неоднорідною твердою фазою (наприклад, керамічна та
целофанова діаграми, ґрунт) викликає напрямлену течію всього розчину крізь
пори до потрібного електрода. Це явище називається електроосмосом.
Рис. 7.6.4. Схема руху частинок під час електроосмосу
Рис. 7.6.5. Застосування електроосмосу Метод електрофорезу знайшов широке використання в
медицині для розділення різних білків, нуклеїнових кислот і навіть клітин.
Існують багато його варіантів: вільний електрофорез, електрофорез на папері,
на агаровому гелі, поліакриламідному гелі та інші. Вільний
електрофорез запропонував Арне Тізеліус, який розділив білки
сироватки крові (Нобелевська премія). Принцип методу полягає в тому, що суміш
білків поміщають у кювети з буферним розчином, який контактує з електродами. Під
дією постійного електричного струму білки починають рухатись. Найшвидше
рухались альбуміни, другими альфа-1-глобуліни, третіми альфа-2-глобуліни,
четвертими бета- глобуліни та п’ятими гама-глобуліни. Цей метод технічно є
складним і потребує спеціальної оптичної системи для спостереження за рухом
білків. Набагато простішим є електрофорез на папері.
Смужку фільтрувального паперу змочують буферним розчином, на один з кінців
смужки наносять суміш білків, а до обох кінців відповідно катод та анод від
джерела постійного струму. Оскільки різні білки мають різний заряд, то вони
з різною швидкістю рухаються в електричному полі, завдяки чому і відбувається
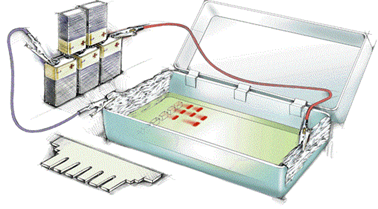
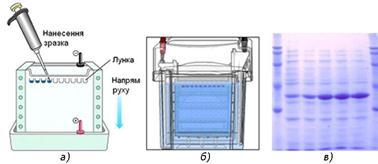
їх розділення. Великим досягненням став електрофорез у гелях (агаровому, поліакриламідному та інших).
Гелі є сітчастими структурамии і молекулярними ситами. Залежно від розміру
пор у гелях одні білки можуть проходити через нього, інші затримуються на
довший час. Тому за таких умов забезпечується сепарація молекул не лише за
величиною їх заряду, але і за їх розміром. Електрофорез в агаровому гелі став
головним методом в аналізі структури ДНК та РНК і використовується під
час проведення полімеразної ланцюгової реакції, за якою можна виявляти
віруси, генетичні мутації, встановлювати батьківство.
Рис. 7.6.6. Схема розділення білків методом гель-електрофорезу: а – нанесення зразків у гель; б – камера для електрофорезу; в – електрофореграма для білків Метод електрофорезу широко використовується в
медицині, наприклад, для видалення та дослідження деяких фракцій білків
плазми крові, що дозволяє діагностувати багато захворювань. Електрофорез
широко застосовують також для поділу амінокислот, антибіотиків, ферментів і
т.ін. За допомогою електрофорезу встановлено, що всі біологічні поверхні
мають негативний електрокінетичний потенціал, величина якого різна для різних
плівок. 7.7. Стійкість і коагуляція колоїдних систем Стійкість колоїдної системи – це здатність зберігати
незмінною в часі структуру, тобто дисперсність і рівномірний розподіл
дисперсної фази. У колоїдних системах розрізняють два види стійкості: агрегативна та кінетична
(седиментаційна). Кінетична (седиментаційна) стійкість – це здатність дисперсної
системи протистояти силі тяжіння. У грубодисперсних системах, де розмір часточок досить значний, сили
ваги набувають великого значення, вони змушують часточки седиментувати
(осідати) і концентруватися на дні посудини. Прикладом може бути утворення
осаду під час розшаровування суспензії крохмалю в холодній воді. Отже, саме
грубодисперсні системи є кінетично нестійкі, на відміну від молекулярних
систем і досить легко седиментують. Істинні розчини мають високу кінетичну стійкість, бо часточки їх досить
легкі, тому дифузія переважає над силами ваги і відбувається вирівнювання
концентрацій в усьому об'ємі системи. Під агрегативною
стійкістю розуміють властивість системи протидіяти збільшуванню,
злипанню (коагуляції) часточок. Цей вид стійкості пояснюється з одного боку,
наявністю однойменного заряду в усіх часточках золю. Заряд перешкоджає
злипанню і збільшуванню колоїдних часточок, тобто перешкоджає коагуляції. З
іншого боку, агрегативна стійкість пояснюється тим, що навколо колоїдних часток утворюються тісно
пов’язані ними сольватні (гідратні)
оболонки з молекул розчинника. Вони не дать змоги протийонам дифузного шару
проникати в адсорбційний шар і нейтралізувати цілком заряд
потенціалвизначаючих йонів. Що товщий дифузний шар, то стійкіший колоїд.
Стійкість колоїдної системи пояснюється взаємодією
міжмолекулярних сил притягання між часточками й електричних сил
відштовхування, що перешкоджають коагуляції. Якщо в колоїдних розчинах сили притягання між часточками більші, ніж
сили відштовхування, то відбувається злипання частинок у більші за розміром
агрегати, що призводить до порушення агрегативної стійкості. Коагуляція – процес злипання колоїдних часток, утворення великих
агрегатів із подальшою втратою колоїдною системою агрегативної стійкості.
Колоїдні розчини мають різну агрегативну стійкість. Початок коагуляції можна
визначити за різними ознаками: зміною забарвлення золю, виникненням каламуті,
початком виділення осаду тощо. Деякі золі живуть лише
секунди, а інші існують тривалий проміжок часу (золь золота створений
англійським вченим Фарадеєм у 1845 році зберігається донині в Британському
музеї).
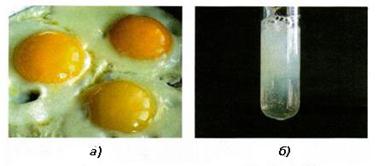
Рис. 7.7.1.
Коагуляція білка: а) під час
нагрівання; б) під час зміни середовища розчину Стійкість колоїдних систем пояснюється взаємодією міжмолекулярних сил
притягання між часточками й електричних сил відштовхування, що перешкоджають
коагуляції. Інтенсивність притягання і відштовхування залежить від відстані
між часточками: на відносно великих віддалях переважає відштовхування, на
малих – притягання. На дуже малих віддалях сили міжмолекулярного притягання
починають переважати над силами відштовхування і часточки золю злипаються,
тобто відбувається коагуляція колоїдних часток.
Рис. 7.7.2.
Процес коагуляції Сили відштовхування зменшуються зі збільшенням товщини електричного
шару, що може бути зумовлене, наприклад, добавкою електроліту до золю. При
цьому відбувається десольватація (дегідратація) йонів дифузного шару, що
спричиняє повну нейтралізацію зарядів потенціалвизначаючих йонів, тобто
втрата заряду колоїдної частинки. Такий стан золю, коли наступає повна
електрична нейтралізація гранул і заряд починає дорівнювати нулю, відповідає
ізоелектричному стану системи. Колоїдний розчин в ізоелектричному стані найменш стійкий і легко
руйнується. При цьому порушується агрегативна стійкість – можливою стає
коагуляція. Потім порушується кінетична стійкість – відбувається осадження
колоїдної речовини під впливом сил тяжіння – седиментація. Коагуляцію можна викликати підвищенням температури, механічною дією,
високочастотними коливаннями та ін. Встановлено, що доливання електролітів
також спричинює коагуляцію. У цьому разі коагуляція пояснюється тим, що
введені в колоїдний розчин йони електроліту дегідратують йони дифузного шару,
сприяють переходові їх до адсорбційного шару. При цьому дифузний шар
стискається і зменшуються сили електричного відштовхування, а сили
міжмолекулярного зчеплення зростають, що сприяє злипанню і збільшенню
часточок.
Рис. 7.7.3.
Процес осадження: 1 – посуд з
коагулянтом; 2 – додавання коагулянта у воду; 3 – дія
добавки; 4 – утворення осаду Щоб викликати коагуляцію золів доливанням електролітів, потрібно брати електроліт
у певній кількості. Якщо концентрації електролітів невеликі, настає лише
початкова стадія коагуляції, коли відбувається незначне злипання часточок.
Початкова стадія коагуляції проходить для неозброєного ока непомітно й тому
називається прихованою коагуляцією. Зі збільшенням концентрації електроліту
коагуляція розвивається, підвищується її швидкість, що супроводиться появою
більших часточок. При цьому золь мутніє. Цю стадію процесу називають явною
коагуляцією. Та найменша кількість електроліту, яка спричинює початок явної
коагуляції, визначає її поріг. У золів поріг коагуляції звичайно невеликий,
виражається він у частках мілімолів електроліту на літр золю. Мінімальну концентрацію
електроліту в ммоль, яка здатна спричинити коагуляцію 1 дм3 золю,
називають порогом
коагуляції (Спор).
де Vел – об’єм електроліту(см3),
що спричинив коагуляцію; Сел – концентрація електроліту, ммоль/дм3; Vзолю –
об’єм золю см3. Стійкість колоїдного розчину можна збільшити, додаючи до нього невелику
кількість розчину високомолекулярної речовини. Це явище називають колоїдним
захистом. Так, червоний золь золота швидко коагулює від доливання невеликої
кількості електроліту. Якщо ж до золю золота попередньо долити невелику
кількість розчину желатину, то стійкість золю до дії коагулюючих йонів різко
зросте. Щоб викликати коагуляцію такого захищеного золю золота, потрібна
значна кількість електроліту. Механізм захисної дії зводиться до утворення навколо колоїдної часточки
адсорбційної оболонки з високомолекулярної речовини. Макромолекули полімеру,
адсорбуючись на поверхні міцели, утворюють міцну оболонку, що перешкоджає
злипанню колоїдних часточок. Флокуляція – один з видів коагуляції, при якій дрібні
частинки, під впливом спеціально доданих речовин (флокулянтів) інтенсивно
осідають пухкі скупчення. На відміну від коагуляції, при флокуляції у
присутності флокулянтів відбувається зчеплення частинок дисперсної фази і
виникнення просторових дисперсних структур. Процес утворення пластівців із дисперсних частинок може протікати за
допомогою високомолекулярних речовин (флокулянтів) на
основі адсорбції макромолекул флокулянта на поверхні
частинок домішок у воді. Флокуляція
Такі біологічні
рідини живих організмів, як кров, плазма, лімфа, спинномозкова рідина, сеча
та інші є колоїдними системами, в яких низка речовин, наприклад, білки,
холестерин, глікоген та інші, перебувають у колоїдному стані. За багатьма
показниками крові можна зробити висновок про фізіологічний стан організму.
Найменші відхилення від норми кількості формених елементів крові
(еритроцитів, лейкоцитів, тромбоцитів), швидкості осідання еритроцитів (ШОЕ),
згортання і т.д. свідчать про наявність патологічних процесів в організмі людини. Взагалі цільну кров
можна розглядати як емульсію, в якій формені елементи – дисперсна фаза, а
плазма – дисперсійне середовище. У той самий час плазма є високодисперсною
системою, в якій дисперсну фазу складають білки, гормони, ферменти і т.д. На
поверхні еритроцитів адсорбовані молекули білків, амінокислот, іони
електролітів, які визначають
негативний заряд. Еритроцити – достатньо великі часточки в нормальному стані,
вони коагулюють і осаджуються з визначеною швидкістю (ШОЕ). За наявності
патологічних процесів в організмі змінюється біохімічний склад крові,
еритроцити адсорбують молекули білків: глобулінів і фібриногенів, змінюється
заряд еритроцитів і збільшується швидкість осідання еритроцитів (ШОЕ). Цей
аналіз використовується для діагностики низки захворювань. Процес
згортання крові є явище, аналогічне коагуляції, і забезпечує мінімальну
втрату крові та утворення тромбоцитів у кровоносній системі. В основі процесу
розчинення тромбів лежить явище пептизації. Пептизатором
проти згортальної системи є антикоагулятор крові – гепарин. Під час
консервування крові необхідно враховувати, що одним з факторів згортання
крові є іони кальцію. Цільну кров декальцинують або домішкою цитрату натрію,
або домішкою антикоагулянтів (гепарин, дикумарин і т.д.), або за допомогою
іонутворювальних смол – катіонітів. СТАБІЛІЗАЦІЯ ЗОЛІВ. КОЛОЇДНИЙ
ЗАХИСТ Колоїдний
захист. Як відомо, гуморальні рідини
організмів – кров, плазма, лімфа та інші – є колоїдними системами, які
містять такі речовини, як білки, холестерин, глікоген тощо у колоїдному
стані. Колоїди різних тканин обумовлюють їх властивості
(стан гелів, еластичність, набухання та ін.). Колоїдні речовини можуть
з’єднувати великі кількості води (сполучна тканина, склоподібне тіло та ін.),
а також адсорбувати (приєднувати) різноманітні речовини.
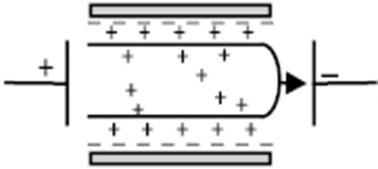
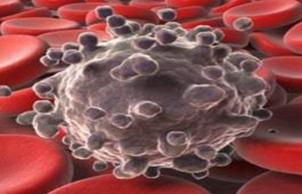
Рис. 1. Колоїдна система Стабілізація золів відносно електролітів шляхом
додавання невеликої кількості ВМС називається захистом, а речовини,
які її викликають – захисними. До них належать
речовини, які розчиняються у воді: білки, ефіри целюлози, ВМС, мила,
декстрин, крохмаль тощо. В основі захисної дії лежить адсорбція молекул
захисної речовини поверхнею колоїдних частинок і внаслідок цього захист їх
від безпосереднього зіткнення між собою, а таким чином і від агрегації.
Захищений золь набуває всіх властивостей адсорбованої захисної речовини.
Захисна дія ВМС залежить від природи колоїдного розчину, який захищається, і
його дисперсності, від природи самого ВМС, від рН і т.д. Захисну
здатність різних речовин можна порівнювати відносно стандартного золю, наприклад,
відносно золю золота. Під захисним числом розуміють кількість міліграм сухої
захисної речовини, яку необхідно додати до 10 мл дослідного золю, щоб
захистити його від коагуляції.
Важливе значення має колоїдний захист для живих
організмів. Захисну дію в організмі мають нуклеїнові кислоти, різні білки та
їх похідні: нуклеопротеїди,
ліпопротеїди і т.д., глікоген, полісахариди, пектини. Вони адсорбуються на колоїдних
частинках гідрофобних систем організму, переводячи їх у стійкий стан. Так,
наприклад, сеча є колоїдним розчином, в якому дисперсні частинки захищені
різними білками – альбумідами. Протеїни сироватки крові збільшують
розчинність СаСО3 в декілька разів. Білки крові захищають
краплинки жиру, холестерин і низку інших гідрофобних речовин, у здорових
людей вміст захисних речовин у рідких системах організму постійний. За деяких
видів патології, а також під час старіння організму захисні властивості білків
та інших речовин змінюються. Зниження ступеня цього захисту призводить до
відкладання, наприклад, холестерину і кальцію на стінках судин (атеросклероз і атерокальциноз). З віком
порушується лецитино-холестеринова рівновага, в результаті чого змінюється співвідношення
між холестерином, фосфоліпідами і білками. Холестерин відкладається на
стінках судин, обумовлюючи вікові зміни судин (зниження еластичності,
зменшення діаметра судин і т.д.), у зв’язку з чим спостерігають значні зміни
в тканинах. Вірогідно, цей процес є одним із суттєвих факторів старіння
організму. Зниження захисних властивостей білків та інших
гідрофільних з’єднань у крові призводить до утворення каменів у нирках,
печінці, протоках залоз травлення. У харчовій промисловості під час виготовлення
маргарину, майонезу, морозива як стабілізатор використовують желатин, яєчні
білки та інші речовини. З давніх часів
лікарям і хімікам відомо про антибактеріальні властивості срібла.
Скориставшись явищем колоїдного захисту, вчені розробили харчові розчини з
додаванням іонів срібла, об’єднанню яких перешкоджають захисні речовини.
Таким чином, з’явилася можливість застосовувати перорально срібло. Колоїдне
срібло використовують в якості природного антибіотика. Існують експерименти
застосування срібла в боротьбі з раком, СНІДом, туберкульозом, у разі
захворювання сечостатевої системи.
Питання для
самоконтролю 1. Дисперсна система, дисперсна фаза,
дисперсійне середовище. 2. Класифікація дисперсних систем. 3. Колоїдні системи, їх ознаки. Методи
одержання колоїдних систем. 5. Оптичні властивості колоїдних систем. 6. Електрофорез, електроосмос. Їх суть і
значення. 7. Як виникає електрокінетичний потенціал
на межі розділу фаз? 8. Які іони називаються потенціал визначальними і
проти іонами? 9. Який шар іонів називають адсорбційним,
а який – дифузним? 11. Який стан золю називається
ізоелектричним?
Явище дифузії в технології
приготування виробів із тіста: вплив швидкості дифузії на кількість
екстрактивних речовин, з овочами в різних технологічних режимах, можливість
керування технологічними процесами. Використання явища осмосу для
приготування цукрових сиропів.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||