|
|
ФІЗИЧНА І КОЛОЇДНА ХІМІЯ Електронний посібник |
||||||||||||||
|
|
ПОВЕРХНЕВІ ЯВИЩА |
||||||||||||||
|
6.3. Адсорбція газів твердими
адсорбентами. Теорія Ленгмюра 6.4. Адсорбція розчинених речовин твердими адсорбентами. Колоїдна
хімія – це самостійний розділ фізичної хімії, що вивчає дисперсні системи,
поверхневі явища та методи їх дослідження.
Адсорбція – це самочинний процес зміни
концентрації компонентів у поверхневому шарі порівняно з їх концентрацією в
об’ємі фази.
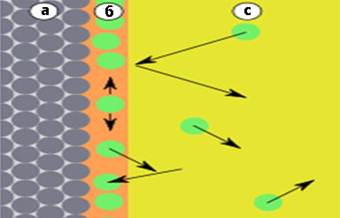
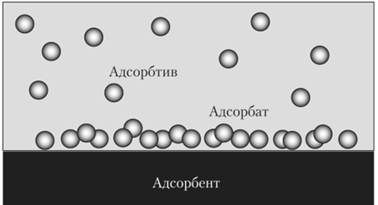
Рис. 6.1.4. Адсорбція: а) адсорбент; б) адсорбат; с) адсорбтив Адсорбент –
це речовина, що здатна поглинати (адсорбувати) інші речовини на своїй
поверхні. Адсорбат
– це речовина, що вже
адсорбована. Адсорбтив
– це речовина, молекули
якої здатні поглинатися адсорбентом.
Якщо внести у водний розчин оцтової або іншої
карбонової кислоти тверду речовину, наприклад, порошок активованого вугілля,
то на поверхні поділу фаз, що утворилася, відбудеться накопичення молекул
розчиненої речовини. Причому далі поверхневого шару це переміщення молекул не
відбувається. Аналогічне явище буде спостерігатися під час контакту вугілля з
повітрям, в якому є фосген, хлор, або інші гази у стані, далекому від
насичення. Наведені приклади, а також усі подібні процеси
Дж.Мак-Бен назвав сорбційними. Отже, сорбцією називають поглинання будь – якою речовиною інших
речовин. Сорбентами називаються
поглинаючі речовини, незалежно від їх агрегатного стану і ступеня
дисперсності (наприклад, тверді сорбенти – активоване вугілля, силікагель;
рідкий сорбент – краплі емульсії; газоподібний сорбент – бульбашки піни).
Рис. 6.1.5. Сорбенти: 1) активоване вугілля; 2) силікагель; 3) бульбашки піни Процеси, які завершуються в поверхневому шарі, можна
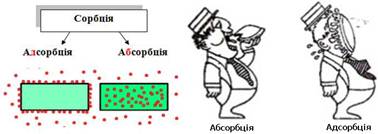
розділити на адсорбцію та поверхневі хімічні реакції. Процеси, які проходять не тільки на поверхні, але й
в об'ємі твердого сорбенту, поділяють на абсорбцію, хемосорбцію і
капілярну конденсацію.
Отже, сорбція – поглинання (вбирання) газів, парів та розчинених
речовин твердими тілами або рідинами (сорбентами). Розрізняють:
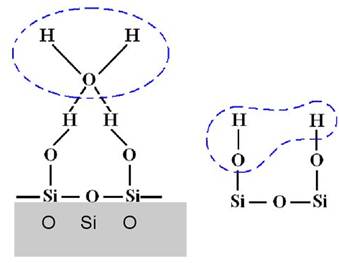
Рис. 6.1.6. Хемосорбція Н2О
на силікагелі (молекули
води утримуються на поверхні
SiO2 хімічними
силами) Хемосорбція спостерігається під час поглинання карбон (IV)
оксиду кальцій гідроксидом, вона супроводжується збільшенням кількості фаз у
системі, на відміну від поверхневих хімічних реакцій. Са(ОН)2 + СО2 =СаСО3 + Н2О
Рис. 6.1.7. Приклад ідеалізованої пористої структури для демонстрації капілярної конденсації Так використовують капілярну
конденсацію для очищення повітря і збирання легколетких дорогих речовин. Вона
дає можливість повторно використовувати ці речовини у виробництві. Наприклад,
у гумовому виробництві використовують дорогий авіаційний бензин. Його не
випускають у повітря, а збирають капілярною конденсацією. Адсорбція – це оборотний процес.
Процес, зворотний адсорбції, називається десорбцією. Кількісно адсорбцію виражають величиною різниці числа ммоль адсорбтива в об'ємі поверхневого шару площею 1 см2
і числа його моль у тому ж об'ємі всередині адсорбенту (Г = ммоль/см2). Адсорбція – Десорбція
Практичне значення адсорбційних явищ
дуже велике. Протигази тієї або іншої конструкції широко застосовують під час
роботи в різних шкідливих виробництвах. Адсорбцію безпосередньо
використовують під час вироблення цукру (для його очищення), в нафтовій
промисловості (для уловлювання бензину з природних газів) і т. д. Адсорбційні
процеси лежать в основі фарбування тканин, дублення шкір і т. д.
Рис. 6.1.8. Практичне
застосування адсорбційних процесів: а) під час фарбування тканин; б) в протигазах ГП-7 Адсорбція відіграє основну роль під час
протікання багатьох каталітичних реакцій і в хімії колоїдних розчинів. На ній
засновані також деякі методи аналітичної хімії. Так, найкраща реакція
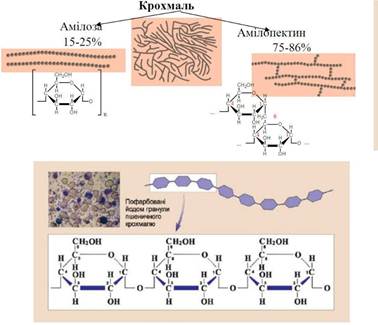
відкриття вільного йоду – синє забарвлення крохмалю – обумовлена утворенням
адсорбційного з’єднання. Важливого значення нині набув так званий,
хроматографічний метод розділення речовин, заснований на різному поглинанні
адсорбентом окремих складових частин вихідної суміші.
Рис. 6.1.9. Якісна реакція на крохмаль (пофарбовані йодом гранули харчового крохмалю) 6.2. Адсорбція на поверхні рідина-газ. Поверхнево-активні та поверхнево-інактивні речовини. Рівняння
гіббса Адсорбентами
можуть бути як рідини, так й тверді речовини. Під час розчинення одні
речовини накопичуються на поверхні розчинника, а інші прагнуть піти з
поверхні усередину рідини. Це обумовлено різним впливом речовин, що
розчиняють, на величину поверхневого натягу розчинника. З курсу фізики
відомо, що поверхневий натяг чисельно дорівнює питомій вільній енергії поверхні.
Оскільки, відповідно до другого закону термодинаміки, вільна енергія
будь-якої системи прагне до мінімуму, речовини під час розчинення яких
поверхневий натяг рідини зменшується, будуть накопичуватися в поверхневому
шарі, тобто адсорбуватися позитивно (Г > 0). Такі
речовини називаються поверхнево-активними (ПАР), тобто речовини що адсорбуючись на поверхні
рідини, знижують її поверхневий натяг.
Рис. 6.2.1. Будова мономолекулярного шару ПАР на поверхні
води: а) заи адсорбції
з дуже розбавленого розчину ПАР; б) за повного заповнення
моношару Речовини,
що підвищують поверхневий натяг і прагнуть піти з поверхні усередину рідини, називаються поверхнево-інактивними. Практично не змінюють поверхневий натяг
сахароза, лактоза. Наприклад,
під час додавання до води
пропанолу С3Н7ОН, поверхневий натяг води
знижується. Тобто цей спирт, по відношенню до води,
є поверхнево – активною речовиною. Відносно води поверхнево-активними
є багато органічних сполук – спирти, карбонові кислоти, аміни та ін., а поверхнево-інактивними – неорганічні:
електроліти –
кислоти, основи, солі.
Рис.6.2.2. Поверхнево-інактивні речовини Загальним для всіх видів
ПАР є їх дифільний
характер, тобто наявність
у молекулі полярної групи
(– ОН, –СООН,
– NH2 та ін.),
що гідратується під час розчинення у воді, та вуглеводневого радикалу, що не має водної
оболонки. Дифільні молекули
прийнято зображувати
символом: – О, де кружок позначає
полярну групу, а риска – вуглеводневий
радикал.
Рис. 6.2.3. Модель молекули ПАР: будова гептанового спирту Наприклад,
молекула гептанолу СН3 – (СН2
)6 – ОН має неполярний вуглеводневий радикал С7Н15
– і полярну гідроксильну групу – ОН. Залежно
від знака заряду частки, що володіє поверхневою
активністю, розрізняють аніонні, катіонні та неіонні ПАР.
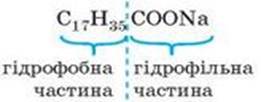
Прикладом аніонних ПАР є мила – солі
вищих жирних кислот (C17Н35COONa →
С17Н35СОО– + Na+),
катіонних – аміни й органічні
похідні амонію (C12H25NH2 + Н2О
→
C12Н25N+H3 + ОН–
), неіонних
– спирти, ефіри сахарози, оксиетильовані сполуки. Залежність між величиною адсорбції (Г),
концентрацією ПАР в розчині й зміною поверхневого
натягу виражається рівнянням
адсорбції Гіббса:
де Г – адсорбція, моль/м2; С – концентрація розчину, моль/м3; R –
універсальна газова стала; Т – температура, К Величина
Рис. 6.2.4. Залежність поверхневого натягу від концентрації водних розчинів кислот
Рис. 6.2.5. Розміщення молекул поверхнево-активної речовини на
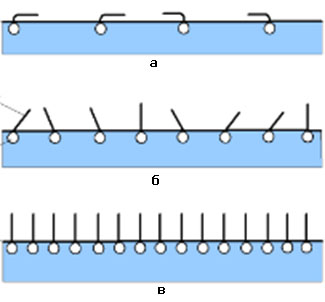
поверхні води за малих а), середніх б) і великих в) концентрацій ПАР Розташування молекул ПАР у поверхневому
шарі залежить від їх концентрації в цих шарах. За низьких концентрацій ПАР в
розчині і, відповідно, в адсорбційному
шарі, полярна група дифільної молекули занурена у воду, а
вуглеводневий радикал розташований на поверхні води (рис. 6.2.5 а). За збільшення концентрації розчину молекули ПАР
спочатку сполучаються в агрегати, в яких радикали орієнтовані паралельно один
одному (рис. 6.2.5 б), а потім вся поверхня
рідини покривається мономолекулярним шаром вертикально розташованих молекул
(рис.6.2.5 в). За подальшого збільшення концентрації ПАР в розчині будова
адсорбційного шару і поверхневий натяг не змінюються. 6.3. Адсорбція газів твердими адсорбентами. Теорія ленгмюра У 1773 році шведський хімік Шеєле описав досліди з поглинанням газів вугіллям. Перші систематичні дослідження поглинання
газів провів швейцарський хімік Соссюр у 1814 році. У XX сторіччі явище адсорбції одержало теоретичне обґрунтування в роботах Гіббса,
Ленгмюра, Поляні та інших вчених. Фундаментальні роботи М.Д. Зелінського та
М.О. Шилова з адсорбції газів на активованому вугіллі, викликані розробкою
протигазів у часи Першої світової війни, були поштовхом до подальшого
вивчення адсорбції на твердих адсорбентах. Так як адсорбція відбувається на поверхні адсорбента, то що більшою буде його поверхня, то вище
його здатність до адсорбції. Особливе значення мають нерівності поверхні, оскільки інтенсивно адсорбція відбувається на активних центрах (кутах,
ребрах кристалів, мікровиступах
поверхні, там, де містяться атоми, що мають
ненасичені вільні валентності). Адсорбат – шар молекул адсорбтиву, що знаходиться на поверхні адсорбенту. Для пористих твердих адсорбентів точно визначити
площу поверхні важко і тому в системі СІ розмірність адсорбції – моль/кг. Кількість адсорбтиву, що адсорбується певним адсорбентом, залежить від природи адсорбенту і газу, від тиску та температури.
За сталої температури адсорбція є функцією тиску газу. Ця функціональна
залежність називається ізотермою адсорбції
і у простому випадку має вигляд:
Рис. 6.2.6. Ізотерма адсорбції Ленгмюра На ізотермі Г – гранична
кількість адсорбційної речовини; І, ІІ, ІІІ – ділянки, що відповідають ізотермі за низьких (І), середніх (ІІ) і
високих тисків (ІІІ) Залежність адсорбції від концентрації за постійної
температури для газів і розчинених речовин на поверхні твердих адсорбентів
можна виразити графічно у вигляді кривої (ізотерма адсорбції), або аналітично за допомогою емпіричного рівняння Фрейндліха:
де х – кількість адсорбованого газу; m – маса адсорбенту; Р – тиск газу. К, 1/n – сталі величини, які залежать від природи адсорбенту і адсорбтиву. Рівняння Фрейндліха застосовується для невеликого
інтервалу середніх значень тиску, в якому ізотерма адсорбції має вигляд
кривої. Його не можна застосовувати для визначення адсорбції при малих і дуже
великих тисках. Відносно задовільно описує адсорбцію як для низьких
так і для високих величин тиску,
рівняння Ленгмюра:
Г – кількість адсорбованої речовини (моль/г
адсорбенту); Гmax – максимальна адсорбція, коли
всі активні центри адсорбенту зайняті адсорбованою речовиною; С – концентрація адсорбтива після встановлення рівноваги; K – коефіцієнт адсорбції; Р – тиск газу. На поверхні твердих тіл можуть
адсорбуватися газоподібні речовини, а також молекули й іони розчинених
речовин. Основні положення адсорбційної теорії були сформульовані
в 1915 році американським
вченим Ленгмюром і полягають у такому:
Ірвінг Ленгмюр
За
відносно великих тисків газу на першому адсорбційному шарі утворюється
другий, а потім третій і наступні. Теорія, яка враховує утворення полі
молекулярних шарів, отримала назву теорія БЕТ (на
ім'я її авторів: С. Брунауер, П.Х. Еммет і Е. Теллер). Існують й
інші теорії адсорбції. 6.4. Адсорбція розчинених речовин твердими адсорбентами Перші
дослідження адсорбції із розчинів належать російському вченому Т.Є. Ловіцу (1785 р.). Він вперше запропонував застосувати
активоване вугілля для очищення спирту та питної води. Адсорбція оцтової кислоти
активованим вугіллям
Адсорбція
із розчинів на твердому адсорбенті – складніший
процес, ніж адсорбція газів. Особливості
адсорбції розчинених речовин із розчинів:
Всі
адсорбенти можна поділити на два основних типи: гідрофільні (добре
змочуються водою), гідрофобні (змочуються органічними
розчинниками).
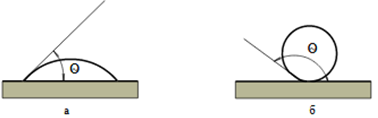
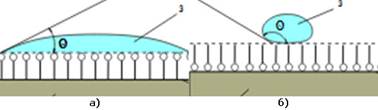
Рис. 6.4.1. Змочування водою а) гідрофільної і б) гідрофобної поверхні твердого тіла, θ – крайовий кут змочування До гідрофільних
адсорбентів належать силікагель, глина, кізельгур, трепел. Ці адсорбенти
доцільно застосувати для адсорбції із неводних розчинів, наприклад для
очищення олій, нафтопродуктів, барвників. Гідрофобні адсорбенти – активоване
вугілля, графіт, тальк – добре адсорбують речовини із водних розчинів. їх
застосовують
у виробництві спирту. У цукровій
і крохмале-патоковій промисловості
за допомогою активованого
вугілля знебарвлюють
цукрові та глюкозні сиропи. Активоване вугілля застосовують для очищення
питної води. Адсорбція розчинених речовин твердими адсорбентами підпорядковується правилу
вирівнювання полярностей Ребіндера. Що ближче за своєю
природою адсорбент до розчинника, то менше адсорбується розчинена речовина з
цього розчинника. З величинами
поверхневого натягу пов'язане явище змочування. Змочування визначається
співвідношенням сил взаємодії між атомами на поверхні твердого тіла та
молекулами рідини, з одного боку, та між молекулами самої рідини – з іншого.
Рис. 6.4.3. Змочування рідиною твердого тіла: а) поверхня змочується рідиною; б) – не змочується Змочування
характеризується величиною крайового кута, який утворюється з площиною (рис.
6.4.3). За певного змочування цей кут дорівнює нулю. Однак природу твердої поверхні
адсорбента можна змінити:
гідрофільну поверхню зробити гідрофобною, а гідрофобну – гідрофільною. Для
цього на твердій поверхні створюють адсорбційний шар поверхнево-активних
речовин (мило, жирні кислоти). Якщо гідрофільну поверхню обробити розчином
будь-якої жирної кислоти, то молекули кислоти адсорбуючись на такій поверхні,
утворюють орієнтовний шар, в якому полярні групи молекул спрямовані до
поверхні матеріалу, вуглеводневий радикал – до повітря. Поверхня речовини
набуває гідрофобних властивостей. Краплі води на такій поверхні утворюють
тупі крайові кути. Це застосовують
під час обробки приладів жировими речовинами: для позбавлення від прилипання в кулінарії, у
кондитерському виробництві, під час випікання хліба. У сучасному посуді
застосовують тефлонові покриття, які є гідрофобним матеріалом. Інколи, навпаки,
гідрофобній поверхні надають властивостей гідрофільності. Наприклад,
під час обробки милом та синтетичними мийними засобами, посуд набуває гідрофільних властивостей. Практичне
значення адсорбції Миюча дія мила ґрунтується на адсорбції
часточок. Адсорбційні властивості мила зумовлені тим, що воно має гідрофільні
властивості.
Наприклад, якщо шкіра рук, білизна,
столовий посуд внаслідок забруднення стають жирними і втрачають властивість
гідрофобності, тобто змочуватись водою, використовують мило. Під час обробки милом ці поверхні стають
гідрофобними, утворюєтья піна, яка піднімає вгору
забруднені частини, тому миюча дія мила заснована на процесах адсорбції
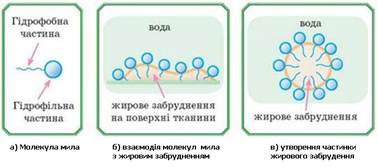
частинок. Якщо на тканині жирна пляма або бруд (а
це зазвичай шкірний жир, змішаний з іншими забрудненнями), то під час їх
прання молекули мила гідрофобною частиною поринають у жир, гідрофільні частини
виявляються ззовні й з допомогою
водневих зв’язків «чіпляються» за молекули води. У
такий спосіб молекули мила «прив’язують» жир до води, у результаті жир і бруд
залишають поверхню тканини й переходять у воду у вигляді дрібних крапель,
утворюючи емульсію (рис. 6.4.4). Якщо тканина повністю очищена від жиру,
бруд не затримується на ній.
Рис. 6.4.4. Мийна дія мила Вуглеводневий ланцюг мила (а)
розчиняється в жировому забрудненні (б). Це призводить до утворення частинок
жирового забруднення, оточеного молекулами мила (в), які змиваються водою.
Явищем адсорбції пояснюється врахування
товарного сусідства під час зберігання продуктів на складах та сховищах. Явище адсорбції впливає на смакові
якості харчових продуктів. Тому необхідно в складських приміщеннях, в
холодильних камерах дотримуватись правил товарного сусідства.
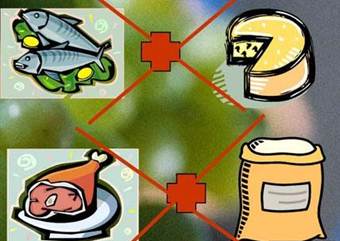
Рис. 6.4.5. Правила товарного сусідства Так, молочні продукти (сир, масло тощо)
не можна зберігати і трансформувати разом з рибними продуктами, копченостями, різними
ароматними речовинами, бо вони поглинають їх запах. Зберігають макаронні вироби,
борошно, крохмаль, цукор і кухонну сіль у сухих чистих приміщеннях (без
сторонніх запахів), які часто вентилюються, без різких коливань температури,
що не перевищує 20 °С і за відносної вологості не більше 70 %. Цукор і крупи
ізолюють від сильно пахучих продуктів, а також вологих продуктів, тому що
вони своєю поверхнею адсорбують сторонні запахи та вологу, при цьому зменшується цукристість, вміст клейковини в борошні. 6.5. Йонообмінна адсорбція Адсорбція іонів залежить від їх природи
– заряду, радіусу, ступеня гідратації. Що більше заряд іона, то краще він
адсорбується.
Із іонів з однаковими зарядами краще адсорбується іон, який має найбільший
радіус, так як він має найменший ступінь гідратації. Гідратна оболонка
запобігає адсорбції, тому що менший ступінь гідратації, то іон краще
адсорбується. Правило Фаянса-Панетта: на поверхні кристалічного твердого тіла
із розчину адсорбується той з іонів, який входить до складу кристалічної гратки або може утворювати
з одним з іонів гратки малорозчинну сполуку.
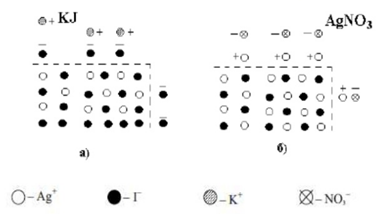
Рис.6.5.1. Схема адсорбції на кристалах AgJ, поміщених у розчин:
а) KJ; б) AgNO3 Розглянемо
адсорбцію йонів із розчину KJ і розчину AgNO3
на
поверхні кристала AgJ (рис. 6.5.1). Йодид-йони, які можуть утворювати
з арґентум йонами малорозчинні сполуки, адсорбуються на поверхні, утворюючи на ній надлишок негативних зарядів. Калій-йони не адсорбуються, бо вони не утворюють з йодид-йонами малорозчиненої сполуки, але під дією електростатичного тяжіння розташовані поблизу
поверхні. Адсорбовані йодид-йони
і калій-йони утворюють подвійний електричний шар. Йони
в розчинах електролітів здатні до йонообмінної адсорбції. Йонообмінна
адсорбція – процес обміну йонів між розчином
і твердою фазою – адсорбентом.
Рис. 6.5.2. Йонообмінна адсорбція: 1 – матриця іоніту (каркас); 2 – функціональні
групи ( ковалентно зв’язані з матрицею); 3 – протийони (електростатично
зв’язані з йоногенними групами) При цьому тверда фаза поглинає з розчину
іони одного знаку (катіони або аніони) і замість них виділяє в розчин
еквівалентну кількість інших іонів цього ж заряду. Такий обмінний іонний
процес аналогічний реакціям іонного обміну в розчинах електролітів, але він
відбувається на поверхні твердої фази. Іоніти
– речовини,
здатні до йонообмінного обміну. Залежно
від того, який вид йонів бере участь в обміні, іоніти поділяють на катіоніти
та аніоніти. Катіоніти
здатні обмінюватись катіонами, зокрема і іон Н+; аніоніти
– аніонами, зокрема ОН-. Обмінна адсорбція йонів відбувається повільніше, ніж молекулярна. Іоніти
класифікують за походженням
на природні таі
синтетичні, а також
за складом – на неорганічні та органічні. До природних неорганічних
іонітів належать силікати типу цеолітів:
глауконіт, клиноптилоліт,
шабазит тощо. До
природних органічних іонітів належать гумусові речовини, що знаходяться в
ґрунті. Синтетичні неорганічні іоніти одержують на основі комплексних сполук сурми, фосфору, цирконію та інших елементів.
Рис. 6.5.3. Схематичне зображення
іоніту: а – катіоніт;
б – аніоніт Практичне
використання йонного обміну значно поширилося після розробки синтетичних смол-іонітів, які вперше були
синтезовані Адамсом і Холмсом у 1934 р. Ці йонообмінні смоли мають такі переваги:
Йонообмінна
адсорбція широко застосовується
для добування демінералізованої
води, тобто такої, що не містить розчинених солей.
Для повного позбавлення води від іонів, її послідовно пропускають через
фільтри катіонів та аніонів. Промислові іоніти мають високу механічну і
хімічну стійкість, вони витримують сотні регенераційних циклів.
Рис. 6.5.4. Застосування йонообмінної адсорбції для добування демінералізованої води Іоніти застосовують
для очищення промислових
вод від йонів важких металів (Хрому, Купруму, Плюмбуму). У цукровій
промисловості іоніти застосовують для очищення дифузного соку від електролітів – патокоутворювачів,
що дозволяє підвищити вихід цукру. У молочній промисловості іоніти
використовують для часткового видалення із молока Са2+ і Мg2+
іонів з заміною їх на іони Na+
і К+.
Таке молоко називається іонітним і використовується для
годування немовлят. За допомогою аніонітної обробки фруктові соки позбавляють зайвої кислотності, яка надає
їм неприємного смаку. У сучасній медицині йонний обмін використовують під час захворювань, пов’язаних з порушеннями йонного балансу в органах і тканинах (виразка
шлунку, гіпертонічні набряки тощо): змістити йонний баланс організму вдається введенням високодисперсних
порошків із іонообмінних смол. Йонообмінна
адсорбція має важливе значення для землеробства, бо від природи
поглинутих ґрунтом катіонів залежить їх родючість. До обміну
йонів здатні не тільки ґрунти, але й низка
природних речовин, наприклад, силікати. Іоніти знайшли також широке
застосування для очищення промислових стічних вод. Адсорбційні процеси широко
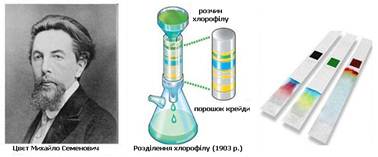
використовують для розподілу сумішей різних речовин. Вони лежать в основі
хроматографічного методу аналізу (М. С. Цвєт, 1903
р).
Рис. 6.6.1. М.С. Цвєт та хроматографічний метод аналізу Хроматографічний метод аналізу
запропонував у 1903 р. російський ботанік М.С.
Цвєт, який довів, що хлорофіл
не є індивідуальною речовиною. Для цього крізь колонку, заповнену крейдою,
він пропустив розчин пігментів зелених листків рослин у петролейному ефірі.
Уздовж безбарвного адсорбенту, в результаті неоднакової швидкості адсорбції
різних пігментів, виникли зони, забарвлені в різний колір (хлорофіл
розділився на чотири зони). Звідси виникла назва запропонованого М.С. Цвєтом
методу – хроматографія (“кольорозапис”
від грецького “хромос” – колір, “графе” – писати). Хроматографія
– це фізико-хімічний метод розподілу суміші речовин, заснований на різному
розподілі компонентів між двома фазами, одна з яких нерухома, а інша – це рухливий
потік, що фільтрується через нерухому фазу. Метод
заснований на різному розподілі речовин суміші між двома фазами:
Речовини,
що складають нерухому фазу – це сорбенти.
Досліджувана суміш – елюент. Елюентом найчастіше є
суміш розчинників, або один розчинник, який рухається під дією сили тяжіння. Ментальна карта видів хроматографії
Як нерухома фаза можуть використовуватися
адсорбенти, поміщені в адсорбційні колони або нанесені у вигляді тонкого шару
на скляні пластинки, а також спеціальний хроматографічний папір. Відповідно
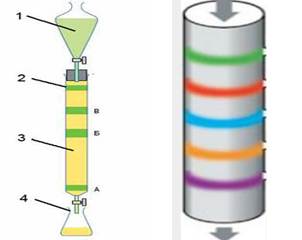
розрізняють колонкову, тонкошарову й паперову хроматографію. Колонкова
хроматографія – це один
з основних способів очищення органічних речовин в сучасній синтетичній
практиці. Силікагелем набивають скляну колонку завтовшки 5 – 5 мм. Зверху
наносять малу кількість концентрованого р-ну суміші, а потім починають
елюювання аналізуючи час від часу розчин, що виходить через малий отвір знизу
колонки.
Рис. 6.6.2. Прилад для колонкової хроматографії: 1 – елюент; 2 –
хроматографічна колонка з сорбентом; 3 – сорбент; 4 – приймач Тонкошарова
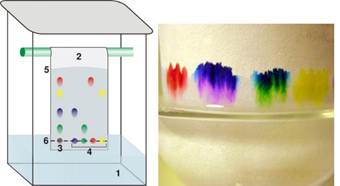
хроматографія Аналітична Тонкошарова хроматографія
широко застосовується в органічній хімії для поточного аналізу сумішей
(сумарний час експерименту 2 – 10 хв). Нерухомою фазою служить силікагель
нанесений на пластинку (найчастіше товсту алюмінієву фольгу). Як рухому фазу
застосовують органічний розчинник. Набір гептан–етилацетат–метанол дозволяє елюювати більшість сполук. Часто також застосовують етер і хлороформ.
Рис. 6.6.3. Тонкошарова хроматографія Паперо́ва хроматографія (рос.
бумажная хроматография, англ. paper
chromatography; нім. Papierchromatographie f)
– хроматографічний метод розділення й аналізу сумішей речовин,
заснований на їхньому розподілі між рухомою і нерухомою фазами; як носій
нерухомої рідкої фази використовують папір. Метод запропонований англійськими
вченими А. Мартіном і Р. Сінгом в 1941 році. Паперову хроматографію використовують
для розділення та аналізу неорганічних та органічних компонентів природних і промислових речовин (наприклад, визначають смоли в нафтопродуктах,
рідкісноземельні елементи в гірських породах та мінералах).
Рис. 6.6.4. Паперова хроматографія Розподіл компонентів може відбуватися
за різними ознаками: здатності вибірково адсорбуватися на даному адсорбенті,
здатності до іонного обміну, різному розподілі між двома рідинами, які не
змішуються. Ці різновиди хроматографічного методу називають адсорбційною,
іонообмінною і розподільною хроматографією. За адсорбційної хроматографії в
процесі пропускання суміші через адсорбент речовини розташовуються в
послідовності, обумовленій їхньою здатністю до адсорбції. У верхньому шарі
розташовується найлегше адсорбуюча речовина й далі зі зменшення здатності до
адсорбції. Пропускаючи через адсорбент розчинник, можна послідовно вимивати
компоненти суміші. За йонообмінної хроматографії адсорбентами служать
йонообмінні смоли. У верхній
частині обмінюються найбільше адсорбуючі йони, потім менш
інтенсивно адсорбуючі і
т.д., в результаті чого відбувається поступове виділення йонів з розчину. У методі розподільної хроматографії
використовується різний розподіл речовин між рідинами, що не змішуються.
Наприклад, якщо суміш речовин, що значно відрізняються між собою за
розчинністю у воді й бензолі, неодноразово обробляти сумішшю цих рідин, то
можна практично повно розділити речовини. Одним з варіантів розподільної
хроматографії є газорідинна. У цьому випадку твердий адсорбент (активоване
вугілля, целіт і ін.) просочують нелетучою рідиною (гліцерин, поліетиленгліколь, ланолін) настільки, щоб він залишався на дотик
сухим і легко продувався газом. Адсорбент поміщують у колону і через неї
продувають будь-який газ (азот, аргон та ін.), до якого
додана розподіляюча суміш
речовин також у вигляді газу або пари. Розподіл речовин відбувається
внаслідок різної адсорбційної здатності компонентів. Осадова
хроматографія – ґрунтується
на утворенні малорозчинних
сполук між речовинами суміші та осаджувачем, що знаходиться в порах сорбенту. Що більша
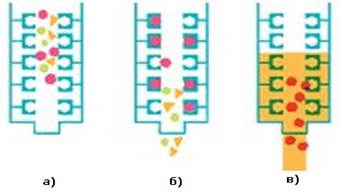
розчинність, то швидше речовина вимиється з сорбенту; Афінна хроматографія Назва “афінна хроматографія” було запропоновано для відносно нового і
ефективного хроматографічного методу, в якому спорідненість відіграє особливо
важливу роль. Цей метод базується на специфічній взаємодії, характерній для
деяких біологічних і біохімічних процесів. Ця взаємодія відбувається між
парами речовин, які реагують у розчині з високою вибірковістю. Так, наприклад, антиген і антитіло специфічно зв’язуються між собою, фермент реагує тільки зі своїм субстратом або
з інгібітором, транспортна рибонуклеїнова кислота “обирає” тільки ту
амінокислоту, яку вона може перенести всередину рибосоми, гормон реагує з
відповідним рецептором. Якщо одна із цих сполук,
яка відноситься до будь-якої
з перерахованих пар, утримується ковалентним зв’язком на відповідному носії і
при цьому зберігає свої властивості (специфічні
характеристики), то подібний десолюбілізований
препарат можна використовувати
для вибіркового зв’язування
із розчину другої сполуки пари. Якщо перемішати десолюбілізований
препарат (у вигляді частинок
з розчином суміші декількох речовин, то при цьому
препарат зв’язує тільки один певний компонент). Отриманий препарат звільняють
від супутніх речовин фільтруванням або центрифугуванням, промивають і
відповідним чином виділяють необхідну сполуку.
Рис.6.6.5. Афінна хроматографія: а) загрузка; б) розділення; в) вимивання Ексклюзійна
хроматографія – це різновид рідинної хроматографії, у якій розділення компонентів
базується на розподілі молекул відповідно до їхніх розмірів між розчинником, який знаходиться у порах
сорбента, і розчинником, що
протікає між його
частинками. У процесі розділення невеликі молекули попадають у сітку полімера, в порах якого розчинник служить нерухомою
фазою, і утримуються там, великі молекули не можуть проникнути в полімерну
сітку і вимиваються із колонки рухомою фазою. Спочатку
елююються найбільші, потім середні та далі невеликі молекули. Тому ексклюзійну хроматографію називають також молекулярно-ситовою. Для проведення хроматографічного
аналізу широко використовуються прилади-хроматографи, які
дозволяють автоматизувати процес і забезпечують швидкий та чіткий розподіл
компонентів.
Рис. 6.6.6. Хроматограф: а) газовий; б) рідинний Хроматографічний аналіз разом з іншими
фізичними й хімічними методами зараз дуже широко застосовується в біології та
медицині. Він дозволяє розділяти складні суміші амінокислот, нуклеїнових
основ, вуглеводів та ін. Хроматографічний аналіз також використовується для
встановлення первинної структури білків, нуклеїнових кислот, полісахаридів,
кількісного визначення вітамінів, гормонів та
інших біологічно активних сполук.
ЦІКАВО ЗНАТИ Очищення акваріумної води
Для фільтрації води в акваріумі часто
застосовується активоване вугілля, яке має сильно пористу мікроструктуру, завдяки
чому ефективно виводить (адсорбує) токсини, кислоти та мікроелементи.
Найчастіше активоване вугілля застосовують у фільтрах після лікування риб в
акваріумі для виведення з акваріумної води залишків лікарських препаратів. Очищення води у басейнах для плавання
У басейнах для плавання переважно застосовується порошкове активоване
вугілля для видалення надлишкової концентрації засобів дезінфекції та
створених там субпродуктів. Активоване вугілля для цих цілей повинно
відповідати вимогам DIN 19643. Цікаві факти
про активоване вугілля Деревне вугілля – тверда пориста маса,
що має структуру вихідної деревини. Під час обробки водяною парою пори і
канали вугілля очищуються від сажі та золи, завдяки чому значно зростає його
поверхня – до 400 м2 на 1 г. Таке вугілля називають активованим.
В очищені таким чином пори і канали деревного вугілля можуть потрапляти й
утримуватися в них молекули газів, розчинених речовин, причому що більша молярна
маса речовини, то більше її поглинається.
Рис. 1. Адсорбція барвника Використання деревного й активованого вугілля
засновано на їх здатності до адсорбції (рис. 1). Через це активоване вугілля
широко застосовують у харчовій промисловості для очищення
спирту від сивушних
масел, цукрового сиропу – від забарвлених речовин,
у протигазах. Перший протигаз винайшов 1915 р.
російський учений М. Д. Зелінський.
М.Д. Зелінський (1861–1953) Він складається з гумової маски і
коробки з активованим вугіллям (рис. 2). Повітря, яким дихає людина, проходить
крізь шар активованого вугілля, яке очищує його від отруйних домішок. За
таким принципом працюють побутові очищувачі води.
Рис. 2. Протигаз
Питання для самоконтролю 1 Що таке адсорбція,
адсорбент, адсорбат, адсорбтив?
2. Які процеси називають сорбційними? Наведіть їх
коротку характеристику? 4. Які речовини відносять до поверхнево-активних (ПАР), поверхнево-інактивних? Наведіть приклади. 5. Сформулюйте правило Дюкло-Траубе та вкажіть
межі його застосування. 6. Запишіть рівняння Гіббса та проаналізуйте
його. 7. Назвіть основні положення теорії адсорбції Ленгмюра. 8. Що таке іонообмінна адсорбція? 10. Опишіть досліди М.С. Цвєта. 12. Де застосовують хроматографію?
Застосування
адсорбції в технологічних процесах освітлення фруктово-ягідних сиропів, під
час використання харчових барвників, виробництва цукру, глюкози, очищення
питної води.
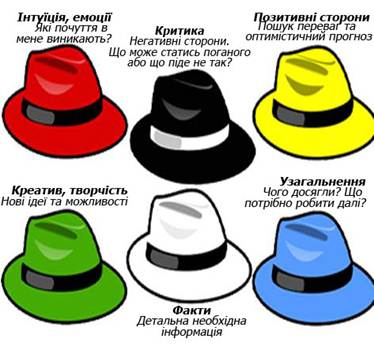
Метод “ Шість капелюхів ” – це психологічна
рольова гра, сенс якої полягає в тому, щоб розглянути одну і ту ж проблемну
ситуацію з шести незалежних одна від одної точок зору. Суть гри полягає в тому, що групу
потрібно поділити на шість команд.
Кожна команда буде представляти капелюх певного кольору і має, спираючись на певний тип мислення,
дотримуватися відповідного підходу до
аналізу предмету дискусії. Наприклад, команда білого капелюха – аналіз
фактів, жовтого – оцінювання переваг, чорного – оцінювання негативного
розвитку, останнім потрібно вислухати синій капелюх.
|
|||||||||||||||