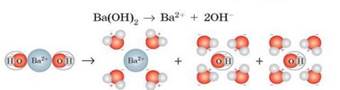|
|
ФІЗИЧНА І КОЛОЇДНА ХІМІЯ Електронний посібник |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
ЕЛЕКТРОХІМІЯ |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
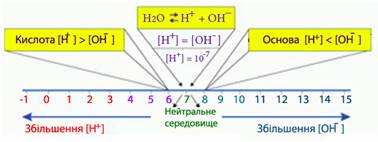
5.1. Предмет електрохімії. Теорія електролітичної дисоціації. 5.2. Йонний добуток води. Водневий показник. 5.3. Електропровідність
розчинів електролітів. Питома і еквівалентна електропровідність. 5.4. Хімічні гальванічні елементи. 5.1. Предмет електрохімії. Теорія електролітичної дисоціації Електрохімія – це наука, що вивчає електрохімічні
процеси та фізико-хімічні властивості іонних систем (розчинів, розплавів та
твердих електролітів). Предметом вивчення електрохімії є електрохімічний
процес і електрохімічна система.
Електрохімічний процес – це явище, яке відбувається за участю заряджених
частинок на межі поділу фаз між електронним та іонним провідниками. Електрохімічні процеси умовно
поділяються на дві основні групи:
Сукупність всіх речовин, що беруть участь в
окремому електрохімічному процесі, – це електрохімічна
система. Джерела
електричного струму
video не
поддерживается вашим браузером.. Електрохімічна система обов’язково містить
окиснену та відновлену форми, які у загальному випадку позначаються
відповідно Ох і Red. Для умовного запису електрохімічної системи
спочатку зазначають окиснену форму, а потім через скісну риску – відновлену (Ох/Red), наприклад: Zn2+/Zn; NO3-
+ 2H+/NO2- + H2O. Оскільки електрохімічні процеси мають окисно-відновну природу, вони
завжди супроводжуються просторовим переміщенням електронів. Однак, на відміну
від звичайної окисно-відновної взаємодії, яка відбувається одночасно в усьому
реакційному об’ємі, електрохімічні процеси проходять виключно на межі поділу
двох контактуючих фаз – електронного та іонного провідників (тобто
провідників відповідно першого і другого родів). Електрохімічна система, що виникає за контакту електронного та іонного
провідників, називається електрод. Електрод, на якому відбувається
окиснення, називається анод,
а той електрод, на якому відбувається
відновлення, – катод.
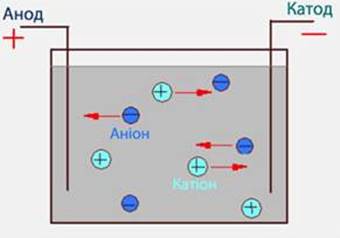
Рис. 5.1.1.
Напрямок руху позитивно і негативно заряджених іонів в
електричному полі Можна побачити рух
йонів до електродів, якщо вони забарвлені. Приєднаємо до батарейки два електроди
й закріпимо їх на фільтрувальному папері. Попередньо змочимо
папір водою, а ще краще водним розчином будь-якого електроліту, наприклад
кухонної солі. Помістимо посередині між електродами кристалик калій
перманганату KMnO4 («марганцівки»). Через деякий час ми побачимо фіолетово-коричневу
«доріжку» в напрямку до позитивно зарядженого електрода (рис. 5.1.2). Це
рухаються забарвлені йони MnO4. Цей дослід можна провести з іншими забарвленими йонами, наприклад
блакитними Cu2+. Звичайно,
ці йони будуть рухатися до негативно зарядженого електрода.
Рис. 5.1.2. Рух йонів до електродів Вам уже відомо, що в речовинах йонної будови, наприклад у кухонній солі, є
заряджені частинки – йони. Ви також знаєте, що електричний струм – це спрямований рух заряджених частинок. Чому
ж тверда кухонна сіль не проводить електричний струм, а її розчин чи розплав
проводять?
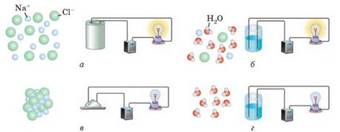
Рис. 5.1.3. Неелектроліти, в яких відсутні переносники
електричного струму (як приклад – дистильована Н2О
і кристалічний NaCl) і провідники другого роду –
електроліти, в яких переносниками електричних зарядів є іони (водний розчин натрій
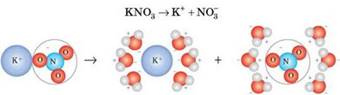
хлориду – за рахунок іонів Na+ і Cl–) Відповідь на це питання дав шведський учений Сванте Арреніус. Він
припустив, що деякі речовини (електроліти) під час розчинення у воді (або
розплавлення) розпадаються на йони, що можуть вільно рухатися. У разі розплавляння частинки речовини стають рухливими, а в разі
розчинення вони рівномірно розподілені у воді, тобто в обох випадках здатні
вільно рухатися. Завдяки цьому розчини й розплави проводять електричний
струм. Йони, що містяться у твердій кухонній солі, розташовані у вузлах
кристалічних ґраток і переміщуватися не можуть, тому тверді електроліти
електричний струм не проводять. У дистильованій воді йони відсутні, тому вона
струм не проводить.
Рис. 5.1.4. Йони,
що вільно переміщуються у розчинах і розплавах
електролітів і здатні проводити електричний струм: а) розплав
кухонної солі; б) розчин кухонної солі; в) тверда кухонна
сіль; г) чиста вода Процес розпаду речовини на йони під час розчинення у воді або плавлення
називають електролітичною дисоціацією. Механізм електролітичної дисоціації Під час розчинення речовин у полярному розчиннику
відбувається сольватація (у воді гідратація ) –
взаємодія речовини з полярними молекулами розчинника. Полярні молекули води, орієнтовані щодо йонів або
полярних молекул, знаходяться у вузлах кристалічних ґраток розчиненої
речовини, і з певною силою, що відповідає значенню діелектричної проникності
води, притягують їх до себе. Якщо сила притягання цих йонів (молекул) до
молекул води перевищує силу їх міжіонного або притягання атомів у полярній
молекулі розчиненої речовини, відбувається йонізація – розпад речовини на
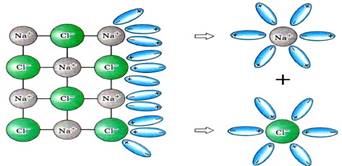
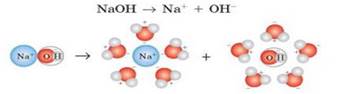
йони. У результаті сольватації йонна сполука (NaCl,
NaOH) переходить у розчин у вигляді сольватованих
(гідратованих) йонів (рис. 5.1.5).
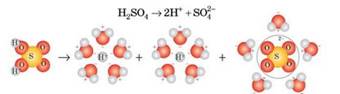
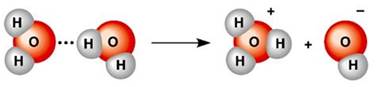
Рис. 5.1.5. Розчинення натрій хлориду у воді (NaCl⇒Na++Cl–) Полярні молекули (Н2SO4, HCl) під час сольватації йонізуються і, подібно до йонних сполук,
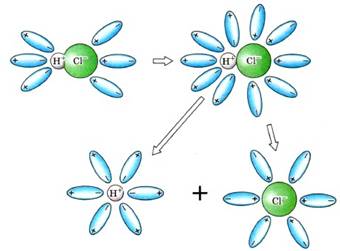
переходять у розчин у вигляді сольватованих йонів (рис. 5.1.6).
Рис. 5.1.6. Дисоціація полярних молекул
під час розчинення речовини у воді Кожний електроліт утворює
два види йонів: позитивні – катіони та негативні – аніони. Цей процес
записують у вигляді рівнянь електролітичної дисоціації. Електролітична дисоціація – це не хімічна реакція,
оскільки не відбувається перетворення одних речовин на інші. Але для зручності
електролітичну дисоціацію записують у формі рівняння, де замість знака
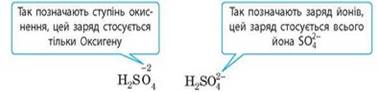
рівності записують стрілку. Записуючи формули йонів у розчині, заряд йонів
указують дещо по-іншому, ніж у записі ступеня окиснення: спочатку записують
цифрове значення, а потім знак заряду (в однозарядних йонах цифру 1 зазвичай
не пишуть).
Наприклад, рівняннями електролітичної дисоціації кислот, основ та солей
є:
Електролітичній дисоціації в розчинах
підлягають речовини з йонними або ковалентними полярними зв’язками. В
розплавах – лише з йонними. Теорія електролітичної дисоціації містить декілька положень:
Йони бувають:
• прості (К+, Na+, Сl-) та складні (NH4+, NO3-, SO42-); • безбарвні (Сl-, К+,
Na+) та забарвлені (МnО4- має малиновий колір, СrO42- – жовтий). Деякі йони надають розчину певний смак: Н+ – кислий,
Ве2+
і Рb2+ – солодкий, Mg2+ – гіркий, Na+, Сl- разом (Na+ > Сl-) обумовлюють солоний смак. Розчини електролітів, крім електропровідності, мають іще низку властивостей,
які їх відрізняють від розчинів неелектролітів (осмотичний тиск, температури
плавлення і кипіння, тиск пари тощо).
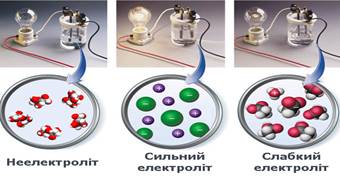
Рис. 5.1.7. Класифікація речовин на електроліти
та неелектроліти Речовини, розчини або розплави
яких проводять електричний струм, називають електролітами, а речовини, що не проводять струм ані в розчині,
ані в розплаві, – неелектролітами.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Назва |
Інтервал переходу рН |
Забарвлення |
|
|
у кислому середовищі |
у лужному середовищі |
||
|
Фенолфталеїн |
8,2 – 10,0 |
безбарвне |
малинове |
|
Метиловий оранжевий |
3,1 – 4,4 |
рожеве |
жовте |
|
Метиловий червоний |
4,2 – 6,3 |
червоне |
жовте |
|
Лакмус |
6,0 – 8,0 |
червоне |
синє |
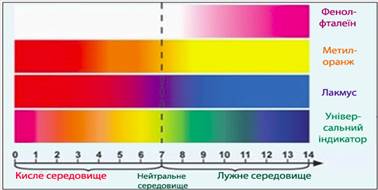
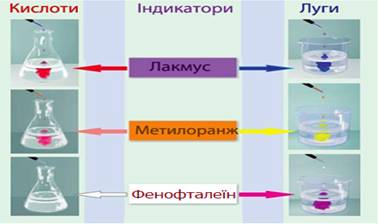
Рис. 5.2.4.
Змінення забарвлення деяких індикаторів залежно від рН середовища
Буферні розчини
Буферні розчини – це такі, що мають певну
стійку концентрацію іонів Н+,
яка практично не змінюється під час додавання до них невеликих кількостей
сильних кислот, лугів або під час розведення чи концентрування.
Буферні розчини поділяються на кислотні
та основні.
Кислотний буферний розчин – це суміш слабкої кислоти і
солі, утвореної цією кислотою, наприклад, ацетатний буфер (суміш СН3СООН
і СН3СООNa), у розчині якого кислота
піддається лише частковій дисоціації, а сіль дисоціює повністю:
![]()
![]()
Якщо до такого буферу додати сильну кислоту, наприклад HCl, відбувається її взаємодія з сіллю буферу:
![]()
або в іонному
вигляді:
![]()
![]()
Як результат
сильна кислота HCl замінюється еквівалентною кількістю слабкої кислоти СН3СООН,
тому концентрація іонів Н+ майже не
збільшується і рН практично не змінюється.
Під час
додавання до ацетатної буферної суміші невеликої кількості лугу відбувається
його взаємодія зі слабкою кислотою буферу, яка зв'язує іони ОН–
в малодисоційовану сполуку – H2O:
![]()
![]()
![]()
При цьому сильна основа NaOH замінюється еквівалентною
кількістю солі СН3СООNa, тому значного зменшення
концентрації іонів Н+ не спостерігається.
Значення рН кислотного буферу обчислюється за формулою:
pH = ![]() + Ig
+ Ig![]()
де рКкисл
= –lgКдис.кисл,
Ссолі і Скисл – відповідно молярні концентрації солі та кислоти.
Основний
буферний розчин – це суміш слабкої основи та її солі, утвореної сильною
кислотою, наприклад, амоніачний буфер, що складається з NH4OH і NH4Cl.
У такому буфері
дисоціація слабкої основи відбувається частково, а дисоціація солі –
повністю:
![]()
![]()
Під час додавання
до амоніачного буферу невеликої кількості сильної кислоти (HCl)
відбувається її взаємодія з основою буферу, внаслідок чого утворюється сіль,
а рН
розчину майже не змінюється:
![]()
![]()
![]()
Під час додавання лугу (NaOH) в реакцію, навпаки, вступає сіль буферу:
![]()
![]()
![]()
Значення рН для цього типу буферів розраховують за рівнянням:
![]()
де ![]()
Ссолі і Сосн – відповідно молярні
концентрації солі та основи.
Важливою характеристикою буферних розчинів є їх буферна ємність – кількість
еквівалентів сильної кислоти чи лугу, яку необхідно додати до 1 л буферного
розчину, щоб змінити його рН на
одну одиницю.
Буферна ємність визначається відносно кислоти чи лугу за рівняннями:
![]() ,
,
![]()
де Ссильн.кислоти і Слугу – еквівалентні
(нормальні) концентрації,
рН – зміщення рН буферного розчину.
Буферні розчини відіграють важливу роль у природі та техніці. Наприклад, завдяки
дії певних буферів у всіх фізіологічних системах організму людини pH змінюється неістотно, мало змінюється pH морської води (pH=8). Під час проведення багатьох технологічних
процесів pH середовище підтримують постійним за допомогою
відповідних буферів.
5.3. Електропровідність розчинів електролітів.
Питома і еквівалентна електропровідність
Електропровідність розчину зумовлена наявністю в ньому
іонів. Здатність розчинів
електролітів проводити електричний струм під впливом накладеного електричного
поля характеризує електропровідність (![]() ).
).

Рис. 5.3.1. Електричний струм
Значення
електричної провідності розчину є зворотним до значення його електричного
опору (R,Ом):
![]() (Ом-1). (1)
(Ом-1). (1)
У системі СІ
величина Ом-1 має назву сименс (См).
Відомо, що
електричний опір металів
![]() , (2)
, (2)
де r –
питомий опір, Ом·м (таблична стала для кожного металу);
![]() – довжина провідника, м;
– довжина провідника, м;
S – площа поперечного перерізу провідника, м2.
Для розчинів ![]() – відстань між
електродами, м; S – площа поперечного перерізу електродів, м2.
– відстань між
електродами, м; S – площа поперечного перерізу електродів, м2.
Величину(æ), зворотну питомому опору (![]() ), називають питомою
електропровідністю:
), називають питомою
електропровідністю:
æ ![]() . (3)
. (3)
Беручи до уваги
рівняння (2), питома
електропровідність набуває вигляду
æ ![]() . (4)
. (4)

Рис. 5.3.2. Питома електропровідність
Її вимірюють в См ·м-1 (або Ом-1· м-1) і вона
дорівнює провідності 1 м3 розчину, що знаходиться між паралельними
електродами на відстані 1 м один від одного та площею поверхні 1 м2.
Зручнішою одиницею об’єму для практичного
використання в лабораторних умовах є часткова одиниця виміру – кубічний
сантиметр (см3). Тоді питома електропровідність буде вимірюватися
в См·см-1 (або Ом-1·см-1) і становитиме
електричну провідність 1 см3 розчину, що знаходиться між двома
електродами з площею поверхні 1 см2 і віддаленими один від одного
на відстань 1 см. Рівняння (4) є головним для вимірів і розрахунків у прямій
кондуктометрії.
Під еквівалентною електропровідністю ![]() розуміють
провідність розчину, що вміщує 1 моль-екв електроліту, який знаходиться між
двома паралельними електродами, відстань між якими 1 м. Одиниця
вимірювання
розуміють
провідність розчину, що вміщує 1 моль-екв електроліту, який знаходиться між
двома паралельними електродами, відстань між якими 1 м. Одиниця
вимірювання ![]() См·м2/моль-1.
См·м2/моль-1.
Еквівалентна і питома електропровідності
зв’язані рівнянням:
![]() (5)
(5)
де æ – питома
електропровідність, Ом-1·м-1; С – молярна концентрація еквіваленту,
моль/л.
![]() – для слабких електролітів; (6)
– для слабких електролітів; (6)
![]() – для сильних електролітів. (7)
– для сильних електролітів. (7)
Електропровідність безмежно розведеного
розчину, в якому передбачаються повна дисоціація електроліту (![]() =1) і відсутність сил електростатичної взаємодії
між іонами, дістала назву граничної еквівалентної електропровідності
=1) і відсутність сил електростатичної взаємодії
між іонами, дістала назву граничної еквівалентної електропровідності
(![]() ) за умов безмежного розведення розчину:
) за умов безмежного розведення розчину:
![]() (8)
(8)
Де ![]() – граничні
рухливості іонів, Ом-1·м2·моль-1.
– граничні
рухливості іонів, Ом-1·м2·моль-1.
Для слабких електролітів співвідношення еквівалентної
електропровідності для розчину певної концентрації ![]() до граничної
еквівалентної електропровідності
до граничної
еквівалентної електропровідності ![]() дорівнює ступеню
дисоціації електроліту:
дорівнює ступеню
дисоціації електроліту:
![]() (9)
(9)
Значення ![]() для різних електролітів за температури 25 0С
наведені в табл. 1.
для різних електролітів за температури 25 0С
наведені в табл. 1.
Таблиця 1
Значення
![]() при 25 0С
(Ом-1· см2· моль-1)
при 25 0С
(Ом-1· см2· моль-1)
|
Катіони |
|
Аніони |
|
|
|
362 |
OH |
205 |
|
|
76 |
½ SO4 |
83 |
|
½
Pb2+ |
73 |
Br |
81 |
|
|
68 |
|
80 |
|
Ag+ |
64 |
I |
80 |
|
½
Zn2+ |
56 |
Cl |
79 |
|
½
Mg2+ |
55 |
NO |
74 |
|
Na+ |
52 |
½ CO |
70 |
Електропровідність
розчинів суттєво залежить від температури. Підвищення температури на 1 К призводить до зростання питомої
електропровідності на 2 – 2,5 %. Це пов’язано зі зменшенням в’язкості розчину,
гідратації іонів і зростанням ступеня дисоціації слабкого електроліту.
На вимірі питомої електропровідності заснований кондуктометричний метод аналізу (кондуктометрія).

Рис. 5.3.3. Лабораторний кондуктометр MP515
Цей метод зручний під час дослідження забарвлених або
митних розчинів, у яких важко помітити зміну забарвлення індикатора.
Розглянемо як приклад титрування сильної кислоти HCl сильною основою NaOH:
![]()
![]()
За поступового
додавання розчину NaOH до кислоти іони H+ і OH-
в розчині замінюються менш рухливими іонами Na+ і
електропровідність розчину зменшується. У точці еквівалентності вона буде найменша.
Під час додавання надлишкової кількості лугу через припинення реакції
нейтралізації іони OH- стануть
накопичуватися в розчині, різко збільшуючи його електропровідність.

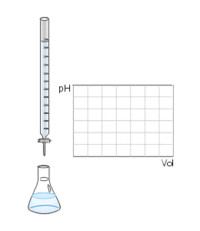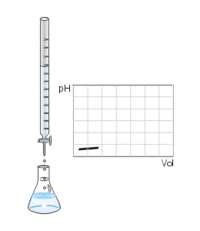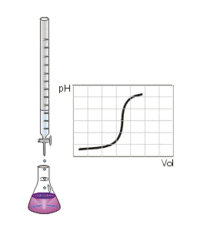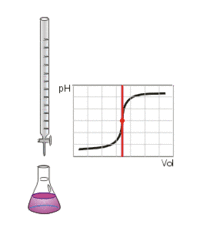
Рис.5.3.4. Крива кондуктометричного титрування
сильної кислоти HCl сильним лугом NaOH
За результатами вимірювань будують графік залежності
електропровідності від обсягу доданого розчину лугу.
Абсциса точки перетину двох прямих відповідає кінцевій точці
титрування, тобто точці еквівалентності.
Розрахунок концентрації та маси кислоти проводять за
рівняннями:
![]()
![]()
де ![]() – молярні концентрації кислоти та лугу,
відповідно, моль/л;
– молярні концентрації кислоти та лугу,
відповідно, моль/л;
![]() – об’єм кислоти,
що титрувався, мл;
– об’єм кислоти,
що титрувався, мл;
![]() – об’єм розчину лугу, що повністю
нейтралізувався, мл;
– об’єм розчину лугу, що повністю
нейтралізувався, мл;
![]() – маса
хлорводневої кислоти, г;
– маса
хлорводневої кислоти, г;
![]() – молярна маса хлорводневої кислоти, г/моль.
– молярна маса хлорводневої кислоти, г/моль.
Методи аналізу, засновані на вимірі електропровідності,
широко застосовуються для технологічного контролю в багатьох виробництвах,
визначення вологості різних об'єктів, змісту солей у воді, в низці
біологічних рідин або ґрунті. За електропровідності розчинів можна кількісно
визначати розчинність важкорозчинних сполук, ізоелектричну точку амінокислот,
пептидів і білків.
5.4. Хімічні гальванічні
елементи
У наш час ми не можемо уявити
своє життя без хімічних джерел струму, в яких частина внутрішньої енергії речовин
перетворюється на електричну енергію. До них відносять гальванічні елементи,
аккумулятори і паливні елементи.
Наприкінці XVIII ст. італійський фізик Алессандро Вольта (рис.
5.4.1) винайшов оригінальний пристрій, що виробляв електричний струм.

Рис. 5.4.1. Алессандро Вольта (1745 –
1827)
Це був немов товстий «бутерброд» iз металічних пластин (міді та цинку) i
тканини, яка заздалегідь була просочена розчином сульфатної кислоти (рис.
5.4.2).
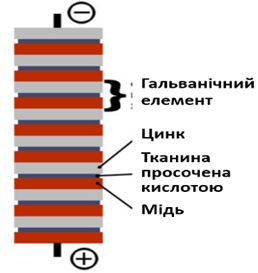
Рис.
5.4.2. Стовп Вольта
До першої та останньої
пластинок припаювали дротинки. Якщо їx занурювали у воду, то на поверхні
кожної дротинки починалося виділення газу. Це відбувався електроліз води.
Отже, крізь воду проходив електричний струм. Винайдене джерело струму було
названо гальванічним елементом на честь Луїджі
Гальвані (1737 – 1798) – італійського лікаря, анатома і фізіолога, який є
одним із засновників електрофізіології.
Демонстрація
будови та дії гальванічного елемента
video не поддерживается вашим браузером.
Перший гальванічний елемент був
незручним у користуванні та мав короткий час дії: поява на електроді
бульбашок газу ускладнювала рух йонів біля електроду. У 1836 році англійський
хімік Джон Фредерик Даніель та незалежно від нього німецький і російський фізик-винахідник
Б.С. Якобі, запропонували інший елемент, що виробляв електричний струм
протягом значно довшого часу.
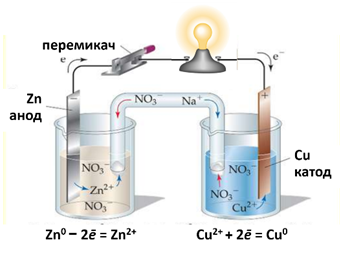
Рис. 5.4.3. Гальванічний елемент
Даніеля-Якобі
Гальванічний елемент Даніеля-Якобі складається з
двох посудин (рис. 5.4.3). В одній міститься розчин цинк сульфату, в який занурено пластинку з
цинку, в іншій – купрум (ІІ) сульфату, в який занурено пластинку з міді.
Розчини з’єднано трубкою (сольовим містком), що заповнена розчином
електроліту, йони якого взаємодіють з іншими в гальванічному елементі,
наприклад натрій нітрату. У такий спосіб забезпечується електричний контакт
між посудинами. Для того щоб розчин не виливався, кінці трубки закривають
скловатою чи гелем, просоченим електролітом.
Якщо електроди з’єднати
дротинками з електричною лампочкою, то вона засвітиться.

Рис.
5.4.4. Електроди відпрацьованого гальванічного елемента
Через деякий час в обох
склянках можна спостерігати хімічні перетворення: цинкова пластинка
розчиняється, а на мідній з розчину осаджується мідь (рис. 5.4.4). Водночас
послаблюється забарвлення розчину купрум (ІІ) сульфату (концентрація йонів Сu2+ знижується). Ці хімічні зміни є результатом перенесення електронів з
однієї частини елемента до іншого, тобто це типовий електрохімічний процес.
Пристрої, що виробляють
електричний струм внаслідок перебігу в них хімічних реакцій, називаються хімічними
джерелами струму.
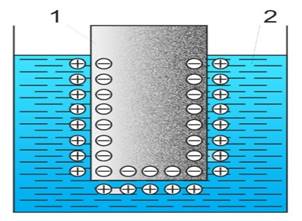
Рис.
5.4.5. Подвійний електричний шар:
1 –
металічна пластина; 2 – розчин
Розглянемо природу цього процесу.
Під дією полярних молекул води катіони металу відриваються з поверхні
пластинки, гідратуються і переходять у розчин, який при цьому заряджається
позитивно, а в металі накопичується надлишок електронів. Що далі протікає
процес, то більше стає заряд як металу, так і розчину. Завдяки
електростатичному притягуванню катіонів розчину і надлишкових електронів
металу на межі поділу фаз виникає подвійний електричний шар (ПЕШ) (рис. 5.4.5), який гальмує подальший перехід катіонів металу в розчин.
Настає момент, коли між розчином і металом встановлюється рівновага, яку
можна виразити рівнянням:
Ме(тв.) ![]() Меn+ + nē.
Меn+ + nē.
Різниця потенціалів, що виникає
між металом і розчином електроліту, називається електродним потенціалом.
Електродний
потенціал залежить від природи металу.
Що активніший метал, то більше
його катіонів переходить у розчин і негативніше заряджена поверхня металу.
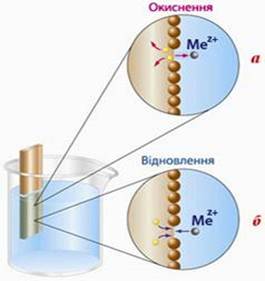
Рис. 5.4.6. Взаємодія
металу з розчином:
а) активний метал; б)
малоактивний метал
Цинк активніший за мідь, тому
цинкова пластинка заряджена негативніше, ніж мідна. Під час з’єднання цинкової
пластинки з мідною металевим провідником електрони переходять від пластинки
цинку до міді, на поверхні якої вони з’єднуються з катіонами Купруму з
розчину і осаджується мідь:
Сu2+ + 2ē
= Сu.
Відбувається процес
відновлення.
Згадаємо, під час електролізу
процес відновлення відбувається на катоді. Така сама роль катода (мідного
електрода) i в гальванічному елементі, але
віддаючи електрони катіонам Сu2+, катод гальванічного елементу набуває
позитивний заряд, на відміну від катоду під час електролізу, який має
негативний заряд.
Інший електрод гальванічного
елемента – цинковий – розчиняється. Атоми Цинку втрачають електрони,
залишаючи їх на електроді, зазнають окиснення й перетворюються на катіони:
Zn – 2ē = Zn2+.
Цинковий електрод у
гальванічному елементі виступає як анод, він має негативний заряд (під час
електролізу анод заряджений позитивно).
Сумарне рівняння
(окисно-відновного перетворення в гальванічному елементі:
Cu2+ + Zn = Сu + Zn2+.
Гальванічний елемент можна
зобразити схематично:
Zn|Zn2+||Cu2+|Cu
Суть перетворення така сама, що
й звичайної хімічної реакції:
CuSО4
+ Zn =
Сu + ZnSО4.
Однак у гальванічному елементі процеси
окиснення й відновлення йдуть окремо на поверхні кожного з двох електродів.
Електрони, що залишаються від атомів Цинку на аноді, рухаються електричним
ланцюгом до катода, де їx отримують катіони Купруму.
Струм буде текти до тих пір, поки весь цинк не розчиниться або всі катіони
Купруму з розчину не відновляться до міді.
Під час роботи гальванічного
елемента в розчині купрум (ІІ) сульфату зменшується кількість катіонів Cu2+, а в розчині цинк сульфату збільшується кількість катіонів Zn2+. Тому сольовий місток не тільки забезпечує електричний контакт між двома
розчинами, а й підтримує електронейтральність розчинів, «постачаючи» катіони
стороннього електроліту (у нашому випадку Na+) у розчин купрум (ІІ) сульфату а аніони (NO3−) – у розчин цинк сульфату.
Використовувати елемент
Даніеля-Якобі для живлення ліхтарика, плеєра чи калькулятора незручно. Вже
давно винайдено сухі гальванічні елементи. В їхніх герметичних оболонках
містяться не розчини, а пастоподібні (вологі) суміші речовин.
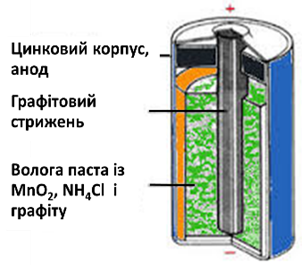
Рис. 5.4.7. Елемент Лекланше
Найпоширеніший серед гальванічних елементів цього типу – манган-цинковий
елемент, який винайшов французький хімік Ж. Лекланше ще у 1865 році (рис.
5.4.7). Корпус цього елемента зроблено
з цинку; він виконує роль анода (це – негативний полюс джерела струму). Всередині міститься волога паста з
манган (ІV) оксиду (МпО2),
амоній хлориду (NH4Cl) i графітового порошку. В пасту занурений графітовий стрижень, що виступає
катодом (позитивний полюс). Елемент герметизовано смолою або воском. Під час
роботи елемента відбуваються такі процеси. Цинк зазнає окиснення:
Zn − 2ē = Zn2+.
Через це корпус елемента iз середини поступово руйнується. На графітовому катоді відновлюється
Манган:
Мn+4 + ē
=Мn+3.
Протікає хімічна реакція, що
описується рівнянням:
Zn + 2MnO2 + 2NH4Cl = 2MnO(OH)
+ ZnCl2 + 2NH3.
На полюсах елемента створюється
напруга в 1,5 В. Якщо послідовно з’єднати кілька таких елементів (катод
першого елемента – з анодом другого, катод другого – з анодом третього i т. д.), то утвориться батарея. Відома плоска батарея містить 3-и
елементи Лекланше i має напругу 4,5 В.
Робота гальванічного елемента
характеризується його електрорушійною силою (ЕРС), яку можна визначити за
різницею потенціалів катоду і аноду: що
більша ця різниця, то більша ЕРС гальванічного елемента.
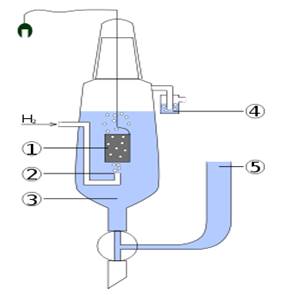
Рис.5.4.8. Стандартний
водневий електрод:
1 – платинова пластина,
покрита губчастою платиною; 2 – трубка для вдування водню;
3 – розчин сульфатної
кислоти; 4 – гідравлічний закрив; 5 – сифон
Абсолютне значення електродного
потенціалу виміряти не можна. Але досить легко виміряти різницю електродних
потенціалів, яка виникає в системі, що складається з двох пар «електрод –
розчин». Такі пари називають напівелементами.
Домовилися визначати електродні потенціали металів по відношенню до так
званого стандартного водневого електроду, потенціал якого умовно прийнятий за
нуль. Стандартний водневий електрод
складається з платинової пластинки, зануреної в розчин сульфатної кислоти з
концентрацією катіонів Гідрогену 1 моль/л, і омивається струменем
газоподібного водню (рис. 5.4.8).
Газоподібний водень
адсорбується на платині та переходить в атомарний стан:
Н2 ![]() 2Н.
2Н.
Між атомами і катіонами
Гідрогену виникає рівновага:
Н ![]() Н+
+ ē.
Н+
+ ē.
Сумарний процес виражається
рівнянням:
Н2 ![]() 2Н+
+ 2ē.
2Н+
+ 2ē.
Платина не бере участі в
окисно-відновному процесі, а є лише носієм атомів Гідрогену.
Якщо пластинку металу, занурену
в розчин його солі з концентрацією металу 1 моль/л, з’єднати зі стандартним
водневим електродом, то вийде гальванічний елемент. Електрорушійна сила цього
елемента, виміряна за температури 25 °С, і характеризує стандартний
електродний потенціал металу.
У таблиці 1 представлені
значення стандартних електродних потенціалів деяких металів. Стандартні
потенціали електродів, що виступають як відновники стосовно водню, мають знак
«–», а як окисники – знак «+».
Таблиця 1
Стандартні
електродні потенціали металів
|
Електрод |
Е0, В |
Електрод |
Е0, В |
Електрод |
Е0, В |
|
Li+ /Li |
– 3,02 |
Zn2+/Zn |
– 0,763 |
Sb3+/Sb |
0,20 |
|
Rb+ /Rb |
– 2,99 |
Cr3+/Cr |
– 0,740 |
Bi3+/Bi |
0,23 |
|
K+ / K |
– 2,925 |
Fe2+/Fe |
– 0,440 |
Cu2+/Cu |
0,337 |
|
Ba2+/Ba |
– 2,900 |
Cd2+/Cd |
– 0,400 |
Cu+/Cu |
0,52 |
|
Sr2+ /Sr |
– 2,890 |
Co2+/Co |
– 0,403 |
Hg22+/2Hg |
0,790 |
|
Ca2+/Ca |
– 2,870 |
Ni2+/Ni |
– 0,250 |
Ag+/Ag |
0,799 |
|
Na+ / Na |
– 2,714 |
Sn2+/Sn |
– 0,166 |
Pd2+/Pd |
0,830 |
|
Mg2+/Mg |
– 2,340 |
Pb2+/Pb |
– 0,126 |
Hg2+/Hg |
0,854 |
|
Al3+/Al |
– 1,700 |
Fe3+/Fe |
– 0,036 |
Pt2+/Pt |
1,20 |
|
Mn2+/Mn |
– 1,180 |
2H+/H2 |
0,000 |
Au3+/Au |
1,500 |
Якщо метали, розташувати в порядку зростання стандартних електродних потенціалів, то отримаємо
електрохімічний ряд напруг металів, який характеризує хімічні властивості
металів.
Що більший негативний
електродний потенціал металу, то більша його відновна здатність.
Кожен метал здатний
відновлювати з розчинів ті метали, які стоять у ряді напруг праворуч від
нього.
Всі метали, що мають негативний
потенціал, тобто що знаходяться в ряді напруг лівіше водню, здатні витісняти
його з розчинів кислот.
Що більше різниця електродного
потенціалу металів, то більшою буде ЕРС гальванічного елемента.
Зверніть увагу, представлений
ряд характеризує поводження металів і їх солей тільки у водних розчинах і за
кімнатної температури.

У нестандартних умовах (та також за стандартної температури
298 К) електродний потенціал розраховують за рівнянням Нернста:
![]()
![]()
![]()
Для металевих електродів за стандартної температури
298К рівняння Нернста має вигляд:
![]()
![]()
![]()
де [Oх] – концентрація окисленої форми(окисника), (моль/л);
[Red] – концентрація
відновленої форми (відновника), (моль/л);
R=8.314 Дж/К.моль – (універсальна газова постійна);
Е0 – відносний
стандартний електродний потенціал (табличні дані); вимірюється у вольтах (В);
Т – абсолютна температура (якщо стандартна, тоді Т
=298К);
F – число Фарадея, що дорівнює 96500 (Кл/моль);
n – число електронів, що беруть участь у процесі;
СМеn+ – молярна концентрація катіонів металу (моль/л).
Е=Е0+0,059/n.IgCMen+, якщо CМe n+=1 моль/л, тоді
Е = Е0.
Гальванічний елемент, складений
з електродів одного і того самого металу, занурених у розчини солі цього
металу різних концентрацій, називається концентраційний гальванічний елемент.
У концентраційному
гальванічному елементі (рис. 5.4.9) роль анода відіграє електрод, занурений у
більш розведений розчин, а катода – той, що знаходиться у розчині вищої
концентрації. У схемах таких елементів обов’язково
зазначаються концентрації (моль/л) розчинів солей, наприклад:
А(−)Zn|ZnSO4(10−4моль/л)||ZnSO4(1моль/л)|Zn(+)K.
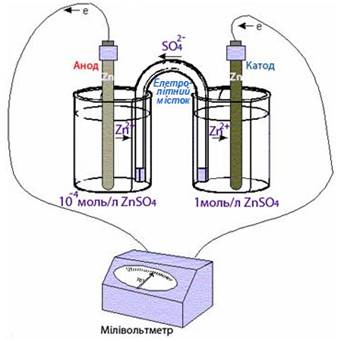
Рис. 5.4.9. Концентраційний
гальванічний елемент
Гальванічний
елемент у потенціометрії складають з індикаторного
електрода, потенціал якого
залежить від концентрації визначеного іону, та електрода порівняння, потенціал якого відомий, добре
відтворюється і не змінюється під час вимірювань. У потенціометрії
використовують два головних класи індикаторних електродів:
![]() на міжфазній межі яких протікають реакції за участю
на міжфазній межі яких протікають реакції за участю
електронів. Такі електроди мають назву
електроннообмінних.
![]() на міжфазній межі яких протікають іонообмінні реакції.
на міжфазній межі яких протікають іонообмінні реакції.
Такі електроди мають назву мембранних або
іоноообмінних, або іон-селек-тивних.
Прикладом електродів порівняння є насичений хлоросрібний
( потенціал + 0,2224 В) та 1 Н чи 0,1 Н каломельні
електроди з потенцілами +0,282 В і +0,334 В відповідно.
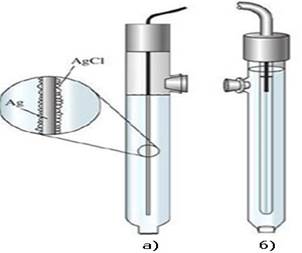
Рис. 5.4.10. Хлорсрібний
електрод (а); каломельний електрод (б)
Потенціометричні методи аналізу поділяють на два
методи. Перший метод – пряма
потенціометрія (іонометрія),
другий метод – потенціометричне
титрування. Метод прямої потенціометрії грунтується на прямому
використанні рівняння Нернста для знаходження активності або концентрації
визначеного іона, для цього для серії стандартних розчинів проводять
вимірювання електрорушійної сили Е або потенціалу ![]() ; будують калібрувальний графік залежності Е
або
; будують калібрувальний графік залежності Е
або ![]() від концентрації
стандартних розчинів (С) визначеного іону. Потім
виміряють Е або
від концентрації
стандартних розчинів (С) визначеного іону. Потім
виміряють Е або ![]() дослідженого
розчину і за калібрувальним графіком знаходять концентрацію визначеного іона.
дослідженого
розчину і за калібрувальним графіком знаходять концентрацію визначеного іона.
Під час
потенціометричного титрування точку еквівалентності знаходять за різкою
зміною (стрибком) електрорушійної сили поблизу точки еквівалентності. У ході
титрування вимірюють і записують Е комірки після додання кожного
певного об’єму титранту. За цими даними будують криву титрування – графік
залежності Е від об’єму титранту (V), (рис. 5.4.11а). Для точнішого знаходження точки
еквівалентності будують диференційну криву титрування – залежність ![]() від об’єму
титранту V (рис. 5.4.11б).
від об’єму
титранту V (рис. 5.4.11б).
|
|
|
|
а) |
б) |
Рис. 5.4.11. Криві потенціометричного
титрування:
а – інтегральна крива титрування; б –
диференційна крива титрування
Потенціометричне
визначення різних хімічних величин та концентрації розчинів застосовується
для визначення якості продуктів харчування (молока, молочних продуктів,
соків, напоїв, вина, карамелі) та інших продуктів переробки молока, плодів,
овочів, м’ясних консервів.
Вироби з металів та їхніх
сплавів, крім золота і платини, під впливом повітря, вологи поступово
руйнуються в результаті хімічних реакцій, які самочинно відбуваються між
металами і речовинами, що містяться в навколишньому середовищі. У результаті
корозії змінюється зовнішній вигляд металу: гладенька, добре відполірована
поверхня стає шорсткою, покривається різними продуктами корозії, якість
виробів і споруд погіршується.
Вони можуть стати навіть зовсім непридатними для використання. У
результаті корозії залізні вироби покриваються бурим нальотом, вироби із
цинку і алюмінію набувають білого чи сірого кольору. На поверхні мідних
виробів появляється зеленкувато-блакитний наліт – це основна сіль (CuOH)2CO3, що є отруйною речовиною. Срібні предмети темніють.

Рис.
5.5.1. Корозія металів
Корозія завдає
великої шкоди, особливо залізним матеріалам, які найбільш поширені. Іржа
«з’їдає» мільйони тонн заліза в світі щорічно. Вважають, що в рік руйнується
20 % сталі, тобто кожна шоста домна працює на повернення збитків, або
¼ чавуну і сталі витрачається для компенсації збитків від корозії. Крім основних витрат, існують
побічні витрати на ремонт і заміну деталей, втрата газу і нафти в пошкоджених
нафтопроводах, псування продуктів, втрата здоров’я і життя людей під час
аварій.
Явище руйнування металів внаслідок хімічних реакцій з речовинами
навколишнього середовища називається корозією.
Рис. 5.5.2.
Корозія опор мосту
Суть корозії
Атоми металічних елементів під час взаємодії з компонентами довкілля
втрачають електрони, тобто окиснюються:
![]()
Метал, що перебував у вільному стані, перетворюється на різні сполуки:
оксиди, гідроксиди, солі.
Суть процесу корозії заліза полягає в тому, що атоми Феруму під впливом
кисню, води і Гідроген-йонів поступово окиснюються. У загальному вигляді
процес корозії заліза і його сплавів можна зобразити так:
Fe0 – 2ē
→ Fe2+; Fe2+
– ē → Fe3+;
а) процес корозії у сухому повітрі:
![]() ;
;
б) процес корозії у вологому повітрі:
![]() ;
;
![]() ;
;
Оскільки в повітрі можуть міститься оксиди CO2, SO2, та оксиди Нітрогену, то в результаті їхньої
взаємодії з водяною парою утворюються кислоти. Капельки роси на металічному
виробі – це слабкі розчини кислот, які сприяють корозії залізних матеріалів:
в) в присутності йонів Гідрогену:
![]() .
.
Корозія металу різко посилюється, якщо він стикається з якимось іншим,
менш активним металом, тобто розміщеним справа від нього в електрохімічному
ряді напруг металів. Корозія послаблюється, якщо метал стикається з
активнішим металом, тобто розміщеним зліва від нього в електрохімічному ряді
напруг металів. Швидкість корозії цього металу залежить також від складу
середовища, в якому перебуває метал. Корозія заліза послаблюється в присутності гідроксид-йонів OH–.
Типи корозії
|
Корозія |
||||
|
Хімічна (руйнування Me
під дією довкілля) |
Електрохімічна (руйнування Me в контакті з іншими Me) |
|||
|
газова (арматура печей, двигуни внутрішнього
згоряння) |
Атмосферна окиснення Me на повітрі: 2Ca0 + O2 → 2Ca–2O |
у розчинах неелектролітів, нафти, газу |
Ґрунтова трубопроводи, кабелі, деталі будівельних
споруд |
Контактна за контакту двох металів у водному розчині
кислот: |
|
Руйнується активніший метал: |
||||
|
анодна реакція: Fe0–2ē → Fe2+ |
катодна реакція: 2H++2ē → H2↑ |
|||
|
2Fe0 + O2 + 2H2O → 2Fe(OH)2 |
||||
Хімічна корозія Цей вид корозії спричинений взаємодією металів з
корозійно активним середовищем – сухими газами і рідинами, які не проводять електричного струму (бензин, гас).
Наприклад, руйнування металу здійснюється під впливом кисню, сірководню та інших агресивних газів, коли немає
вологи. Цій корозії піддаються метали під час їхньої термічної
обробки, вона відбувається в газових турбінах, автомобільних двигунах, соплах
ракетних двигунів тощо:
4Fe + 3О2 = 2Fe2O3
2Fe° + 2H2S + О20–
2FeS + 2H2O
Більшість металів окиснюється киснем
повітря, утворюючи на поверхні оксидні плівки, які захищають ці метали від подальшої корозії (перехід поверхні металу в неактивний
(пасивний) стан, пов'язаний з утворенням тонких поверхневих шарів сполук, що запобігають
подальшому протіканню реакції (корозії)):
4А1 + 3О2 = 2А12О3
Такі щільні захисні плівки утворює алюміній, хром, цинк, нікель. У заліза
окисна плівка крихка, легко відокремлюється від металу, тому не захищає його
від корозії. Процес іржавіння заліза можна виразити рівнянням:
4Fe + 3О2
+ 6Н2О = 4Fe(OH)3
Швидкість хімічної корозії залежить від температури, природи
навколишнього середовища, активності металу, його чистоти (надчисте залізо
практично корозії не піддається). 3 підвищенням температури, як правило,
інтенсивність корозії зростає. Це зумовлюється швидкістю дифузії, зокрема
кисню і металу крізь оксидну плівку на поверхні металу, та утворенням тріщин, крізь які
кисень проникає глибше в метал і окиснює його.
За наявності
деяких речовин, які руйнують захисну оксидну плівку, корозія відбувається
особливо енергійно. Речовини, що
пришвидшують корозію металів і сплавів, називають активаторами корозії. До
енергійних активаторів належать
розчинений у воді кисень, хлорид-йони Сl-. Саме йони Сl-, яких багато в морській воді, сприяють активній корозії
підводних частин кораблів.

Рис. 5.5.3.
Кораблі іржавіють у морській воді швидше, ніж у прісній
Електрохімічна корозія
Електрохімічна корозія відбувається при контакті металевих виробів з двох
різних металів (з різними окисно-відновними потенціалами) у корозійному
середовищі й супроводжується виникненням електричного струму.
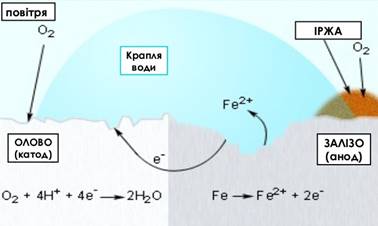
Рис. 5.5.4. Механізм електрохімічної корозії
За контакту двох металів, наприклад
цинку й міді, утворюється гальванічний елемент: відбувається процес окиснення цинку як активнішого металу і перехід
катіонів Zn2+ y шар електроліту. Вільні електрони приєднують йони Гідрогену Н+:
Н+:
Zn0 – 2e→ Zn2+
2H+ +2e→ H20
Крім окиснення
активнішого металу, спостерігається перенесення електронів від активнішого
металу до менш активного — виникає струм. Такі електрохімічні процеси
відбуваються завжди за контакту двох різних металів у розчині електроліту. При цьому активніший метал завжди
руйнується.
Корозійним середовищем може бути розчин електроліту, ґрунтова вода, вода
природних водойм (особливо морська), звичайна дощова вода або конденсат (сконденсована волога
повітря), у яких завжди розчинена якась кількість
вуглекислого газу.
|
Захист від корозії |
||||
|
Захисне покриття |
Виготовлення
сплавів, стійких
до корозії (нержавіюча сталь) |
Зміна середовища (добавляння інгібітора) |
Електрохімічні:
а)
заклепки активніших металів; б)
протекторний захист; в) нейтралізація електричного струму |
|
|
Металами
(Ni, Au, Cr, Zn, Sn) |
Неметалами (лаком, фарбою, емаллю) |
|||
![]() Захисні поверхневі покриття металів бувають
металічними (покриття цинком, оловом, свинцем, нікелем, хромом, золотом та
іншими металами) і неметалічними (покриття лаком, фарбами, змазками, ґумою,
каучуком).
Захисні поверхневі покриття металів бувають
металічними (покриття цинком, оловом, свинцем, нікелем, хромом, золотом та
іншими металами) і неметалічними (покриття лаком, фарбами, змазками, ґумою,
каучуком).
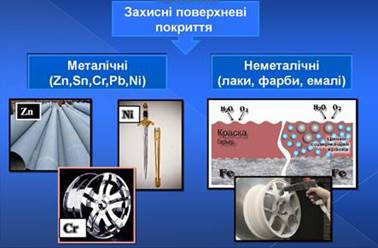
Рис. 5.5.5.
Методи захисту металів в сплавів від корозії –
захисні
поверхневі покриття: металічні, неметалічні
Ці покриття ізолюють метал від зовнішнього
середовища. Крім того, покриття залізних виробів надає їм привабливого
зовнішнього вигляду.
Добавки нікелю, міді, кобальту посилюють
антикорозійні властивості сталі. Введенням до складу
сталі близько 12 % хрому добувають нержавіючу сталь стійку проти корозії.
![]() Для уповільнення корозії металевих виробів до
електроліту вводять
Для уповільнення корозії металевих виробів до
електроліту вводять
речовини (найчастіше органічні), які називають інгібіторами.
Останнім часом зроблені леткі (атмосферні) інгібітори, якими просочують папір
і обгортають ним металеві вироби. Пари інгібіторів адсорбуються на поверхні
металу і утворюють на ній захисну плівку.
|
|
Цікавий факт
Встановлено
найперспективніші види рослинної сировини щодо створення на її основі летких інгібіторів
атмосферної корозії. Показано, що оптимальним комплексом властивостей володіють хміль та шрот
ріпаку.

За результатами вивчення та аналізу хімічного складу екстрактів цих
рослин (органічних та мінеральних) встановлено сполуки, які вносять основний
вклад у гальмування корозійних процесів. Ізопропанольні екстракти цих рослин
– це суміш поверхнево-активних органічних речовин, що містять функціональні
групи, здатні забезпечити інгібування процесів корозії на поверхні чорних
металів в умовах періодичної конденсації вологи протягом 20 діб на рівні 73 –
93 %.
![]() Електрохімічні методи використовують у
середовищах, які добре проводять електричний струм.
Електрохімічні методи використовують у
середовищах, які добре проводять електричний струм.
Що більше різняться між собою за хімічною активністю два метали, що
стикаються, то сильніше кородує активніший з них і надійніше захищений від
корозії менш активний метал. Протекторний захист застосовують у тому разі,
коли захищається конструкція (корпус судна, підземний трубопровід), яка
перебуває в середовищі електроліту (морська вода, підземні ґрунтові води
тощо). Суть такого захисту полягає в тому, що конструкцію сполучають з
протектором (від лат. protector – «захисний») – більш активним металом, ніж метал конструкції. Металічні
деталі, наприклад, рейси, скріплюють заклепками із активніших металів.
Захистити метал від корозії можна, зробивши його катодом, тобто з’єднавши
з негативним полюсом джерела струму – катодний захист. За певної сили струму
окисник відновлюється на катоді, анод окиснюється, що забезпечує стійкість
виробу до корозії.
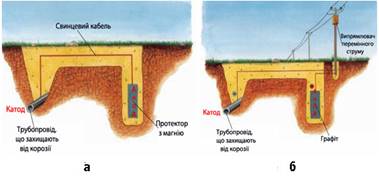
Рис. 5.5.6.
Катодний захист металевих конструкцій:
а) протекторний
захист, б) захист зовнішнім струмом
![]() Для
гальмування корозії нині все ширше впроваджують методи штучного осушення
повітря, яке оточує вироби. Несприятливе до корозії середовище створюють у
паронепроникних чохлах або металевих контейнерах за допомогою спеціальних
речовин (наприклад, силікагелей). У цих умовах на поверхні виробу не
утворюється плівки вологи і корозія не виникає. Такий спосіб захисту
застосовують під час транспортування машин і деталей морськими шляхами. Зараз
розробляють нові методи захисту металів, а також створюють речовини –
замінники металів – пластмаси, кислототривкі цементи тощо.
Для
гальмування корозії нині все ширше впроваджують методи штучного осушення
повітря, яке оточує вироби. Несприятливе до корозії середовище створюють у
паронепроникних чохлах або металевих контейнерах за допомогою спеціальних
речовин (наприклад, силікагелей). У цих умовах на поверхні виробу не
утворюється плівки вологи і корозія не виникає. Такий спосіб захисту
застосовують під час транспортування машин і деталей морськими шляхами. Зараз
розробляють нові методи захисту металів, а також створюють речовини –
замінники металів – пластмаси, кислототривкі цементи тощо.
|
|
ЗАДАЧІ
Приклад
1. Які процеси відбуваються за
нещільного контакту цинкової та нікелевої пластини
а) у вологому повітрі; б) у кислому середовищі?
Розв’язок. За контакту зазначених металів кородує більш
активний цинк, що має менше значення електродного потенціалу:
ε0Zn2+/Zn = –0,76B, ε0Ni2+/Ni = –0,25B
а) У вологому повітрі
утворюється корозійний гальванічний елемент, в якому цинк відіграє роль
анода, а менш активний нікель – катода:
А(–) Zn | O2, Н2O |
Ni (+)K.
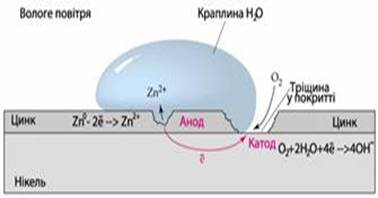
Рис. Корозійні процеси за нещільного контакту
цинкової та нікелевої пластин
Анод окиснюється, а на катоді
спостерігається киснева деполяризація – це описують електронними рівняннями
анодного і катодного процесів:
(-) A: Zn0−2e¯→Zn2+,
(+) K: O2+2H2O+4e¯→4OH−
б) У кислому середовищі корозія
проходить з водневою деполяризацією, тому цинк піддається анодному окисненню,
а на нікелевому катоді відновлюються йони гідрогену і виділяється вільний
водень.
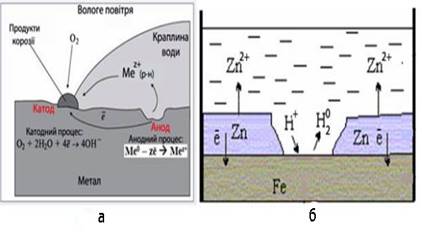
Рис. Схема корозії металу:
а) з кисневою деполяризацією; б) з водневою
деполяризацією
Схема корозійного гальванічного
елемента і електронні рівняння електродних процесів мають вигляд:
А(-) Zn |
Н+, Н2O | Ni (+)K.
(-) A: Zn0−2e¯→Zn2+,
(+) K: 2H++2e¯→H2.
Приклад 2. Розрахувати рН
розчину калій гідроксиду КОН концентрації 0,01 моль/л.
Розв’язок. Калій гідроксид належить до
сильних електролітів, тому в розведених розчинах дисоціює повністю:
КОН ![]() K+ + OH–.
K+ + OH–.
Як випливає з рівняння дисоціації, концентрація гідроксильних іонів
дорівнює концентрації КОН, тобто
[OH– ] = CМ(KOH) =
0,01 моль/л = 10–2 моль/л.
Гідроксильний показник, який визначається від’ємним логарифмом
концентрації іонів ОН–, пов’язаний з
водневим показником співвідношенням
рН + рОН = 14,
звідки рН = 14 – рОН.
Однак,
рОН = – lg[OH–] = – lg10–2 = 2, тому рН = 14 – 2 = 12.
Це вказує на сильнолужне середовище.
Приклад 3. Написати рівняння дисоціації
основ: калій гідроксиду і ферум (ІІ) гідроксиду, скласти вираз константи
дисоціації.
Розв’язок. Калій гідроксид – луг,
належить до сильних електролітів і піддається у розчинах повній дисоціації:
KOH ![]() K+ + OH–.
K+ + OH–.
Оскільки КОН є сильним електролітом, він не підкоряється закону діючих
мас і константа дисоціації для нього не записується.
Ферум (ІІ) гідроксид, навпаки, є слабким електролітом, дисоціює по двом
ступеням, кожному з яких відповідає свій вираз константи дисоціації:
![]()
![]()
Приклад 4. Складіть
схему і напишіть електронні рівняння електродних процесів гальванічного
елемента, що складається з пластин олова і цинку, опущених у розчини станум
хлориду і цинк хлориду відповідно. Вкажіть процеси, що відбуваються на електродах. Визначте стандартну електрорушійну
силу цього елементу.
Розв’язок.
Схема
гальванічного елемента:
(–) Zn0|Zn2+||Sn 2+|Sn 0(+).
Електронні
рівняння електродних процесів:
Анод: Zn0 − 2ē
→ Zn2+ процес окиснення;
Катод: Sn2+ + 2ē → Sn0 процес відновлення.
Стандартна ЕРС
гальванічного елемента:
Е°=Е°(катода) −
Е°(анода)=Е°(Cu2+/Cu) − Е°(Zn2+/Zn)= − 0,166 − (−0,763) = 0,597 В.
Приклад 5. У гальванічному елементі протікає хімічна реакція
Mg+NiSO4=MgSO4+Ni.
Напишіть схему
гальванічного елемента і рівняння електродних реакцій.
Розв’язок.
Схема
гальванічного елемента:
(–)Mg
0|Mg 2+||Ni 2+|Ni 0(+).
Електронні
рівняння електродних процесів:
Анод: Mg0 − 2ē
→ Mg2+;
Катод: Ni2+ + 2ē →
Ni0.
|
|
ЦІКАВО ЗНАТИ
Якщо
порівнювати смак кефіру й лимонного соку, то можна впевнено стверджувати, що
лимонний сік набагато кисліший, тобто кислотність цих розчинів різна.Це зумовлено
надто малою концентрацією йонів H+. Часто буває недостатньо
сказати, що середовище кислотне чи лужне, а необхідно кількісно його
схарактеризувати.
Значення водневого показника рH водних розчинів багатьох речовин та природних розчинів перебуває переважно
в інтервалі від 1 до 13 (рис. 1).
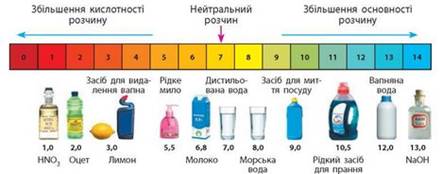
Рис. 1 Значення
рН різних природних та штучних розчинів
Для точнішого вимірювання рH існують спеціальні прилади – рН-метри (рис. 2). Вони дозволяють
визначити рH-розчину з точністю до 0,001 –
0,01.
Загалом, спектер сфер застосування рН-метрів дуже великий:
науково-дослідницька та лабораторна практика, водопідготовка, акваріумістика,
мікробіологія, агрохімія і грунтознавство, виробництво пального, медична.
косметична та лакофарбова галузі, а також хімічні виробництва.

Рис. 2.
Вимірювання рН розчинів:
а) універсальний
індикатор – визначає приблизне значення рН; б) Рн-метри
Тіло людини має
певне кислотно-лужне співвідношення, що характеризується рН (водневий показник). Чим нижче рівень рН –
тим середовище більш кисле (від 6.9 до 0), лужне ж середовище має високий
рівень рН (від 7.1 до 14).
|
|
|
Тіло людини на 70
% складається з води, тому вода – одна з найбільш важливих його складових.
Залежно від рН воду класифікують згідно з табл. 1.
Таблиця 1
Класифікація води за значенням
рН
|
Група води |
Значення рН |
|
Сильнокисла |
до 3,0 |
|
Кисла |
3,0 – 5,0 |
|
Слабокисла |
5,0 – 6,5 |
|
Нейтральна |
6,5 – 7,5 |
|
Слаболужна |
7,5 – 8,5 |
|
Лужна |
8,5 – 9,5 |
|
Сильнолужна |
більше
9,5 |
Яким має бути значення рН
питної води?
Відповідно до ДСанПіН 2.2.4-171-10 «Гігієнічні вимоги до води питної,
призначеної для споживання людиною» визначено, що рН питної води має
відповідати значенням згідно з табл. 2.
Таблиця 2
Значення рН питної води
|
Питна
вода |
Водопровідна |
З колодязів і каптажів джерел |
Фасована, з пунктів розливу
та бюветів |
Газована |
|
Нормативи
рН питної
води |
6,5 – 8,5 |
6,5 – 8,5 |
6,5 – 8,5 |
≥4,5 |
Отже, рН будь-якої питної води має бути в межах 6,5 – 8,5, окрім
газованої, для неї рН≥4,5.
Здоровий ріст рослин залежить від правильного синтезу ідеального
середовища. Коригування рівня рН грунту або води сприяє
гармонійному розвитку рослин, незадовільні значення рівня рН
призводять до їх хвороби або навіть загибелі.
|
|
|
Рис. 3. Вимірювання рН грунту
рН грунту можна визначити за його кольором: грунт
зеленого відтінку, як правило, більш лужний, а грунт, що має жовтий або
помаранчевий відтінок, більш кислий. Проте колір дає нам тільки наближені значення рН.
Більш точне значення рН грунту може бути виміряне за
допомогою рН-метра – приладу, який спеціально призначений для
дослідження грунтів.
|
|
Чи знаєте Ви, що?
Одна батарейка, викинута у сміття, забруднює 20 м2 землі, на якій росте 2 дерева, живуть:
·
2
кроти,
·
1
їжачок,
·
кілька
тисяч дощових хробаків.
Що ж такого шкідливого та небезпечного в
батарейках?
У складі
використаних батарейок міститься ртуть, кадмій, магній, свинець, нікель,
цинк, тому потрапляючи в організм людини накопичуються в ньому. Зокрема, хром
та кадмій накопичуються у нирках, мідь – у шлунково-кишковому тракті, ртуть
вражає центральну нервову систему і нирки.
Викинута батарейка
покривається корозією, через що шкідливі речовини можуть потрапити в ґрунтові
води, а далі – в річки, озера, артезіанські води. Одна пальчикова батарейка
може забруднити 400 літрів води або 20 квадратних метрів землі.
Потрапивши у воду, ртуть перетворюється у метил-ртуть, яка є
токсичнішою за ртуть. Малі водні мікроорганізми поглинають метил-ртуть, а їх,
в свою чергу, поїдають риби. Люди, які споживають таку рибу, можуть захворіти
на хворобу Мінамата, головними ознаками якої є порушення зору та слуху,
неврологічні розлади. Свинець накопичується в кістках у вигляді нерозчинної
сполуки, переходить у кров і може викликати отруєння
організму, спричинює захворювання мозку і нервові розлади. Кадмій блокує
роботу ферментів, вражає печінку та здатний викликати ракові захворювання.
Розгадка Кутубської колони та Ейфелевої вежі.
За 20 км від Делі
(Індія) височить одна з найзагадковіших споруд світу – залізна Кутубська
колона (рис.7, а).
Її висота – 7,3 м,
загальна маса – 6,5 т, діаметр біля основи – 42 см, біля верхівки – 30 см.
Попри вологий і жаркий тропічний клімат на ній немає жодної плями іржі,
навіть віршовані рядки на санскриті, викарбувані на колоні, легко читаються.
Секрет полягає у складі колони: 99,7 % заліза, незначний вміст сірки і
вуглецю. Надчисте залізо практично не піддається корозії. Таємницею
залишається виготовлення колони. Існує декілька версій її походження. Так, за
однією, колону споруджено із метеоритного заліза, а за іншою – стародавнім
індійцям допомагали інопланетяни. Деякі дослідники вважають Кутубську колону
пам’яткою культури давно зниклої цивілізації. Місцеві жителі наділяють колону
цілющою силою. Що за цим – самонавіювання чи реальний вплив енергетичного
поля споруди?
Розгадка
Кутубської колони чекає свого часу.

Рис.7. Кутубська залізна колона (а),
Ейфелева вежа (б)
Ейфелева вежа
(рис. 7, б) – найупізнаваніша пам’ятка Парижа, всесвітньо відома як символ
Франції. Споруджена (1887 – 1889) за проектом інженера Густава Ейфеля як вхід
до Всесвітньої виставки 1889 р. Її висота 300 м (з телевізійною антеною – 324
м), маса металевих конструкцій становить 7 300 т, загальна маса – 10 100 т.
Металеві складові вежі зроблені з так званого пудлінгового заліза, яке
містить близько 0,3 % вуглецю і до 2 % інших домішок. «Залізна пані», як
називають цю споруду парижани, протидіє корозії завдяки 60 т фарби трьох
відтінків. За 120 років існування вежу фарбували 18 разів, кожні 7 років. Це
призвело до збільшення маси металевих конструкцій майже на 15 %.
|
|
Питання для самоконтролю
2. Які речовини називають електролітами? Наведіть
приклади.
3. Які речовини називають неелектролітами? Наведіть
приклади.
4. Які положення включає теорія електролітичної
дисоціації?
5. Що називається питомою та еквівалентною електропровіднітю? Одиниці вимірювання?
6. Сформулюйте закон
Кольрауша.
8. У чому сутність кондуктометричного титрування?
9. Сформулюйте закон розбавлення Оствальда.
10. Що таке стандартний водневий електрод?
11. Як побудувати елемент Даніеля – Якобі?
12. Що таке корозія металів? Види корозії.
13. Які методи захисту від корозії існують?
14. Із наведеного переліку випишіть окремо формули речовин, що є: а)
електролітами; б) неелектролітами.
NaI, HBr, O2, СН4, CaCl2, KOH, H2SO4,
C12H22O11 (цукор).
|
|
Вплив рН середовища на
ферментативні та технологічні процеси приготування їжі.
До чого може призвести
поєднання залізних іа мідних деталей в одному апараті?
|
|
В якому випадку залізо буде ржавіти. Чому?

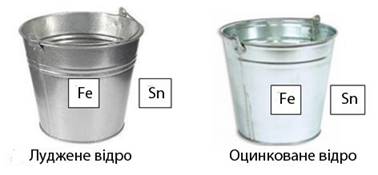
Яке відро
слугуватиме довше: луджене чи оцинковане?
Чому на морі
металеві конструкції піддаються корозії швидше?

Корозія опор мосту
Відповідь до запитань знайдіть у хмарі слів: