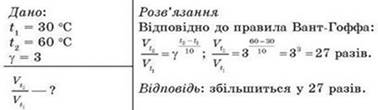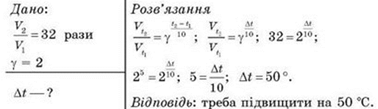|
|
ФІЗИЧНА І КОЛОЇДНА ХІМІЯ Електронний посібник |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
ХІМІЧНА КІНЕТИКА. КАТАЛІЗ |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
4.1. Швидкість хімічної реакції. Вплив різних
факторів на швидкість хімічної реакції. 4.1. Швидкість хімічної реакції. Вплив
різних факторів на швидкість хімічної реакції Хімічна реакція – це хімічний процес, який характеризується
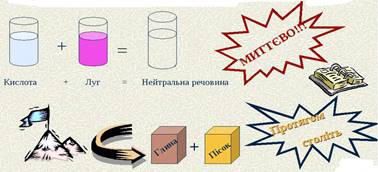
швидкістю взаємодії однієї речовини або елемента з іншою. Деякі хімічні реакції відбуваються миттєво
(вибух киснево-водневої суміші; реакції обміну з утворенням осаду; петарда,
кинута у полум’я: миттєво вибухає), другі – швидко (горіння
речовин, взаємодія магнію з кислотою; свіжовідрізіна скибочка яблука досить
швидко на повітрі вкривається коричневою плівкою), треті – повільно
(іржавіння заліза, гниття органічних решток). Відомі настільки повільні
реакції, що людина їх просто не помічає, зокрема перетворення граніту на
пісок та глину (відбувається протягом тисяч років).
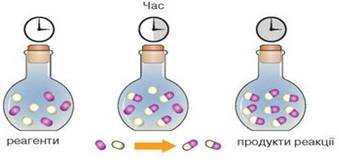
Рис. 4.1.1. Хімічні реакції які
відбуваються: а) миттєво; б)
швидко; в) повільно Хімічна кінетика – це розділ фізичної хімії, що
вивчає швидкість хімічних реакцій. Швидкість хімічної реакції (υ) оцінюють, виходячи зі зміни
кількості частинок (концентрації – С) речовини реагенту чи продукту
реакції за одиницю часу. Концентрація – кількість частинок (атомів,
молекул, йонів) реагенту чи продукту реакції.
Рис. 4.1.2. Схема
зміни концентрації реагентів за певний проміжок часу Коли в рівнянні швидкості хімічної реакції враховують зміни кількості
частинок реагуючих речовин, у його правій частині ставлять знак «мінус», тому
що кількість частинок цих речовин зменшується. Якщо початкову кількість
частинок речовини позначити С1, а через деякий час t – С2, то швидкість реакції в
загальному вигляді можна зобразити так:
Де υ – швидкість реакції, С – концентрація (моль/л), ΔС – заміна концентрації певного
компонента реакції, t – час (с), τ (тау) – певний проміжок часу. Коли в рівнянні враховують зміну кількості частинок речовин, які
утворюються у правій його частині, ставлять знак «плюс», оскільки кількість
утворених частинок речовин збільшується:
Отже, Швидкість хімічної реакції визначається зміною
концентрації однієї з речовин, що реагують, за одиницю часу. Час вимірюють у секундах,
кількість речовини – у молях, об’єм – у літрах, а швидкість, відповідно, – у
моль/л·с.
Рис. 4.1.3. Хімічні реакції: а) з малою швидкістю; б) з великою швидкістю Припустимо, що
початкова концентрація сульфур (IV) оксиду в реакції окиснення його до сульфур
(VI) оксиду була 3 моль/л, а через 50 с стала 0,5 моль/л. У цьому випадку
швидкість цієї реакції дорівнює:
Це означає, що за кожну секунду в 1 л газової суміші 0,05 моль SO2 перетворюється в SO3.
Рис. 4.1.4. Хімічні реакції, які
відбуваються з різною швидкістю Реакція нейтралізації між лугом і
кислотою
video не
поддерживается вашим браузером.. Для характеристики механізму хімічних реакцій в кінетиці застосовують
такі поняття, як порядок і молекулярність реакції. Порядком хімічної реакції називають суму показників степенів у рівнянні
швидкості реакції. Залежно від виду кінетичного рівняння, що зв'язує швидкість реакції з
концентрацією реагуючих речовин, розрізняють реакції нульового, першого,
другого
і третього порядку. Якщо швидкість реакції не залежить від концентрації реагуючих речовин, то
реакція має нульовий
порядок. Якщо швидкість реакції залежить від концентрації
речовини в першому степені, то це реакція першого порядку; якщо в другому
степені, то це реакція другого
порядку і т.д.
Рівнянням першого
порядку можуть описуватися швидкості елементарних мономолекулярних реакцій (ізомеризація,
термічний розклад та ін.), а також реакції зі складнішим механізмом,
наприклад гідроліз сахарози з утворенням глюкози і фруктози. Ця реакція бімолекулярна, однак через наявність великого
надлишку води швидкість залежить тільки від концентрації сахарози. Реакції 1-го порядку порівняно рідкісні. Вони відбуваються лише з
речовинами, які розпадаються на складові частини без впливу інших речовин.
Прикладом реакцій другого порядку є освітлення й розкладання йодиду
водню, тобто пряма і зворотна реакції в системі:
а також
розкладання діоксиду азоту 2NO2 → N2 + 2O2.
По третьому порядку йде, наприклад, реакція окислення оксиду азоту до
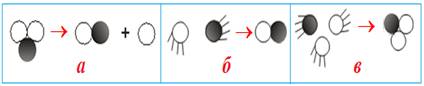
діоксиду: 2NO + О2 → 2NО2 Під молекулярністю реакції розуміють число частинок (атомів, молекули йонів), які беруть участь в
елементарному акті взаємодії. За цією ознакою реакції поділяють на
мономолекулярні, бімолекулярні та тримолекулярні.
Cl2= 2Cl, 2N2O5 = 2N2O3
+ 2O2.
H2 + J2 = 2HJ, CO + Cl2 = COCl2.
2NO + O2 = 2NO2. Статистично такий
процес є малоймовірним і тому в хімії зустрічається рідко.
Рис. 4.1.5. Моделі реакцій: а) мономолекулярні реакції; б) бімолекулярні реакції; в) тримолекулярні
реакції Як правило,
молекулярність простої реакції збігається з порядком реакції, однак бувають і розбіжності. Незбіг порядку і
молекулярності спостерігається в процесах гідролізу речовини. Це пояснюється
тим, що концентрація одного з реагентів (переважно середовища) в процесі
реакції практично не змінюється. Так, реакція гідролізу сахарози розведеному
розчині є реакцією бімолекулярною, але першого порядку: С12Н22О11
+ НОН = С6Н12О6 + С6Н12О6 сахароза глюкоза фруктоза Математичний запис для реакцій “0”, ”1”,
”2”, ”3” порядків
Наприклад, омилення метилоцтового ефіру при 298К протікає за рівнянням: СН3СООСН3 + NaOH = CH3COONa + CH3OH Отримано такі експериментальні дані:
СоNaOH = СoCH3COOCH3 = 0,01 моль/л Розв’язування. По черзі підставляємо
дослідні дані, у рівняння першого й другого порядку, розуміючи, що реакцією
нульового порядку може бути тільки каталітичний процес, яким ця реакція не є. K11 = 1/τln(Сo/C)=1/180∙2.3lg(0,01/0,0074)c-1 K21 = 1/1500∙2,3lg(0,01/0,00245)c-1
= 0,0009 c-1 K12
= 1/τln(1/С – 1/Co)=1/180∙2,3lg(1/0,0074–1/0,01) = 0,196 K22 = 1/1500 (1/0,00245 –
1/C0,01) = 0,196 л/моль∙с. Отже, можемо зробити висновок, що реакція омилення
метилоцтового ефіру є реакцією
другого порядку. Хімічні реакції можна поділити на дві групи залежно від їх значення для
людини: бажані та небажані. Що швидше відбувається бажана реакція, то більше
за одиницю часу утвориться потрібного продукту, й економічно вигіднішою буде
ця продукція. Деякі хімічні реакції завдають шкоди (псування харчових
продуктів, процес корозії металів), тому швидкість таких небажаних реакцій
потрібно сповільнювати.
Рис. 4.1.6.
Охолодження продуктів харчування для кращого зберігання або
транспортування Використовуючи ці знання, технологи проектують заводську апаратуру, в
якій відбуватимуться хімічні перетворення, планують її продуктивність. Швидкість хімічної реакції визначають різними методами: відбирають із реагуючої суміші проби і аналізують
їх; вимірюють кількість газу, що виділяється внаслідок реакції, або будь-яку
із фізичних властивостей, що пов'язані з концентрацією. Це може бути зміна
кольору розчину, електропровідність, теплопровідність, показник заломлення
світла.
Розглянемо основні фактори, що впливають на
швидкість хімічної реакції.
Яка умова є обов’язковою для того, щоби почалася хімічна реакція?
Частинки (атоми, молекули, йони), які вступають у реакцію, мають зіштовхнутися
одна з одною. Якщо ми хочемо збільшити швидкість реакції, треба ці зіткнення
зробити частішими, а якщо зменшити швидкість – то, відповідно, навпаки. У разі збільшення концентрації реагентів швидкість реакції збільшується,
тому що частішає зіткнення між частинками. Це правило підходить для речовин у газоподібному й рідкому станах. – Уявіть шкільний коридор, у якому всього два учні. Якою є ймовірність їх
зіткнення? Низька. – А тепер уявіть перерву, у коридорі багато учнів (підвищилася концентрація),
і зіткнення почастішали. Збільшення концентрації передбачає збільшення частинок речовини в певному
об’ємі або в перерахуванні на загальну масу.
Рис. 4.1.7. Вплив
концентрації речовин на швидкість хімічної реакції Вплив
концентрації речовин на швидкість хімічної реакції
video не
поддерживается вашим браузером.. Таким чином, швидкість хімічної реакції пропорційна добутку
концентрацій реагуючих
речовин у ступенях, які дорівнюють коефіцієнтам, що стоять перед формулами
речовин у відповідному рівнянні реакції. Цю закономірність встановили експериментально у 1867 р. Гульберг і Вааге.
Вона має назву закону діючих мас
(далі – ЗДМ). Діючими масами на той час називали концентрації
речовин. Наприклад, для хімічної реакції: aA + bB = cC + dD, швидкість
дорівнює: v = kCa(A)Cb(B) =
k[A]a[B]b. Величина k
– коефіцієнт пропорційності поміж швидкістю і концентрацією, що називається константою
швидкості реакції. Вона
чисельно дорівнює швидкості реакції, якщо концентрація відповідних речовин
дорівнює одиниці. Константа швидкості за сталої температури величина стала і характеризує
природу реагуючих речовин. Константа швидкості – це
швидкість реакції за умови, що концентрації реагуючих речовин
дорівнюють 1 моль/л. Рівняння, що пов’язує швидкість реакції з
концентраціями реагентів, називають рівнянням швидкості, або кінетичним
рівнянням реакції.
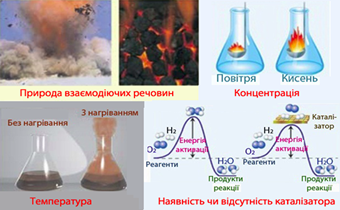
Важливо, які речовини вступають у реакцію, якими є їхній склад і будова,
тобто якою є природа реагентів. Наприклад, розглянемо реакцію горіння в кисні
різних речовин: аркуш паперу, шматок вугілля, порох, шматок деревини. В
якому випадку швидкість реакції буде максимальною? Рис. 4.1.8. Реакція горіння таких
речовин: 1) аркушу паперу; 2) вугілля; 3)
деревини; 4) пороху Так, коли горить
порох (швидке горіння – вибух). Найменша швидкість горіння – у шматка
вугілля. У цьому випадку,
щоправда, треба враховувати ще й ступінь подрібнення вугілля і його контакт
із киснем. Якщо вдмухувати тонкий порошок вугілля в кисень, моментальне
згоряння забезпечене. Розглянемо
реакції однотипних речовин.
Рис. 4.1.9. Вплив
природи реагуючих речовин на швидкість
хімічної реакції Вплив природи
редагуючих речовин на швидкіть хімічної реакції
video не
поддерживается вашим браузером.. Наприклад,
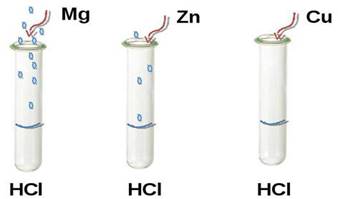
магній і цинк розчиняються в хлоридній кислоті з різною швидкістю: Mg + 2HCl = MgCl2 + H2 V1, Zn + 2HCl = ZnCl2 + H2 V2, Сu + HCl ≠ Швидкість хімічної
реакції V1 більша швидкості хімічної реакції V2 Це
пояснюється різною хімічною активністю цих металів. Те, що магній активніший, ніж
цинк, видно з його розміщення в електрохімічному ряду напруг металів, де він
знаходиться лівіше цинку.
Як правило, речовини з йонними або ковалентними полярними зв'язками
реагують миттєво; з малополярними зв'язками – повільніше. Це пояснює досить низьку
швидкість реакцій за участю органічних речовин. Наприклад, цинк реагує з
хлоридною кислотою швидше, ніж з ацетатною. Швидкість технологічних процесів також залежить від природи речовин, що
входять до складу продуктів харчування. Тому спостерігається різний термін
часу під час варіння круп, різна ступінь доведення до готовності м'яса різних
тварин.
Якщо в реакцію вступають рідини або гази, то, перемішуючи реагенти, ми теж
прискоримо реакцію, тому що це теж призводить до збільшення числа зіткнень
між реагуючими частинками.
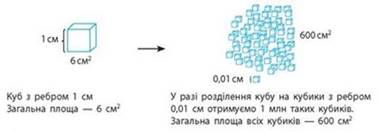
Рис. 4.1.10. Збільшення загальної площі
поверхні у разі подрібнення речовини Вплив площі поверхні на швидкість хімічної реакції
video не поддерживается вашим
браузером.. Якщо один із реагентів у твердому
стані, то швидкість реакції безпосередньо залежить від площі зіткнення реагентів.
Це зрозуміло: тільки на поверхні твердої
речовини можливе зіткнення молекул. Що більше
подрібнена речовина й краще відбувається перемішування, то швидше реакція. Усім відомо, що
алюмінієві вироби в повітрі не горять. Однак порошок алюмінію у разі внесення
в полум’я загоряється, розкидаючи сніп іскор. А якщо такий порошок вдмухувати у вогонь, може статися вибух. Недарма дуже подрібнений
алюміній використовують як
тверде пальне для ракетоносіїв.
Рис. 4.1.11. Вплив площі поверхні на швидкість хімічної
реакції: а) горіння порошку алюмінію; б) морський запуск ракети (Sea
Launch) з ракетоносієм, виготовленим на українському заводі
”Південмаш” (м. Дніпро) Що дрібніші частинки
алюмінію, то швидше вони реагують з киснем. Так само відбувається і в разі
подрібнення інших речовин. Деякі, на перший
погляд, «безпечні» речовини (цукор, борошно, деревина тощо) у разі
подрібнення й розпилення в повітрі можуть вибухати. Наприклад, велика
концентрація вугільного пилу в шахтах може призводити до пожеж, тому що він
легко займається.
Цікавий факт Якщо насипати вугільний
пил купкою й намагатися його підпалити, горіти буде досить погано. Відомо, що
млини належать до першої категорії за пожежонебезпечністю внаслідок того, що
в повітрі багато борошняного пилу. Але знов-таки підпалити борошно не
вдається, якщо воно насипано купкою.
Наш життєвий досвід підтверджує, що швидкість більшості хімічних реакцій
збільшується з підвищенням температури. Так, м’ясо за кімнатної температури псується
набагато швидше, ніж у холодильнику. У країнах з теплим і вологим кліматом
фрукти дозріваютьраніше, а машини іржавіють швидше, ніж у північних країнах. Збільшення числа зіткнень між молекулами не є
головною причиною такого значного збільшення швидкості реакції під час
нагрівання.
Рис. 4.1.12.Вплив
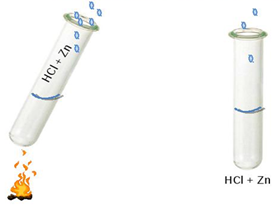
температури на швидкість реакції Для оцінювання залежності швидкості хімічної реакції від температури
користуються правилом Вант-Гоффа. За підвищення температури на кожні 10° швидкість хімічної реакції
збільшується в 2 – 4 рази. Цю залежність
можна відобразити рівнянням:
де V2 – швидкість хімічної реакції за
температури t2; V1 – швидкість хімічної реакції за температури t1 γ – температурний коефіцієнт = 2
– 4; t2 – t1 – різниця температур. Зауважимо, що це правило справедливе для відносно вузького інтервалу температур
(0° – 100 °С). Чіткіша залежність швидкості хімічної реакції від температури пояснюється
в теорії активних зіткнень Арреніуса. В основу цього покладено твердження, що реагують лише ті молекули,
енергія яких для даної температури вища за середню на величину Еа — енергію активації. Енергія активації – надлишок енергії, яку повинні
мати молекули (частинки) реагуючих речовин, щоб перетворитися на активні. Таке пояснення природне, тому що реакції повинні передувати ослаблення та
руйнування хімічних зв'язків у реагуючих молекулах, на що потрібна витрата
енергії. Величина енергії активізації визначається природою реагуючих
речовин. Тільки активні молекули, що мають у момент зіткнення необхідний надлишок
енергії, можуть подолати енергетичний бар'єр і вступити у хімічну взаємодію.
Із зменшенням величини енергетичного бар'єра їх число збільшується. За Арреніусом залежність швидкості хімічної реакції від температури має
вигляд:
де к – константа
швидкості; к0 – константа, що мало залежить
від температури (частотний фактор); Еа – енергія активації; R – універсальна газова стала; Т – температура. Теорія активних зіткнень Арреніуса має такий істотний недолік – вона не
враховує час, необхідний для перерозподілу зв'язків і утворення нових
молекул. Швидкість хімічної
реакції змінюється за наявності деяких речовин. У багатьох випадках скерувати
реакцією в бажаному напрямку, а також різко збільшити її швидкість вдається
за допомогою каталізаторів. Каталізатори – це речовини, що змінюють швидкість хімічної реакції, але
самі при цьому не витрачаються і не входять до складу кінцевих продуктів
реакції.
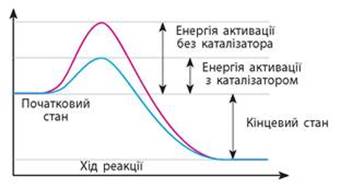
Рис. 4.2.1. Енергетична діаграма реакції: а) без каталізатора; б) за наявності
каталізатора Каталізаторам
притаманні деякі специфічні особливості. Не піддаючись якісним і кількісним
зміненням внаслідок реакції, каталізатори зменшують енергію активації, але не
впливають при цьому на термодинамічні показники реакції (ΔН, ΔG, ΔS) і на константу хімічної
рівноваги, рівною мірою збільшуючи швидкість як прямої, так і зворотної
реакцій.
Рис. 4.2.2. Деякі специфічні властивості каталізаторів Каталітичні реакції дуже різноманітні. Вони відіграють винятково важливу роль у живій природі
і мають широке промислове застосування. Каталіз – явище зміни швидкості реакції під дією каталізаторів. Прикладом
позитивного каталізу є наявність нікелю в реакціях гідрування жирів,
ферментів у біохімічних процесах. Інгібітори –
каталізатори,
що
сповільнюють
швидкість
хімічної
реакції. Механізм дії інгібіторів є аналогічним дії каталізаторів – участь у проміжних стадіях процесу, наслідком чого є зниження числа активних молекул реагенту, які забезпечують перебіг реакції. Наприклад, атоми багатьох важких металів (Hg, Cd) в організмі людини реагують з молекулами білків, сповільнюючи життєво важливі біохімічні процеси.
Рис. 4.2.3. Конкурентне інгібування: S – субстрат, І – інгібітор, Е – фермент (гальмування відбудеться тоді, коли
концентрація інгібітора перевищить концентрацію субстрату) До інгібіторів
належать антистарителі (речовини, які уповільнюють процес старіння гуми, таку
функцію виконують парафін, віск); антиокисники (сповільнюють окиснення
органічних речовин). Наприклад, згіркненню жирів перешкоджає лимонна та
аскорбінова кислоти. Речовини, які
запобігають псуванню харчових продуктів, називають консервантами.
Рис. 4.2.4. Консервант Особливим випадком
каталізу є автокаталіз. Автокаталіз – явище прискорення хімічної реакції одним із її продуктів. Характерною
особливістю автокаталітичної реакції є збільшення її швидкості з накопиченням
продукту реакції. Далі у зв’язку зі зниженням концентрації вихідних речовин
швидкість реакції зменшується. Розрізняють два
види каталізу: гомогенний і гетерогенний. Гомогенним називається каталіз, при якому і каталізатор, і
реагенти знаходяться в одному агрегатному стані. Для пояснення механізму гомогенного каталізу було
запропоновано теорію
проміжних сполук. Її виклав у своїх працях Оствальд в
1884 – 1911 рр. Згідно з цією теорією, каталізатор утворює з однією із
реагуючих речовин нестійку проміжну сполуку – комплекс, яка далі взаємодіє з
іншими реагентами; при цьому каталізатор вивільнюється у незмінному вигляді. Наприклад, якщо реакція типу А
+ В = АВ
відбувається повільно, то підбирають каталізатор К, який з однією із
вихідних речовин реагує з більшою швидкістю, тобто отримують– А + К = АК. Далі речовина АК
з більшою швидкістю реагує з речовиною В
і, таким чином, отримують АК + В = АВ + К. У цих рівняннях АК – проміжна сполука. Збільшення швидкості реакції при гомогенному каталізі
пояснюється тим, що кожна зі стадій характеризується низькою енергією
активації і, відповідно, відбувається з більшою швидкістю. До класичних прикладів
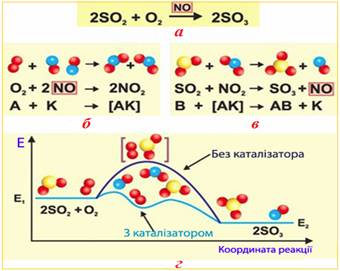
гомогенного каталізу можна віднести реакцію окислення сульфур (IV) оксиду SO2(г) киснем O2(г) за участю каталізатора NO(г), що застосовується у
виробництві сульфатної кислоти (рис. 4.2.5):
Рис. 4.2.5. Механізм гомогенного
каталізу: а) загальне рівняння каталітичної
реакції між реагентами SO2(г) і O2(г) за участю
каталізатора NO(г); б)перша стадія, протягом якої каталізатор взаємодіє
з однією з вихідних речовин – киснем, окислюючись до NO2; в) друга стадія, під час якої
відбувається регенерація проміжної сполуки NO2 при її взаємодії з
іншою вихідною речовиною (SO2) і відновлення
початкової форми каталізатора (NO(г)); г)
енергетична схема реакції 2SO2(г) + O2(г) → 2SO3(г) без каталізатора
і за його наявністю Існують такі типи гомогенного каталізу:
кислотно-основний, окисно-відновний, координаційний, гомогенний газофазний,
ферментативний. За гомогенного каталізу швидкість хімічної реакції
пропорційна концентрації каталізатора. Гетерогенний каталіз – це вид каталізу, в
якому каталізатор знаходиться в іншій фазі, ніж реагенти. Типовим прикладом гетерогенного
каталізу є процес окислення сульфур (IV) оксиду SO2(г) киснем O2(г) на поверхні твердого
каталізатора V2O5(тв) (рис. 4.2.6).
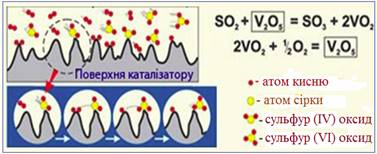
Рис. 4.2.6. Схема
гетерогенного каталізу при одержанні Сульфур (VІ) оксиду SO3 у сульфатнокислотному
виробництві В якості інших прикладів гетерогенного каталізу можна навести прискорення
таких процесів: розклад гідроген пероксиду за участю манган (IV) оксиду:
синтез амоніаку
виробництво метилового спирту
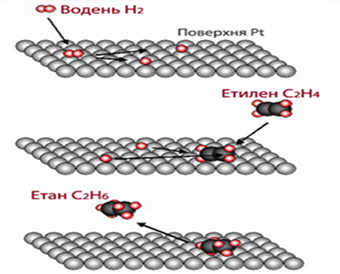
гідрування етилену на платині
Рис. 4.2.7. Схема каталітичного
гідрування етилену на платиновому каталізаторі Найчастіше
каталізатор перебуває в твердому стані, а реагенти і продукти реакції – в рідному
або газоподібному. Швидкість
гетерогенної каталітичної реакції залежить від реагуючої поверхні
каталізатора, бо усі реакції за гетерогенного каталізу протікають на його
поверхні. Встановлено, що каталітичну активність має не вся поверхня
каталізатора, а тільки її певні ділянки – активні центри. Активними
центрами можуть бути фізичні неоднорідності на поверхні каталізатора. Можуть
бути також атоми, що мають ненасичені валентності і, завдяки чому, вони
можуть утворювати нестійкі поверхневі проміжні сполуки з речовинами рідкої
або газоподібної фази. Наявність активних
центрів на поверхні каталізатора підтверджується високою чутливістю
каталізатору до дії каталітичних отрут. Каталітичні отрути – речовини, що знижують каталітичну активність
каталізатора. Дія каталітичних
отрут пояснюється тим, що молекули цієї речовини накопичуються на активних
центрах, блокують їх і виводять із участі в реакції. Так як активні центри
займають невелику частину поверхні, то для їх «отруєння» достатньо невеликої
кількості каталітичної отрути. Під час збільшення
неоднорідності поверхні збільшується активність каталізатору. Це досягається
збільшенням дисперсності або введенням у каталізатор деяких речовин, які самі
не є каталізаторами, але змінюють структуру поверхні, збільшуючи активність
каталізаторів. Такі речовини називають промоторами. На активність і селективність каталізатора впливає природа матеріалу,
на який він нанесений (носія).
Один і той самий каталізатор, нанесений на різні носії, каталізує реакції
різних типів. Це пояснюється різною будовою активних центрів каталізатора,
залежно від природи носія, і його поверхні. Весь каталітичний процес, що відбувається на твердому каталізаторі,
можна розбити на п’ять послідовно протікаючих стадій:
Перша і остання стадії називаються дифузійними, решта – кінетичними.
Всі ці стадії можуть відбуватися з різними швидкостями і швидкість всього
каталітичного процесу визначається (лімітується) його найбільш повільною
стадією. Слід зазначити, що каталізатори мають специфічну дію, тобто кожен
хімічний процес може прискорюватись або сповільнюватись тільки певним
каталізатором. Наприклад, під час пропускання парів етанолу за температури 300 – 400
0С над мідним каталізатором відбувається дегідрування спирту з
утворенням етаналю:
Якщо
каталізатором є алюміній оксид, то відбувається дегідратація спирту з
утворенням етилену:
Слід відзначити, що в практиці рідко застосовуються каталізатори, до
складу яких входить лише одна речовина. У переважній більшості промислових
процесів доводиться застосовувати складні багатокомпонентні системи, які
мають достатню активністю і селективність. Компоненти таких складних
каталізаторів можуть утворювати хімічні сполуки, тверді розчини чи
знаходитись у вигляді суміші окремих фаз. Під час ферментативного каталізу каталізатором служать ферменти (або ензими).
Це біологічно активні речовини, які є продуктами життєдіяльності організмів. Ферменти – це
біологічні каталізатори, що прискорюють хімічні реакції в живих організмах.
Реагенти в реакції, що каталізуються ферментами, називаються субстратами, а
отримувані речовини – продуктами. Ферменти зазвичай
є білковими макромолекулами. Вони специфічно зв’язують субстрати реакції в
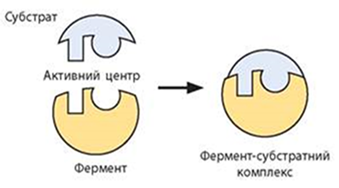
особливій ділянці – активному центрі (рис. 4.2.8).
Рис. 4.2.8. Специфічне зв'язування
субстрату, зумовлене просторовою будовою й хімічною спорідненістю активного центру
ферменту При цьому
субстрати орієнтуються так, що набувають оптимального положення для перебігу
реакції. Енергія активації, що необхідна для перебігу реакції, при цьому
знижується (рис. 4.2.9).
Рис. 4.2.9. За умови ферментативного каталізу знижується енергія
активації реакції Ферменти мають білкову природу. Кожен фермент каталізує певний хімічний
процес або певну групу хімічних перетворень.
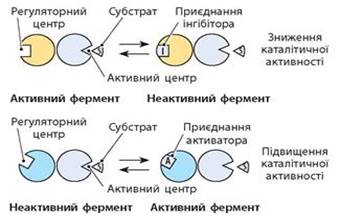
Рис. 4.2.10. Принцип алостеричної
регуляції активності ферменту Ферментативні процеси є основою життєдіяльності будь-якого організму.
Важливе значення мають ферментативні процеси в харчовій промисловості
(квашення капусти, виготовлення пива, квасу, вина, спирту, хліба тощо.). Тут
головну роль відіграють процеси бродіння, ферменти виробляються
мікроорганізмами дріжджів, бактерій, плісені. Важливу роль у харчовій
промисловості відіграють гідролізуючі ферменти: протеїнази використовують у
хлібопекарному виробництві, пектинази застосовують у виноробстві, інвертази –
в кондитерському виробництві. Випуск ферментних препаратів, застосування яких
у харчовій промисловості дає високий економічний ефект, збільшується. Використання ферментних препаратів строго лімітованої протеолітичної
активності в хлібопекарному виробництві дає можливість регулювати такі
властивості тіста, як пластичність, пористість, еластичність м'якуша,
посилити інтенсивність забарвлення шкірки, покращити смак і аромат
хлібопекарських виробів.
Рис. 4.2.11. Дія
ферментів у мийних засобах Також ферменти
використовують у мийних засобах, вони розщеплюють жири, цукри та білки на
наших посудах після їжі набагато швидше, ніж інші миючі засоби. Існують хімічні реакції,
в яких енергія виділяється у вигляді світла. Найпоширенішою такою
реакцією є горіння. Але є й інші. Так, у разі зберігання білого фосфору на
повітрі він одразу починає реагувати з киснем. Частина енергії під час цієї
реакції виділяється у вигляді світла, тому білий фосфор світиться в темряві.
Це явище називають хемілюмінесценцією.
Явище
хемілюмінесценції притаманне й живим організмам: хімічні реакції забезпечують
світіння в темряві світлячків, деяких медуз тощо. До речі, хемілюмінесценція
дуже поширена серед рослин і тварин у фантастичному світі з кінофільму
«Аватар».
Рис. 4.3.1. Реакції з виділенням енергії: а) білий фосфор на повітрі і в темряві;
б) світіння світлячків; в) світіння мешканців океанських глибин Існують хімічні
реакції, що відбуваються з поглинанням світла, їх називають фотохімічними.
Найвідоміша фотохімічна реакція – це фотосинтез. Також під дією світла
відбувається перетворення кисню на озон. Речовини-барвники, якими забарвлений
наш одяг, поглинають світло й перетворюються на безбарвні речовини, через що
одяг із часом вицвітає. А в деяких окулярах містяться фотохромні лінзи, завдяки яким такі окуляри всередині
помешкання безбарвні, а за сонячного освітлення стають темними. У
фотохімічних процесах беруть участь особливі молекули на сітківці нашого ока,
завдяки чому ми бачимо. Також до
фотохімічних реакцій відносяться: розпад бромистого срібла на світлочутливому
шарі фотопластинки; взаємодія хлору з воднем на світлі з утворенням HCl; засмага (потемніння шкіри людини під впливом
ультрафіолетових променів) тощо.
Рис. 4.3.2. Фотохімічні реакції Ф.Х. Гроттус (1817) встановив, що
хімічно активним є те світло, яке поглинається реакційним середовищем. К.А.
Тимірязєвим (1875) показав, що кількість продукту, отриманого за певної
фотохімічної реакції, пропорційна кількості поглинутої світлової енергії. Ці
співвідношення були піддані різносторонньому вивченню в працях П.П. Лазарєва
(1907 – 1910), який показав, що кількість речовини, яка розклалася,
пропорційна кількості поглинутої енергії. У подальшому теорія фотохімічних реакцій розвивалася на
основі квантової теорії світла. Фотохімічна дія
світла полягає в тому, що атоми або молекули реагуючої речовини, поглинаючи
світлові кванти (фотони), збуджуються, тобто збільшується їх внутрішня
енергія і, зокрема, та її форма, яка впливає на перебіг даної реакції. Між кількістю
поглиненої енергії під час фотохімічних реакцій і кількістю речовини, що
прореагувала, існує залежність – закон фотохімічної залежності Ейнштейна:
кожна молекула, що реагує під дією
світла, поглинає один квант випромінювання, що і викликає реакцію. Експериментальна перевірка закону фотохімічної
еквівалентності довела, що інколи число прореагувавших молекул не дорівнює
числу поглинених квантів. Тому для кінетичної характеристики фотохімічних
реакцій введене поняття квантового виходу. Квантовий вихід фотохімічної реакції – це відношення числа
молекул N, що взяли участь
у реакції, до числа поглинутих квантів світла п.
Згідно з законом
фотохімічної еквівалентності, квантовий вихід має дорівнювати одиниці, але
зустрічаються реакції в яких він або менше, або більше одиниці. Відхилення від
законів фотохімічної еквівалентності уявні та пов'язані з різними вторинними
процесами. Квантовий вихід менше одиниці – частина фотонів
поглинається молекулами сторонніх речовин, що знаходяться в суміші з
реагуючими речовинами. Можлива і передача енергії молекулами, що поглинають
квант світла, іншим молекулам під час зіткнення. Квантовий вихід більше одиниці може бути зумовлений
тим, що перетворення, викликані поглинанням молекулою кванта світла,
призводять до утворення активних частинок, які вступають у вторинні реакції. До цього часу ми розглядали хімічні реакції, умовно вважаючи,
що вони протікають до кінця, тобто реагенти повністю перетворюються на
продукти реакції. Насправді, таке положення стосується лише деяких реакцій,
які називаються необоротними. Необоротні реакції відбуваються
тільки в одному напрямку й перебігають майже до кінця. Наприклад:
Необоротними називають такі реакції, під час перебігу яких:
ВаСl2 + H2SO4
= ВаSO4↓ + 2НСl;
Na2CO3 + 2HCl
= 2NaCl + СО2↓ + H2O;
НСl + NaOH = Н2О + NaCl;
Mg + ½O2 = MgO, ∆Н
= – 602,5 кДж/моль. У рівняннях необоротних реакцій між лівою і правою частинами ставиться
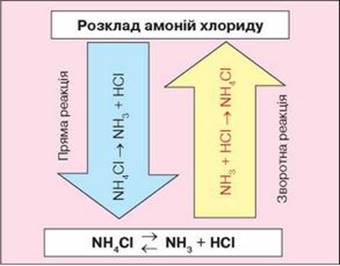
знак рівності або стрілка. Оборотні реакції за одних і тих самих умов одночасно відбуваються у
двох взаємно протилежних напрямках і тому не перебігають до кінця. Наприклад: N2+3H2 → 2NH3 Реакція, яка
відбувається вбік утворення продуктів реакції (у нашому випадку NH3), називається
прямою, а реакція, яка одночасно відбувається вбік утворення реагентів (у нас
це N2 і H2), називається зворотною. У рівняннях
оборотних реакцій замість знака «=» ставлять дві стрілки, спрямовані в
протилежних напрямах. Оборотною є
реакція взаємодії водню з йодом. Утворення молекул гідроген йодиду
(рис.4.4.1) – це пряма реакція, а розклад утвореного продукту на водень і йод
– зворотна.
Рис. 4.4.1. Схема прямої та зворотної
реакцій утворення та розкладу гідроген йодиду Розглянемо детальніше оборотні реакції, які одночасно за певних умов
перебігають у двох напрямках.
У перший момент швидкість прямої реакції Vпр =k1пр[A]а[B]в визначається початковими концентраціями
вихідних речовин. Швидкість зворотної реакції при цьому дорівнює нулю. По
мірі взаємодії Н2 і I2 і утворення
С і D швидкість прямої реакції зменшується, а
швидкість зворотної реакції Vзв = k2зв[C]c [D]d буде зростати. Через певний час швидкість прямої та зворотної реакцій
зрівняються (рис. 4.4.1). При цьому кількість утворених молекул С
і D буде дорівнювати кількості
молекул С i D, які прореагували і перетворились на А і B. Тобто концентрації всіх речовин у момент, коли
швидкість прямої та зворотної реакцій однакова, не змінюються. Такий стан
реакційної системи називається хімічною
рівновагою.
Рис. 4.4.2. Зміна швидкості прямої і
зворотної реакції з часом Хімічна рівновага – це стан системи, за якого швидкість прямої реакції
дорівнює швидкості зворотної. Рівноважними називаються концентрації
реагентів і продуктів у стані хімічної рівноваги. Якщо в стані хімічної рівноваги Vпр = Vзв, то k1пр [A]a [B]b = k2зв [C]c [D]d відповідно
Константа
хімічної рівноваги – це
відношення констант швидкості прямої та зворотної реакції.
Рис. 4.4.3. Приклад прямої та зворотної
реакції Змінюючи умови, можна перевести систему з одного рівноважного стану в
інший, що відповідає новим умовам. Рівновага зміщується, тому що зміна умов
неоднаково впливає на швидкість прямої та зворотної реакцій. Характер
зміщення рівноваги залежно від зовнішніх факторів можна визначити за принципом Ле Шательє
(1884): якщо на систему, що перебуває у стані рівноваги, впливати
ззовні, то рівновага зміщується у бік тієї реакції, що послаблює цей вплив. Значення принципу Ле Шательє в хімії дуже велике, оскільки дає змогу
передбачити напрямок реакції за різних умов, отже, керувати перебігом
реакцій. Розглянемо зміщення хімічної рівноваги за змін
концентрації реагуючих речовин, температури і тиску. Вплив концентрації Згідно принципу Ле
Шательє, введення у рівноважну систему додаткової кількості одного з
реагентів викликає зміщення рівноваги у тому напрямку, при якому концентрація
цього реагенту зменшиться і відповідно збільшиться концентрація продуктів
його взаємодії. Наприклад, до рівноважної системи
додали кисень:
Це викличе
посилення процесу утворення оксиду вуглецю(IV). Процес буде протікати до тих пір, поки система не
прийде до стану рівноваги. Таким чином, у рівноважній системі, не можливо
змінити концентрацію одного з реагентів, не викликаючи зміну концентрації
решти. Вплив тиску Зміна тиску впливає
на стан рівноваги у тих випадках, коли реакція супроводжується зміною об'єму
системи (зміною кількості газоподібних речовин). Відповідно до принципу Ле
Шательє збільшення тиску зміщує хімічну рівновагу у бік утворення меншого
числа молекул газоподібних речовин. Наприклад, для реакції димеризації оксиду
азоту(IV): 2NO2 З двох
газоподібних молекул NO2, утворюється одна
молекула N2O4. У разі підвищення тиску рівновага зміститься у бік утворення меншого числа
молекул газу, тобто у бік утворення N2O4. У разі зменшення
тиску – у бік утворення NO2. Вплив температури Згідно з принципом
Ле Шательє збільшення температури викликає зміщення рівноваги у напрямку того
з процесів, протікання якого супроводжується поглинанням теплоти, а зниження
температури – виділенням теплоти. У рівноважних системах: 2NO2(г) 2CO(г.) + O2 Підвищення
температури призводить до розкладу N2O4 та CO2 відповідно, а зниження температури, навпаки, – утворення N2O4 та CO2. Приклад. Визначимо, в який бік зміститься рівновага, якщо: 1) у рівноважну суміш
водню, азоту та аміаку додати азоту; 2) за рівноважного стану реакції С+СО2
→2СО збільшити тиск; 3) підвищити температуру під час
проведення реакції: СО+Сl2 → СОСl2; DH= –123 кДж. Відповідь: 1) рівновага зміститься у бік синтезу аміаку, бо реакція,
протидіючи збільшенню концентрації азоту, перетворить його на амоніак; 2)
вліво, бо при цьому число частинок газуватих речовин зменшується, що зумовлює
зниження загального тиску; 3) вліво, бо частина теплоти витрачається на
розклад фосгену СОСl2 і нагрівання зменшується. Таблиця 4 Умови
зміщення рівноваги
ЗАДАЧІ Приклад 1 Запишіть математичний вираз константи рівноваги
для реакції 2Н2О(г) + 2С12(г) Розв’язання. За законом діючих мас для стану хімічної рівноваги
Приклад 2 Під час розкладання сульфур(VI) оксиду за деякої температури встановились рівноважні концентрації речовин: [О2] = 0,06
моль/л, [SO2] = 0,12
моль/л, [SO3] = 0,04
моль/л. Визначте константу хімічної рівноваги реакції
Приклад 3 Як зміниться
швидкість реакції 2NO(г) + O2(г) = 2NO2(г) якщо зменшити об’єм речовини втричі? Розв’язання: Обидва
реагенти газуваті, тому υ = k ∙ [NO]2 ∙ [O2]. Внаслідок зменшення об’єму концентрація кожної з речовин,
що реагують, зросте втричі. Отже, υ = 3 ∙ [NO]2 ∙ 3[O2] = 32 ∙ 3 =
27. Відповідь: швидкість реакції
збільшиться у 27 разів Приклад 4 Як зміниться
швидкість хімічної реакції СН4 + 2О2 = СО2
+ + 2Н2О, якщо збільшити тиск у 4 рази? Розв’язання. За законом
діючих мас υ = k ∙ [CH4] ∙ [O2]2. Зі збільшення тиску концентрації кожного з
реагентів збільшення в 4-и рази. Звідси: υ = 4 ∙ [CH4] ∙ 4[O2]2 = 4 ∙ 42 = 64. Відповідь: Після збіьшення тиску вчетверо
швидкість хімічної реакції збільшиться у 64 рази Приклад 5 Як зміниться швидкість реакції з підвищенням температури реакції від 30
до 60 °С, якщо температурний коефіцієнт реакції дорівнює 3?
Приклад 6 На скільки
градусів треба підвищити температуру реакції, щоб її швидкість зросла в 32
рази, якщо температурний коефіцієнт реакції дорівнює 2?
Приклад 7 Як зміниться
швидкість реакції з підвищенням температури реакції від 115 до 175 °С, якщо
температурний коефіцієнт реакції дорівнює 3?
Приклад 8 Як впливатиме підвищення тиску на хімічну рівновагу в оборотній системі Fe3O4 (т) + СО (г) ⇆ 3FeO (т) + СО2 (г) Розв’язання. Запишемо вирази
для швидкостей прямої (vпр) і зворотної (vзвор) реакцій: vпp = kпр [СО]; vзвор = kзвор [СО2]. Швидкості прямої і зворотної
реакцій не залежать від концентрацій твердих речовин. За підвищення тиску в
два рази в таке саме число разів збільшуються концентрації СО і СО2. Отже, швидкості прямої та зворотної реакцій
збільшаться в однакове число разів, і рівновага в системі не зміститься. Приклад 9 Поміркуйте, в який бік зміститься рівновага реакції. CO(г)
+ H2O(г)
↔ СO2(г) + H2(г) ; ΔH=−42,6
кДж якщо: а) збільшити температуру; б) зменшити концентрацію вуглекислого газу СО2; в) збільшити тиск у системі. Розв’язання: а) пряма реакція є
екзотермічною, а зворотна – ендотермічною. Підвищення температури зміщує
рівновагу в бік ендотермічної реакції, тобто ліворуч; б) зменшення концентрації
вуглекислого газу приведе до зміщення рівноваги в бік реакції його утворення,
тобто праворуч; в) рівняння реакції показує, що
один об'єм CO реагує з одним об'ємом водяної пари (разом два
об'єми), утворюючи 1 об'єм CO2 і 1 об'єм H2 (також два
об'єми). Отже, кількість молекул газоподібних речовин у системі не змінюється
і підвищення чи зниження тиску не приведе до зміщення рівноваги.
ЦІКАВО ЗНАТИ У давнину існували
так звані «вогняні потіхи», які влаштовували на свята. У полум’я смолоскипа
вдмухували дрібні спори плауна, вони спалахували
великою вогненною кулею. Можна вдмухувати в полум’я й порошок
крохмалю.
Рис. Вогняні потіхи Чому застосування кисневого дуття інтенсифікує згоряння
палива? Збільшення
концентрації кисню інтенсифікує горіння. Демонстрація добування кисню з гідроген пероксиду
video не поддерживается вашим
браузером. Виявляючи тліючою скіпкою кисень у
посудині, ви також пересвідчилися, що збільшення його концентрації (порівняно
з умістом в повітрі) істотно пришвидшує реакцію горіння.
Рис. Виявлення кисню: а – жевріюча скіпка на повітрі; б –
спалахування скіпки в кисні Чому не можна під час пожежі прочиняти вікна та двері? Зі зростанням тиску
швидкість реакції за участю газуватих речовин зростає, бо вміст активних
молекул газу в одиниці об'єму (концентрація) збільшується.
Чому продукти в холодильнику зберігаються довше? Температура, за якої
відбувається хімічна реакція, також позначається на її швидкості. Зі
зростанням температури хімічні реакції переважно пришвидшуються. Це зумовлено
збільшенням умісту активних молекул (чи інших структурних частинок) у реакційній
суміші. Натомість охолодження уповільнює взаємодію між реагентами. Саме тому
харчові продукти довше зберігаються за низьких температур.
Виникнення
каталізу Людство
використовувало каталіз з давніх-давен, не знаючи про це. Бродіння, як один з прикладів каталізу, застосовувалося під час
варіння пива, виготовленні вина та сирів. Пізніше здатність лугів каталізувати гідроліз естерів застосовували у процесі виготовлення паперу. В
середині XVIII століття в Англії
було відкрито перше хімічне виробництво, яке базувалося на гомогенній
каталітичній реакції, – окисненні оксиду сірки в присутності оксидів азоту.
Рис. Бродильні бочки у винному сховищі
компанії «Croft Port» (2009) У березні 1835
року хімік Єнс Якоб Берцеліус подав до Шведської
академії наук статтю, в якій доповів про спостереження за сполуками, що впливають на
розклад речовин та утворення нових, причому самі вони залишаються незмінними.
У статті Берцеліус наводив уривки робіт європейських вчених: Кірхгоффа (1812), Деві (1817), Деберайнера (1822), дослідження яких були тісно пов'язані з процесами каталізу. Саме
Берцеліус назвав описані явища каталізом. До кінця XX століття вважалося, що каталізатор ініціює перебіг
реакцій. Вільгельм Оствальд був першим, хто зрозумів, чому за його
відсутності реакція не відбувається: це не тому, що вона взагалі не
відбувалася, а тому, що її швидкість є надто малою для експериментального
виявлення. Після робіт Оствальда теорія каталізу набула сучасних рис.
Питання для
самоконтролю 1. Що називається швидкістю хімічної реакції? 2. Від яких чинників залежить швидкість хімічних реакцій? 3. Як залежить швидкість реакції від природи реагуючих речовин? 4. Як залежить швидкість реакції від температури? 5. Як залежить швидкість реакції від концентрації реагуючих речовин? 7. Які речовини називають інгібіторами? 8. Поясніть плив каталізатора на швидкість хімічних реакцій. 10. Наведіть приклади реакцій,
які ви спостерігали у побуті, що відбуваються з різною швидкістю? 11. Що називають хімічною рівновагою? 12. Які чинники впливають на стан хімічної рівноваги? 13. Які реакції називають оборотними? 14. Що таке необоротні реакції? 15. Як формулюється принцип Ле Шательє?
– Роль ферментів під час
бродіння та випікання тіста. – Вплив рН середовища на ферментативні та
технологічні процеси приготування їжі. Розгляньте малюнки
і класифікуйте реакції за наявністю межі поділу фаз: горіння сірника, горіння
природного газу, реакція нейтралізації.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||