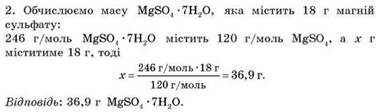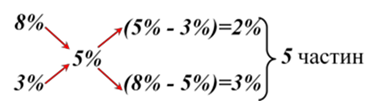|
|
ФІЗИЧНА І КОЛОЇДНА ХІМІЯ Електронний посібник |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
3.1. Фазові переходи. Правило фаз Гіббса. 3.4. Загальна характеристика розчинів. Способи
виразу концентрації розчинів. 3.5. Розчинність газів у рідинах. 3.6. Взаємна розчинність рідин. 3.7. Розчинність твердих речовин у рідинах. 3.9. Замерзання і кипіння розчинів. Кріоскопія та ебуліоскопія. 3.1. Фазові переходи. Правило фаз Гіббса Усі системи, що існують у природі, можна умовно
поділити на гомогенні та гетерогенні. Гомогенними називаються однофазні системи, окремі частини яких однакові за
властивостями та складом. Прикладом гомогенних систем є ненасичені розчини,
суміші газів, кристали будь-якої речовини. Гетерогенними називаються системи, які мають поверхню розділу та складаються з двох або
більше фаз. Прикладом гетерогенних систем є насичений розчин солі в рівновазі
з її кристалами, вода в рівновазі з льодом, рідка вода в рівновазі з льодом
та парою. Гомогенні та
гетерогенні системи класифікують:
Фазою називається
сукупність частинок системи, однакових за складом та фізико-хімічними
властивостями, що відокремлені від інших частин системи видимою поверхнею
розділу. Наприклад, гомогенна система з суміші газів азоту та кисню – є однофазною,
система «нафталін – пари нафталіну» є двофазною, а система «лід – рідка вода
– водяна пара» є трифазною. Фазовим переходом називається процес, який супроводжується
переходом речовини із одного агрегатного стану в інший. Розглянемо
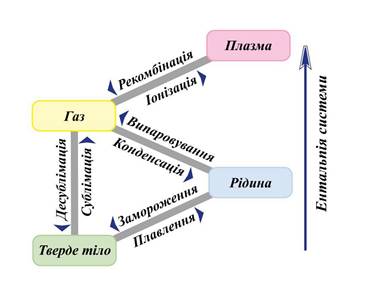
основні фазові переходи: Випаровування – перехід
рідини в газоподібний стан.
Рис. 3.1.1. Випаровування води Конденсація – перехід
речовини з газоподібного стану в рідкий.
Рис. 3.1.2. Випадання роси Сублімація - перехід
речовини з твердого стану в газоподібний.
Рис. 3.1.3. Сублімація сухого льоду
(твердого оксиду вуглецю (IV) CО2) Приклади
сублімації: графіт можна нагріти до тисячі, двох тисяч і навіть трьох тисяч
градусів і, тим не менш в рідину він не перетвориться він сублімується, тобто
з твердого стану зразу перейде в газоподібний. Безпосередньо в газоподібний
стан (минаючи рідке) переходить і так званий сухий лід (твердий оксид вуглецю
СО2),
який можна побачити в контейнерах для транспортування морозива. Всі запахи,
якими володіють тверді тіла (наприклад, нафталін), також обумовлені
сублімацією: вилітаючи з твердого тіла, молекули утворюють над ним газ (або
пару), що володіє запахом. Десублімація – перехід
речовини з газоподібного стану в твердий.
Рис. 1.3.4. Утворення взимку візерунків з
кристаликів льоду Плавлення – перехід речовини з твердого
стану в рідкий.
Рис. 1.3.5. Плавлення (топлення) металів, танення льоду Кристалізація – перехід
речовини з рідкого стану в твердий.
Рис. 1.3.6. Замерзання води Лід плаває тому, що на відміну від
більшості інших речовин, кристалізація яких супроводжується збільшенням густини,
вода під час замерзання розширюється і густина її зменшується. Причина цього полягає в особливостях структури льоду і
води. Вода – єдина речовина, що вільно зустрічається в природі, густина якої
в рідкому стані більша, ніж у твердому. Саме тому водойми зазвичай не
промерзають до дна, хоча за екстремальних температур повітря це можливо. Рівновага у
гетерогенних системах, у яких не проходить хімічна взаємодія між
компонентами, а здійснюються лише фазові переходи, називається фазовою рівновагою. До фазових відносяться рівноваги, що
виникають між фазами в гетерогенних системах у результаті протікання процесів
плавлення, кристалізації, сублімації, розчинення тощо.
Рис. 3.1.7. Номенклатура фазових
переходів Рівновага в гетерогенних системах залежить від тиску, температури,
концентрації. Умови, за яких фази системи знаходяться в рівновазі одна з
одною, встановлені законом рівноваги, сформульованим Гіббсом (1876 р.), і отрималио
назву правило фаз Гіббса:
С – число ступенів свободи (це число умов темпер, тиск, концентрація, які
можна змінювати довільно не змінюючи числа і виду фаз системи); К – число компонентів; Ф – число фаз. Компонентом називається хімічно однорідна складова частина системи, яка може бути
виділена з системи та існувати в ізольованому стані тривалий час. Трифазна
гетерогенна система «лід – рідка вода – водяна пара» складається з одного
компонента (води) і є однокомпонентною. Розчин хлориду натрію у воді є
двокомпонентною системою. Найменше число
компонентів (складових частин) системи, достатнє для утворення всіх її фаз,
називається числом незалежних компонентів. Якщо в системі між
компонентами відбуваються хімічні реакції, то число незалежних компонентів
дорівнює загальному числу компонентів (числу складових частин системи) мінус
число хімічних реакцій, що протікають у даній системі. Приклад Визначити число
незалежних компонентів у гетерогенної системі:
Розв’язання. Система
складається з трьох основних частин (компонентів), а число незалежних
компонентів рівне двом, оскільки в системі протікає одна хімічна реакція. Приклад Визначити найбільшу кількість фаз, які можуть
перебувати в рівновазі в системі, що складається з води і хлориду натрію. Розв’язання. У цій системі число компонентів (К) дорівнює
двом. Отже, С
=
4 – Ф. Найбільше число фаз відповідає найменшому числу ступенів
свободи. Так як число ступенів свободи не може бути негативним, то найменше
значення С
дорівнює нулю. Отже, найбільше число фаз дорівнює чотирьом. Цій умові задана
система задовольняє, коли розчин хлориду натрію у воді знаходиться в
рівновазі одночасно з льодом, твердою сіллю і водяною парою. У такому стані
система безваріантно (інваріантна), тобто це стан досягається тільки за
строго певних температур, тиску і концентрації розчину. В однокомпонентній системі фази складаються з однієї
речовини, яка знаходиться в різних агрегатних станах. Якщо речовина може
перебувати в різних модифікаціях, то кожна з них утворює окрему фазу. Вода
залежно від умов може знаходитися як мінімум у трьох модифікаціях; сірка –
кристалізуватися як у ромбічній, так і у моноклінній формах; існує біле і
сіре олово; відомий білий, червоний та чорний фосфор. Кожна з наведених
модифікацій стійка у певному інтервалі температури та тиску.
Рис. 3.2.1. Алотропні
модифікації: а) фосфору; б) сірки Згідно з правилом
фаз Гіббса при К=1 (однокомпонентна система) число ступенів вільності
дорівнює С = 1 + 2 – Ф,
таким чином, число рівноважних фаз не може бути більше трьох, тобто можуть
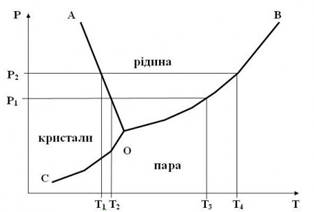
існувати системи як одно-, так і дво- і трифазові. Прикладом діаграми
стану однокомпонентної системи є діаграма стану води в інтервалі середніх
значень тиску (рис. 3.2.2).
Рис. 3.2.2. Діаграма стану
води Як видно з рис.
три криві (АО, ВО і СО) розбивають
діаграму на три поля, кожне з яких відповідає одному з агрегатних станів
води: парі (Г), рідині (Р) та льодові (Т). Ці криві відповідають рівновазі, що
існує між двома суміжними фазами. Крива ВО характеризує
залежність тиску насиченої пари води від температури і відповідає всій
сукупності можливих у системі моноваріантних рівноваг типу:
Це означає, що з
двох параметрів системи (р і Т) незалежним може бути
лише один. Найчастіше незалежним параметром вважають Т, а р
– залежним параметром. Такий перехід, що відбувається за сталої температури,
називають кипінням. Крива СО
відображає сукупність термодинамічних рівноваг типу:
Вона характеризує
процес випаровування твердої речовини, який називають сублімацією. Крива ОА описує сукупність моноваріантних термодинамічних
рівноваг типу:
У цьому випадку
незалежним параметром зручніше вважати тиск р,
а залежним – температуру Т. Нахил кривої ОА вліво пов'язаний з тим, що густина води після її
топлення збільшується (при помірних тисках). Точка О на діаграмі відображає стан системи, при якому в
термодинамічній рівновазі знаходяться три фази:
Ф = 3; С=1+2–3 = 0. У цій точці система
безваріантна. Потрійна точка має точно визначені координати, які для води
дорівнюють: Т = 0,01 °С, р = 1,01·105
Па. Якщо змінити величину одного з параметрів, трифазова система
перетворюється в одно- або двофазову. Визначимо значення кількості ступенів свободи для системи з двох
компонентів, використовуючи правило фаз: При Ф=1 С=2–1+2=3 При Ф=2 С=2–2+2=2 При Ф=3 С=2–3+2=1 При Ф=4 С=2–4+2=0 Найбільше число ступенів свободи дорівнює трьом, тобто можна довільно
встановлювати не менш ніж три умови – температуру, тиск, концентрацію для
одного із компонентів. Це має місце, коли система однофазна. Якщо ж найменше
число ступенів свободи дорівнює нулю, то в цьому випадку два компоненти
знаходяться в чотирьох фазах. У такій системі рівновага можлива лише за
певної температури, тиску і концентрації компонентів. Так як максимальна кількість ступенів свободи для
двокомпонентної системи дорівнює трьом, то стан системи визначається трьома
параметрами. Для графічного відображення можливих станів необхідні три вісі
координат. Під час вивчення конденсованих систем задача графічного
відображення значно спрощується. Наприклад, конденсованою системою можна
вважати водно-сольовий розчин або розплав. Конденсовані системи – системи, що не містять
газоподібної фази. Під час побудови діаграм таких систем достатньо двох
осей. Діаграма, буде побудована на площині в координатах: «температура –
склад» або «тиск – склад». Діаграми стану двокомпонентних систем з твердими
фазами отримують експериментальним методом термічного аналізу, тому їх
називають діаграмами плавкості. Діаграма плавкості – це діаграма, що показує стан системи
залежно від температури плавлення сумішей та їх складу. Аналіз цих діаграм дозволяє без розділення систем на
складові частини судити про характер взаємодії між компонентами, з’ясовувати
наявність хімічних сполук, їх склад, стійкість та ін. Термічним аналізом називається розділ фізико-хімічного
аналізу, який вивчає залежність температури кристалізації (плавлення)
досліджуваної системи від складу. Побудова та аналіз діаграм плавкості з простою евтектикою Діаграми плавкості
цього типу найбпоширеніші та характерні для бінарних систем неізоморфних речовин,
що не утворюють хімічних сполук, наприклад, свинець – сурма, хлорид калію –
хлорид літію, ά-нафтол – нафталін, фенол – метиламін, камфора –
бензойна кислота, аспірин – фенацетин та ін. Фігуративні
точки
tA
та tB
на діаграмі плавкості (рис. 3.3.1) відповідають температурам плавлення (кристалізації) чистих компонентів А та В. Відповідно до закону Рауля, під час додавання компонента В
до А температура кристалізації А знижується. Аналогічно під час додавання А до В
знижується температура кристалізації В. Лінії tAЕ та tBЕ називають лініями ліквідусу. На відміну від
чистих компонентів бінарні суміші кристалізуються (плавляться) не за сталої
температури, а у певному інтервалі температур, який визначається складом
системи. Найнижча температура, за якої закінчується кристалізація розплаву
будь-якого складу (або починається плавлення суміші), називається евтектичною
температурою tE. Лінія СD, яка відповідає евтектичній температурі, нижче якої не
може існувати рідка фаза, називається лінією
солідусу.
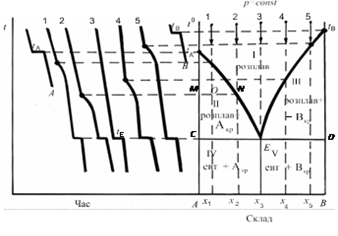
Рис. 3.3.1. Побудова діаграми плавкості з
простою евтектикою за кривими охолодження
3
Відповідно до
цього рівняння для точок на кривих плавлення число ступенів свободи дорівнює
одиниці, тобто довільно та у невеликих межах можна змінювати лише одну
змінну, щоб не порушити рівноваги у системі. Друга змінна при цьому
змінюється у функціональній залежності від першої. У точці перетину кривих
плавлення, тобто в евтектичній точці Е, в рівновазі перебувають три
фази: дві тверді та розплав, а тому С = 0. В полі 1, С =
2, довільно та у невеликих межах можна змінювати обидва параметри, не
змінюючи числа та вигляду фаз, які перебувають у рівновазі, тому що зміна
складу розплаву не розглядається як зміна вигляду цієї фази. Поле II відповідає умовам (t, с), за яких співіснують твердий компонент А та розплав із А
і В,
а поле III – розплав із А і В та твердий компонент В. Діаграма стану
дозволяє у будь-якій точці О (рис. 3.3.1) визначити не тільки число рівноважних фаз і їх
склад, але й маси рівноважних фаз за допомогою правила важеля. Для цього
проводять через точку О горизонтальну лінію MN, яка називається конодою, або нодою. За точками M i N визначають склад рівноважних фаз. Фігуративній точці О в полі II відповідає система, що містить х1%
компонента В. За температури t1 вона складається із двох рівноважних фаз: кристалів компонента А
(точка М) і розплаву (точка N, х2% компонента В). Загальний матеріальний баланс
можна представити у вигляді рівняння m0 = m1 + m2, де m0 – маса всієї
системи; m1 і m2 – маса кристалів і розплаву відповідно. Матеріальний
баланс компонента В описується рівнянням:
Підставимо
значення m0 і одержимо:
Таким чином, кількості твердої і рідкої
фаз обернено пропорційні довжинам відрізків ОM і ОN. Розглянемо перший спосіб побудови діаграм плавкості.
Речовини А та В, із яких утворена ця система, а також
низка сумішей цих речовин різного складу розплавляють. Потім кожен з
одержаних розплавів охолоджують і вимірюють його температуру за допомогою
точного термометра або термопари через певні та невеликі проміжки часу.
Одержані дані представляють у вигляді графіка в координатах температура –
час. Запис кривих охолодження може бути здійснений автоматично. Якщо під час
охолодження (нагрівання) у системі відбуваються фазові перетворення
(наприклад, випадіння твердої фази з рідини, перехід однієї поліморфної модифікації
в іншу), то теплота, яка виділяється (поглинається) під час перетворення,
змінює швидкість спадання (зростання) температури системи, що призводить до
зміни кутового коефіцієнта кривої температура – час. Тому у проміжки часу, які відповідають температурам фазових
перетворень, на кривих охолодження з'являються злами або горизонтальні
ділянки. Розглянемо процес
охолодження сумішей різного складу. Криві охолодження А та В (рис. 3.3.1)
належать відповідним чистим компонентам, а криві 1, 2, 3, 4, 5 – сумішам складу х1, х2, х3,
х4, х5
в яких вміст компонента В поступово збільшується. Криві
охолодження А та В починаються похилими лініями, які
відповідають охолодженню розплавів чистих компонентів до температури їх
кристалізації, горизонтальні ділянки відображають процеси кристалізації
компонентів А та В, тому що теплота кристалізації,
яка виділяється, практично компенсує втрату тепла у довкілля. Потім йдуть
похилі лінії, які характеризують швидкість охолодження затверділих чистих
речовин. Крива 3 відображає процес охолодження евтектичної суміші
(евтектичний склад х3). Горизонтальна
ділянка на цій кривій вказує на значне виділення тепла за сталої температури,
що можна пояснити тільки повним затвердінням розплаву та перетворенням його у
тверду евтектику такого ж складу. Злами на кривих 1 та 2 відповідають
температурам кристалізації компонента А з розплавлених сумішей складу х1
та х2,
в яких вміст А більший, ніж в евтектиці. Тут не спостерігається повної
зупинки температури, бо по мірі кристалізації компонента А розплав збагачується
компонентом В, що призводить до подальшого зниження температури
кристалізації А та потребує для його виділення ще більшого охолодження
розплаву. Другі (горизонтальні) зупинки температури на кривих 1, 2 пояснюються
тим, що у результаті кристалізації компонента А склад розплаву стає евтектичним і він повністю
кристалізується. Аналогічно пояснюється хід кривих 4, 5. Але у розплавах
складу х4 і х5 надлишком (у
порівнянні з його вмістом у евтектиці) є компонент В і тому злами на
кривих відповідають початку його кристалізації із відповідних розплавів.
Горизонтальні ділянки на цих кривих, як і на кривих 1, 2, 3, відображають
процес затвердіння евтектики. За допомогою
отриманих кривих охолодження будують діаграму плавкості з простою евтектикою,
як показано на рис. 3.3.1. Температура на обох осях ординат повинна бути
відкладена у однаковому масштабі. Для побудови
діаграм плавкості бінарних лікарських систем часто використовують візуальний
метод визначення температур
початку та кінця плавлення низки сумішей різного складу. Тверді суміші з
різним вмістом компонентів А і В (рис. 3.3.1) починають плавитися за
однієї і тієї же температури, яка відповідає евтектичній. Температура кінця
плавлення різна для досліджуваних сумішей, вона є температурою, за якої
плавиться надлишковий (у порівнянні з його вмістом в евтектиці) компонент.
Через точки, які відповідають температурі початку плавлення усіх сумішей,
проводять пряму лінію, паралельну осі абсцис, і одержують лінію солідусу.
Точки кінця плавлення усіх сумішей, які з'єднують плавними кривими, утворюють
дві гілки лінії ліквідусу. Точка перетину цих кривих (евтектична точка) дає склад
евтектичної суміші. Перевагою цього
методу є його простота і швидкість виконання, недоліком – можливість
суб'єктивних помилок, непридатність для дослідження забарвлених об'єктів. Діаграми плавкості бінарних систем, які складаються із компонентів, необмежено розчинних у рідкому стані
та утворюючих хімічні сполуки у твердому стані Два компоненти,
які є неізоморфними речовинами, можуть вступати у хімічну взаємодію і утворювати хімічну
сполуку АmBn: mA + nB → AmBn. Якщо сполука під час
плавлення не розкладається (конгруентне плавлення),
на діаграмі утворюється гострий максимум (рис. 3.3.2), якщо розкладається розмитий максимум. Діаграму з
хімічною сполукою (рис. 3.3.2) можна представити як дві діаграми стану з
простою евтектикою. Вона має дві евтектичні точки Е1 та Е2, що відповідають евтектикам,
які сполука AmBn утворює з компонентами А та В. Принцип побудови
цієї діаграми такий же, як і діаграми з простою евтектикою. Ліва частина
діаграми утворена речовиною А та хімічною сполукою AmBn, а права –
речовиною В та хімічною сполукою AmBn. Сукупність кривих
аE1МE2в називається лінією ліквідусу, а сукупність прямих cd та qр – лінією солідусу.
Максимум на кривій ліквідусу відповідає хімічній сполуці AmBn, тому що найвищу
температуру плавлення мають чисті речовини, а додавання другого компонента
знижує температуру плавлення. Отже, направо і наліво від точки максимуму
крива плавкості знижується. Склад хімічної сполуки відповідає абсцисі точки М,
яка називається сингулярною точкою.
Рис. 3.3.2. Діаграма плавкості системи,
компоненти якої утворюють стійку хімічну сполуку Якщо у системі
утворюється кілька хімічних сполук, на діаграмі плавкості з'являється кілька
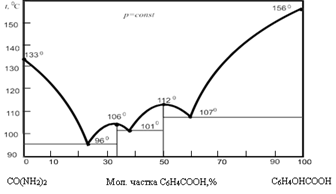
максимумів (рис. 3.3.3). Як видно з рис. 3.3.3, на діаграмі стану системи
саліцилова кислота – сечовина крива ліквідусу має два максимуми, які
відповідають конгруентним сполукам:
Перший максимум за температури 106 0С,
що відповідає 66,67 мол.% сечовини і 33,33 мол.% саліцилової кислоти, вказує
на утворення сполуки із співвідношенням компонентів 2:1. Другий максимум за температури 112 0С
відповідає 50 мол.% сечовини і 50 мол.% саліцилової кислоти, тобто вказує на
утворення сполуки із співвідношенням компонентів 1:1.
Рис. 3.3.3. Діаграма стану системи
“сечовина – саліцилова кислота” Система “саліцилова кислота – сечовина”
має три евтектичні точки. Перша евтектична точка за температури 96 0С
відповідає 77 мол. % сечовини, друга точка за температури 101 0С –
62,5 мол. % сечовини і третя – при 107 0С – 40 мол. % сечовини. Таким чином, наведену діаграму можна
представити як сполучення діаграм із евтектикою для трьох систем:
3.4. Загальна характеристика розчинів. Способи
виразу концентрації розчинів Розчин – це однорідна гомогенна система, яка складається
з розчинника, розчиненої речовини і продуктів їх взаємодії. Хімічні речовини,
під час змішування яких утворюється розчин та які можна виділити із нього у
чистому вигляді, називають компонентами розчину.
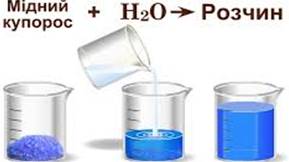
Рис. 3.4.1. Приклад розчину Речовину, яка під
час розчинення не змінює свого агрегатного стану, або входить до складу
розчину в більшій кількості, називають розчинником. Найпоширенішим у
природі розчинником є вода. Другим компонентом
розчину є розчинена речовина (одна або кілька). Частинками розчиненої
речовини є окремі молекули або йони з розміром менше 1 нм, які рівномірно
розподілені між молекулами розчинника. Важливо, що під час утворення розчину
компоненти частково втрачають свої фізичні властивості. Розглянемо, як відбувається розчинення речовин з різною кристалічною
структурою на прикладі найпоширеніших харчових продуктів – цукру (сахарози) і
кухонної солі (натрій хлориду).
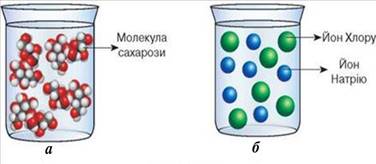
Рис. 3.4.2. Розчини: а – сахарози (цукру) у воді; б) натрій
хлориду ( кухонної солі) у воді Цукор (сахароза) є речовиною молекулярної будови. Його молекули містять у
своєму складі атоми із зарядами 8+ і 8–, що й зумовлює
притягування молекул води протилежними полюсами. Між молекулами цукру та
полярними молекулами води утворюються водневі зв’язки. Навколо однієї
молекули цукру концентруються декілька молекул води, які сполучаються між
собою. Унаслідок такої взаємодії та руху молекул води молекули цукру
відокремлюються від кристалів. Отже, відбувається руйнування структури
кристала. Другий процес пов’язаний з утворенням гідратованих молекул цукру та
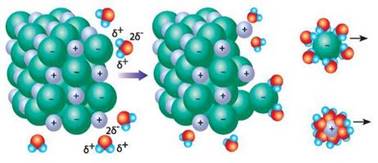
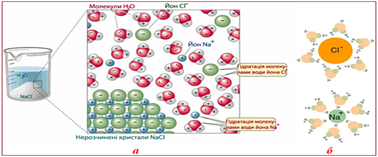
рівномірним поширенням і розподілом їх між молекулами розчинника (води). Розчинення йонних сполук (натрій хлориду) теж характеризується
руйнуванням структури кристала й утворенням гідратованих йонів. Дипольні
молекули води притягуються до йонів різними полюсами: до позитивно
зарядженого йона Натрію – негативним, а до негативно зарядженого йона Хлору –
позитивним. Унаслідок взаємного притягання зв’язки між йонами в кристалі
руйнуються і йони переходять у розчин. У результаті в розчині утворюються
гідратовані катіони Натрію й аніони Хлору.
Рис. 3.4.3. Схема процесу розчинення
кристалів натрій хлориду у воді Необхідно зазначити, що є розчини, в яких розчинені не одна, а кілька
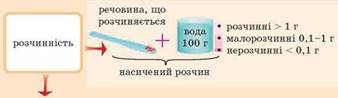
речовин (морська та мінеральні води, фруктові напої, маринади тощо). Швидкість розчинення твердої речовини залежить від
розміру його частинок. Що більші шматки, то повільніше йде розчинення; навпаки, що дрібніші
окремі частки твердої речовини, то швидше переходить вона в розчин. Тому
перед розчиненням твердої речовини її завжди слід подрібнити в ступці та
відважувати для розчинення тільки подрібнену речовину. Це не стосується
гігроскопічних речовин. Оскільки вони в подрібненому стані дуже легко
поглинають вологу з повітря внаслідок значного збільшення поверхні. Тому
гігроскопічні речовини розчиняють, не подрібнюючи, хіба тільки швидко
розбивши великі шматки.
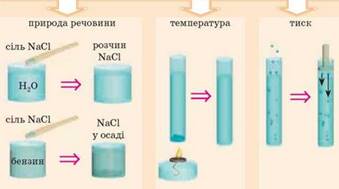
Рис. 3.4.4. Чинники, що впливають на
розчинність Розчини посідають
проміжне місце між механічними сумішами і хімічними сполуками. Від суміші
розчин відрізняє те, що будь-який його мікроскопічний об'єм, який знаходиться
у стані динамічної рівноваги, має однаковий хімічний склад і фізичні
властивості, як і вся маса розчину. Важливо і те, що утворення розчинів
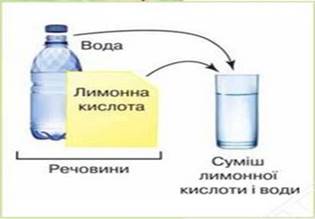
супроводжується тепловим ефектом та зміною об'єму.
Рис. 3.4.5. Утворення суміші лимонної
кислоти і води На відміну від
хімічних сполук, склад розчинів може змінюватись залежно від кількості взятих
компонентів. Отже, розчини не підлягають законам сталості складу і кратних
відношень і тому їх називають сполуками змінного складу. Крім того, для
розчинів характерні слабкі Ван-дер-Ваальсові взаємодії, а у деяких випадках –
виникнення водневих зв'язків між компонентами розчину. Класифікація розчинів Класифікують розчини за різними ознаками:
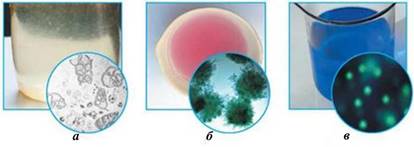
Рис. 3.4.6.
Класифікація розчинів за розміром частинок: а) грубо
дисперсні – завись крейди (у зависях розподілена речовина перебуває у вигляді
великих кристаликів твердих речовин або крапель рідини); б) колоїдні – золь
золота (у колоїдних розчинах частинки речовини доволі великі й складаються з
десятків або тисяч молекул, атомів або йонів); в) істинні – розчин купрум
(ІІ) сульфату (в істинних
розчинах речовина існує у вигляді окремих молекул або йонів)
Для газових систем
характерний хаотичний рух молекул усіх компонентів, дуже слабка взаємодія між
ними і відсутність певної структури. Тому кожен компонент зберігає характерні
для нього фізичні та хімічні властивості. З огляду на це, газові розчини за
звичайного тиску можна розглядати як фізичну суміш. Прикладом такого розчину
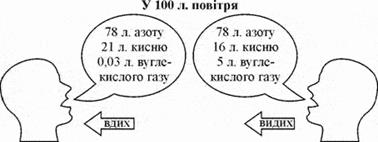
є повітря. Склад сухого атмосферного повітря (у відсотках за об'ємом) такий:
азоту 78,09 %; кисню – 20,95 %; вуглекислого газу – 0,032 % та 0,93 %
благородних газів. Зазвичай у повітрі, крім названих газів, ще міститься
водяна пара (0,02 – 4 % за масою).
Рис. 3.4.7. Склад атмосферного повітря Рідкі
розчини можна одержати розчиненням у рідині газів (наприклад,
амоніаку, гідроген хлориду (хлороводню), кисню у воді), твердих речовин
(зокрема, натрій хлориду або цукру у воді, йоду в етанолі) і рідин
(наприклад, етанолу у воді, бензену в ацетоні). Розчинення хлороводню у воді
video
не поддерживается вашим браузером. Тверді розчини (зокрема, сплави) утворюються за кристалізації рідких
розплавів металів. Кристалічну ґратку твердого розчину утворюють частинки
усіх компонентів (атоми, йони, молекули), які розміщені неупорядковано і
утримуються за рахунок міжатомної, міжіонної та міжмолекулярної взаємодій;
Рис. 3.4.8. Тверді розчини: сплави,
мінерали, кольорове скло
Розбавленим вважають
розчин, у якому вміст розчиненої речовини не перевищує 30 %, а у
концентрованому розчині масова частка розчиненої речовини становить понад 30
%.
Рис. 3.4.9. Розчини оцтової кислоти
різної концентрації: а, б – розведені розчини (столовий та
яблучний оцет); в – концентрований (оцтова есенція)
Рис. 3.4.10. Кислоти у природі: 1) оцет – водний розчин оцтової кислоти;
2) лимонна кислота; 3) кефір містить молочну кислоту; 4)
незрілі яблука – джерело яблучної кислоти; 5) мурашину кислоту продукують мурашки
Якщо у даній масі розчинника якась маса речовини ще може розчинитись, то
такий розчин за даних умов є ненасиченим: АВ → АВ тверда
фаза розчин
Рис. 3.4.11. Ненасичений розчин У разі, коли досягнуто межі розчинення,
тобто кількість речовини, що переходить у розчин за одиницю часу, дорівнює
кількості речовини, що виділяється у вигляді твердої фази, – розчин називають
насиченим: АВ « АВ тверда
фаза розчин
Рис. 3.4.12. Насичений розчин Якщо речовини
розчинено більше, ніж її потрібно для насичення за даних умов, то такий
розчин є пересиченим. Ця система
нестійка, тому за найменшої зміни умов (потирання скляною паличкою об стінки
посуду, внесення маленького кристалу розчиненої речовини) розпочнеться процес
кристалізації: АВ ¬ АВ тверда фаза
розчин
Рис. 3.4.13. Перенасичений розчин Зауважимо, що для
добре розчинних речовин концентровані розчини можуть бути далекими від стану
насичення. Так, за температури 60°С розчин з масовою часткою натрій нітрату
50 % є ненасиченим. І навпаки, для малорозчинних речовин дуже розведені
розчини є вже насиченими. Наприклад, за температури 40°С розчин з масовою
часткою гіпсу 0,2 % є насиченим;
Рис. 3.4.14. Приклади розчинів: а) водних; б) спиртових Фізико-хімічна теорія розчинів Фізична теорія
розчинів, основоположниками якої були відомі фізико-хіміки Я. Вант-Гофф і С.
Арреніус, розглядає процес розчинення як простий розподіл (диспергування)
однієї речовини у всьому об'ємі іншої, і таким чином, властивості розчинів
повинні залежати тільки від концентрації розчиненої речовини. За фізичною
теорією розчинник – це індиферентне середовище, в якому хаотично розподілені
частинки розчиненої речовини. Хімічна теорія,
яку називають сольватною або гідратною (Д. Менделєєв, І. Каблуков, М.
Курнаков) грунтується на тому, що під час розчинення між частинками
розчиненої речовини і розчинника утворюються нестійкі комплекси – сольвати
(якщо розчинником є вода – гідрати), які потім руйнуються. Лише для
кристалогідратів ці комплекси стійкі та зберігаються ід час випаровування з
розчину (CuSO4 5H2O). У своїх працях
Д.І. Менделєєв показав, що в розчині є сполуки, які утворюються завдяки
взаємодії молекул розчиненої речовини і розчинника. Такі сполуки називаються сольватами
(гідратами), а процес їх утворення в результаті взаємодії компонентів
розчину – сольватацією (гідратацією). Термін “гідрати” і “гідратація”
застосовують, коли розчинником є вода.
Рис. 3.4.15.
Забарвлення розчинів кобальт (ІІ) хлориду CoCl2 за
утворення: а) гідратів з
молекулами води CoCl2 · nН2О;
б) сольватів з
ацетоном CoCl2 · m(CH3)2CO Існування
сольватів (гідратів) у розчині підтверджується виділенням сполук з розчинів у
вигляді кристалосольватів або кристалогідратів. Так, якщо розчинити у воді
безводні солі, наприклад CuSO4, Na2SO4, Mg(ClO4)2, то потім з розчину вони виділяються у вигляді кристалогідратів складу: CuSO4×5H2O, Na2SO4×10H2O, Mg(ClO4)2×6H2O. Подібним способом поводять себе більшість солей і
деякі представники інших класів неорганічних сполук. З неводних розчинників
також можна добути кристалосольвати. Наприклад, CaCl2 і Mg(ClO4)2 з метиловим спиртом утворюють сольвати CaCl2×6CH3OH і Mg(ClO4)2×6CH3OH. Концентрація – це величина, що характеризує кількісний склад розчину. Існують різні способи вираження кількісного складу
розчинів. Способи вираження кількісного складу розчинів
Еквівалент
речовини – маса речовини,
що в хімічних реакціях еквівалентна (рівнозначна) 1,008 г Гідрогену.
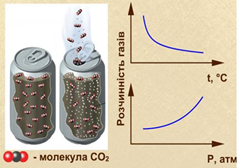
3.5. Розчинність газів у рідинах Під час розчинення газів у воді
відбувається екзотермічний процес (∆Н°< 0). Тому
розчинність газів з підвищенням температури зменшується. За нагрівання
склянки з холодною водою внутрішні стінки вкриваються бульбашками газу – це
повітря, що було розчинене у воді. Кип'ятінням можна виділити з води все
розчинене у ній повітря.
Рис. 3.5.1. Процес кипіння води Цей факт слід враховувати під час виготовлення і зберігання напоїв, що
містять вуглекислий газ. За зберігання в теплому приміщенні вони витрачають СО2
і їх якість погіршується.
Рис. 3.5.2. Зміни, які відбуваються
під час відкорковування пляшки з газованими
напоями Однак під час розчинення газів в органічних рідинах, дуже часто
відбувається поглинання теплоти. У цих випадках зі зростанням температури
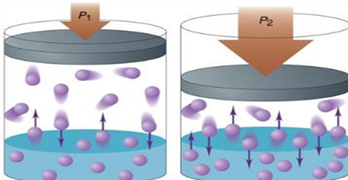
розчинність газів збільшується. Під час розчинення газу у рідині встановлюється рівновага: газ
+ рідина При цьому об'єм системи значно зменшується. Відповідно, підвищення тиску
повинно призводити до зміщення рівноваги вправо, тобто до збільшення
розчинності газу. Розчинність газу зменшується за наявності в розчині третього компоненту.
Так, у розчинах солей, основ, кислот гази розчиняються значно гірше, ніж у
чистій воді. Наприклад, в 1 г води за температури 0 °С розчиняється 3·10-3м3
хлору, а в 1 г насиченого розчину натрій хлориду розчиняється у 10 разів
менше. Тому, під час зберігання хлору над рідиною воду замінюють на розчин
натрій хлориду. Залежність розчинності газів від тиску визначається законом Генрі (англійський хімік) Згідно цього закону: Розчинність
газу за постійної температури прямо пропорційна тиску газу над розчином: С = К ∙ р, де С – концентрація
газу в розчині; К – коефіцієнт пропорційності, що
залежить від природи рідини і газу; р – тиск газу над розчином.
Рис. 3.5.3.
Залежність розчинності газів від тиску Закон Генрі справджується тільки для розбавлених розчинів в умовах
низьких тисків. Для суміші газів розчинність кожного з них пропорційна його
парціальному тиску. Гази, що вступають у взаємодію з розчинником (напр.NH3, SO2, НСl), закону Генрі не підкоряються. Отже, майже всі
газоподібні речовини здатні в тій чи іншій мірі розчинятися у воді або
органічних розчинниках. Деякі з них, наприклад NH3, HCl, жадібно поглинаються водою. Інші ж гази (кисень,
водень та ін.) мають меншу або незначну розчинність у воді, причому вона
залежить від температури води і зовнішнього тиску. Що вище парціальний тиск
газу, то більше він розчиняється у воді, і що вище температура води, то менше
розчинність газів. Тому воду для видалення розчинених у ній газів кип’ятять. 3.6. Взаємна розчинність рідин Взаємна розчинність рідин залежить, перш за все, від їх хімічної будови. Ще
алхімікам було відомо, що «подібне розчиняється в подібному», тобто полярні
рідини розчиняються в полярних, а неполярні – в неполярних. За цієї причини,
вода (полярна рідина) – добрий
розчинник для полярних рідин (етанолу, оцтової кислоти) і зовсім не розчиняє
неполярні рідини (бензин, гас).
Якщо рідини відрізняються одна від одної за полярністю, то вони обмежено
розчиняються одна в одній. За обмеженої розчинності кожна із рідин переходить
в іншу до максимально можливого значення, внаслідок чого утворюється
двошарова система. На відміну від розчинності газів у рідинах, розчинення рідини є більш
складним процесом. Під час
змішування двох рідин можуть відбуватись процеси:
Рис. 3.6.1.
Розчинність кислот та спирту у воді Якщо, наприклад, взяти 50 об'ємів води і стільки ж спирту, то вийде не
100 об'ємів суміші, а тільки 96,3 (так зване явище контракції).
Рис. 3.6.2. Утворення хімічних світлофорів
(нерозчинність рідини з більшою густиною в рідині з меншою густиною)
ЦІКАВИЙ ДОСЛІД Візьми склянку з водою і тихенько налий туди масло. Що сталося з маслом?
Ти бачиш, як амінокислоти намагаються якомога швидше відокремитися від води, формуючи
невеликі кульки або бульбашки. Якщо ти залишиш склянку ненадовго в спокої, то
незабаром ти побачиш, що масло повністю відокремилося від води і піднялося
вгору, утворивши на поверхні єдину ліпідну мембрану. Так чому масні руки не можна відмити водою? Чому нафта,
що розлилася в морі, збирається на поверхні? Чому масло ніколи не змішається
з водою? Існує дві основні причини, за якими масло і вода ніколи не змішуються, навіть, якщо вони
знаходяться в одній ємності. Весь світ навколо нас складається з молекул, і
змішання двох речовин повністю залежить від виду та кількості цих молекул. Перша причина, по якій вода і масло ніколи не змішаються – це те, що вони мають різну
кількість молекул, тобто щільність цих речовин різна. Молекули води упаковані
дуже щільно, їх багато. В одній склянці води більше молекул, ніж всіх зірок
на небі. У маслі молекул менше, вони упаковані не так щільно. Це означає, що
якщо ми візьмемо однакову кількість води і масла, то в воді молекул буде
більше, а в маслі менше. Саме через різну щільність вода осяде внизу, а масло
підніметься наверх. Друга причина, по якій ці рідини не змішуються – це полярність. Пам'ятаєш про грозові
хмари, в яких є позитивні та негативні заряди? Точно так само і тут. Вода
складається з полярних молекул, тобто кожна її молекула, з одного боку, має
позитивний заряд, а з іншого – негативний. Якщо протилежності притягуються,
то й молекули води притягуються один до одного. Молекули масла, навпаки,
неполярні, та покриті оболонкою тільки з негативних зарядів. Так як полярні
молекули розчиняються тільки в полярних розчинниках, а неполярні молекули – в
неполярних, то вода і масло ніяк не можуть змішатися. Їх молекули просто
відштовхуються одна від одної. Ось чому, навіть
якщо ти струсиш склянку, ці дві речовини все одно не змішаються і утворять
два різних шари;
Рис. 3.6.3. Емульсія ефір у воді не стійка: а) після струшування; б) через певний час рідини
розшаровуються Якщо у систему із двох взаємно
незмішуваних рідин внести речовину, яка розчиняється в обох рідинах
(розчинність у яких різна), то з часом ця речовина розподілиться між двома
розчинниками так, що співвідношення її рівноважних концентрацій в обох фазах С1
і С2
буде величиною сталою. Це положення відоме як закон розподілу Нернста: kрозп = C1C2 Величину kрозп називають коефіцієнтом розподілу. На законі розподілу ґрунтується
екстрагування – процес вилучення із розчину одного або кількох розчинених компонентів
за допомогою іншого розчинника.
Рис. 3.6.4. Процес (спосіб розділення суміші речовин на складові
частини за допомогою розчинника, в якому вони розчиняються неоднаково) На основі закону розподілу
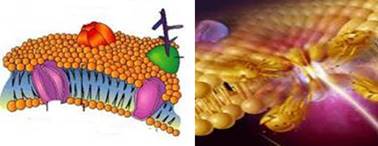
пояснюють проникнення речовин крізь клітинні мембрани. Так, водонерозчинні
неполярні речовини (жирні кислоти, жири, холестерин тощо) проникають у
клітину шляхом розчинення у ліпідному шарі мембрани. Вони важко розчиняються
у водному середовищі та їх нагромадження у ліпідному шарі мембран підлягає
закону розподілу.
Рис. 3.6.5. Будова клітинної мембрани Часто, з
підвищенням температури, взаємна розчинність рідин зростає, а за деяких температур
обидві рідини вже імітуються в будь-яких співвідношеннях і межа між шарами
зникає. Така температура має назву критичної температури розчинення. Під час розчинення рідин, як і твердих тіл, спостерігається або виділення
тепла, або його поглинання. Це явище використовують під час виготовлення
охолоджуючих сумішей або для хімічного нагрівання. 3.7. Розчинність твердих речовин у
рідинах Процес розчинення твердих речовин у рідинах складається
із руйнування кристалічної ґратки і дифузії речовин в об'єм. При цьому, під
впливом розчинника, від поверхні твердих речовин поступово відриваються
окремі молекули або йони і рівномірно розподіляються по всьому об'єму
розчину.
Рис. 3.7.1. Схема розчинення солі NaCl: а) руйнування кристалічної решітки і
гідратація іонів Na+ і Cl–; б) моделі гідратованих іонів Na+ і Cl– Розчинність
твердих речовин у рідинах визначається природою розчинника і речовини, а
також температурою. Під час розчинення твердої речовини в рідині досягається
концентрація, за якої тверда речовина далі перестає розчинятися і
встановлюється рівновага між розчином і твердою речовиною. Такий розчин
називається насиченим. Концентрація
насиченого розчину за цієї температури характеризує розчинність речовини. За певних умов
можна добути розчини, концентрація яких вище концентрації насиченого розчину.
Такі розчини називають пересиченими.
Вони дуже нестійкі та під час перемішування, струшування розділяються на осад
і насичений розчин.
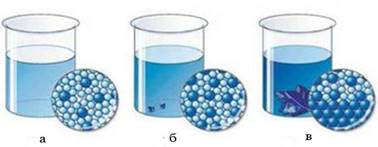
Рис. 3.7.2. Розчини різної концентрації: а) ненасичений розчин (додані кристалики
речовини із часом розчиняються); б) насичений розчин (у разі додавання
речовина вже не розчиняється); в) пересичений розчин (розчинена речовина виділяється з
розчину, додані кристалики збільшуються) За певних умов
можна добути пересичений розчин, тобто такий, у якому розчинено речовини
більше, ніж може бути розчинено за певної температури. Такі розчини є дуже
нестабільними й за незначного впливу «намагаються» надлишок речовини виділити
в осад. Наприклад, пересичений розчин натрій ацетату навіть у разі дотику до
нього виділяє надлишок солі й перетворюється на суміш води із сіллю.
Рис. 3.7.3. Кристалізація перенасиченого
розчину Що таке дифузія? У нашому повсякденному житті ми іноді не помічаємо
деяких фізичних явищ. Наприклад, хтось відкрив флакон з духами, і ми, навіть
перебуваючи на великій відстані, відчуємо цей запах. Піднімаючись сходами до
своєї квартири, ми можемо відчути запах їжі, приготованої вдома. Ми опускаємо
в склянку з гарячою водою пакетик з заваркою для приготування чаю, і навіть
не помічаємо, як заварка забарвлює всю воду в чашці.
Рис. 3.8.1. Явище дифузії в газах,
рідинах і твердих тілах Всі перераховані
явища пов'язані з одним і тим же фізичним явищем, яке називається дифузією. Дифу́зія (лат. Diffusio – поширення,
розтікання, розсіювання, взаємодія) – процес взаємного проникнення молекул
або атомів однієї речовини поміж молекул або атомів іншої, що зазвичай
призводить до вирівнювання їх концентрацій у всьому займаному об'ємі.
Дифузія 1,2 Інтенсивність руху
частинок, а отже і швидкість протікання дифузії зростає зі збільшенням
температури.
Залежність дифузії від температури Дифузія в живих організмах Дифузія дуже
розповсюджене явище, яке відіграє велику роль у функціонуванні живих
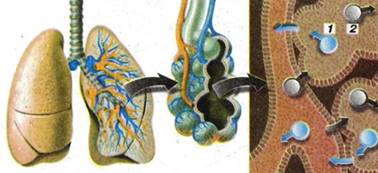
організмів. У легенях молекули кисню дифундують у кровоносні судини, завдяки
процесам дифузії відбувається обмін рочовин у клітинах. Завдяки дифузії
видихається нами вуглекислий газ, який не скупчується навколо нас, а
розсіюється в просторі і змішується з ксинем, тому ми можемо триваий час
спокійно дихати в закритій кімнаті. Рис. 3.8.2. Модель дифузії газів у
легенях: 1) молекула кисню; 2) молекула
вуглекислого газу Як дифузія
впливає на якість повітря, яким ми дихаємо? Дифузія відіграє важливу роль у процесах
життєдіяльності тварин, рослин, у тому числі мікроорганізмів. Якби не було
дифузії, біля землі розташувався б прошарок найважчого вуглекислого газу,
непридатного для життя людей і тварин.
Рис. 3.8.3. Склад вдихуваного і
видихуваного повітря Вміст вуглекислого
газу збільшується у 167 разів! Вуглекислий газ негативно впливає на
самопочуття людей. Особливе значення дифузія має і в шахтах, де вона
сприяє рівномірному розподілу шкідливих газів в атмосфері гірничих виробок,
попередженню їх небезпечних скупчень.
Вплив дифузії на якість повітря Внаслідок
явища дифузії повітря забруднюється відходами різних фабрик, через нього
шкідливі відходи життєдіяльності людини проникають у грунт, воду, а потім
роблять шкідливий вплив на життя і функціонування тварин і рослин.
Збільшується площа земель, забруднених викидами промислових підприємств і
т.д. Понад 2 тис. гектарів землі зайнято звалищами промислових і побутових
відходів. Одне з найскладніших є питання утилізації промислових відходів,
зокрема токсичних.
Нагальною проблемою є забруднення повітря вихлопними
газами, продуктами переробки шкідливих речовин, які викидають в атмосферу
різні заводи. У деяких медичних дослідженнях було показано зв'язок
захворюваності органів дихання і верхніх дихальних шляхів зі станом повітря.
Відзначається пряма залежність між показником рівня захворюваності органів
дихання і обсягом викидів шкідливих речовин в атмосферу. Нині загальна кількість емісії газів в атмосферу
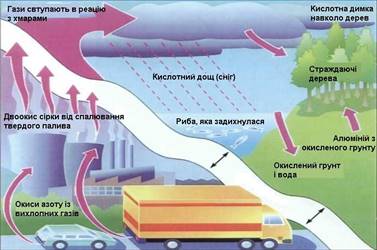
перевищує 40 мільярдів тонн на рік. Надлишок вуглекислого газу в атмосфері
небезпечний для живого світу Землі, порушує кругообіг вуглецю в природі,
призводить до утворення кислотних дощів. Для зниження викиду шкідливих газів
з промислових труб, труб теплових електростанцій встановлюють спеціальні
фільтри. Рис. 3.8.4. Схема
утворення кислотних дощів Важливість процесів дифузії в медицині У
медицині лікарські речовини у формі аерозолів вводять інгаляційним способом. Вони надходять у кров шляхом дифузії через легеневу тканину і
швидко проявляють загальну дію. Чому кольорову білизну не радять прати з білою? Явище дифузії дуже
ефектно демонструє дослід зображений на (рис. 3.8.5). Якщо опустити марлевий
рулон одним кінцем у розчин амоній дихромату (оранжевого забарвлення), а
другий кінець рулону помістити в порожню склянку й так само занурити інший
марлевий рулон у розчин купрум (ІІ) сульфату (синього забарвлення), то марля
поступово просочиться розчинами й у середній склянці збереться рідина, яка
матиме зелене забарвлення.
Рис. 3.8.5. Явище дифузії в рідинах
Цікавий дослід Щільно скласти дві тканини, покласти у порожню посудину і замочити
гарячою водою. Через 2–3 хвилини дістати білу тканину вона зафарбується у колір темної.
Чому? Як називається це явище? Чому при пранні білизни її радять сортувати? (Білу і кольорову окремо). І
дотримуватись температурного режиму? Дифузія фарби у рідин
video
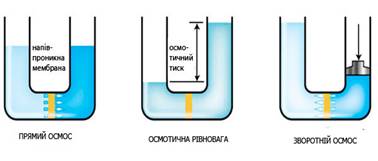
не поддерживается вашим браузером. ОСМОС Якщо розчини
різної концентрації розділити напівпроникною мембраною, процес дифузії може
прийняти однобічний характер. В організмі є
незліченна безліч мембран. Це оболонки клітин і їхніх органоїдів (ядро,
тельця Гольджі та ін.), стінки кровоносних судин, оболонки органів та ін.
Мембрани розрізняються за своїм складом, структурою, розмірами пор і, як
наслідок, за проникністю. Одні з них проникні тільки для молекул води, інші
можуть пропускати іони й малі молекули.
Рис. 3.8.6. Графенове сито для отримання
прісної води (молекули води можуть пройти крізь сито,
а молекули солі NaCl вже ні) Різноманітна
проникність для іонів може залежати від взаємодій між зарядженими групами
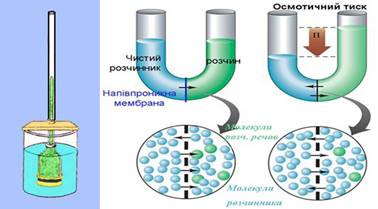
мембрани до цих іонів. Якщо мембрану, проникну тільки для розчинника, занурити між чистим
розчинником і розчином або між розчинами різної концентрації виникає процес,
що називається осмосом Тиск, який викликає осмос, називається осмотичним тиском. Він чисельно дорівнює додатковому тиску, який
необхідний для припинення осмосу.
Рис. 3.8.7. Схема Осмометра Як показав
Вант-Гофф, осмотичний тиск розчину
чисельно дорівнює тиску, який чинила б розчинена речовина, якби вона за тієї
ж самої температури знаходилася в газоподібному стані та займала об'єм, що
дорівнює об'єму розчину. Це і є закон осмотичного тиску. Вант-Гофф звернув увагу на те, що осмотичний тиск розбавлених розчинів
підкоряється законам ідеальних газів. Звідки він зробив висновок, що
осмотичний тиск можна розрахувати за рівнянням Менделєєва-Клапейрона: Pосм = де С= n/V, тоді Pосм =
СRT, С – концентрація. Явище осмосу відіграє важливу роль у багатьох хімічних і біологічних
системах. Поживні речовини і волога з ґрунту надходять у рослини завдяки
капілярним або осмотичним явищам. У рослинах осмотичний тиск сягає 1–1,5 мПа. Коріння має нижчий осмотичний
тиск, ніж надземні частини. Підвищення осмотичного тиску від кореня до листя
сприяє руху соків уверх по рослині. Наприклад, якщо ми візьмемо гілочку квітучого дерева або яку-небудь
квітку білого кольору і поставимо її в підфарбовану воду, то через деякий час
у прожилках пелюсток побачимо фарбу: кольорова вода всмокталася рослиною. Це і буде результат осмосу.
Рис. 3.8.8.
Результат осмосу: а) листочки білі;
б) листки пофарбувались у рожевий колір Так ось осмос діє в бік, де велика концентрація речовини. Чиста вода (без
солей і цукрів) проникає в клітини рослини, тому що в них знаходиться більш
концентрований розчин солей і цукрів. Дослід з кубиками картоплі. Один покладемо в просту прісну воду. Другий –
в трохи підсолену воду. Третій – в сильно солону воду (він навіть не захоче
тонути, тому що його щільність виходить менше щільності води). І почекаємо
кілька годин. А потім перевіримо, що стане з шматочками картоплі?
Рис. 3.8.9. Явище
осмосу в: 1) дистильованій
воді; 2) слабосолоній воді; 3) сильно солоній воді 1-ий кусок: набряк – збільшився (адже концентрація солі в ньому вища, ніж
у простій воді – ось вона й наситила його клітини, щоб вирівняти
концентрацію). 2-ий шматок: залишився як є (адже трохи підсолена вода має концентрацію
солей майже таку ж, як і сама картопля); 3-ий шматок: зменшився і втягнувся всередину (сильно солоний розчин солі
у воді "витягнув" сік з картоплі).
Рис. 3.8.10.
Картопля після осмосу: 1) у дистильованій
воді; 2) у слабо солоній воді; 3) у сильно солоній воді В організмах тварин і рослин осмотичний тиск є визначальним фактором щодо
розподілення води і поживних речовин між різними органами і тканинами. Механізм осмосу в організмах тварин залежить від природи мембран. В одних
випадках мембрана працює за типом решета, пропускаючи дрібні частинки і
затримуючи більші. В інших випадках крізь неї вибірково проходять молекули
певних речовин, що пояснюється або розчиненням цієї речовини в ліпідах мембрани,
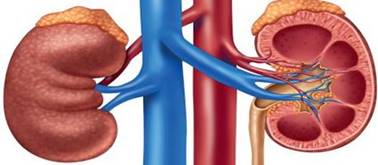
або її взаємодією з мембраною. Прикладом осмотичного приладу є нирки.
Рис. 3.8.11.
Приклад осмотичного приладу – нирки У нирки з крові надходять кінцеві продукти обміну. В сечу з нирки (сеча –
більш концентрований розчин) значною мірою завдяки осмосу крізь напівпроникну
мембрану надходять вода та дрібні іони (наприклад, Na+ і СІ-). Ці
іони знов активно повертаються в кров крізь мембрану. Виведення води крізь нирки
регулюється антидіуретичним гормоном (далі – АДГ), концентрація
якого впливає на проникність ниркової мембрани. За його нестачі з сечею
виводиться більша кількість води (іноді в 10 разів більше за норму). Надлишок
АДГ призводить до зниження проникності клітинної мембрани. Отже, інколи крізь
нирки виводиться води вдвічі менше за норму. Вивчення осмотичних властивостей організму довело, що всередині клітини
осмотичний тиск завжди дещо вищий, ніж у міжклітинній рідині. Це явище пояснив
Ф. Доннан, тому воно відоме під назвою рівноваги Доннана. У процесі регуляції осмотичного тиску в організмі беруть участь органи
виділення, головним чином нирки і потові залози. Завдяки їм вода, що
надходить в організм, і продукти метаболізму виводяться із сечею та потом, не
спричинюючи суттєвих змін осмотичного тиску. Принцип роботи зворотного осмосу на прикладі
салату з моркви Спочатку потремо її на тертці. Потім половину морквини посипаємо цукром,
а іншу – залишимо просто так. Через хвилин 10–20 стане добре видно, що
звичайна морква починає сохнути, а посипана цукром «пустила сік». Це завдяки
осмосу рідина з морквини, в якій було мало цукрів, вийшла через клітини
назовні – в тей бік, де цукрів багато.
Рис. 3.8.12.
Морква натерта: а) морква без
цукру: на початку досліду; в кінці досліду; б) морква з
цукром: на початку досліду; в кінці досліду
3.9. Замерзання і кипіння розчинів.
кріоскопія та ебуліоскопія Будь-яка рідина, що знаходиться у відкритій посудині,
поступово зменшує свій об'єм завдяки випаровуванню: молекули рідини
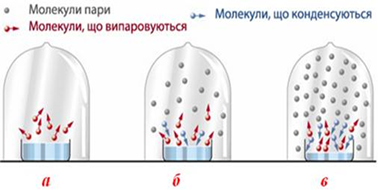
переходять у газову фазу і віддаляються від поверхні. Однак, якщо рідина перебуває в закритій посудині (рис. 3.9.1а), то
внаслідок випаровування молекули накопичуються над поверхнею, а частина з них
– піддається зворотному процесу – конденсації і повертається в рідину (рис.
3.9.1б). У деякий момент встановлюється динамічна рівновага між процесами
випаровування і конденсації – отже, пара стає насиченою (рис. 3.9.1в).
Рис. 3.9.1.
Утворення насиченої пари За сталої температури тиск насиченої пари чистої рідини (розчинника) –
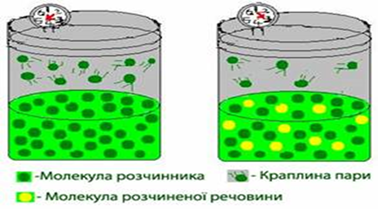
величина постійна. Але досвід свідчить, що під час розчинення у цій рідині
якоїсь іншої речовини тиск насиченої пари завжди знижується. Це пояснюється
тим, що молекули розчиненої нелеткої речовини перешкоджають випаровуванню з
розчину молекул розчинника (рис. 3.9.2), оскільки, по-перше, зв’язують певну
кількість молекул розчинника на утворення сольватів і, по-друге, займають
частину поверхні, зменшуючи площу випаровування.
Рис. 3.9.2.
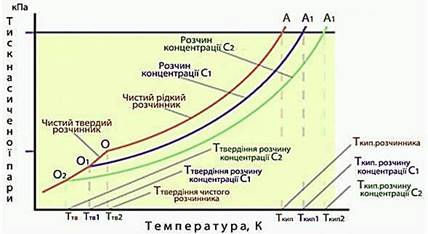
Кількість молекул розчинника, що випаровуються з розчину На діаграмі фазового стану тиск насиченої пари над чистим розчинником А
у широкому інтервалі температур дає певну криву (рис. 3.9.3). Однак під
час вимірювання тиску насиченої пари розчинів А1 і А2,
концентрації розчинених речовин в яких складають відповідно С1
і С2,
криві на діаграмі тиск–температура будуть розташовуватися нижче кривої, що
відносилася до чистого розчинника А (рис. 3.9.3).
Рис. 3.9.3.
Діаграма тиску насиченої пари Залежність тиску насиченої пари над чистим розчинником А
і над розчинами А1 і А2,
концентрації розчинених речовин в яких складають відповідно С1
і С2. Отже, за умов
сталої температури тиск насиченої пари розчинника над розчином менший, ніж
над чистим розчинником. При цьому зниження тиску насиченої пари розчинника
над розчином то помітніше, що вища концентрація розчину. Цю залежність
виражає перший (тонометричний) закон Рауля: зниження тиску насиченої пари
розчинника над розчином пропорційне мольній частці нелеткої розчиненої
речовини Р0А – РА
= ΔРА
= Р0А χВ, де Р0А і РА – тиск насиченої пари розчинника
відповідно над чистим розчинником і над розчином; ΔРА – зниження (або депресія) тиску насиченої пари; χВ – мольна частка розчиненої речовини В. Тиск насиченої пари розчинника над розчином впливає на температури
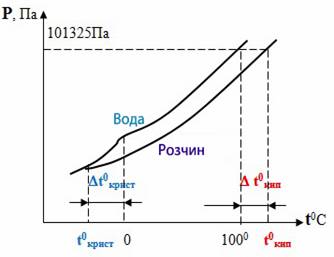
кипіння і замерзання (кристалізації) розчинів (рис. 3.9.4). Зменшення цього
тиску спричиняє підвищення температури кипіння або зниження температури кристалізації
розчину порівняно з відповідними температурами для чистого розчинника. Підвищення температури кипіння розчину зумовлюється тим, що кипіння
відбувається за умови, коли тиск насиченої пари розчинника над розчином стає
рівним атмосферному тиску. А це трапляється за температури, вищій, ніж
температура кипіння чистого розчинника.
Рис. 3.9.4. Криві
залежності тиску насиченої пари над чистою водою
і водним розчином Аналогічно і зниження температури замерзання (кристалізації, твердіння)
зумовлюється нижчим тиском насиченої пари розчинника над розчином, ніж над
чистим розчинником. Цю залежність встановлює другий
закон Рауля: підвищення температури кипіння або зниження температури замерзання
розчину прямо пропорційне моляльній концентрації розчиненої речовини: Δ Ткип
= КЕ ∙ Сm, (1) Δ Тзам
= КК ∙ Сm, (2) де Сm – моляльна концентрація, що
показує кількість речовини ν, розчиненої у 1кг розчинника; КЕ і КК –
відповідно ебуліоскопічна і кріоскопічна константи, які визначаються
природою розчинника і не залежать від складу та концентрації розчиненої
речовини. Фізичний зміст цих сталих випливає з рівнянь (1) і (2) під час розгляду
випадку, коли Сm=1моль/1кг. Тоді КЕ і КК
чисельно дорівнюють відповідно підвищенню температури кипіння і зниженню
температури замерзання одномоляльних розчинів порівняно з температурою
кипіння і температурою замерзання чистого розчинника. Ебуліоскопічну КЕ
і кріоскопічну КК константи вимірюють
у градусах, їх значення для різних розчинників наводяться у довідниках. Якщо в рівняння (1) і (2) підставити вираз моляльної концентрації, то другий
закон Рауля можна виразити інакше:
Користуючись рівняннями (3), визначають молярну масу розчиненої речовини
за даними щодо підвищення температури кипіння чи зниження температури
замерзання:
Визначення
молярних мас речовин за величиною підвищення температури кипіння або зниження
температури замерзання розчинів називається відповідно ебуліоскопія
і кріоскопія. Метод дослідження властивостей розчинів, заснований на визначенні
температури їх кипіння, називається ебуліоскопією. Метод вивчення властивостей розчинів, оснований на
вимірюванні температури замерзання називається кріоскопією. Цей метод
використовують для визначення молекулярних мас розчинених речовин за
зниженням температури замерзання. Здатність розчинів замерзати за нижчої
температури, ніж чистий розчинник, застосовується для приготування різних
охолоджувальних сумішей і розчинів з низькою температурою замерзання –
антифризів для циліндрів двигунів при їх експлуатації у зимовий період.
Наприклад, 66,7 % водний розчин етиленгліколю замерзає лише за температури –
750С. Антифризи – речовини, додавання яких знижує температуру замерзання розчину.
Використовують як охолоджувальні суміші для автомобільних і тракторних
двигунів у морозну погоду. Завдяки тому, що
температура замерзання розчинів нижча, ніж температура замерзання
розчинників, речовини використовують в якості холодоносіїв. Для цього
використовують розчини етиленгліколю, гліцеролу. Така рідина, як молоко, є
багатокомпонентним розчином. Температура замерзання коров’ячого молока
становить – 0,54–0,58°С. Відхилення від цієї температури свідчить про
розведення молока водою. Зниження температури замерзання розчинів дає
можливість зберігати овочі та фрукти за температури – 1°С, бо температура
замерзання їхнього клітинного соку нижча від цієї температури через вміст у
ньому значних концентрацій органічних речовин. Кріометричні та ебуліометричні сталі розчинників
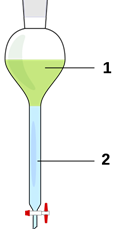
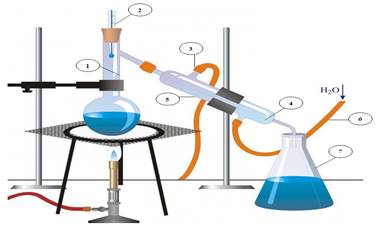
Дистиляція – процес розділення твердих або рідких речовин (чи їхньої суміші) на
складові частини (компоненти) шляхом випаровування з наступною конденсацією
без доступу повітря. Використовується для відокремлення
рідин від нелетких твердих речовин, як під час перегонки спиртних напоїв із
зброджуваних продуктів, або для поділу двох або більше рідин з різною
температурою кипіння, як під час виробництва бензину, гасу і мастил з нафти.
Інші промислові застосування включають переробку таких хімічних продуктів, як
формальдегід і фенол, опріснення морської води. Процес дистиляції,
ймовірно, використовувався ще стародавніми експериментаторами. Аристотель
(384–322 рр. до н. е.). Згадував, що чисту воду можна отримати шляхом
випаровування морської. Пліній Старший (23–79 рр. н.е.). Описав примітивний
спосіб конденсації, при якому масло, що отримується шляхом нагрівання
каніфолі, збирається на шерсті, вміщеній у верхній частині перегінного куба.
Рис. 3.9.1. Прилад для дистиляції: 1) колба; 2) термометр; 3) вихід нагрітої води; 4) внутрішня трубка
холодильника; 5) холодильник; 6) подавання холодної води; 7) склянка – збірник
ЗАДАЧІ Масовою часткою розчиненої речовини (w)
називають відношення маси розчиненої речовини до загальної маси розчину:
Масову частку ще
виражають у відсотках:
де т
(розчину) = т (речовини) + т (розчинника). Якщо замість маси
розчину т (р-ну) наведено значення його об’єму V (p-нy) та густини р (р-ну), то
використовують іншу формулу:
Таким чином, уміст
розчиненої речовини в розчині виражають у частках одиниці або відсотках. Знання цих
способів дуже важливе для практичного приготування розчинів і розв’язування
задач. Приклад 1. У 180 г води розчинили 60 г цукру. Яка масова частка (%) розчиненого
цукру в розчині?
Приклад 2. Яку масу натрій хлориду та води потрібно взяти для приготування 460 г
розчину з масовою часткою NaCl
15 %?
Приклад 3. Якою є масова частка (%) натрій гідроксиду у випареному розчині, якщо
300 г його розчину з масовою часткою NaOH
5 % випарили до 200 г?
Нагадаємо, що кристалогідрати – це кристалічні речовини, які містять
молекули води. Отже, готуючи розчини з кристалогідратів, треба враховувати
кристалізаційну воду, що входить до їхнього складу. Розглянемо, як визначити
в такому разі масу солі та масу води, потрібні для приготування розчину. Приклад 1. Яку масу кристалогідрату MgSO4 ∙7H2O необхідно
використати, щоб приготувати 360 г розчину з масовою часткою MgSO4 5 % ?
Приклад 2. Визначте масу води, необхідну для приготування розчину з масовою часткою
купрум(ІІ) сульфату 4 % із купрум(ІІ) сульфату пентагідрату масою 35 г.
Під час
розв’язування задач на розчини з різними концентраціями найчастіше
застосовують діагональну схему правила змішування (ПРАВИЛО ХРЕСТА). Під
час розрахунків записують одну над одною масові частки розчиненої речовини у
вихідних розчинах, праворуч між ними – її масову частку в розчині, який
потрібно приготувати, і віднімають по діагоналі від більшого значення менше.
Різниця в обчисленнях показує масові частки для першого й другого розчинів,
необхідні для приготування потрібного розчину.
Приклад 1. Визначте, скільки потрібно взяти розчинів солі 3 %-ї та 8 %-ї
концентрації для приготування 260 г розчину 5 %-ї концентрації. Розв’язання
Приклад 2. У яких кількісних відношеннях
треба змішати 16 % і 8 % розчини, щоб добути 14 % розчин?
Відповідь: щоб приготувати 14 % розчин
необхідно змішати 3-и вагові частини 16 % розчину і 1 частину 8 % розчину.
ЦІКАВО ЗНАТИ Гірська хвороба Розчинність кисню, вуглекислого
газу та азоту має особливе значення для нормального перебігу фізіологічних
процесів у живих організмах. На різниці парціальних тисків
кисню та вуглекислого газу в крові і в повітрі ґрунтується газообмін, який
здійснюється в основному у легенях.
Так, на певній висоті за умов
зниженого тиску виникає гірська хвороба. При цьому значно зменшується
концентрація кисню в крові (кисневе голодування), різко збільшується легенева
вентиляція. Під час зниження атмосферного
тиску гази, що містяться всередині організму, розширюються, знижується їх
розчинність у рідкому середовищі, точка кипіння крові та інших рідин
знижується до такої міри, що вони можуть закипіти за температури тіла. У льотчиків, які здійснюють
політ у негерметичній кабіні, може виникнути «висотний метеоризм» (розширення
повітря в кишках), біль у вухах, кровотеча з носа через розрив дрібних судин.
На висоту понад 19 км не можна
підніматися без надійної герметизації кабіни. У разі розгерметизації
космічного корабля настає миттєва смерть унаслідок закипання крові та інших
рідин організму, а також через розвиток блискавичної форми гіпоксії. Кесонна хвороба Під час опускання на глибину
внаслідок збільшення тиску концентрація газів у крові збільшується. За швидкого піднімання
водолазів з глибини різке зниження тиску призводить до бурхливого виділення
розчинених у крові газів. Утворені бульбашки закупорюють капілярні кровоносні
судини (газова емболія), порушують кровопостачання органів, що може
спричинити серйозні функціональні розлади. Тому для попередження кесонної
хвороби людину з глибини слід піднімати на поверхню повільно.
В умовах гіпербарії у крові та
всіх тканинах організму розчиняється додаткова кількість газів. Азот, який
міститься в повітрі, спричинює синдром специфічних порушень у осіб, що
працюють з підвищеним тиском. Найбільших уражень зазнає нервова система. Спочатку це виявляється легким
збудженням, що нагадує ейфорію («глибинне захоплення»), далі настають явища
некрозу та інтоксикації. Для уникнення цих явищ в підводні пристрої подають
киснево-гелієві суміші. Значення розчинів у природі та житті людини Всюди – у природі,
виробництві й повсякденному житті ми зустрічаємося з різноманітними
розчинами. Уся природна вода – розчини. У цьому легко переконатися, якщо
морську воду або воду з водогону чи колодязя помістити в колбу і дати їй
випаруватись. Під час випаровування морської води, наприклад, на дні колби
залишаться кристалики речовини – це виділились розчинені у цій воді солі.
Кристалики солі після випаровування морської води Розчини мають
величезне значення в природі. З природних водних розчинів утворилися
величезні товщі багатьох гірських порід та мінералів, наприклад, кам’яної
солі.
Поклади кам’яної солі
Питання для самоконтролю 2. Сформулюйте правило фаз Гіббса. 3. Сформулюйте
визначення понять «розчин», «розчинник», «розчинена речовина». 4. Фактори, що визначають розчинність речовини. 5. Розчини насичені, ненасичені та пересичені; розведені та
концентровані. 6. Основні способи вираження концентрації розчинів: в) молярна концентрація еквівалентів; 7. Наведіть приклади істинних розчинів, які
використовують у різних галузях народного господарства. 9. Від яких факторів
залежить швидкість дифузії? 11. Що таке кріоскопія та
ебуліоскопія? 12. У воді об’ємом 120 мл
розчинили цукор масою 40 г. Обчисліть масову частку цукру в утвореному
розчині.
Наведіть приклади розчинів, у
яких розчинено речовини в різних агрегатних станах. Антифризи, їх використання в холодильній техніці для зберігання овочів та
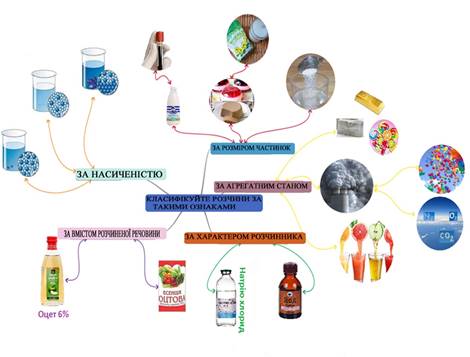
фруктів Розгадайте ментальну карту. Використовуючи малюнки, класифікуйте розчини за різними ознаками:
розміром частинок; характером розчинника; насиченістю; вмістом розчинених
речовин; агрегатним станом. МЕНТАЛЬНА
КАРТА
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||