|
|
ФІЗИЧНА І КОЛОЇДНА ХІМІЯ Електронний посібник |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
ОСНОВИ ХІМІЧНОЇ ТЕРМОДИНАМІКИ |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2.1. Основні поняття та величини термодинаміки. 2.2. Перший закон термодинаміки. 2.3. Термохімія. Основні закони термохімії.
2.4. Другий закон термодинаміки. Ентропія.
2.5. Термодинаміка біохімічних процесів. 2.1.
Основні поняття та величини термодинаміки Термодинаміка вивчає різні процеси
через дослідження змін енергетичного стану тіл. Ці зміни можна
охарактеризувати кількістю теплоти Q та роботи А, які отримуються або
витрачаються в процесі. Відповідно до цього вона й дістала назву від грецьких слів “terme” – теплота та “dinamic” – сила, робота. Уперше термін у вигляді прикметника “термодинамічний” був
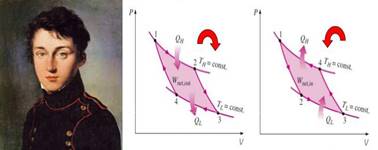
використаний Дж. Томсоном у 1849 р. для
характеристики запропонованої Саді Карно теплової машини, яка виконувала
роботу.
Рис. 2.1.1. Саді Карно. Прямий і
зворотний цикл Карно Зміни
енергетичного стану пов’язані зі зміною низки властивостей тіл, наприклад,
агрегатного стану, здатності розчиняти інші речовини, вступати з ними в
хімічні реакції тощо. Таким чином,
термодинаміка використовує існування певного взаємозв’язку між змінами
властивостей тіл у певному процесі та енергетичними характеристиками цього
процесу – теплотою та роботою. Конкретними завданнями термодинаміки є вивчення:
Розрізняють загальну, технічну та хімічну термодинаміки. Загальна термодинаміка розглядає теоретичні
основи усіх напрямів термодинаміки та їх застосування до деяких фізичних явищ
(магнетизм; електрика, випромінювання тощо). У технічній – розглядаються взаємні перетворення теплоти та робота,
головним чином, під час експлуатації теплових двигунів. Об’єктами вивчення хімічної термодинаміки є різні хімічні
та фізико-хімічні процеси, тобто такі, де має місце зміна хімічного складу
або структури. Термодинаміка має низку властивостей:
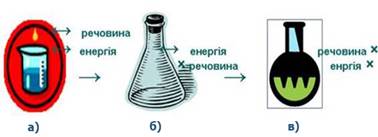
Термодинамічна термінологія Термодинамічною системою називається
тіло або група тіл, що перебувають у тепловій та механічній
взаємодії і відокремлені від зовнішнього середовища реальною або уявною межею
розподілу. Усі тіла, що оточують термодинамічну систему, утворюють зовнішнє
середовище.
Рис. 2.1.2. Приклад термодинамічної
системи: а) газ у балоні; б) речовина в
склянці Система може
складатися із речовини в однаковій фазі, або із речовин, що відокремлені одна
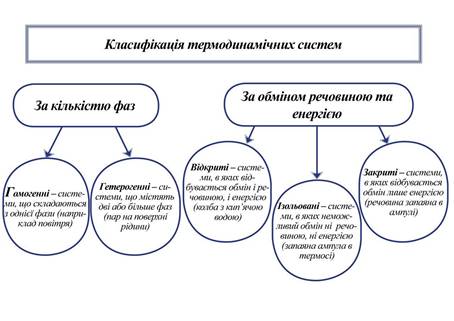
від одної поверхнею розділу фаз. Залежно від цього системи бувають однорідні (гомогенні)
та неоднорідні (гетерогенні). Гомогенні – системи, що складаються з однієї фази.
Наприклад, повітря – це суміш газів, розчин цукру у воді. У цих системах між
складовими частинами відсутня поверхня розділу фаз.
Рис. 2.1.3. Приклади гомогенних
систем: а) суміш газів – повітря; б) водні
розчини солей – розчин цукру у воді. Гетерогенні
– системи, що містять 2 або
більше число фаз. Наприклад, пар, що знаходиться на поверхні рідини, утворює
з нею гетерогенну систему з рідкою і газоподібною фазою. У гетерогенних
системах їх складові частини – фази розділені поверхнею розділу.
Рис. 2.1.4. Приклад гетерогенних
систем: а) рідина – газ; б)рідина – рідина;
в) газ – тверда фаза; г) рідина – тверда фаза Фаза може
відповідати будь-якому із трьох агрегатних станів: газоподібному, рідкому, твердому.
Фази, які утворюють систему, можуть перебувати як в однаковому, так і в
різних агрегатних станах.
Рис 2.1.5. Приклад систем: а) відкритої; б) закритої; в)
ізольованої Відкриті – системи, в яких відбувається обмін речовиною і енергією.
Наприклад, колба з киплячою водою обмінюється з навколишнім середовищем
речовиною (Н2О) та енергією у вигляді теплоти (Q).
Рис. 2.1.6. Приклади відкритих систем Закриті – системи, в яких відбувається обмін лише
енергією. Наприклад, речовина, що запаяна в ампулі, може отримувати або
віддавати енергію, але обмін речовиною з навколишнім середовищем не
відбувається.
Рис. 2.1.7. Приклади закритих систем Ізольовані – системи, в якій неможливий обмін ні речовиною, ні енергією.
Наприклад, запаяна ампула в термосі.
Рис. 2.1.8. Приклади ізольованих
систем
Фізичні величини, які
дають змогу визначити стан системи, називаються параметрами
стану: об’єм, тиск, температура, концентрація. Сукупність термодинамічних
параметрів визначає стан системи. Параметри стану, що підлягають
безпосередній зміні, вважають основними. Стан
системи може бути:
Перехід
системи із одного стану в інший, при час якого змінюються термодинамічні
параметри, – це термодинамічний процес. Щоб
не порушувалася термодинамічна рівновага системи з навколишнім середовищем,
процес має здійснюватися дуже повільно, а в ідеалі – нескінченно довго. При
цьому можуть змінюватися всі або окремі параметри системи. Залежно від
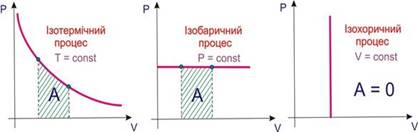
сталості певних параметрів термодинамічні процеси поділяються на типи:
За сталості
двох параметрів процес належить до комбінованих; це відображається в його назві, наприклад,
ізобарно-ізотермічний процес,
якщо Р,Т
= const.
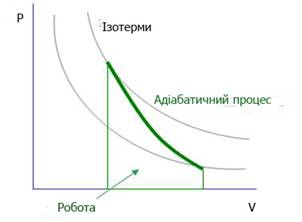
Рис. 2.1.9. Термодинамічні процеси Адіабатними
процесами називають зміни стану системи, які відбуваються у такий короткий
проміжок часу, що тепловий обмін з оточуючим середовищем не встигає відбутися,
наприклад, вибухи. Графічно в координатах Р – V ці процеси
відображені на рис. 2.1.10.
Рис. 2.1.10. Графічне зображення
залежності Р від V Усі процеси поділяють
на дві групи – оборотні і необоротні. Оборотним називають процес, який можна
здійснити в прямому і зворотному напрямах через ті самі стадії. Процеси, для
яких такі переходи неможливі, називають необоротними. 2.2.
Перший закон термодинаміки Основні
положення термодинаміки подають у формі законів. Перший закон (перше начало) термодинаміки витікає із закону збереження енергії. Згідно з
цим законом, у всіх явищах природи енергія не зникає безслідно і не виникає з
нічого, а лиш перетворюється з однієї форми в іншу в строго еквівалентних
кількостях. Є декілька
формулювань першого закону
термодинаміки, але всі вони виражають одну й ту ж думку:
Своєрідним
вираженням першого закону термодинаміки є прислів’я: “Під лежачий камінь вода
не тече”, “Без праці не витягнеш рибку зі ставка” тощо. Отже, на прикладі
прислів’я про рибку і працю, можна уявити, що рибка і є наша умовно закрита
система, в ній не відбудеться ніяких змін (рибка сама себе не витягне зі
ставка) без нашого зовнішнього впливу та участі (праці). Цікавий факт: саме перший закон термодинаміки встановлює, чому зазнали невдачі всі
численні спроби вчених, дослідників, винахідників винайти «вічний двигун»,
адже його існування є абсолютно неможливим згідно з цим самим законом.
Рис. 2.2.1. Перший закон термодинаміки
(неможливо зробити вічний двигун першого роду, бо неможливо виготовити машину, яка здійснює роботу без підведення
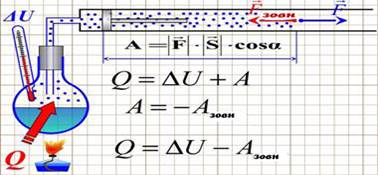
енергії) Як приклад
розглянемо таку просту термодинамічну систему як газ, що знаходиться в
циліндрі під поршнем (рис. 2.2.2). При підводі до системи теплоти газ
нагрівається (збільшується внутрішня енергія) і розширюється (здійснюється
робота А). Затрачена теплота іде на збільшення внутрішньої енергії
та а виконання роботи:
де ∆U
– зміна внутрішньої енергії; A – робота, яку виконує система. Зміна внутрішньої енергії системи може
відбуватися тільки внаслідок притоку (відтоку) енергії з довкілля в формі
теплоти або роботи.
Рис. 2.2.2. Формула першого закону
термодинаміки 2.3. Термохімія. Основні закони
термохімії Термохімія – це розділ хімічної
термодинаміки, що вивчає теплові ефекти хімічних реакцій. Для термохімічних розрахунків використовують
термохімічні рівняння. Термохімічні
рівняння – це рівняння реакцій, в яких вказують агрегатні
(чи фазові) стани речовин і тепловий
ефект реакції, а коефіцієнти перед формулами сполук
позначають не кількість
молекул, а кількість речовини. Агрегатний стан
позначають літерами: г – газоподібний,
р
– рідкий, т – твердий,
кр – кристалічний.
Якщо агрегатні стани речовин для умов реакції очевидні, наприклад О2,
N2, Al2O3, то їх, як правило, не
вказують. Таким чином, будь-яку хімічну реакцію можна зобразити у вигляді
відповідного термохімічного рівняння, наприклад, утворення із простих речовин
водяної пари і рідкої води:
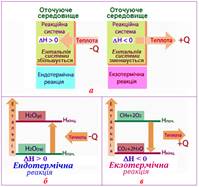
Ентальпія – це функція стану, що за умов постійного тиску
характеризує внутрішню енергію системи та її здатність до виконання роботи. Ентальпія залежить від кількості речовини, тому її змінення ΔH відносять до
одного моля і вимірюють у [кДж/моль]. Змінення ентальпії системи внаслідок взаємодії речовин за умов
постійного тиску називається тепловий ефект хімічної реакції. Якщо вихідні
речовини і продукти реакції перебувають у стандартному стані,
то тепловий ефект реакції називається стандартна ентальпія хімічної
реакції ΔH0298. Стандартні умови – це Температура – 298К (або t=25 оС); Тиск – 101325Па; Кількість
речовини – 1 моль. Необхідно
пам’ятати, що стандартні стани речовин не залежать від
температури. Хімічні процеси
супроводжуються виділенням або поглинанням енергії. Реакції, що
супроводжуються виділенням теплоти, називають екзотермічними. Реакції, що супроводжуються поглинанням теплоти,
називають ендотермічними.
Кількість теплоти, що виділилась або поглинулась у процесі реакції, називають
тепловим ефектом реакції.
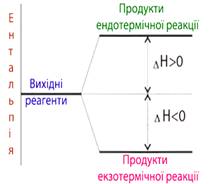
Рис. 2.3.1. Змінення ентальпії
внаслідок екзо- і
ендотермічної реакції Під час
термохімічних розрахунків слід пам'ятати перший
закон термохімії, відомий
під назвою закон
Лавуазьє-Лапласа: під час розкладання складної сполуки на прості
речовини поглинається (чи виділяється) стільки теплоти, скільки її
виділяється (чи поглинається) під час утворення такої ж кількості складної
сполуки із простих. З огляду на сучасний стан розвитку термодинаміки перший закон термохімії формулюється так: ентальпія утворення складної сполуки чисельно дорівнює ентальпії її розкладу, взятій з протилежним
знаком.
Наприклад, Незалежність
теплоти хімічної реакції від
шляху процесу за ізобарно-ізотермічних
умов (Р,Т=const)
була встановлена на основі експериментальних досліджень і має назву закон Гесса, або другий закон термохімії: Закон Гесса Тепловий ефект
хімічної реакції не залежить від шляху його проходження, а залежить від
початкового і кінцевого стану реагуючих речовин. Закон Гесса є окремим випадком першого закону термодинаміки, що застосовується до
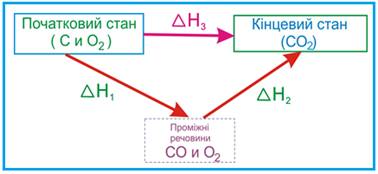
хімічних процесів, які протікають в ізохорних або ізобарних умовах. Наприклад,
згоряння вуглецю можна здійснити в дві стадії: – спочатку отримати
карбон (II) оксид:
– потім чадний газ окиснити до карбон (IV) оксиду:
Сумарний
тепловий ефект дорівнює:
Але реакцію
можна було б провести прямим шляхом, здійснюючи її в одну стадію:
З цього можна зробити
висновок, що згідно із законом Гесса незалежно від того, яким шляхом ми здобули карбон (IV) оксид (С02) –
сумарний тепловий ефект буде однаковий.
Рис. 2.3.2. Теплові ефекти реакцій
утворення СО2 двома способами Закон Гесса використовують для багатьох хімічних розрахунків, зокрема для обчислення теплових ефектів
реакцій, які технічно складно чи зовсім неможливо встановити
експериментально. Із закону Гесса випливають
важливі наслідки. Перший наслідок закону
Гесса: Тепловий ефект
хімічної реакції дорівнює різниці сум теплоти згоряння вихідних речовин і
теплоти згоряння продуктів реакції.
Наприклад,
тепловий ефект ∆Н° реакції:
дорівнює:
Інколи вигідно вираховувати тепловий ефект реакції за теплотами згорання. Теплота згорання – це теплота що
виділяється при повному згоранні 1 моля речовини в кисні. Другий наслідок закону Гесса: Тепловий ефект хімічної
реакції дорівнює різниці сум теплоти утворення продуктів реакції і теплоти
утворення вихідних речовин.
Наприклад,
розрахуємо тепловий ефект хімічної реакції:
Користуючись довідковими даними стандартних ентальпій утворення сполук, отримаємо:
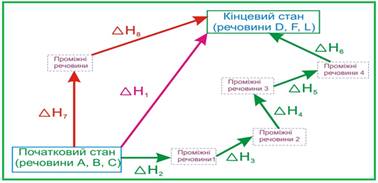
Рис. 2.3.3. Ілюстрація
до закону Гесса для реакції А + B + C = D + F + L Закон Гесса
доводить, що яким би шляхом не перебігала реакція, її тепловий ефект буде однаковим,
якщо при цьому не змінюється кінцевий і вихідний стани системи. Таблиця 1 Стандартні ентальпії утворення ∆Н0298, ентропії S0298 та енергії Гіббса утворення ∆G0298 деяких речовин при 298 К ( 250С)
2.4.
Другий закон термодинаміки. Ентропія Під час вивчення хімічних процесів надзвичайно
важливо оцінити принципову можливість чи неможливість їх перебігу, а також
напрямок і межі самочинного перебігу реакцій за даних умов. Самочинні
процеси
– це такі процеси, що перебігають без підведення
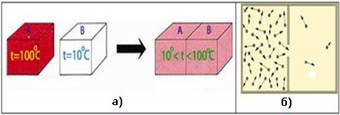
енергії ззовні. Приклади
самочинних фізичних процесів – це передавання теплоти від нагрітого тіла
холодному (рис. 2.4.1, а), здатність молекул газу займати весь об’єм посудини
(рис. 2.4.1, б), а приклади хімічних реакцій – утворення іржі на металах
(рис. 2.4.1, в), розчинення солі у воді тощо.
Рис. 2.4.1. Приклади самочинних
процесів: а) передавання теплоти від
нагрітого тіла холодному; б) здатність молекул газу займати
весь об’єм посудини; в) утворення іржі на металах Перший закон термодинаміки
не дозволяє передбачити, чи буде процес самодовільним або несамодовільним.
Так, самодовільний перехід теплоти від холодного тіла до гарячого не
суперечить першому закону термодинаміки. Йому не суперечать і такі процеси,
як самодовільне розподілення розчину на складові його речовини або
самодовільне стиснення газів. На запитання,
буде проходити чи ні цей процес,
наприклад хімічна реакція, самодовільно, якими параметрами буде характеризуватися
система, коли перейде у стан термодинамічної
рівноваги, можна отримати відповідь за допомогою другого закону термодинаміки. Другий закон термодинаміки дозволяє логічним шляхом створити струнку систему
співвідношень між параметрами стану системи, за допомогою яких можна отримати
не тільки відповіді на зазначені запитання, але й цілу низку інших
фундаментальних результатів, які відіграють важливу роль у фізичній хімії,
фізиці, техніці. Основний зміст другого закону термодинаміки
полягає у ствердженні існування ентропії та її неспадання в ізольованій системі. Історично
закон був отриманий спочатку в результаті аналізу роботи теплових машин. Запропоновано
багато різних формулювань другого закону термодинаміки. Усі
вони рівносильні та можуть
бути виведені логічно
один з одного. Постулат Клаузіуса, одне з формулювань другого закону термодинаміки, звучить так: єдиним
результатом будь-якої сукупності процесів не може бути перехід теплоти від
холодного тіла до гарячого. Це твердження за своєю суттю еквівалентне
такому (постулат Томпсона): теплота
найхолоднішого з тіл, що беруть участь у процесі, не може бути джерелом
роботи. Формулювання Оствальда стверджує, що неможливе створення вічного двигуна
другого роду. Вічний двигун другого роду – це теплова машина, що виконує роботу тільки за рахунок
поглинання теплоти із довкілля, але не передає частини її іншим тілам. Під
час роботи такої машини закон збереження енергії не порушується, але
створення такої машини неможливе. Чому вічні двигуни не працюють
вічно
З другого
закону термодинаміки випливає, що теплота не може самочинно перейти від менш
нагрітого тіла до більш нагрітого. У практичній діяльності іноді потрібно здійснити
зворотній процес, наприклад, передати теплоту від менш нагрітих тіл до більш
нагрітих. Такий процес здійснюють у холодильних машинах. У них теплова
енергія відбирається з охолоджувальних тіл і відводиться у навколишній
простір з вищою температурою. Щоб здійснити такий процес, потрібна затрата
енергії. Отже, холодильна машина – це тепловий двигун, що працює у зворотному
напрямку.
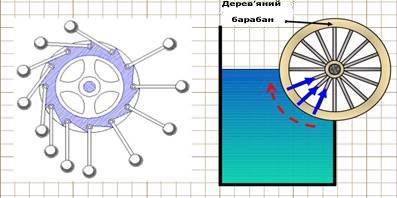
Рис. 2.4.2. Принцип роботи
холодильника Нарешті, можна
сформулювати другий закон термодинаміки, постулюючи існування деякої функції стану системи, що називається’
ентропією (S) (від грецького “τροπη” – перетворення),
має розмірність Дж/моль∙К: існує функція стану системи (S), змінювання якої, таким чином, пов’язане
із поглинутою теплотою й температурою системи. Ентропія системи – це міра невпорядкованості її
стану. До зростання ентропії призводить
підвищення температури речовини, оскільки зростає інтенсивність руху частинок
і, відповідно число варіантів її розміщення. Ентропія зростає під час фазових
переходів, випаровування, хімічних реакцій, особливо, якщо внаслідок цього
збільшується число молекул. Процеси, для яких DS >
0: розширення газів, фазовий
перехід від твердого до рідкого та газоподібного, розчинення
кристалів. Процеси, для яких DS
<
0: стиснення і зрідження газів, конденсація, кристалізація. Якщо під час хімічної реакції DS >
0, то збільшується об¢єм
системи, наприклад:
Стандартна ентропія чистої речовини
відноситься до 1 моль речовини за р = 101,325 кПа і температури 298 К.
Стандартна ентропія простих речовин не дорівнює 0. Так як ентропія є функцією
стану, то зміна ентропії DS,
що супроводжує хімічну реакцію, дорівнює різниці між значеннями абсолютних ентропій продуктів і реагентів за температури і тиску, при яких відбувається реакція. Для
хімічної реакції в стандартних умовах:
Для хімічної реакції в загальному вигляді аА + bB = cC + dD:
Зміна ентропії під час реакції
утворення сполуки із простих речовин
називається ентропією утворення сполуки. 2.5. Термодинаміка біохімічних
процесів Закони термодинаміки є важливими принципами науки біології. Ці принципи регулюють хімічні процеси (обмін
речовин) у всіх біологічних організмах. Перший закон термодинаміки, також
відомий як закон збереження енергії, стверджує, що енергія не може з'явитися
нізвідки і зникнути. Вона здатна переходити від однієї форми до іншої, але
енергія в замкненій системі залишається сталою. Другий закон
термодинаміки свідчить, що при передачі енергії, в кінці термодинамічного
процесу її буде менше, ніж на початку. Через ентропію, яка є мірою
невпорядкованості в замкненій системі, вся доступна енергія не буде корисна
для організму. Ентропія збільшується в міру передачі енергії. В доповнення до
законів термодинаміки теорії клітин, генів, еволюції та гомеостаз складають
головні принципи, які лежать в основі вивчення життя. Перший закон термодинаміки в біологічних системах Всі біологічні
організми потребують енергії для виживання. У замкненій системі, такій як
Всесвіт, ця енергія не споживається, а трансформується з однієї форми в іншу.
Наприклад, клітини організму виконують низку важливих процесів, на які
витрачається енергія. Під час фотосинтезу сонячна енергія поглинається
клітинами листків рослини і перетворюється в хімічну.
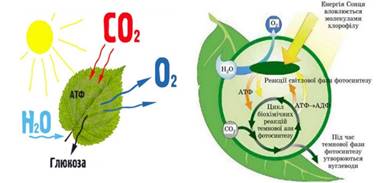
Рис. 2.5.1. Процес фотосинтезу Хімічна енергія
зберігається у вигляді глюкози, яка використовується для утворення складних
вуглеводів, які необхідні для створення
рослинної маси. Енергія, що зберігається в глюкозі, також може
виділятися через клітинне дихання. Цей процес дозволяє рослинним і тваринним
організмам отримувати доступ до енергії, яка зберігається у вуглеводах,
ліпідах та інших макромолекулах, шляхом виробництва АТФ. Ця енергія необхідна
для виконання клітинних функцій, таких як реплікація ДНК, мітоз, мейоз, рух
клітин. Другий закон термодинаміки в біологічних системах Як і у випадку
з іншими біологічними процесами, передача енергії на 100 % не ефективна. Під
час фотосинтезу, наприклад, не вся енергія світла поглинається рослиною.
Деяка частина енергії відбивається, а інша частина трансформується в тепло. Втрата енергії
в довкілля призводить до збільшення безладу або ентропії. На відміну від
рослин організм тварин не може утворювати енергію з сонячного світла. Тому
вони повинні споживати рослинну і тваринну для отримання енергії.
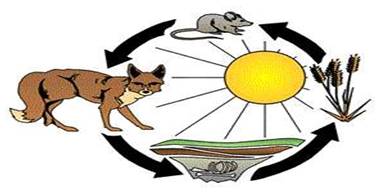
Рис. 2.5.2. Ланцюг живлення Що вище
організм знаходиться в харчовому ланцюгу, то менше доступної енергії він
отримує від власних джерел їжі. Велика частина цієї енергії втрачається під
час метаболічних процесів. Тому для організмів у вищих трофічних рівнях
доступно набагато менше енергії. Що менше енергії, то менше число організмів
може вижити. Саме тому в екосистемі більше виробників, чим споживачів. Живі системи постійно потребують енергії для підтримки власного високоупорядкованого
стану. Клітини,
наприклад, сильно впорядковані мають низьку ентропію. В процесі підтримки
цього порядку деяка енергія втрачається в довкіллі або трансформується. Таким
чином, в той час як клітини впорядковані, процеси, що виконуються для
підтримки цього порядку, призводять до збільшення ентропії навколо клітини (організму). Передача енергії призводить
до збільшення ентропії у Всесвіті.
ЦІКАВО ЗНАТИ Яким чином відбувається перетворення енергії?
Багатьом незрозумілий факт переходу енергії з
одного стану в інший. Але ми в повсякденному житті настільки часто
користуємося переходом енергії, що не замислюємося
над тим звідки вона береться. Так, наприклад, щодня сідаючи в автомобіль, ми
не думаємо про те, що в момент їзди хімічна енергія переходить в електричну.
В електродвигуні початкова електрична енергія переходить у механічну, а в
паровій турбіні тепло перетворюється в механічну фізичну величину. При цьому є певні кількісні співвідношення різних
форм енергії. Але під час перетворення відбуваються процеси з деякими
кількісними втратами: споживання корисної енергії завжди вище, ніж її
вироблення. Це явище легко пояснюється: перетворення не відбувається без
тертя, під час якого частина енергії стає теплом і розсіюється в просторі.
Виходить, що ця частина вже не може бути використана як корисна величина.
Таким чином, будь-яке перетворення не відбувається без втрат.
продуктів
харчування Калорі́йність їжі або енергети́чна ці́нність харчови́х продуктів –
кількість енергії, яка утворюється при окисненні жирів, білків, вуглеводів,
що міститься у продуктах харчування і витрачається на фізіологічні функції
організму. Калорійність – важливий показник харчової цінності продуктів,
вимірюється в кілокалоріях (ккал) або в кілоджоулях (кДж). Одна
кілокалорія дорівнює
4,184 кДж. Для визначення енергетичної цінності застосовують
прилад калориметр. Енергетична цінність
(ΔНзгор.): 1 г білка становить 4,0 ккал (17,1 кДж); 1 г жиру – 9 ккал (38,9 кДж); 1 г вуглеводів – 4,75 ккал (17,1 кДж). Мінеральні речовини, вода прихованої енергії не
мають, а енергетичну цінність вітамінів, ферментів та інших органічних
речовин не враховують, оскільки в продуктах їх дуже мало. Таким чином,
енергетична цінність харчових продуктів залежить від вмісту білків, жирів і
вуглеводів. Енергетичну цінність розраховують на 100 г їстівної частини
продукту харчування. Середня добова потреба дорослої людини становить у
вуглеводах 385 г, у жирах – 100 г і білках – 80г. Наприклад: Визначити енергетичну цінність харчового продукту масою 350 г, що містить
50% води, 30% білка, 15% жирів та 5% вуглеводів. Розв’язання: m(білків) = 350 · 0,30 = 105 г; m(жирів) = 350 · 0,15 = 52,5 г;
m(вуглеводів) = 350· 0,05= 17,5 г. Загальна енергетична цінність харчового
продукту становить: 105 · 17,1 + 52,5·38,9 + 17,5 · 17,1 = 4137 кДж. Для
того, щоб перевести кілоджоулі в калорії, потрібно результат поділити на 4,18
(1ккал = 4,184 кДж). Відповідь:енергетична цінність (калорійність)
харчового продукту становить: 4137:4,18 = 989,7
ккал або 4137 кДж.
Цікаві факти
про відкриття першого закону термодинаміки Один з перших відкрив
перший закон термодинаміки німецький
лікар Майєр Юліус Роберт (1814 – 1878). Майєр закінчив Тюбінгенський
університет. У 1840 – 1841 рр. як корабельний лікар
він брав участь у плаванні на о. Яву. Під час плавання він помітив, що колір
венозної крові моряків у тропіках значно світліший, ніж у північних широтах.
Рис.
1. Колір венозної кровотечі Ця зміна кольору крові наштовхнула його на думку, що
існує зв’язок між споживанням речовини і утворенням тепла.
Він також встановив, що кількість процесів окислення
в організмі людини збільшується з збільшенням виконаної роботи. Все це дало Майєру підставу в 1840 р. припустити, що теплота і механічна робота здатні взаємоперетворюватись. У своїх роботах Майєр вперше сформулював закон збереження енергії та детально виклав його в роботі “Органічний рух
в його зв’язку з обміном речовин”, опублікованій у 1845 р. Однак видатне відкриття Майєра не було визнано. Першовідкривачем закону почали називати
Джоуля, а потім Гельмгольца. Спроби Майєра захистити свій пріоритет у відкритті закону збереження і перетворення енергії викликали
напади з боку місцевих вчених. Це негативно вплинуло на стан Майєра і призвело до тяжкого психічного розладу. Лише в 50 – 60-х роках XVIII ст. пріоритет Майєра у відкритті першого закону термодинаміки був визнаний. Перший закон термодинаміки є окремим випадком закону
збереження і перетворення енергії стосовно процесів, що відбуваються в
термодинамічних системах.
Питання для самоконтролю 1. Що називається термодинамічною системою? 2. Наведіть класифікацію
систем за характером взаємодії з довкіллям. 3. Що називається
параметрами стану? 4. Дайте різні формулювання
першого закону термодинаміки. 5. Які умови називаються
стандартними? 6. Чим відрізняються
термохімічні рівняння від хімічних? 7. Сформулюйте закон
Лавуазьє-Лапласа. 9. Сформулюйте другий закон
термодинаміки. ЗАДАЧІ 1. Визначте теплоту згоряння одного кубометра (н.у.) метану СН4 і пропану C3Н8.
Який з цих двох газів вигідніше застосовувати в якості балонного
газоподібного палива? Відповідь: – 35813; – 91241 кДж. 2. Розрахуйте теплові ефекти реакцій згоряння
одного моля етану C2Н6, етилену C2Н4
і ацетилену С2Н2. Який з цих трьох газів вигідніше
застосовувати для зварювання металів? Відповідь: – 1423; – 1218; – 802 кДж. 3. Обчисліть тепловий ефект реакції
відновлення оксиду заліза (II) воднем, виходячи з наступних термохімічних
рівнянь: I. FeO(к) + CO(г) = Fe(к)
+CO2(г), ∆НI = – 13,18 кДж II. CO(г) + ½O2(г) = CO2(г), ∆НII
= – 283,0 кДж III. Н2(г)
+ ½O2(г) = Н2О(г), ∆НIII
= – 241,83 кДж Відповідь: + 28,0 кДж. 4. Порівняйте теплові ефекти за стандартних умов
реакцій відновлення оксиду заліза (III) різними відновниками: а) Fe2O3(к)
+ 3Н2(г) = 2 Fe(к) + 3Н2О(г) б) Fe2O3(к)
+ 3С(графіт) = 2 Fe(к)
+3 CO(г) в) Fe2O3(к)
+ 3 CO(г) = 2 Fe(к) + 3 CO2(г) Відповідь: 97,4; 490,7; – 26,8 кДж. 5. Обчисліть стандартні зміни енергії Гіббса і визначте, які з наступних реакцій можна використувати для одержання металів з їх оксидів: а) Fe2O3(к) + 2 Al(к) = 2 Fe(к)
+Al2O3(к) б) 3СаО(к) + 2 Al(к) = 3Са(к) + Al2O3(к) в)Cr2O3(к) + 2 Al(к) = 2Cr(к) + Al2O3(к) г) Fe2O3(к) + 2Cr(к) = 2 Fe(к) +Cr2O3(к) . Відповідь: – 842; 231; – 532; – 310 кДж
Для надання виробам з прісного
тіста пористості, розсипчастості в якості розпушувача використовують натрій гідрогенкарбонат: 2NaHCO3 = Na2CO3
+ CO2 + H2O. Визначити тепловий ефект цієї реакції. Охарактеризуйте енергетичну цінність харчових
продуктів. Які добові потреби людини в білках, жирах і вуглеводах? Створіть та внесіть у таблицю три своїх найулюбленіших продукти харчування за прикладом: 1) Найменування продуктів, 2) хімічний склад; 3) калорійність
основних продуктів харчування. Калькулятор калорійності продуктів. Із запропонованого колажу класифікуйте картинки за кількістю
фаз та за обміном речовиною та енергією:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||