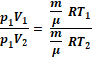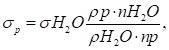|
|
ФІЗИЧНА І КОЛОЇДНА ХІМІЯ Електронний посібник |
|||||||||||||||||||||||||||||||||||||
|
|
АГРЕГАТНИЙ СТАН РЕЧОВИНИ |
|||||||||||||||||||||||||||||||||||||
|
1.2. Рідкий стан речовини. В’язкість та поверхневий натяг. 1.3. Твердий стан речовини. Кристалічні та аморфні тіла. Молекулярно-кінетична
теорія – це вчення, що пояснює властивості тіл взаємодією і рухом молекул та
атомів. Залежно від зовнішніх умов (температури і тиску) майже кожна речовина
може бути в одному з трьох
агрегатних станів (від латинського слова aggregatus – приєднаний).
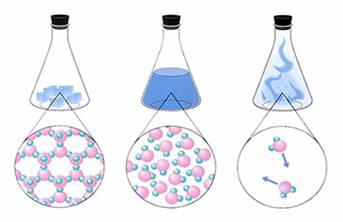
Рис. 1.1.1. Схеми
агрегатних станів речовини: а) твердий; б) рідкий; в) газуватий Речовина може
переходити з одного агрегатного стану в інший. Наприклад, кисень в оточуючому
нас повітрі є газом. Але при температурі 193 0C він перетворюється на рідину. Залізо в нормальних
умовах є твердим, а за температури 1535 0C воно плавиться і переходить в рідкий стан. При цьому
над розплавленим залізом буде знаходитись газ з атомів заліза, які з нього
випарувалися.
Рис. 1.1.2. Склад
молекули води однаковий у всіх її агрегатних станах (лід, вода,
водяна пара) Водяна пара, вода,
лід – це три агрегатні стани тієї самої речовини, утвореної однаковими
молекулами – молекулами води. Чому ж фізичні властивості речовин, які
утворені однаковими молекулами, але перебувають у різних агрегатних станах,
відрізняються одна від одної? Імовірно, причина такої відмінності полягає в
тому, що молекули по-різному рухаються та взаємодіють? Агрегатні стани
води
video не
поддерживается вашим браузером.. Рух молекул води
зі зміною температури
video не
поддерживается вашим браузером.
Рис. 1.1.3. Тверде тіло У тілі, яке
перебуває у рідкому стані, відстані між молекулами дещо менші, ніж у твердому
стані, але молекули рідини не рухаються безладно, вони лише ковзають одна
біля одної. Молекули, які опинилися на поверхні, можуть переборювати сили
молекулярної взаємодії і переходити в газоподібний стан – випаровуватися.
Рідини легко змінюють свою форму, тому їх можна переливати з однієї посудини
в іншу. Ця властивість називається текучістю. У рідинах молекули зберігають
певне просторове розміщення. Чим
нижча температура рідини, тим більша впорядкована її структура.
Рис.
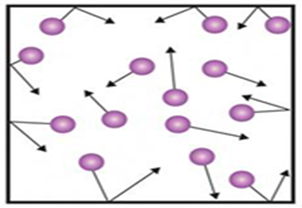
1.1.4. Рідина У газах молекули перебувають у
безперервному поступальному русі. Рухаючись, вони стикаються одна з одною і відразу ж
розлітаються, бо мають малі вандерваальсові сили притягання і велику кінетичну енергію.
Рис.
1.1.5. Газ Агрегатні стани
речовини
video не
поддерживается вашим браузером. Твердий, рідкий і газоподібний агрегатні стани речовини є основними у земних умовах. У
Всесвіті ж найпоширенішим станом речовини є плазма. Це газ, який складається з позитивних і негативних йонів. Під час
нагрівання речовини зростає швидкість руху її окремих частинок (атомів,
молекул) і відбувається руйнування структури речовини: тверде тіло
перетворюється на рідину, рідина – на газ. За подальшого нагрівання газу
швидкість руху молекул газу настільки зростає, що починає відбуватися процес
відриву електронів від атомів. Утворюється особливий стан газу – плазма.
Рис. 1.1.6.
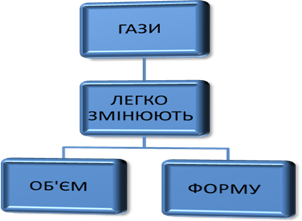
Приклад плазми Характеристика газоподібного стану речовини Гази характеризують такими властивостями: рівномірно заповнюють увесь
наданий їм об’єм; мають малу густину; мають велику швидкість дифузії, легко
стискуються; мають хаотичний рух та велику швидкість між молекулами.
Ці властивості газів пояснюються дуже швидким хаотичним рухом їх молекул. Відстань між молекулами газів настільки значна по
відношенню до розмірів їх молекул, що сили взаємодії між молекулами суттєво
не впливають на характер і невпорядкованість руху. Сили взаємодії між
молекулами можна не враховувати. При невеликому тиску можна не враховувати і
об'єм самих молекул, тому що об'єм газу буде залежати не від об'єму молекул,
а від відстані між ними. При цьому об'єм молекул складає дуже малу частину
всього об'єму, що займає газ. При нормальних умовах (Т = 273К, р=101,325 кПа) у
газоподібному стані знаходяться Не, Nе та інші гази цієї
групи, а також O2, N2, H2, F2, Сl2. Атмосферне повітря
складається із N2 і О2 (відповідно 75,5 і
23,1 % за масою), інертних газів, N2О, СО2 і
водяної пари. У природі гази утворюються як продукти життєдіяльності
бактерій, під час перетворення органічних речовин, відновлення мінеральних
солей. Ідеальний газ. Основні
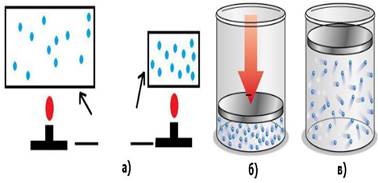
закони ідеальних газів Найважливішою теоретичною моделлю газоподібного стану є ідеальний газ. Ідеальним називається газ, в якому
відсутні сили притягання між молекулами.
Рис.1.1.7.
Модель ідеального газу Фізичний стан ідеального газу визначається трьома
параметрами: температурою – Т; тиском – р; об’ємом – v.
Рис.
1.1.8. Залежність ідеального газу від: а)
температури; б) тиску; в) об’єму Усі ці величини пов’язані між собою. Залежність між
ними називається рівнянням стану. Воно випливає з трьох газових законів.
Кожен із цих законів установлює залежність між будь-якими двома параметрами
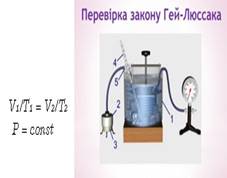
при незмінному третьому параметрі. У разі сталого
тиску об'єм даної маси газу змінюється прямопропорційно температурі.
Рис. 1.1.9. Ізобарний процес Ізобарний процес, тобто р1= р2.
Запишемо рівняння стану ідеального газу для двох станів: Для стану І (1)
Для стану ІІ (2)
Поділимо
рівняннях (1) на (2) , тоді
звідки або V~T. Ми отримали закон Гей-Люссака
У разі сталого
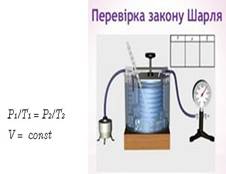
об’єму тиск даної маси газу змінюється прямопропорційно температурі
Рис. 1.1.10. Ізохорний
процес ІЗОХОРНИЙ ПРОЦЕС, тобто V1= V2. Запишемо рівняння стану
ідеального газу для двох станів: Для стану І (3)
Для стану ІІ (4)
Поділимо
рівняння (3) на (4) , тоді
звідки або р~T. Ми отримали закон Шарля
Уразі сталої
температури об’єм даної маси газу обернено пропорційний тиску, під яким газ
знаходиться.
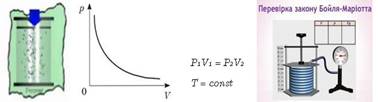
Рис. 1.1.11. Ізотермічний процес ІЗОТЕРМІЧНИЙ ПРОЦЕС, тобто Т1= Т2.
Запишемо рівняння стану ідеального газу для двох станів: Для стану І(1)
Для стану ІІ(2)
Оскільки у рівняннях (1) та (2) праві частини рівні, то й праві частини
рівні, тоді можна записати, що – ми отримали закон Бойля-Маріотта.
У хімічних
розрахунках за необхідності здійснювати перехід від нормальних умов до
реальних (або навпаки) користуються об’єднаним газовим законом:
де Pо – тиск 1013251 Па; То – температура (0 оС або 273 оК); V0 – об’єм газу за нормальних умов; Р – реальний тиск; Т – абсолютна температура (273 + t); V – об’єм газу за реальних
умов. У рівних об'ємах різних газів за однакових
умов (температурі та тиску) міститься однакова кількість молекул. Із закону Авогадро маємо низку важливих наслідків: Однакова кількість молекул
різних газів за однакових умов займає однаковий об'єм. За нормальних умов (Р = 101,325кПа, Т = 273К) один моль різних газів
займає об'єм 22,4 л. Це, так званий,
молярний об'єм газу Vm= 22,4 л/моль. Відношення мас рівних об’ємів газів дорівнює
відношенню їх молярних мас:
Відношення молярних мас газів отримало назву відносної густини D
Нормальними називають умови, коли тиск становить
при 0 0С (273 К) 1 атм або Рівняння Менделєєва-Клапейрона:
R – універсальна (молярна) газова стала
Реальні гази. Критичний
стан. Зрідження газів та застосування Реальні гази – це такі, які існують у природі і перебувають в умовах порівняно високого тиску
і низьких температур. Для характеристики їх стану необхідно враховувати сили
міжмолекулярної взаємодії, об’єм самих молекул та міжмолекулярні відстані.
Рис. 1.1.12.
Ван-дер-Ваальс та його газ Закони ідеальних газів для реальних газів не виконуються. Так, для азоту при Р = 1 атм. добуток РV = 1000, а при Р = 430,86 атм. РV =126,96 (відповідно до закону Бойля-Маріотта, РV є величиною незмінною, тобто, як би сильно не
змінювали тиск, добуток РV не повинен змінюватись). Тому
для реальних газів було запропоновано
де b – поправка на об’єм молекул
(вона приблизно на 2,5 % більша за об’єм одного моль даної речовини у рідкому
стані); а/ V2 – величина міжмолекулярної
взаємодії. Це рівняння є емпіричним, тобто, параметри, що отримані за розрахунками
на основі рівняння, не завжди співпадають з експериментально визначеними.
Але, це рівняння задовільним чином описує стан реальних газів під час
переходу їх в рідкий стан. Якщо збільшувати тиск і знижувати температуру, то
майже всі гази можна перетворити в рідину. Однак на таку просту схему
накладаються умови, суть яких у тому, що для кожного газу
є гранична температура, вище якої газ не зможе бути переведений в рідину
навіть за високому тиску.
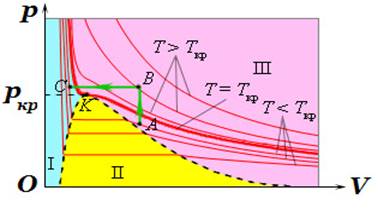
Рис. 1.1.13. Ізотерми реального газу: область I – рідина, область II – двофазна система
«рідина + насичена пара», область III – газоподібна
речовина. K – критична точка Це так звана критична температура. Для зрідження газів необхідна
температура нижче критичної, і чим нижча, тим менший вимагається тиск.
Критичній температурі відповідає критичний тиск і критичний об’єм.
Стан газу, що перебуває під критичним тиском при критичній температурі і
займає критичний об’єм, називають критичним станом. Для багатьої газів розраховані
критичні константи (таблиця 1). Таблиця 1 Критичні константи деяких речовин
Критичним об'ємом
називається об'єм 1
моль газу при критичному тиску і критичній температурі. Критичним станом газу
називається стан газу, що знаходиться під критичним тиском при критичній
температурі і займає критичний об’єм. Зріджені або рідкі гази використовуються для одержання
низьких температур у техніці, лабораторії. Крім того, рідкі гази легше
транспортувати. Зріджений кисень, який одержують з повітря, використовують у
металургії та хімічній промисловості, у громадському харчуванні для
виготовлення шипучих напоїв використовують карбон (IV) оксид. У промисловість його постачають у
балонах у зрідженому стані. Рідку вуглекислоту використовують для гасіння
пожеж. Останнім часом для заморожування харчових продуктів почали
використовувати рідкий азот (–75 0С). Таке заморожування називають
кріогенним. Цьому заморожуванню піддають гриби, хлібобулочні вироби, морські
продукти. Заморожування рідким азотом широко використовують у медицині. 1.2. РІДКИЙ СТАН РЕЧОВИНИ. В’ЯЗКІСТЬ ТА
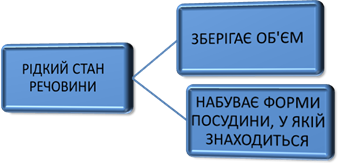
ПОВЕРХНЕВИЙ НАТЯГ Рідина
характеризується наявністю відповідно об’єму і відсутністю форми. Сили
міжмолекулярного притягання не дають молекулам рідини віддалятися одна від
одної на великі відстані і кожна молекула перебуває у сфері дії сусідніх
молекул. Тому рідини характеризуються сталістю об’єму. Хоч сили міжмолекулярної
взаємодії і великі, та все-таки недостатні, щоб утримувати молекули в певних
точках простору. Тому рідина не має сталої форми, а набуває форми тієї
посудини, в якій перебуває. Молекули рідини намагаються зайняти деяке
впорядковане розташування в просторі; рідина має об’ємну пружність, як і
тверді тіла, тому що пружно протидіють не лише всебічному стисканню, а й
всебічному розтягненню.
В’язкість або внутрішнє тертя – це протидія що виникає при русі одних шарів рідини відносно інших під
час їх переміщення.
Рис. 1.2.1. Поведінка рідин із малою
(вгорі) і великою (внизу) в’язкістю Якщо мішати воду, а потім додати туди мед, цукровий сироп, згущене
молоко, гліцерин або рослинну олію, то при цьому буде спостерігатись протидія
– під час руху одного шару рідини сусідні шари будуть втягуватись у цей рух,
але водночас чинять йому опір. Величина цього опору для різних рідин неоднакова і залежить від хімічної природи рідин,
тобто сил міжмолекулярної взаємодії. У таких рідин як мед, цукровий сироп
в’язкість висока, а у води, етилового спирту вона невелика.
Рис. 1.2.2. Залежність
в’язкості від хімічної природи рідини В’язкість рідин
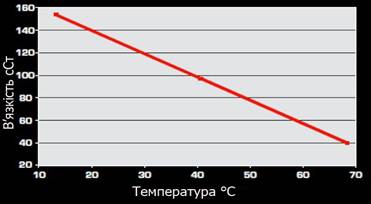
залежить від температури. З підвищенням температури вона зменшується,
рідина стає рухливою, збільшується її текучість. Було встановлено, що з підвищенням температури на 1 С в’язкість зменшується приблизно на 2 %. За деяких умов в’язкість
підвищується настільки, що рідина перестає бути текучою і переходить у
кристалічний стан, набуває властивостей твердих тіл.
Рис. 1.2.3. Залежність
в’язкості від температури В’язкість
розчинів значною мірою залежить від їх
концентрації. Чим вища концентрація, тим більшою буде в’язкість.
Рис.
1.2.4. Залежність в’язкості від концентрації У рідинах під час перемішування одних шарів відносно
інших між шарами виникає сила тертя, яка направлена протилежно до напряму
руху. Кількісну характеристику цієї сили виражає
закон Ньютона:
де η – коефіцієнт пропорційності, F – сила тертя; Ѕ – площа контакту двох шарів, Δv – різниця швидкостей v2 і v1 цих шарів, що
містяться на відстані один від одного. Тому в’язкість кількісно характеризується коефіцієнтом
в’язкості або коефіцієнтом внутрішнього тертя, який залежить від природи
рідини і температури. В’язкість вимірюють в пуазах (П). Це дуже велика
величина, бо 1 П = 0,1 Н×с/м2. Наприклад, в’язкість води дорівнює
0,01 П, олії – 0,98 П. На практиці ще визначають відносну
в'язкість рідини. Відносною в'язкістю називається
відношення в'язкості досліджуваної рідини до в’язкості води, що приймається
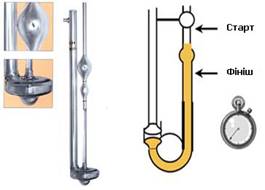
за одиницю. Один з методів виміру в’язкості заснований на вимірі часу витікання
рідини із капілярної трубки віскозиметра
Оствальда.
Рис. 1.2.5. Віскозиметр ВПЖ-2 0,39 У віскозиметрі
рідина витікає з резервуара під дією власної ваги. Відносну в’язкість можна
визначити за часом протікання однакових об’ємів досліджуваної і стандартної рідини
через один і той же капіляр. Віскозиметр заповнюють досліджуваною рідиною і
вимірюють час, що витрачається на проходження рідини від мітки А до мітки В. Потім цей дослід проводять з дистильованою
водою. На підставі дослідних даних проводять розрахунок відносної в’язкості
за формулою:
Визначення в’язкості має важливе значення під час
вивчення властивостей розчинів білків, вуглеводів і жирів. Від в’язкості
залежить швидкість дифузії речовини в рідких середовищах, а, отже, і
швидкість хімічних реакцій у розчинах. Розчини майже завжди більш в’язкі, ніж
чисті розчинники. Особливо яскраво це спостерігається в розчинах
високомолекулярних сполук. В’язкість має важливе значення в технології
приготування їжі. У багатьох харчових
виробництвах за показником в'язкості визначають готовність і якість продуктів
або напівфабрикатів. Наприклад, терте какао, під час виготовлення шоколаду,
має мати рідку консистенцію і в'язкість її не повинна бути більшою 6 П. В'язкість рідких продуктів може змінюватись залежно від
технологічних прийомів обробки, що призводить до зміни смакових якостей
продукту. Наприклад, в'язкість молока збільшується з підвищенням в ньому
вмісту жиру і білків. Із усіх типів білків, що містить молоко, найбільший
вплив на в'язкість має казеїн. Існує лінійна залежність зниження в'язкості
молока під час підвищення температури до 30 °С, потім ступінь зниження
зменшується. Значно підвищується в'язкість молока під час гомогенізації, тобто механічної обробки
молока під тиском 10 – 15 МПа і температури 45 – 55 °С, за якої подрібнення
жирових кульок молока збільшується, підвищується в'язкість і покращиться
смак. В'язкість сиропів і меду залежить від концентрації
вуглеводів. Під час кип'ятіння розведених цукрових розчинів відбувається
гідроліз цукру (сахарози), що сильно знижує в'язкість. Тому для добування
в'язких сиропів слід вести процес за м'яких умов кипіння. Вважається, що соки з більш високою в'язкістю мають
більш високу якість, ніж з низькою. В'язкість фруктових соків залежить
головним чином від вмісту пектинових речовин. Ферменти, що містяться в плодах
можуть значно знизити в'язкість соків, що пов'язано із перетворенням
пектинових речовин. Унаслідок гомогенізації в'язкість соків підвищується,
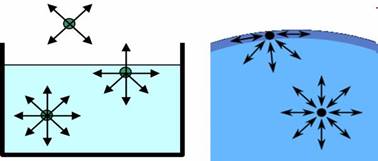
тому що збільшується загальна поверхня частинок. Поверхневий натяг та методи його визначення Поверхневий шар рідини за фізико-хімічними властивостями
відрізняється від її внутрішніх шарів, кожна молекула внутрішнього шару
рідини з усіх сторін притягується
сусідніми молекулами, розташованими поруч. Унаслідок цього сили
компенсуються, тому що рівнодіюча між ними дорівнює нулю. Рис.
1.2.6. Схема дії міжмолекулярних сил усередині рідини і на її поверхні В іншому положенні
знаходяться молекули, розташовані у верхньому шарі. На них діють сили
притяжіння тільки з боку молекул нижньої напівсфери. Дію молекул газу або
пару, що знаходиться над поверхнею рідини можна не враховувати, так як їх
концентрація незрівнянно менша, ніж у рідині. Рівнодіюча
молекулярних сил в цьому випадку не дорівнює нулю і спрямована вниз. Таким
чином поверхневі молекули рідини завжди знаходяться під дією сил, що прагнуть
втягнути їх всередину. Це призводить до того, що поверхня рідини намагається
скоротитися. Цим пояснюється кулеподібна форма краплі рідини (куля має
мінімальну поверхню); ідеально гладка поверхня рідини в широкому посуді;
мильні бульбашки в повітрі мають сферичну форму. Форму,
близьку до сферичної, мають краплини роси. Рис. 1.2.7. Сферична
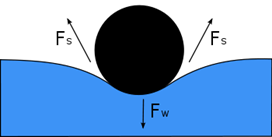
форма краплини Якщо на поверхню
рідини помістити якийсь предмет, то вона під ним прогнеться, площа поверхні
рідини зросте, тобто сила тяжіння, діюча на предмет, виконає роботу по
збільшенню поверхневої енергії рідини. Оскільки рідина прагне до зменшення
площі поверхні, то на границі між рідиною і предметом виникне сила
поверхневого натягу, яка намагатиметься зменшити площу поверхні. Ця сила
напрямлена по дотичній до поверхні розділу середовищ перпендикулярно до лінії
розділу середовищ. Сила поверхневого натягу пропорційна довжині межі розділу
середовищ: F=σl. У випадку, якщо вона не менша за силу тяжіння, то
предмет буде триматись на поверхні рідини і не тонути.
Рис. 1.2.8. Приклад поверхневого натягу Вільна поверхнева енергія –
це потенціальна енергія молекул поверхневого шару. Поверхневий натяг – це робота, що витрачається на утворення
одиниці площі поверхні. Поверхневий натяг можна розглядати як силу, що діє на одиницю довжини
лінії, яка обмежує поверхню рідини і спрямована в бік скорочення поверхні.
де δ – поверхневий натяг, що
вимірюється в Дж/м2 або н/м, Е – поверхнева енергія; S – площа поверхні. Чим міцніші міжмолекулярні зв'язки в рідинах, тим більший її поверхневий
натяг. Поверхневий натяг для чистих рідин залежить від природи рідини і
температури, а для розчинів – від природи розчинника, а також від природи і
концентрації розчиненої речовини. Поверхневий натяг рідин зі зростанням температури зменшується. Поверхневий натяг рідини може різко змінюватись під час розчинення в ній
різних речовин. При цьому поверхневий натяг може знижуватись або
збільшуватись ІІоверхнево-актнвними
речовинами (ПАР) називаються речовини, що знижують поверхневий
натяг. До поверхнево-активних речовин належать спирти, естери, карбонові
кислоти, мила. Додавання таких
речовин до води сприяє піноутворенню емульгуванню.
Рис. 1.2.9.
Молекула ПАР Поверхнево-інактивними називаються речовини, що збільшують поверхневий
натяг. Поверхневий натяг води, наприклад, збільшується під час розчинення в ній
неорганічних кислот, лугів різних солей. Вимірюють поверхневий натяг різними методами. Найпростішим є метод “рахунку крапель” за допомогою
приладу –
сталагмометру.
Рис.
1.2.10. Сталагмометр СТ-2 Сталагмометр – це піпетка, що має дві поділки (умовно А
і В). Нижня частина
сталагмометру закінчується капіляром, кінець якого притертий, щоб отримувати
однакові за розміром краплі. Визначення поверхневого натягу засновано на
тому, що відрив краплі від капіляру настає тоді, коли її вага буде
перевищувати силу поверхневого натягу на мінімальну величину. Тобто, в момент
відриву краплі можна вважати, що вага краплі практично дорівнює поверхневому
натягу. Чим більший поверхневий натяг рідини, тим більшими будуть краплі і
тим меншою буде їх кількість. Сталагмометр заповнюють досліджуваною рідиною і рахують кількість крапель
n, що витікають із сталагмометру при проходженні
рідини від мітки А до мітки В.
Потім сталагмометр заповнюють дистильованою водою і рахують кількість крапель
води, що витікають при проходженні того самого об’єму. Розрахунки
проводять за формулою:
де σр – поверхневий натяг досліджуваної рідини, н/м; σН2О – поверхневий натяг
води; ρр – густина досліджуваної рідини, г/см3, кг/м3; ρ Н2О – густина води; n Н2О – кількість крапель води;
пр
– кількість крапель досліджуваної рідини. Під час експериментального дослідження слід враховувати
температуру проведення дослідів і поверхневий натяг води за цієї температури. 1.3. Твердий стан речовини. Кристалічні
та аморфні тіла Є два різновиди твердого стану. Це кристали та аморфні тіла Тверді тіла, які мають впорядковане
розташування своїх частинок, що періодично повторюється у просторі,
називаються кристалами. Частинки кристалу утворюють у просторі правильну
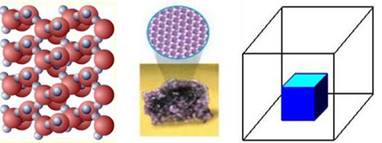
кристалічну. Основою кристалічної ґратки є елементарна комірка – фігура найменшого
розміру, послідовним переміщенням якої можна побудувати весь кристал.
Рис. 1.3.1. Основа кристалічної ґратки – елементарна
комірка Отже, кристалічні тіла характеризуються просторовою періодичністю в
розміщенні рівноважних положень частинок. Щоб краще уявляти собі елементарні
комірки, центри атомів (молекул) на рисунках показують за допомогою кульок та
ліній, які їх з’єднують. Насправді таких ліній не існує. Їx проводять лише для того, щоб зосередити увагу на
особливостях того чи іншого просторового розташування частинок. Щоб краще
розрізняти атоми різних речовин, з яких утворений даний кристал, їх
зображають різними кольорами (рис. 1.3.2).
Рис.
1.3.2. Кристалічні ґратки окремих тіл: 1) кухонна сіль; 2) лід; 3) алмаз; 4) графіт Кристали мають правильну поперечну форму. Наприклад, якщо розглядати
кухонну сіль через лупу, то можна побачити, що кристали солі мають форму
куба. А форма сніжинки свідчить про геометричну правильність будови
кристалічного тіла – льоду (рис. 1.3.3).
Рис.
1.3.3. Сніжинка – кристалічне тіло, яке утворює в просторі кристалічну ґратку Навіть в одному агрегатному стані одна й та сама речовина може мати різні
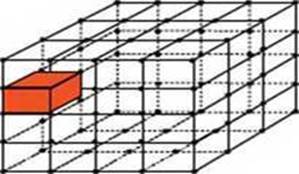
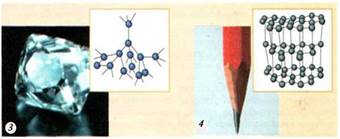
властивості. Наприклад, за хімічним складом і алмаз, і графіт є простою
речовиною, що складається з атомів Карбону. Але їх кристалічні ґратки суттєво
різні (рис. 1.3.4, а, рис. 1.3.4, б, відповідно).
Рис. 1.3.4.
Кристалічні ґратки
твердих тіл: а) графіт; б)
алмаз Перебуваючи в кристалічних ґратках на постійних місцях, частинки зазнають безперервних теплових коливань. Існують монокристали та полікристали. Монокристал – це
одиночний кристал, який має форму правильного багатогранника. Монокристали
рідко досягають розмірів у декілька сантиметрів (рис. 1.3.5, а).
Монокристалічними є дорогоцінне каміння, ісландський шпат, топаз. Найчастіше
у природі зустрічаються полікристали – сукупність
монокристалів (рис. 1.3.5, б), які хаотично зрослися між собою (кам’яна сіль, цукор, кварц, лід, залізо, мідь).
Рис. 1.3.5.
Кристалічні тіла: а) монокристали;
б) полікристали Окрім кристалічних твердих тіл, є й аморфні, яким притаманні властивості
як твердих тіл, так і рідин. Аморфний – від грецького слова amorphous – безформний. Відмінності у властивостях твердих тіл пояснюються різною будовою їх
кристалічних Ґраток. На відміну від кристалів, у аморфних тіл відсутній
порядок в розташуванні атомів. У аморфних тілах атоми коливаються навколо
хаотично розміщених точок, що не мають просторової періодичності (рис. 1.3.6,
а) До аморфних тіл належать скло, каніфоль, віск, пластмаси, цукровий
льодяник.
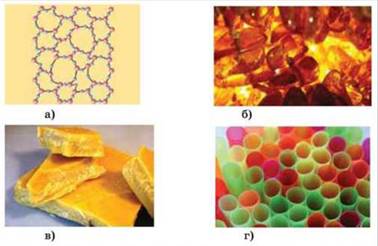
Рис. 1.3.6.
Аморфні тіла: а) аморфні тіла
навіть у твердому стані не мають періодичності у розташуванні атомів; б) смола; в)
віск; г) пластмаси Отже, кристали і аморфні тіла є твердими тілами. Але їх фізичні
властивості значно відрізняються. З цих двох станів більш стійким є
кристалічний. Під час нагрівання тверді тіла перетворюються на рідини. Кристалічні – за
певної температури, яка залежить від речовини твердого тіла. Аморфні тіла з твердого стану переходять до
рідкого поступово: спочатку вони розм’якшуються, а потім стають рідкими. Це
пов’язано з тим, що навіть у твердому стані аморфні тіла не мають строгої
періодичності у розташування атомів. Тверді тіла різняться й іншими фізичними властивостями, наприклад,
здатністю передавати теплоту або проводити електричний струм.
ЦІКАВО ЗНАТИ У природних умовах біля поверхні Землі плазма практично відсутня.
З’являється вона лише у верхніх шарах атмосфери – йоносфері. У космічному
просторі плазма – це найпоширеніший стан речовини. Сонце, гарячі зірки, які
мають дуже високі температури, повністю складаються з плазми. Біля поверхні Землі плазма утворюється лише під час спалахів блискавки. Плазма заповнює лампи денного світла, скляні трубки неонової
реклами.
Рис. 1. Приклади природної плазми Найбільші кристали природного походження З давніх-давен кристали привертали увагу людей своїм зовнішнім виглядом.
Їx навіть наділяли магічними властивостями. Сьогодні кристали мають суто практичну цінність: вони є основою багатьох
технічних пристроїв; кристали дорогоцінного каміння використовуються для
виготовлення ювелірних прикрас. Важливою характеристикою кристалу є його
розмір. На глибині 300
метрів розташована унікальна печера Naica з гігантськими кристалами. Naica – це шахта з видобутку свинцю, цинку і срібла, в якій
були знайдені великі порожнини, які містять кристали селеніту (гіпс). Найбільший зі
знайдених кристалів має розмір 11 метрів завдовжки, 4 метри завширшки, за
маси 55 тонн. Це один з найбільших відомих кристалів у світі. У печері дуже
жарко, температура досягає 48 °C при вологості 90 – 100 %. Ці фактори дуже ускладнюють
дослідження печери, роблячи необхідним використання спеціального спорядження. Як сформувалися кристали в печері: внаслідок природного створення унікальних температурних умов та
природної закупорки середовища, яка не порушувалася кілька мільйонів років. Де розташована: на глибині 300
метрів під містом Найка, штат Чіуауа, Мексика.
Рис. 2. Величезні
кристали селеніту (кристалічний гіпс) – мають форму колон, масу близько 55
тонн та досягають 1 – 2 м у
діаметрі Сьогодні наука і техніка досягли такого рівня, що учені можуть штучно
вирощувати кристали навіть більшого розміру, ніж це
робить природа. Зокрема, у 2009 році в лабораторіях Інституту монокристалів Національної
академії наук України (м. Харків) був вирощений один з найбільших у світі
монокристалів масою 504, 5 кг.
Рис. 3. Один з
найбільших кристалів у світі Для його створення використовувалася новітня технологія, яка дозволяє за
18 – 19 днів вирощувати кристали діаметром 0,5 м. Українські вчені впевнені, що після розроблення відповідного
обладнання вони зможуть вирощувати й набагато більші екземпляри. До речі, Інститут монокристалів є одним з лідерів у розробці й
удосконаленні техніки вирощування монокристалів, а також виготовлення
кристалів різного призначення та найвищої якості. Дослідження й напрацювання
науковців цього інституту користуються попитом не лише в Україні, але й
далеко за її межами, оскільки кристали використовуються у медичному
обладнанні для діагностування небезпечних хвороб, на митних пунктах для
виявлення шкідливих вантажів, в оборонній промисловості. Від теорії до практики. Що таке сапфірове скло?
Рис. 4. Сапфірове скло
(кристал, який має дуже велику міцність) Це не скло, а кристалічне тіло. Воно виготовляється із сапфірів,
одержаних штучним способом. Сапфірове скло – це надтвердий матеріал, а тому
воно використовується для виготовлення дуже міцного скла, зокрема,
куленепробивного. Сапфірове скло також встановлюється у вітринах великих
торговельних центрів, у коштовних швейцарських годинниках. Найближчим часом компанія Apple планує розпочати масове виготовлення сапфірового скла для смартфонів та
айфонів. Адгезія або чому гуси виходять з води сухими?
Всі ми знаємо, що
гуси і качки виходять з води сухими. Чому ж їх пір’я не намокають?
Виявляється, у них є спеціальна залоза, яка виділяє жир, яким водоплавні
птахи за допомогою дзьоба змащують своє пір’я. І вони залишаються сухими,
тому що вода стікає з них крапельками. Помістимо краплю
води на пластинку з полістиролу. Вона приймає форму сплющеної кульки. Таку ж
краплю спробуємо помістити на скляну пластинку. Ми побачимо, що на склі вона
розтікається. Що ж відбувається з водою? Вся справа в тому, що сили тяжіння
діють не тільки між молекулами самої рідини, але і між молекулами різних
речовин у поверхневому шарі. Ці сили називаються силами адгезії (від
латинського adhaesio – прилипання).
1. Охарактеризувати газоподібний, рідкий і твердий стан речовини. 2. Сформулювати закон Бойля-Маріотта і
написати формулу залежності об’єму газу від тиску. 3. Сформулювати закон Гей-Люссака і
написати формулу залежності об’єму газу від температури. 4. Сформулювати закон Шарля і написати
формулу залежності тиску газу від температури. 5. Написати рівняння Клапейрона-Менделєєва
і пояснити зміст. 6. Написати рівняння Ван-дер-Ваальса для
реальних газів. 7. Фізико-хімічний зміст поверхневого
натягу. 9. Чим пояснити, що
з підвищенням температури зменшується поверхневий натяг і в’язкість? 10. За якими ознаками можна відрізнити кристалічне тіло від аморфного? 11. Значення в’язкості в технології приготування їжі?
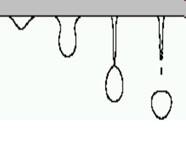
З крану самовару падають краплі. Коли ці краплі
більш важкі, коли вода гаряча чи вже охолола? Відповідь обґрунтуйте.
КЛАСИФІКУЙТЕ ЗОБРАЖЕННЯ ВОДИ ЗА
АГРЕГАТНИМ СТАНОМ:
|
||||||||||||||||||||||||||||||||||||||