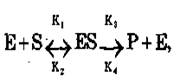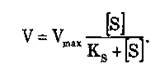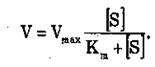|
|
ЗАГАЛЬНА БІОХІМІЯ II частина Електронний посібник |
||||||||||
|
7. ФЕРМЕНТИ – БІОЛОГІЧНІ КАТАЛІЗАТОРИ |
|||||||||||
|
7.1. Характеристика та класифікація ферментів. 7.4. Значення ферментів у харчовій
промисловості. 7.1. Характеристика та класифікація ферментів Ферменти є органічними сполуками білкової природи, які утворюються в живих організмах і здатні прискорювати перебіг хімічних реакцій в організмі. Від
інших каталізаторів ферменти відрізняються тим, що в природі
вони зустрічаються лише в
живих організмах, мають високу специфічність і каталітичну дію. Всі хімічні
реакції, які відбуваються за участю ферментів, проходять за
нормального тиску, температури,
близькій до кімнатної, за
слабокислої, нейтральної або слаболужної (у більшості випадків) реакції середовища і т.д.
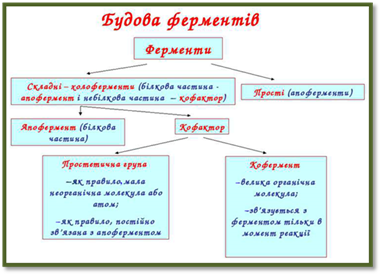
Прості ферменти Складні (двокомпонентні) ферменти, крім білкової
частини, містять групу небілкової природи – кофактор.
Усі кофактори ферментів поділяються на коферменти, простетичні групи та активатори. За новою
систематичною номенклатурою назви ферментів складаються з двох частин. Перша частина вказує на назву
субстрату, на який діє фермент, а друга –
на природу хімічної реакції, яку він каталізує, з додаванням суфікса – аза.
В основу класифікації ферментів покладено принцип розподілу їх за типами хімічних
реакцій, які вони каталізують.
Класи ферментів поділено на підкласи, а останні – на підпідкласи. До підпідкласу
входять уже окремі представники ферментів.
Номенклатура. Класифікація та
структура ферментів Більшість дослідників вважають, що механізм дії ферментів у процесах каталізу тих чи інших реакцій пов'язаний з
утворенням фермент-субстратних комплексів. За цих
умов фермент змінює молекулу субстрату так, що енергія, яку необхідно
прикласти для переведення її в активний стан, значно зменшується.
Під час каталітичного процесу утворення фермент-субстратного
комплексу відбувається поетапно. На
першому етапі ферментативного каталізу субстрат з'єднується з ферментом, на
другому – відбуваються активація і видозмінення субстрату з утворенням одного
або кількох активованих комплексів і на останньому (третьому) етапі –
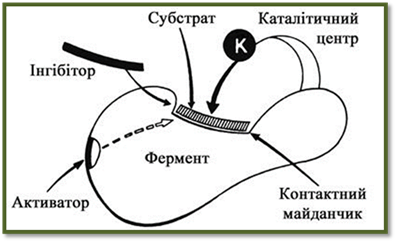
відділення продуктів реакції від ферменту. Активний центр ферментів Субстрат зв'язується не з усією молекулою, а з окремою
її ділянкою, яка називається активним центром, який визначає специфічність і
каталітичну активність ферменту. У складних ферментах (протеїдах) активний центр
утворений кофактором і залишками амінокислот; у простих ферментах
(протеїнах) активний центр представлений певною комбінацією залишків
амінокислот, які розміщені на відповідній ділянці молекули ферменту.
7.3. Властивості
ферментів Активність ферментів. Характерною
особливістю дії ферментів є їх висока каталітична активність. Вона значно вища, ніж неорганічних каталізаторів. Активність ферментів характеризується швидкістю хімічних
реакцій, які вони каталізують. Активність ферментів виражають в одиницях, які
називаються каталами (скорочено кат.). Катал – це каталітична активність, яка
здійснює хімічне перетворення 1 моль субстрату за 1 с. Вплив температури на активність
ферментів. Ферменти – термолабільні речовини. Зміна температури
зумовлює зміну їх активності. Так, підвищення температури на 10°С прискорює
швидкість хімічних реакцій приблизно в 2 рази. Однак ферменти є білками
і підвищення їх каталітичної активності відбувається доти, поки не
починається денатурація білка. Денатурація ферменту викликає руйнування
нативної структури, а це, в свою чергу, зумовлює втрату ферментативної
активності.Температура,за
якої фермент
має максимальну активність, називається оптимальною. Для
більшості ферментів, виділених з організму людини і тварин, оптимальна
температура коливається від 37 до 45°С. Вплив рН – середовища на
активність ферментів. Активність ферментів досить чутлива до
кислотності середовища. Вважають, що вплив концентрації
водневих іонів на активність ферментів пов'язаний насамперед з їх дією на
активні центри ферментів. Залежно від рН середовища активний центр ферменту
може бути в різній мірі іонізований, що впливає на формування активного фермент-субстратного комплексу. Специфічність дії ферментів. Під специфічністю дії ферментів
розуміють відповідну спрямованість їх впливу на певний субстрат, групу
субстратів, близьких за своїми властивостями, або певний тип зв'язку. Залежно
від цього розрізняють абсолютну, відносну (групову) і просторову
(стереоізомерну) специфічність ферментів. Абсолютна специфічність. Ферменти, які каталізують лише одну
реакцію і діють на один точно визначений субстрат, мають абсолютну
специфічність (уреаза каталізує гідролітичне розщеплення сечовини). Групова специфічність характерна для ферментів, які діють на
різні субстрати, що мають однаковий тип зв'язку (естерази каталізують
гідролітичне розщеплення зв'язку складноефірного типу). Стереоізомерна (просторова)
специфічність ферментів виявляється тоді, коли вони діють на оптично
активні сполуки, або сполуки, для яких характерна цис- і трансізомерія
(наприклад, це такі ферменти, які каталізують окислення тільки L-амінокислот
або тільки £-амінокислот). Активність ферментів часто змінюється
під дією різних хімічних сполук, що знаходяться в середовищі. Речовини, які
підвищують активність ферментів, називаються активаторами, а ті, що знижують
їх активність – інгібіторами. Властивості ферментів Кінетика ферментативних
реакції Вивчаючи кінетику ферментативних
реакцій,
дослідники відзначили їх відмінність від звичайних хімічних реакцій. За малих
концентрацій речовин, що вступають у реакцію, тобто субстрату,
спостерігається закономірність, яка є характерною для звичайних хімічних
реакцій: швидкість реакції пропорційна концентрації субстрату. При збільшенні
концентрації субстрату швидкість реакції, як і в хімічних процесах,
знаходиться в складній залежності від низки причин. Однак
при подальшому збільшенні концентрації субстрату швидкість ферментативної
реакції стабілізується та припиняє залежати від його концентрації. Це
значить, що в процесі ферментативної реакції відбувається насичення ферменту
субстратом. Ферментативну реакцію можна зобразити
у в вигляді рівняння:
де Е – фермент; S – субстрат; ES – фермент-субстратний комплекс; Р
– продукт реакції. Співвідношення K2/Kj=Ks має назву константи дисоціації. Рівняння Міхаеліса-Ментена для
визначення швидкості ферментативної реакції має вигляд:
У подальшому Дж. Б. Холдейн та Д.
Бріггс удосконалили залежність Міхаеліса-Ментена:
Це рівняння відрізняється від
попереднього тільки константою Кт, яка має більше значення, ніж
константа Ks, оскільки вона дозволяє певною мірою враховувати
вплив кінцевого продукту реакції. Локалізація ферментів у
клітині Зараз ферменти виявлено в усіх
структурних компонентах клітини. Різновидність їх у тих чи інших органелах
залежить в основному від функцій органел і природи хімічних процесів, які в
них відбуваються. Так, у мітохондріях, де протікають аеробні процеси, що
забезпечують клітину енергією, зосереджено всі ферменти і кофактори
дихального ланцюга, а також ферменти окислювального фосфорилювання, які
беруть участь в утворенні АТФ. У цих структурних компонентах клітини
локалізовано також ферменти циклу ди- та трикарбонових кислот і ферменти
р-окислення жирних кислот. Ферменти циклу утворення сечовини
зосереджено в різних органелах. Так, орнітин (карбамоїлтрансфераза) і більшу частину
карбаматкінази зосереджено в мітохондріях, а два інших ферменти цього циклу
(аргініносукцинатліаза та аргініносукцинат-синтетаза) знаходяться в
цитоплазмі. Для завершення циклу, очевидно, має місце зустрічне
транспортування орнітину і цитруліну крізь мембрану мітохондрій. Досить важливим компонентом клітини є
ядро. В ньому відбувається синтез різних нуклеотидів і окремих видів
нуклеїнових кислот. Вважають, що в ядрі зосереджені такі ферменти, як
НМФ-аденіліл-трансфераза, ДНК-полімераза І, ДНК-полімераза II
тощо. У рибосомах зосереджено ферменти, що беруть участь у синтезі
нуклеїнових кислот. Різні ферменти класу гідролаз локалізовані переважно в
лізосомах, де відбуваються процеси деструкції органічних сполук до тих
структурних одиниць, з яких вони побудовані. Важливою функцією лізосом є
постачання ферментів для внутрішньо- і позаклітинного використання. До ферментів, які перебувають у
розчиненому стані в цитоплазмі, належать ферменти гліколізу, біосинтезу ліпідів,
вуглеводів, амінокислот та ін. Отже, в клітинах організму має місце
відповідна локалізація ферментів у певних її структурах, в яких відбуваються
реакції. Необхідно відмітити, що всі біохімічні реакції і процеси, які
відбуваються в клітині, скоординовані між собою. Це забезпечує нормальну
життєдіяльність різних органів і тканин, а також організму в цілому.
Your browser does
not support the video tag. Активний центр та механізм дії ферментів 7.4. Значення ферментів у харчовій промисловості
Ферменти широко використовують у
багатьох галузях народного господарства, медицині. Так, у харчовій промисловості під час
випікання хліба використовують ферментні препарати, які значно поліпшують
його якість і аромат. Крім того, прискорюється визрівання тіста і значно
зменшуються витрати цукру на виготовлення булочних виробів. Ферменти, які
спричиняють молочнокисле бродіння, застосовують під час виготовлення молочних
продуктів – кефіру, ряжанки і простокваші. Такий фермент, як хімозин
(виділяють із слизової оболонки сичуга), зумовлює зсідання білків молока і
використовується в сироварінні. У м'ясній промисловості застосовують
протеолітичні ферменти, які частково розщеплюють білки і прискорюють
дозрівання м'яса: роблять його більш м'яким і ніжним, поліпшують смак,
аромат, підвищують його соковитість. З такого м'яса виготовляють високоякісні
продукти: напівфабрикати, ковбаси, консерви тощо. Різні види ферменту амілази
використовують у пивоварінні та під час виробництва спирту. Так, застосування
ферментних препаратів у пивоварінні дає можливість зекономити 165 г ячменю під час виробництва кожного декалітра пива. Ферменти та їх препарати
використовують також у тваринництві для підвищення продуктивності тварин. В останні роки ферментні препарати
успішно застосовують і під час силосування різних кормів, в результаті чого
поліпшується хімічний склад і біологічна цінність силосованих кормів,
засвоєння їх організмом тварин. Ферменти як лікувальні препарати ширше
почали застосовувати в медицині. Новою перспективною галуззю медичної
ензимології є використання іммобілізованих ферментів, тобто тих, які
прикріплені до відповідних нерозчинних речовин (носіїв), що захищають їх від
руйнування. ФЕРМЕНТИ – БІОЛОГІЧНІ КАТАЛІЗАТОРИ ПИТАННЯ ДЛЯ САМОПЕРЕВІРКИ 1. Які речовини називаються ферментами ? 2.Охарактеризуйте роль ферментів у процесах
життєдіяльності організмів. 3. Охарактеризуйте особливості дії ферментів як
біокаталізаторів. 4. Що таке
прості ферменти та яка хімічна природа ферментів? 5. Яка будова складних ферментів? 6. Що таке активний центр ферментів-протеїнів і ферментів-протеїдів? 7. Поясність механізм дії ферментів. 8. Назвіть характерні властивості ферментів. 9.Як впливає на активність ферментів температура і рН- середовище?
10.Як впливає на активність ферментів температура ? 11.Що таке специфічність дії ферментів? Види специфічності та їх
характеристика. 12.Назвіть принципи номенклатури і класифікації ферментів. 13.Назвіть найширше застосування ферментів. |
|||||||||||