|
|
ФІЗИЧНА І КОЛОЇДНА ХІМІЯ Електронний посібник |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
ВИСОКОМОЛЕКУЛЯРНІ
СПОЛУКИ ТА ЇХ РОЗЧИНИ |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
11.1.
Природні та хімічні високомолекулярні сполуки. 11.2.
Набухання і розчинення полімерів. 11.3.
Властивості розчинів високомолекулярних сполук. 11.4.
Висолювання і коацервація. 11.1. Природні та хімічні
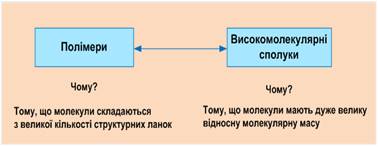
високомолекулярні сполуки Високомолекулярні сполуки (далі
– ВМС) – хімічні сполуки, що мають
молекулярну масу від декількох тисяч до кількох мільйонів а.о.м. Молекули
таких сполук називать макромолекулами. Основну частину ВМС складають полімери – сполуки, побудовані з повторюваних фрагментів
(монометрів).
Будь-який атом чи група атомів, які
входять до складу ланцюга полімеру, називаються структурною
ланкою.
Рис.
11.1.1. Фрагменти
макромолекул крохмалю (угорі) і поліетилену (унизу) та їх елементарні ланки Структурні ланки, з яких складаються молекули
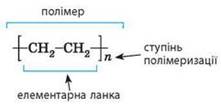
полімерів, – це групи атомів, що є характерними для кожного полімеру, їх
називають елементарними ланками (рис. 11.1.1). Елементарна ланка – це група атомів, що багаторазово повторюється в
макромолекулі полімеру. У відомих вам крохмалі та целюлозі елементарними ланками
є залишки молекул глюкози, а в поліетилені – це група атомів CH2-CH2. Хімічні формули полімерів записують, зазначаючи у
квадратних дужках формулу елементарної ланки. За дужками символом n позначають
середнє число елементарних ланок у макромолекулах, яке називають ступенем
полімеризації. Ступінь полімеризації – середнє число елементарних ланок у макромолекулі
полімеру:
Назву лінійного полімеру утворюють додаванням префікса
«полі»: а) до назви складової повторюваної ланки, яку пишуть у дужках (систематичні назви); б) до назви мономера, з
якого одержали полімер (напівсистематичні назви, які IUPAC рекомендує
використовувати для найпоширеніших полімерів). Назву складової повторюваної
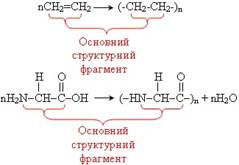
ланки утворюють за правилами хімічної номенклатури. Наприклад: [–CH2–CH2–]n Полі (етилен), поліетилен Як приклад, можна розглянути реакції утворення
поліетилену і гліцилгліцину:
Mr(полімеру) = n ∙
Mr(ел.ланки), де n –
середньоарифметичне значення ступеня полімеризації для даного полімеру.
Обчисліть середню молекулярну масу
поліетилену, якщо його ступінь полімеризації дорівнює 5000. Найпоширеніші полімери
ü
лінійна форма, наприклад: поліетилен, природний поліізопрен, що входить до складу природного каучуку; ü
розгалужена форма, наприклад: крохмаль,
глікоген; ü просторова форма, наприклад: вулканізований
каучук.
Рис. 11.1.2. Структура полімерів Лінійна будова. У таких макромолекулах елементарні ланки
сполучені послідовно, без розгалужень. Такі макромолекули можуть набувати
різної форми: витягуватися в довгі молекули, скручуватися у спіраль або
клубок (рис. 11.1.2).
Рис. 11.1.3. Утворення різних просторових
форм лінійними макромолекулами Вони можуть
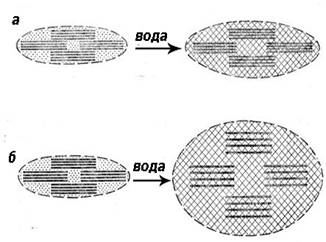
оборотно (без розривання хімічних зв’язків) змінювати свою форму, тобто
виявляти гнучкість. Це зумовлює еластичні властивості полімерів: під час
деформації полімеру скручені макромолекули розпрямляються (рис. 11.1.4а), а
після зняття навантаження – знову скручуються (рис. 11.1.4б).
Рис.11.1.4. Дія навантаження на еластичні
полімери: а) макромолекули розпрямлюються; б)
оборотно скручуються після знімання Таблиця 1 Характеристики
полімерів різної будови
* У воді чи
органічних розчинниках залежно від полярності полімеру.
Рис. 11.1.5. Будова макромолекули
полімерів: а) розгалуженої; б) сітчастої Розгалужена будова. У макромолекулах розгалуженої форми у деяких
місцях трапляються розгалуження ланцюгів за рахунок сполучення однієї ланки з
кількома іншими (рис. 11.1.5а). Сітчаста (просторова, або тривимірна) будова. Усі структурні ланки об’єднуються у велику просторову
міцну сітку (рис. 11.1.5б). Будова таких полімерів певною мірою нагадує
будову речовин з атомними кристалічними ґратками.
Синтетичні високомолекулярні сполуки становлять основу пластмас, волокон, гуми. За деякими
властивостями ці матеріали переважають традиційні – дерево, кераміку, скло,
металічні сплави. Синтетичні матеріали набули широкого використання у
промисловості, будівництві, медицині, засобах зв’язку, на транспорті, а також
у нашому повсякденному житті, на роботі, відпочинку.
Рис. 11.1.6. Застосування матеріалів на
основі синтетичних високомолекулярних сполук Серед синтетичних
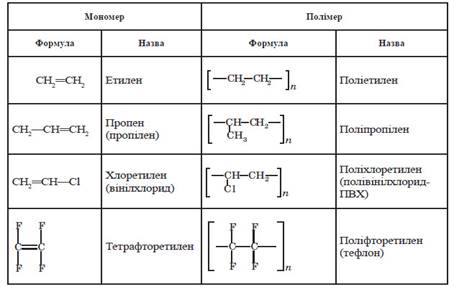
високомолекулярних сполук – поліетилен, поліпропілен, полістирол. Загальна
назва цих та інших подібних речовин – полімери (часто полімерами називають
усі високомолекулярні сполуки). Способи утворення
полімерів Полімеризація – процес послідовного з'єднання молекул
мономеру за реакцією приєднання. Наприклад,
реакція утворення поліхлорвінілу
Наприклад,
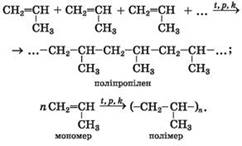
реакція утворення поліпропілену: Під час утворення
макромолекул поліпропілену в кожній молекулі пропену руйнується один зі
складників подвійного зв’язку, і молекули сполучаються в довгий ланцюг
простим ковалентним зв’язком. Наводимо схему утворення полімеру з іншого ненасиченого
вуглеводню – пропену:
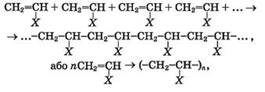
Реакція полімеризації – реакція
утворення полімеру в результаті послідовного сполучення молекул мономера за
рахунок розриву одного зі складників кратного зв’язку (тобто розриву π-зв’язків). Реакція
полімеризації
мономер полімер Загальна схема
реакцій полімеризації за участю ненасичених вуглеводнів та їх похідних,
молекули яких містять один подвійний зв’язок, –
де X–H
(мономером є етен, полімером – поліетилен), CH3 (пропен,
поліпропілен), Cl (вінілхлорид, полівінілхлорид), C6H5 (стирол,
полістирол). Складіть схему
утворення полівінілхлориду. У реакції
полімеризації можуть брати участь дві різні сполуки (два мономери); у цьому
разі утворюється співполімер.
Наприклад, реакція утворення
фенолформальдегідних смол (новолак, резол):
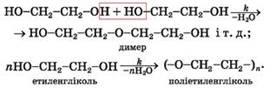
Реакція поліконденсації – реакція
утворення полімеру в результаті взаємодії характеристичних груп молекул
мономера з виділенням води, амоніаку, хлороводню. Реакція поліконденсації мономер Під час реакції поліконденсації взаємодіють між собою
характеристичні групи різних молекул мономера. Таких груп у кожній молекулі
має бути принаймні дві. Процес поліконденсації є ступінчастим. Спочатку взаємодіють
дві молекули мономера з утворенням молекули димера, потім реагують димерні
молекули і т. д. Наводимо схему реакції поліконденсації
двоатомного спирту етиленгліколю:
Зрозуміло, що маса макромолекули полімеру – продукту
реакції поліконденсації – менша, ніж сумарна маса молекул мономера. У реакції поліконденсації можуть брати участь два
мономери або навіть більше. Прикладом такої взаємодії є утворення поліпептиду
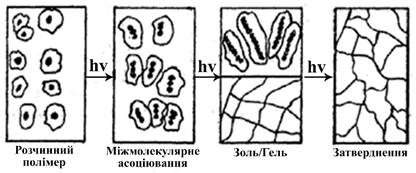
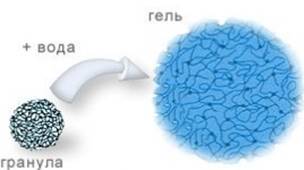
з кількох амінокислот. 11.2. Набухання і розчинення полімерів Набухання – це довільний процес проникнення (дифузії) молекул
розчинника між молекулами ВМС, що супроводжується значним збільшенням об’єму
та маси ВМС. Набухання полімерів
video
не поддерживается вашим браузером Збільшення об’єму ВМС
пов’язане з особливостями їх структури. Ланцюгоподібні макромолекули ВМС
упаковані відносно нещільно і мають порожнечі, в які й проникають молекули
розчинника. Спочатку полімер поглинає маленькі молекули розчинника
(набухання), потім, коли макромолекули набряклого полімеру віддалені одна від
одної по всій довжині, вони поступово відриваються і переходять у розчин
(розчинення). Набухання, яке
завершується повним розчиненням і утворенням розчину ВМС називається необмеженим. Наприклад, набухання желатину у гарячій воді, природного каучуку
у вуглеводнях.
Рис.11.2.1. Набухання желатину в гарячій
воді Проте набухання
полімеру не завжди закінчується розчиненням. У такому випадку воно не
супроводжується самовільним розчиненням, а лише частковим поглинанням певної
кількості рідини (рис. 11.2.3). Тобто, встановлюється рівновага і система
буде складатись з 2-ох фаз:1 – насичений розчин ВМС у воді, 2 – насичений
розчин розчинника у ВМС. Набухання, яке не закінчується розчиненням, а
система набуває драглеподібного стану (утворення еластичного студню)
називається обмеженим.
Рис. 11.2.2. Гелі і студні Таке набухання характерне для
полімерів, що мають хімічні зв’язки, які не дають молекулам відірватись одна
від одної і перейти в розчин (лінійна форма молекул). Наприклад, набухання желатину у холодній воді, гуми у
вуглеводнях.
Рис. 11.2.3. Розчинення полімера Обмежене набухання
характеризується ступенем набухання. Ступінь набухання (а) – це відношення приросту об’єму (або маси)
досліджуваного зразка полімеру до його початкового об’єму (чи маси):
де (V – Vo) – приріст об’єму; V – об’єм набряклого
зразка полімеру; Vo –
початковий об’єм.
де (m – mo) – приріст маси; m – маса набряклого зразка полімеру; mo – початкова маса. На ступінь набухання впливають такі фактори: природа розчинника та полімеру, температура, тиск, рН
середовища, сторонні речовини (особливо електроліти), ступінь дисперсності
полімеру, вік (термін виготовлення). Температура і тиск
впливають за принципом Ле Шательє. Якщо набухання (розчинення) супроводжується виділенням
теплоти, то з підвищенням температури ступінь набухання (розчинність) зменшується,
але швидкість набухання (розчинення) зростає відповідно зі збільшенням
швидкості дифузії. Загальний об’єм системи під час набухання зменшується,
тому з підвищенням тиску ступінь набухання зростає. Ступінь набухання
змінюється у широкому діапазоні. Наприклад,
ступінь набухання білка може досягти 200 %, крохмалю – до 10 %. У
деяких природних ВМС ступінь набухання перевищує 1600 %.
Рис. 11.2.4. Процес набухання Під час набухання об’єм полімеру завжди
збільшується, однак, об’єм усієї системи (полімер + розчинник) зменшується. Тобто, об’єм набряклого полімеру менший, ніж
сума об’ємів полімеру до набухання та поглиненої ним рідини.
Таке зменшення загального об’єму системи під час набухання називається
контракцією. Це пояснюється тим, що частина поглинутої набряклим полімером
рідини міцно пов’язана з його молекулами і знаходиться в більш ущільненому
стані, ніж вільна рідина. Збільшення об’єму
полімеру є одним із проявів набухання. Якщо вихідний полімер помістити у
щільно закриту посудину, то під час дифузії молекул розчинника в середину полімеру
та збільшення його об’єму у системі виникатиме тиск набухання. Він
аналогічний до осмотичного тиску розчинника в осмотичній комірці. Тиск
набухання найвищий під час поглинання полімером перших порцій розчинника,
потім він зменшується, а під час досягнення рівноваги між полімером і
розчинником падає до нуля. Під час набухання бобових та зернових тиск
набухання досягає десятків і сотень МПа. Набухання
характерне тільки для високомолекулярних органічних сполук (білки, крохмаль,
клітковина, каучук). З неорганічних сполук набухання властиве лише деяким
сполукам (мінерали, наприклад,
глина).
Рис. 11.2.5. Набухання глинистих матеріалів Набухання потрібно враховувати у
процесах переробки та зберігання зерна, у хлібопекарській промисловості,
кондитерському виробництві та інших технологічних процесах харчових
виробництв. Набухання властиве життєдіяльності усіх рослинних і тваринних
організмів та людині. Так, у молодому віці ступінь набухання колоїдів
організму високий, а з віком здатність колоїдів до набухання втрачається, що
гальмує процеси обміну. 11.3.
Властивості розчинів високомолекулярних сполук Для полімерів характерні особливі
властивості, що відрізняють їх від низькомолекулярних речовин. 1. Механічні
властивості. Для полімерів характерні: • еластичність або гнучкість; • незначна крихкість склоподібних полімерів (наприклад,
оргскло); • здатність молекул орієнтуватися вздовж напрямку
механічного навантаження, що використовують для виготовлення волокон та
плівок. 2. Здатність розчинятися. Полімери розчиняються набагато гірше
за їх низькомолекулярні аналоги. Розчинність полімерів залежить насамперед
від полярності їхніх молекул: полярні (гідрофільні) полімери краще
розчиняються у воді чи полярних органічних розчинниках, а неполярні
(гідрофобні) – у неполярних органічних розчинниках. Також на розчинність
впливає розмір і будова молекул полімерів. 3. Термопластичність. Властивість тіла змінювати свою форму за
нагрівання і зберігати її після охолодження називають термопластичністю. За цим параметром полімери поділяють на
термопластичні
та термореактивні.
Чимало полімерів після нагрівання й
подальшого охолодження не зазнають хімічних перетворень і зберігають свої
фізичні властивості. Ці речовини можна
багато разів розплавляти і заливати у форми, де вони під час охолодження
тверднуть. Полімери з такими властивостями називають термопластичними. Серед
них – поліетилен, поліпропілен. Із термопластичних полімерів за допомогою
пресування, лиття виготовляють вироби різного призначення. Існують також
полімери, які під час нагрівання втрачають здатність плавитися, а також
пластичність. Це – результат необоротних хімічних змін у речовинах,
пов’язаних з утворенням додаткових ковалентних зв’язків і формуванням
сітчастої будови. Такі полімери називають термореактивними. До
них належать фенолоформальдегідні смоли. Хімічні властивості полімерів залежать від наявності в їхніх макромолекулах кратних
зв’язків, різних функціональних груп. Багато полімерів реагує з окисниками,
концентрованими розчинами кислот і лугів. Значну хімічну інертність виявляють
поліетилен і поліпропілен. Полімери –
термічно нестійкі сполуки. Реакцію розкладу поліетилену
використовують у
лабораторії для добування етену (рис. 11.3.1).
Рис. 11.3.1. Розклад поліетилену і
знебарвлення етеном бромної води Таблиця 2 Порівняльна
характеристика розчинів
В’язкість ВМС Низькомолекулярні
рідини, істинні розчини та деякі колоїдні розчини підлягають законам Ньютона
і Пуазейля. Розчини ВМС навіть низьких концентрацій не підпорядковуються цим
законам і мають аномальну в’язкість (навіть розбавлені розчини полімерів менш
текучі, ніж чисті рідини). Розчини ВМС відрізняються від істинних та
колоїдних розчинів високою в’язкістю (внутрішнім тертям). Висока в’язкість
полімерів пов’язана із сильною взаємодією молекул ВМС з молекулами
розчинника, утворення асоціатів та легко руйнівних структур. Структуроутворення
може відбуватися під час набрякання твердих ВМС. Набрякання високополімеру
відбувається у такій послідовності: твердий
ВМС → студень → структурований розчин → молекулярний розчин. Велика в’язкість
цих розчинів залежить від ступеня спорідненості між молекулами: сили
зчеплення гідрофільних молекул білків і поліцукридів з молекулами води дуже
високі, і в’язкість їх навіть у дуже розбавлених розчинах також буде високою.
Важливе значення має форма частинок.
Якщо витягнуті частинки розташовуються упоперек потоку, то вони чинять
найбільший опір. Під час збільшення зовнішнього тиску на рідину ці частинки
орієнтуються уздовж потоку, в результаті в’язкість розчину зменшується. Зі збільшенням концентрації в’язкість розчинів ВМС
різко зростає, оскільки при цьому розчинені частинки утворюють
структури. Об’єм вільного розчинника швидко зменшується, тому що частина його
виявляється іммобілізованою в петлях структур. Під час збільшення зовнішнього
тиску структури руйнуються, розчинник звільняється, в’язкість зменшується. Коли вся структура
виявляється зруйнованою, розчини ВМС підпорядковуються постулату Ньютона і
закону Пуазейля. Аномальну в’язкість таких розчинів називають також
структурною. Аналогічні структурні сітки можуть утворюватися і в розчинах
деяких колоїдів, що мають анізометричні (тобто які мають неоднакову довжину і
поперечні розміри) частинки. Витягнута, паличкоподібна форма частинок
зумовлює найбільшу в’язкість. 11.4. Висолювання і коацервація Додаючи електроліт до розчину ВМС, можна викликати
відокремлення розчиненої речовини від розчинника з подальшим випаданням її в осад. Випадання в осад
високомолекулярних сполук під дією концентрованих розчинів електролітів
називається висолювання. Воно викликане тим, що йони доданих солей,
гідратуються і забирають воду в молекул ВМС. Тому
під час висолювання головну роль відіграє не валентність йонів, а їх
гідратація. Дегідратація
частинок ВМС, викликана дією електроліту, відбувається у тому випадку, коли
йони електроліту володіють достатньо високою енергією гідратації, що
перевищує енергію гідратації частинок ВМС. Йони електроліту в концентрованому
розчині гідратовані лише частково, оскільки кількість води в такому розчині
недостатня для повної гідратації йонів. Такі частково гідратовані йони здатні
забирати воду від частинок ВМС, руйнуючи їх гідратні оболонки. Дегідратовані
частинки, що не мають зв’язку з розчинником, з’єднуються під впливом сил
молекулярного тяжіння в агрегати, що випадають в осад. Це явище, що зовні
нагадує коагуляцію гідрофобних колоїдів електролітами, має свої особливості.
Тоді як коагуляція гідрофобних золів викликається невеликими концентраціями
електролітів, що виражаються сотими частками мілімоля на літр, осад ВМС
вимагає концентрацій електролітів, які в десятки і сотні разів перевищують
пороги коагуляції цих же електролітів по відношенню до гідрофобних золів. Висолююча дія
різних електролітів по відношенню до однієї і тієї ж речовини неоднакова.
Різниця у висолюючій дії сильніше виражена у аніонів, ніж у катіонів. По
висолюючій дії аніони розміщуються таким чином: сульфат, цитрат, хлорид,
нітрат, роданід; а катіони так: літій, натрій, калій, рубідій, цезій (з цих сполук найчастіше застосовують
сполуки з катіонами натрію та калію). Такі ряди
називаються ліотропними рядами. Положення йонів у ліотропних рядах
визначається ступенем їх гідратації: що сильніше гідратовані йони цього
електроліту, то сильніше виражене дегідратуюча, а разом з тим і висолювальна
дія цього елекроліту. Висолюючою дією може володіти не тільки
електроліт, але й спирт і гліцерин. Коацервація Якщо до розчину
ВМС додати електроліт у кількості, недостатній для повної дегідратації
частинок, то замість випадання розчиненої речовини в осад
відбувається розділення розчину на дві рідкі фази. Розділення розчину
високомолекулярної сполуки на дві фази, одна з яких містить велику частину
розчиненої речовини, називається коацервацією. Нова
фаза, збагачена розчиненою речовиною, називається коацерватом.
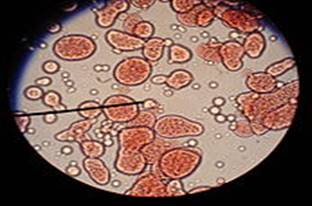
Рис. 11.4.1. Коацервати Коацервація відрізняється від
висолювання тим, що дисперсна фаза не відокремлюється від розчинника у
вигляді твердого пластівцеподібного осаду, а збирається спочатку в невидимі
неозброєним оком жирні краплі, що поступово змішуються в краплі більшого
розміру, а потім відбувається розшарування на 2-а шари: 1-й шар –
концентрований шар полімеру ВМС і розчинника; 2-й шар –
розведений розчин того ж полімеру.
Рис.11.4.2. Коацервація Ззовні це відбувається так: спочатку в
розчині з’являються дуже дрібні крапельки, видимі тільки під мікроскопом; поступово
збільшуючись, ці крапельки зливаються в суцільний шар рідини. Розчинена
речовина, яка до виділення нової фази була рівномірно розподілена по всьому
об’єму розчину, переходить майже повністю до складу краплин; у зовнішній
рідині розчиненої речовини залишається значно менше, ніж у складі крапель. Частинки ВМС, що
входять до складу коацерватних краплин, відокремлені
одна від одної тонкими гідратними оболонками. На користь цього припущення
свідчить оборотність процесу коацервації. З одного боку, за зменшення
концентрації речовини, яка викликала коацервацію, а також за зміни умов (рН
середовища або температури) коацерватні краплі зникають і система переходить
в однофазну, з іншого – зміна умов у бік посилення дегідратації частинок
викликає руйнування коацерватних краплин і випадіння розчиненої речовини в осад. Коацервація
викликається дією на розчини ВМС не тільки електролітів, але й таких
дегідратуючих речовин, як спирт в суміші з невеликою кількістю електроліту.
Як правило, коацервація відбувається за змішування розчинів двох ВМС,
частинки яких несуть електричні заряди протилежного знаку. Високомолекулярні електроліти здатні в розчинах дисоціювати з утворенням йонів. Залежно від
природи йонів ВМС поділяють:
До останніх відносяться білки. Білки – поліпептиди, які складаються із фрагментів молекул α-амінокислот і виконують особливі функції в живих
організмах.
ЦІКАВО ЗНАТИ Білки містяться
також у безклітинних організмах – вірусах. В організмах
тварин і людини білки є складовими м’язової, сполучної, покривної тканин,
волосся, нігтів. Серед найважливіших білків – гемоглобін, міоглобін (обидва
містяться в крові), інсулін (у підшлунковій залозі), кератин (у волоссі),
колаген (у шкірі, кістках), імуноглобуліни, інтерферони. Людина отримує
білки з їжею, молоком, тварини – з кормами. За дії ферментів вони
розщеплюються на амінокислоти, з яких синтезуються інші білки, властиві
певному організму. У рослинах білки утворюються з неорганічних речовин у
результаті фотосинтезу:
Склад
білків. Розрізняють прості й складні білки. До простих білків зараховують ті, молекули яких
складаються лише із залишків молекул амінокислот.
Назвіть елементи, атоми
яких містяться в молекулах простих білків. Молекули складних
білків містять ще й залишки молекул вуглеводів, ортофосфатної кислоти, деяких
інших сполук. Будова молекул. Білки за своєю будовою не мають аналогів серед інших
органічних сполук. Молекули цих речовин складаються із фрагментів молекул α-амінокислот, сполучених пептидними групами. Білки також
характеризуються ізоелектричною точкою (pI) – кислотністю середовища pH, за якого молекула певного білка не несе електричного
заряду (стає електронейтральною). Визначення ізоелектричної
точки білків ґрунтується на здатності білків під дією осаджувачів, що
викликають їх дегідратацію білків, при значенні рН середовища, що
відповідає їх ізоелектричній точці, легко осаджуватися.
Структура білків. Первинна структура білка – це поліпептидний ланцюг із чіткою послідовністю амінокислотних
залишків:
(R – вуглеводневі та інші залишки). Ланцюг може набувати певної просторової
форми (здебільшого – спіралі) завдяки утворенню водневого зв’язку між атомом
Оксигену СО-групи одного витка спіралі й атомом Гідрогену NH-групи
сусіднього витка. Таку структуру білка називають вторинною (рис.
11.4.3).
Рис. 11.4.3. Вторинна структура білка Третинна структура
формується під час згортання спіралі поліпептидного ланцюга у клубок
(глобулу) внаслідок виникнення зв'язків -S-S-, -СОО- ...+NH3- між
фрагментами молекул. Четвертинна структура білка є системою складної форми; у ній об’єднано кілька глобул. Це – єдиний
комплекс, який виконує певну функцію в живому організмі. Між фрагментами
глобул виникають нові водневі та інші зв’язки. Таку структуру має гемоглобін;
його молекула складається із чотирьох глобул. Властивості білків. Під час нагрівання білків або їх колоїдних розчинів,
додавання до них розчинів кислот, лугів, солей Купруму(ІІ), Плюмбуму(ІІ) або
деяких інших металічних елементів, органічних розчинників (наприклад,
етанолу), а також за дії ультрафіолетових променів, радіації, ультразвуку
відбувається осадження білків. Це явище називають денатурацією (термін
походить від грецького слова denaturatus – позбавлений природних властивостей) (рис. 11.4.4).
Воно зумовлене руйнуванням просторової структури білка, внаслідок чого вони
втрачають здатність виконувати свої біологічні функції. Осадження білків
спостерігаємо й під час скисання молока, коли утворюється молочна кислота.
Рис. 11.4.4. Денатурація білка У разі отруєнні
людини солями деяких металічних елементів рекомендують випити молока.
Токсичні катіони осаджуватимуться разом із відповідними білками. За наявності
кислот, лугів або ферментів білки зазнають гідролізу. Кінцеві продукти такого
перетворення – амінокислоти, залишки молекул яких містились у складі молекул
білка. Гідроліз відбувається в кілька стадій: білок →поліпептиди → дипептиди → амінокислоти. Біуретова реакція Під час взаємодії білків
із розчином солі Купруму(ІІ) в лужному середовищі виникає фіалкове
забарвлення. Це – біуретова реакція, яка є якісною на пептидні групи в
молекулах органічних сполук (рис. 11.4.5). За допомогою
біуретової реакції можна виявити білок у сироватці, молоці, колоїдних
розчинах речовин, які є в гороху, квасолі.
Рис. 11.4.5. Результат біуретової реакції Якщо білки або їхні розчини нагрівати з
концентрованою нітратною кислотою, то наявні в білках фрагменти молекул
ароматичних амінокислот взаємодіють із цією кислотою з утворенням
нітрогеновмісних сполук жовтого кольору (ксантопротеїнова реакція, рис.
11.4.6). Це саме
відбувається під час потрапляння нітратної кислоти на шкіру (утворюється
жовта пляма, яка не змивається водою).
Рис. 11.4.6. Результат ксантопротеїнової
реакції Практичне значення. Білки є невід’ємним складником нашого харчування, а
також раціону тварин. Добова потреба дорослої людини в білках становить у
середньому 100 – 110 г. Білкові препарати використовують для лікування і
профілактики деяких захворювань. У тваринництві й птахівництві для збільшення
харчової цінності кормів їх збагачують штучними білками, які виробляють за
допомогою мікробіологічного синтезу. Із давніх часів
люди використовують різноманітні речовини і матеріали, що мають білкову
основу, – вовну, шкіру, шовк, хутра, клеї та ін. Сучасні пральні порошки
містять ферменти, які сприяють розкладу білкових забруднень на тканинах.
ЦІКАВО ЗНАТИ Більше ніж 10 % від маси всіх побутових
відходів припадає на синтетичні полімери і пластмаси. Полімери – основа пластмас. Розглянемо найважливіші полімери, які входять до
складу пластмас. Поліетилен (-СН2-СН2-)n – безбарвний прозорий або білий напівпрозорий матеріал,
що зовні нагадує парафін (рис. 1). Механічні та фізичні властивості
поліетилену залежать від умов здійснення реакції полімеризації.
Рис. 1. Поліетилен: а) гранули поліетилену; б) тривимірна
модель молекули Розрізняють
поліетилен високого й низького тиску. Полімер другого виду має трохи більшу
густину.
Рис. 2. Код переробки поліетилену: а) високої щільності; б) низької
щільності Поліетилен
використовується для виробництва матеріалів і виробів для пакування – плівки
і пластикових пакетів з неї, ємностей (пляшок, каністр тощо). Також
використовується для виробництва труб, як ізолюючий матеріал в
електротехнічній та радіоелектронній промиловості, при виробницті кабелів,
матеріалів для гідроізоляції (рис. 3).
Рис. 3. Вироби з поліетилену Політетрафторетилен, або тефлон, схожий на поліетилен. Він має високу хімічну стійкість, не
руйнується навіть концентрованими кислотами, не розчиняється й не набрякає в
жодному розчиннику. На відміну від поліетилену тефлон – негорючий полімер; він
витримує досить високу температуру.
Поліпропілен нагадує поліетилен не лише зовні, а й за більшістю властивостей. Поліпропілен,
як і поліетилен, добувають, здійснюючи реакцію полімеризації.
Із поліпропілену
виготовляють відра, посуд для гарячих страв, одноразові шприци, контейнери
для заморожування продуктів. Цей полімер використовують для виробництва
волокон, труб, пакувальної плівки, тари, деталей технічної апаратури,
предметів побуту, іграшок, одноразового посуду, а також як ізоляційний
матеріал (рис. 4). Вироби з поліпропілену мають підвищену
твердість, стійкі до тертя.
Рис. 4. Вироби з поліпропілену Полівінілхлорид
– тверда речовина, стійка до розчинів лугів, кислот, більшості органічних
розчинників. Під час нагрівання
вище 110 °С сполука розкладається з виділенням хлороводню.
Полівінілхлорид є
термопластичним полімером. Це найотруйніший та небезпечний для здоров’я вид
пластмас. Його використовують для виробництва штучної шкіри, лінолеуму, труб,
віконних профілів, плівки для натяжних стель, ізоляційних проводів та
кабелів. Із полівінілхлориду виготовляють чоботи (рис. 5), захисні
рукавички.
Рис. 5. Вироби з полівінілхлориду Полістирол –
аморфний термопластичний полімер лінійної будови. Полістирол отримують в результаті полімеризації
стиролу, який є канцерогеном. Полістиролу можна надавати будь-якої форми і
кольору; він добре склеюється та обробляється. Недоліки цього
полімеру – невисокі міцність і термостійкість.
Вироби з полістиролу і пінополістиролу
широко використовують у побутовій техніці, електроніці, будівництві,
медицині. Із цього полімеру виготовляють звуко- і теплоізоляційні,
облицювальні та декоративні плити, деталі для медичних приладів і систем
переливання крові, тару для харчових продуктів, дитячі іграшки, рятувальні
круги, буйки, захисні шоломи, одноразовий посуд тощо (рис. 6).
Рис. 6. Вироби з полістиролу
Питання для
самоконтролю 3. Як визначити молекулярну масу ВМС? 4. Класифікація
високомолекулярних сполук. 5. Охарактеризуйте реакції
полімеризації та поліконденсації. 6. Як відбувається розчинення полімерів? Види набухання. 7. Що таке ступінь набухання? Як він визначається? 8. Які властивості мають розчини полімерів? 10. Чим подібні і чим відрізняються розчини ВМС і колоїдні розчини? 11. У чому суть понять «висолювання», «коацервація»?
Формулу поліпропілену можна записати так: H-[CH2-CH(CH3)]n-H. Визначте молярну масу поліпропілену, якщо кожна молекула містить по 150
структурних ланок. - Формулу полістиролу можна записати так: H-[CH2-CH(C6H5)]n-H. Визначте кількість структурних ланок у його молекулах, якщо його
молярна маса дорівнює 12 482 г/моль. - Формулу капрону, що є продуктом поліконденсації
певної амінокислоти, можна записати так: H-[NH-(CH2)x-CO]n-OH. Визначте число атомів Карбону в одній
молекулі цієї амінокислоти, якщо молярна маса капрону дорівнює 6368 г/моль, а
кожна його молекула містить по 50 структурних ланок.
Загадка В середині 19
століття популярною була гра в більярд. Більярдні кулі виготовляли із
слонової кістки, що робило гру дорогим задоволенням. У 1863 році два
американських фабриканти встановлюють премію 10 млн доларів за винайдення речовини,
яка могла б замінити слонову кістку у виробництві більярдних куль. Що це за речовина?
Загадка Цей предмет добре знайомий
із повсякденного життя. Виявилося, що він є однією із причин вимирання
велетенських черепах, основною їжею яких є медузи. З’ясувалося що черепахи
помилково вважають ці предмети медузами і ковтають їх. Так під час розтину
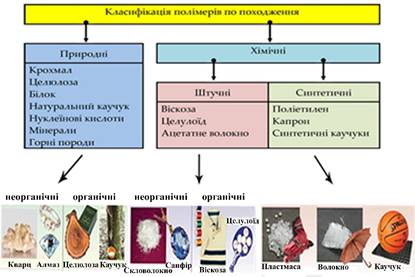
однієї із загиблих істот в її шлунку знайшли аж 15 таких виробів. Що це за предмет? Використовуючи полімери з хмари слів класифікуйте їх на природні, штучні
та синтетичні.
|
||||||||||||||||||||||||||||||||||||||||||||||||||