|
|
ФІЗИЧНА І КОЛОЇДНА ХІМІЯ Електронний посібник |
||||
|
|
КОЛОЇДНІ ПОВЕРХНЕВО-АКТИВНІ
РЕЧОВИНИ |
||||
|
10.1. Властивості розчинів колоїдних ПАР. 10.2. Утворення міцел колоїдних ПАР і
застосування їх розчинів. 10.3. Миюча дія колоїдних ПАР. 10.1. Властивості розчинів колоїдних
ПАР Колоїдні поверхнево – активні
речовини (далі – ПАР) – це речовини, які не тільки знижують
поверхневий натяг на границі поділу фаз, але за певних
концентрацій здатні до мимовільного міцелоутворення, тобто утворення нової фази. Відмінність
колоїдних ПАР від звичайних полягає тільки в довжині вуглеводневого радикала.
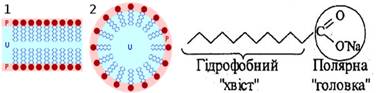
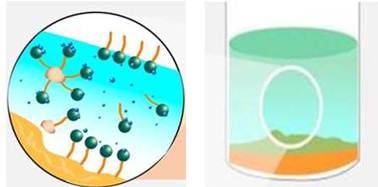
Рис. 10.1.1. Будова колоїдних ПАР Властивості ПАР зумовлені їх дифільною природою – наявністю гідрофобного вуглеводневого
радикалу і полярної гідрофільної групи. Подвійність природи ПАР сприяє
самодовільному накопиченню їх на поверхні розділу фаз, а певна орієнтація
молекули, де кожна частина обернена до навколишнього середовища тією з
частинок, до якої має найбільшу спорідненість, сприяє зниженню поверхневого
натягу.
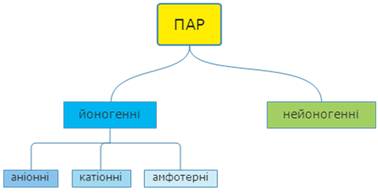
За здатністю до дисоціації на йони, ПАР поділяють на йоногенні (ті, що дисоціюють на йони) і нейоногенні (не
здатні до дисоціації). У свою чергу,
йоногенні ПАР залежно від того, який із йонів (аніон
чи катіон) має поверхневу
активність, поділяють на катіонні, аніонні та амфотерні.
Аніонні ПАР дисоціюють у воді з утворенням більшого
поверхнево-активного аніона. До них належить, наприклад, мило (солі жирних кислот RСООМе), алкілсульфати (солі
естерів вищих спиртів і сульфокислот R0S03Ме), алкіл сульфонати (солі високомолекулярних
сульфокислот RSО3 Ме). Вуглеводневий радикал R таких ПАР містить від 10 до 20 атомів Карбону, бо за малої довжини, радикали мають
низьку поверхневу активність. Типовим прикладом аніонактивної ПАР є натрій стеарат, який у воді дисоціює таким чином: С17Н35СОONa=С17Н35СОО- + Nа+. Катіонні ПАР – дисоціюють у воді з утворенням поверхнево-активного катіону.
Вони токсичні і, зазвичай, використовуються
як бактерицидні та дезінфікувальні
речовини. До них відносять солі амінів [RNH3]С1, чверткових
амонієвих основ [R(CH3)3N]С1, алкіл піридинових основ [RNС6Н5]С1. Амфотерні ПАР мають дві функціональні групи: кислотного і
основного характеру. Залежно від
рН-середовища можуть проявляти аніонактивні властивості (в лужному середовищі) або катіонактивні (в кислотному середовищі).
Наприклад, алкіл амінокислоти [RNН2СООН]. Нейоногенні ПАР – не здатні до
дисоціації. Прикладом таких ПАР є продукти взаємодії декількох молекул
етиленоксиду з вищими спиртами, кислотами або фенолами, з загальною формулою [R(ОСН2СН2)mОН]
Зростання ступеню токсичності
поверхнево-активних речовин
Рис. 10.1.2. Вплив ПАР на організм
людини Для розчинів
ПАР, що мають довгий ланцюг, існує своєрідна зміна фізико-хімічних
властивостей залежно від концентрації, що відображається в появі зламів на
кривих. Наприклад, якщо поверхневий натяг розчину
низькомолекулярної ПАР плавно зменшується зі збільшенням концентрації, то для
ПАР з більшим вуглеводневим радикалом поверхневий натяг спочатку
зменшується, але після досягнення певної концентрації, стає постійним. Еквівалентна електропровідність розчинів йоногенних ПАР зі збільшенням концентрації спочатку різко
знижується, а потім залишається практично сталою У розчинів ПАР
за певної концентрації змінюється розсіювання світла.
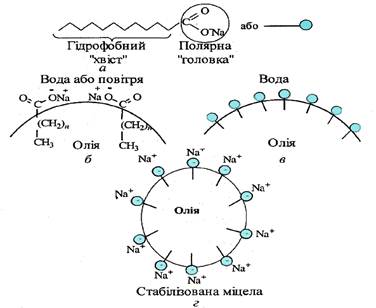
Молекули колоїдних іонних ПАР справжні
(істинні) розчини у воді не утворюють, оскільки мають значний гідрофобний
вуглеводневий фрагмент («хвіст») – позначений на схемі а, але їхні
полярні гідрофільні групи
(«голови») на зразок карбоксилатної або сульфатної у воді розчиняються (б,в).
Внаслідок цього формуються відповідні агрегати їхніх молекул у вигляді міцел,
в яких полярні аніони «голови» (наприклад, карбоксилатні групи) розчинені у воді, а гідрофобні «хвости» розчинені в олії (г)
або агреговані з гідрофобними «хвостами» інших молекул. 10.2. Утворення міцел колоїдних ПАР і
застосування їх розчинів Міцелярний розчин
ПАР – це система термодинамічно
стійка, рівноважна і оборотна. Міцели ПАР, на відміну
від міцел ліофобних золів, термодинамічно стабільні та не змінюються, доки під дією зовнішніх факторів не зсунеться
рівновага в системі.
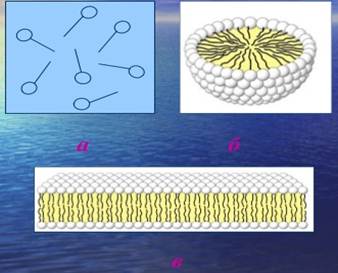
Рис.10.2.1. Будова міцелколоїдних
ПАР: а) розбавлений розчин, який містить
окремі молекули ПАР; б) концентрованіший
розчин зі сферичними міцелами; в) концентрований розчин, що містить
пластинчасті міцели Причини міцелоутворення Термодинамічною
рушійною силою міцелоутворення
є гідрофобні взаємодії: вуглеводнева частина дифільної молекули виштовхується із водного
середовища, щоб уникнути контакту ланцюга з водою. Як результат утворюються
міцели, внутрішня частина яких складається із рідкого вуглеводню (з'єднаних,
щільно упакованих вуглеводневих ланцюгів), а зовнішня, звернена до води, – із
полярних груп. Видалення з води вуглеводневих ланцюгів розкладає структуру
води, внаслідок цього ентропія системи збільшується (∆S >
0), а енергія Гіббса
відповідно зменшується (∆G=∆H
– T∆S < 0). Отже, міцелоутворення — самодовільний процес. Механізм
міцелоутворення можна пояснити таким чином: за збільшення концентрації зростає
хімічний потенціал ПАР, тобто збільшується енергія системи, за малих
концентрацій молекули ПАР виходять у поверхневий шар, зменшуючи тим самим
енергію. Коли поверхневий шар стає насиченим, система виводить гідрофобні ланцюги
з води у нову фазу – міцелу,
віддокрмлюючи її від води гідрофільною оболонкою з полярних груп. Таким
чином, у розчині колоїдного ПАР існує термодинамічна рівновага між молекулами
або іонами ПАР і міцелами, до деякої міри аналогічна утворенню нової конденсованої
фази. Числа агрегації міцел (число молекул
у міцелі) не такі великі
(50 – 100 для більшості міцел), щоб розглядати їх як фази, але
достатні для того, щоб вважати
сукупність міцел «псевдофазою». Тому для термодинамічної інтерпретації
властивостей цих систем з успіхом використовують гомогенне
трактування (рівновага молекули ↔ асоціат,
яка визначається законом діяння
мас) і гетерогенне, засноване на фазовій рівновазі,
яка визначається рівністю хімічних потенціалів у двох співіснуючих фазах. Утворення міцел відбувається за певної концентрації – так званій
критичній концентрації міцелоутворення (далі – ККМ). Так
називають мінімальну концентрацію розчиненої речовини (моль/дм3),
за якої можна експериментально виявити у розчині колоїдно – дисперсну фазу. Саме на цій різкій зміні
фізико-хімічних властивостей розчинів ПАР основані методи визначення ККМ. Наприклад,
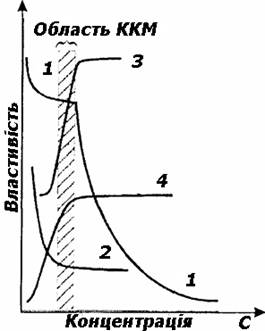
крива залежності молярної електричної провідності А від концентрації
(рис. 10.2.2) має злам, який відповідає різкому зменшенню λ в області ККМ.
Рис. 10.2.2. Крива залежності молярної електричної провідності
від концентрації На кривій залежності поверхневого
натягу від концентрації в цій області спостерігається вихід на горизонтальну
ділянку (2). Так само різко змінюються й інші властивості, зокрема, мийна
здатність (3), осмотичний тиск (4), світлорозсіювання, показник заломлення та
ін. Будова міцел
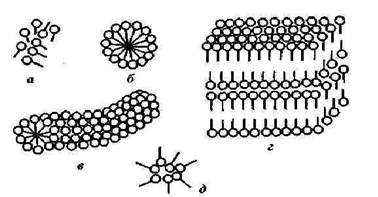
Рис.10.2.3. Стадії міцелоутворення в розчинах ПАР:
а – молекули ПАР, б – сферична міцела, в – циліндрична міцела,
г – пластинчаста міцела, д – зворотна міцела За концентрацій, відповідних ККМ, у
розчинах ПАР утворюються сферичні міцели, або міцели Гартлі (рис.10.2.3.б). У водних розчинах сферична міцела –
це компактне утворення, яке складається із рідкого вуглеводневого ядра,
покритого шаром полярних груп. Внутрішню
частину таких міцел можна розглядати як мікрокраплину рідкого вуглеводню. У неводних розчинах виникають зворотні міцели,в яких
молекули поверхнево –
активних речовин повернуті своїми гідрофобними частинами до розчинника (рис.10.2.3.д). За підвищення концентрації розчину ПАР
розмір міцел збільшується, вуглеводневі ланцюги розташовуються паралельно
один одному, і в результаті утворюються пластинчасті
міцели Мак-Бена (рис. 10.2.3.г). У
водних розчинах ці міцели складаються з двох шарів молекул ПАР, звернених
один до одного вуглеводневими ланцюгами, а до розчинника – полярними групами.
Пластинчасті міцели розташовуються паралельно, їх достатньо концентровані
розчини можуть переходити у гель, структура якого складається зі стрічок і
плівок. Міцели характеризуються кількістю агрегації (кількість молекул у
міцелі) та міцелярною масою (сума молекулярних мас). Однією із
характерних властивостей колоїдних ПАР, пов'язаних
з їх міцелярною будовою, є солюбілізація. Солюбілізацією
називають процес самодовільного розчинення у міцелярних
системах нерозчинних у даному
розчиннику сполук.
Наприклад, у достатньо концентрованих водних розчинах колоїдних ПАР
розчиняються органічні речовини, практично нерозчинні у воді:
аліфатичні і ароматичні вуглеводні, маслорозчинні барвники і т.д.
Рис. 10.2.4. Схема міцелярної солюбілізації жирової речовини у воді
з використанням диспергатора Солюбілізацію називають також колоїдним
розчиненням. Колоїдне розчинення води у неводних розчинах колоїдних ПАР – це зворотна солюбілізація.
Рис. 10.2.5. Зворотна
солюбілізація В результаті солюбілізації утворюється прозорий термодинамічно рівноважний розчин, який, однак, належить не до істинних, а до колоїдних
розчинів, внаслідок того, що він має колоїдний ступінь дисперсності.
Речовина, яка розчиняється у міцелярній
системі, називається солюбілізатом. Солюбілізація
полягає у проникненні солюбілізата у міцелу.
Рис. 10.2.6. Механізм
солюбілізації Можливі
різні механізми солюбілізації. За прямої солюбілізації неполярні вуглеводні розчиняються у ядрі міцели. Полярні органічні
речовини (спирти, аміни) розташовуються у міцелі так, щоб їх вуглеводнева
частина містилася усередині міцели, а полярну групу було направлено до водної
фази. За солюбілізації
у пластинчастих міцелах
речовина входить усередину міцели, розташовується між вуглеводневими кінцями
молекул ПАР і тим самим розтягує шари молекулярних ланцюгів. Експериментально встановлено, що солюбілізація вуглеводнів зменшується
зі зростанням довжини ланцюга, а солюбілізуюча здатність ПАР у
межах одного гомологічного ряду зростає зі збільшенням кількості атомів
вуглецю. Неіоногенні
сполуки мають меншу солюбілізуючу здатність порівняно з іоногенними. Виключно велику солюбілізуючу активність мають біологічно активні колоїдні електроліти – холат і дезоксихолат натрію, які розчиняють
жири, що надходять до організму. Значення
міцелярних розчинів ПАР для біологічних систем та на практиці визначається, головним чином, здатністю міцел солюбілізувати різні речовини. Крім того, в наші часи міцели розглядають як
моделі біологічних мембран, виходячи зі схожості деяких властивостей структур
мембран і міцел. Міцели солей жовчних кислот відіграють значну роль у транспортуванні і адсорбції ліпідів, вони є солюбілізаторами
холестерину і забезпечують виведення
шлаків з організму. Явище
солюбілізації покладене в
основу емульгування жирів
жовчю в процесі їх засвоєння
організмом. Оборотна солюбілізація зустрічається у виробництві маргарину. Приклади практичного застосування міцел ПАР
різноманітні. У харчовій промисловості
колоїдні ПАР застосовують для збільшення пластичності шоколадних мас, тіста,
ковбасного фаршу, їх також використовують для підвищення пластичності
косметичних препаратів. Колоїдні ПАР
використовують для прання і обробки
тканин, як диспергатори твердих
тіл; як емульгатори у виробництві косметичних і фармацевтичних препаратів; як флотоагенти під час збагачення руди. Особливе значення мають естери сахарози і одноосновних вищих карбонових
кислот. Вони не подразнюють слизової оболонки, не викликають печії очей, тому
їх широко використовують у виготовленні шампунів, туалетного мила, зубних
паст. Міцелярні
системи мають сильні мийні властивості. При сухому хімічному
чищенні відбувається солюбілізація оборотними міцелами полярних забруднень з тканин: прямими міцелами солюбілізуються жирні вуглеводневі забруднення – в цьому суть мийної дії ПАР. Найбільш
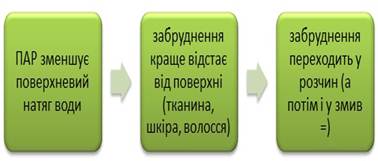
важлива властивість колоїдних ПАР – це їх мийна дія. Як правило, частинки забруднених речовин є гідрофобними, тобто не змочуються
водою. Тому, навіть за високої температури, мийна дія чистої води дуже мала. Позбавлення від
забруднень значно полегшується під час застосування розчинів колоїдних ПАР За контакті
розчину ПАР – мила або іншого мийного засобу з забрудненою поверхнею –
молекули ПАР адсорбуються на ній. Вони поступово проникають між частинками
бруду і поверхнею, що очищується, внаслідок чого частинки бруду відриваються
від поверхні.
Рис.10.3.1.
Миюча дія колоїдних ПАР Окремі частинки
бруду утворюють у рідкій фазі емульсію або суспензію, що стабілізується
молекулами ПАР.
Рис. 10.2.2. Міцелоутворення
в колоїдних ПАР При цьому
концентрація молекул ПАР у розчині не змінюється, бо кількість адсорбованих
молекул компенсується в розчині за рахунок розпаду міцел. Крім того, мийна
дія посилюється ще й тим, що колоїдні ПАР є добрими піноутворювачами і частинки
бруду разом з піною легко змиваються водою. Таким чином, мийна
дія – це складний комплекс колоїдно-хімічних
процесів – адсорбції, емульгування, стабілізації суспензії та піноутворення. Слід відмітити,
що важливою умовою широкого застосування синтетичних ПАР, як мийних засобів,
у побуті та промисловості є можливість їх біологічного розкладу. Ця обставина
має важливе значення з екологічної точки зору.
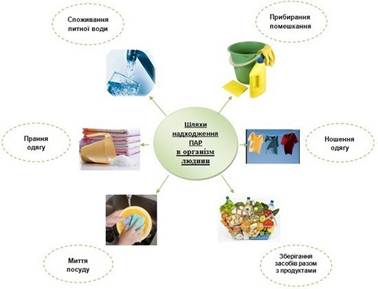
ЦІКАВО ЗНАТИ Яким чином ПАР потрапляють у наш
організм можна побачити з такої схеми:
Рис. 1. Шляхи надходження поверхнево-активних речовин в організм людини Важливими показниками рівнів
безпечності ПАР в побуті виявлено здатність до поглинання тканинами, змивання з посуду
та викликання алергічних реакцій. Так, аніонні та катіонні
ПАР, у порівнянні з неіоногенними,
більше поглинаються тканинами, але додавання неіоногенних ПАР у засіб зменшує
поглинання аніонних ПАР тканинами в
2 – 3 рази. Порівняльне вивчення змивання
ПАР показало, що основна їх маса видаляється зі стінок посуду після першого
ополіскування, але аніонні й катіонні ПАР змиваються гірше, ніж неіоногенні ПАР. Що стосується здатності до викликання алергічних реакцій,
то виявлена залежність виникнення можливих алергічних реакцій від збільшення
відсотку концентрацій ПАР.
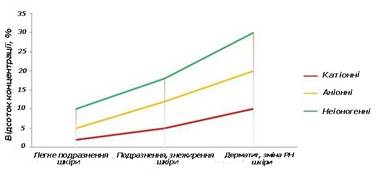
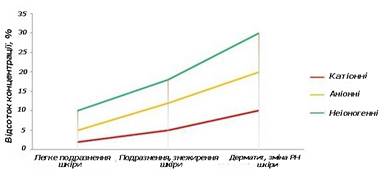
Рис. 2. Залежність виникнення можливих алергічних реакцій від збільшення відсотку концентрацій ПАР З графічного зображення можна побачити,
що порогові відсотки концентрацій, які здатні викликати алергічні реакції,
складають для: катіонних ПАР – 2 %; аніонних ПАР – 5 %; неіоногенних
ПАР – понад 10
%. Широке використання засобів на основі
ПАР призводить до постійної дії ПАР на організм людини, що може призвести до
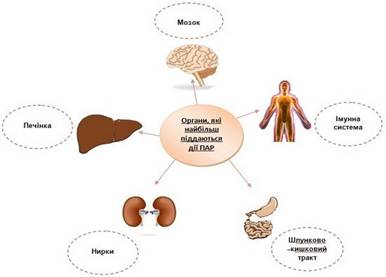
порушення обмінних процесів в організмі. Органи,
які найбільше піддаються дії ПАР
Рис. 3. Органи, які найбільше піддаються дії ПАР Цікаві факти: 1) мило на основі ПАР існує вже майже
4000 років і залишається найпоширенішим у світі ПАР; 2) світове виробництво ПАР становить 2
– 3 кг на душу населення в рік; 3) ПАР знижують надходження кисню з
повітря у воду (на 15 – 20 %).
Питання
для самоконтролю 1. На які групи і за якими ознаками поділяють поверхнево-активні
речовини? 2. Як залежить поверхневий натяг розчинів колоїдних ПАР від концентрації? 3. Що називається критичною концентрацією міцелоутворення? 4. Як визначити ККМ за кривою залежності молярної електропровідності
розчину ПАР від концентрації? 5. Яку будову мають міцели колоїдних ПАР у водних розчинах невеликих
концентрацій? 7. Що таке зворотна солюбілізація? 8. Які процеси покладені в основу мийної дії?
Поверхнево-активні речовини (ПАР) та їх роль у приготуванні їжі: емульгування, піноутворення. Використовуючи хмару слів опишіть як впливають
ПАР на довкілля, зокрема на повітря, воду, живі організми та землю.
|
|||||