|
|
ЕПІЗООТОЛОГІЯ З МІКРОБІОЛОГІЄЮ I частина Електронний
посібник |
||||||||||
|
|
|||||||||||
|
6.1. Мікробіологічна діагностика
хвороб 6.3. Правила роботи в мікробіологічній лабораторії 6.3.1. Правила роботи з імерсійною системою
мікроскопа 6.3.2. Темнопольна мікроскопія 6.3.3. Фазово-контрастна мікроскопія 6.3.4. Аноптральна мікроскопія 6.3.5. Інтерференційна мікроскопія 6.3.6. Люмінесцентна мікроскопія 6.4. Мікроскопічне дослідження 6.4.1. Виготовлення препаратів-мазків з твердого
матеріалу 6.4.2. Виготовлення мазків із рідкого матеріалу 6.4.3. Виготовлення мазків із харкотиння або гною 6.4.4. Виготовлення мазків із крові 6.4.6. Метод роздавленої краплі 6.4.8. Висушування і фіксування препаратів мазків 6.5. Забарвлення препаратів мазків 6.5.1. Прості способи забарвлення бактерій 6.5.2. Складні методи забарвлення бактерій 6.5.2.1. Забарвлення за Грамом 6.5.2.2. Забарвлення кислотостійких бактерій 6.5.2.5. Забарвлення джгутиків 6.1. Мікробіологічна діагностика хвороб Під час проведення
мікробіологічної діагностики інфекційних хвороб з
метою їх раннього і остаточного розпізнавання у сучасних лабораторіях
використовують різні методи дослідження. Мікроскопічний (бактеріоскопічний,
вірусоскопічний, протозооскопічний)
– виготовлення
й забарвлення мазків із досліджуваного матеріалу від хворого і вивчення його
під мікроскопом. Він дає змогу швидко виявити характерні морфологічні
особливості збудника. Бактеріологічний метод зводиться до посіву матеріалу від
хворого на відповідні живильні середовища, виділення чистої культури збудника
й визначення його виду, а, отже, і встановлення остаточного діагнозу
захворювання. Серологічний метод базується на виявленні специфічних
антитіл у сироватці крові хворих до певного збудника. Для цього
використовують різні імунологічні (серологічні) реакції: аглютинації,
преципітації, зв'язування комплементу тощо. Біологічний (експериментальний) метод
полягає у зараженні чутливих лабораторних тварин виділеною чистою культурою
збудника, досліджуваним матеріалом або введенні бактерійних токсинів і
відтворенні типової картини захворювання. Для цього використовують білих мишей, щурів, гвінейських свинок, кроликів. Цим методом
визначають і вірулентність мікробів. З діагностичною метою біологічну пробу
часто використовують при чумі, сибірці, туляремії, правці, ботулізмі
анаеробній газовій інфекції, кліщовому енцефаліті тощо. Алергічний метод дає змогу встановити діагноз за
допомогою внутрішньо-шкірних алергічних проб, які виявляють стан підвищеної
чутливості до збудника чи продуктів його життєдіяльності (алергенів). Цим
методом широко користуються під час діагностики туберкульозу, бруцельозу,
туляремії та багатьох інших хвороб. Для глибокого
розуміння, засвоєння і логічного застосування бактеріоскопічного
методу діагностики важливе значення має фундаментальне вивчення морфології й
ультраструктури мікробів, методів їх простого й складного забарвлення,
виявлення окремих структур і включень у бактерійній клітині. З цією метою в
лабораторії широко використовують сучасні мікроскопи –
високоінформативні оптичні прилади. Мікроорганізми
(особливо віруси) дуже малі за своїми розмірами, отже, побачити їх
неозброєним оком неможливо. У той же час морфологія мікробів, їх розміри,
форма, взаємне розташування клітин, наявність чи відсутність джгутиків,
внутрішня ультраструктура є дуже важливою їх характеристикою і часто служить
основою класифікації. Зважаючи на це,
одним з найважливіших методів дослідження будови мікроорганізмів є
мікроскопія. В основі сучасних мікроскопічних методів дослідження лежить
світлова мікроскопія з численними її різновидами, такими як темнопольна, фазовоконтрастна, аноптральна, поляризаційна, інтерференційна,
люмінесцентна та ін. Під час вивчення анатомії й ультраструктури вірусів
використовують електронну мікроскопію.
Мікроскоп складається з механічної, оптичної й
освітлювальної частин. До механічної
входять штатив, тубус, револьвер, предметний столик, макро- й мікрогвинт,
до оптичної – об'єктиви й окуляри, до освітлювальної – дзеркало й конденсор. У верхній
частині штатива є тубус, у який вставляється окуляр, а знизу він має
револьвер, в отвори якого вгвинчені 3 – 4
об’єктиви. Обертаючи револьвер, можна встановити будь-який об’єктив під отвір
тубуса. Останній підіймається і опускається за допомогою макро-
й мікрометричного гвинтів. Для грубого наведення зображення користуються макрогвинтом. Більш точно це робиться за допомогою мікрогвинта. Мікрометричний гвинт є однією з найбільш
тендітних частин мікроскопа й вимагає обережного поводження з ним. Предметний
столик має круглу або прямокутну форму. У його центрі знаходиться отвір, над
яким вміщують предметне скло з препаратом (мазком). У більш досконалих
мікроскопах є дуже зручні предметні столики, які за допомогою спеціальних
пристроїв переміщують предметне скло у двох взаємно перпендикулярних
напрямах. Найціннішою
частиною мікроскопа є об’єктиви, які складаються з кількох лінз у загальній
металевій оправі. Об’єктиви поділяються на сухі (х8, х40) та імерсійні (х90
х120). Сухими називають такі об’єктиви, між фронтальною лінзою яких і
предметним склом знаходиться повітря.
При цьому, в зв’язку з різницею показників заломлення скла й повітря,
частина світлових променів не потрапляє в око мікроскопіста. Імерсійними називають такі об’єктиви, між
фронтальною лінзою яких і досліджуваним об’єктом знаходиться кедрова,
персикова олія чи "імерсіол", коефіцієнт
заломлення світла яких такий самий, як і в скла. Під час дослідження
морфології мікроорганізмів користуються переважно імерсійними об’єктивами,
які часто називають імерсійною системою.
Окуляр
складається з двох лінз і тільки збільшує зображення, яке виходить від
об’єктива, не добавляючи до нього будь-яких деталей. Існують окуляри з такими збільшеннями: х7,
х10, х15. Ці цифри позначені на них. Освітлювальний
апарат знаходиться під предметним столиком і складається із дзеркала та
конденсора з діафрагмою. Дзеркало спрямовує пучок світла в конденсор, а через
нього в об’єктив мікроскопа. Один бік дзеркала ввігнутий, другий – плоский.
Під час мікроскопування з конденсором необхідно користуватись лише плоским
дзеркалом. Конденсор складається з системи лінз для збирання пучка променів в
одній точці (фокус), яка знаходиться в площині досліджуваного препарату. Під
час роботи з денним освітленням конденсор потрібно підіймати до рівня
предметного столика, з штучним – опускати доти, поки зображення джерела
світла не з’явиться в площині, препарату. Досліджуючи незабарвлені препарати
конденсор також опускають. Об’єм світла
відповідно до потреб дослідження регулюється діафрагмою, яка знаходиться під
конденсором. Вона може звужуватись і розширюватись подібно до зіниці ока.
Забарвлені препарати розглядають за відкритої, а незабарвлені – за звуженої
діафрагмі. Бінокулярний
мікроскоп має спеціальну насадку з двома тубусами (бінокулярна насадка). Це
створює низку переваг за мікроскопування. Досліджуваний препарат розглядають
відразу обома очима, що не викликає перевтоми органа
зору. При цьому одночасно досягається більша чіткість глибини зображення і
його пластичність. Універсальний
біологічний дослідницький мікроскоп МБД-15. За його допомогою можна проводити
широкий об’єм мікроскопічних досліджень: візуальне спостереження,
використання світлого і темного полів зору в прямому, косому та відбитому
світлі, методу фазових контрастів, люмінесцентної та інтерференційної
мікроскопії. Для мікрофотографування досліджуваних
об’єктів мікроскоп оснащений фотоапаратом з автоматичним затвором,
фотоекспонометром та імпульсною лампою. Під час
вивчення динаміки розвитку і розмноження мікроорганізмів, дії на них різних
фізичних і хімічних факторів, утворення L-форм та інших проблем виготовляють
спеціальні мікроскопи з мікроустановками для цейтраферної (переривчастої) мікрокінозйомки
особливо з використанням методу фазових контрастів. 6.3. Правила роботи в мікробіологічній лабораторії 1. До роботи
в бактеріологічній лабораторії допускаються особи, які обізнані з правилами
роботи в ній. 2. Персонал
лабораторії повинен мати індивідуальний спецодяг (халат, шапочку, взуття). У
боксі працюють у стерильних халатах, шапочках і марлевій масці. При зараженні
і розтині тварин одягають фартух, нарукавники і гумові рукавички. Особисті
речі працюючих зберігаються в спеціально пристосованому приміщенні. 3. Курити,
вживати їжу і зберігати продукти в лабораторії категорично заборонено. 4. Матеріал,
що поступає в лабораторію для дослідження, завжди вважають інфекційним, його
обов’язково записують у спеціальному журналі і маркують. 5.
Відпрацьовані культури мікробів, заразний матеріал підлягають обов’язковому
щоденному знищенню. Поверхню робочого
місця як і використані інструменти дезінфікують. 6. Переливати
рідини, які містять патогенні мікроби, необхідно над посудиною з
дезінфікуючим розчином. Під час набирання таких рідин в піпетки потрібно
користуватися гумовими балонами або грушами. 7. Коли
розбивають колби чи пробірки і заразний матеріал або жива культура потрапляє
на робочий стіл, інші меблі, одяг, руки, підлогу – негайно повідомити про це
завідувача лабораторії або лікаря-бактеріолога і за його присутності провести
дезінфекцію заражених ділянок, потім обробити руки дезрозчином
і ретельно вимити руки з милом. 8. У
лабораторії не допускаються зайві ходіння, різкі рухи, непотрібні
розмови. Виконання цих вимог
попереджає проникання сторонніх мікробів з повітря і ротової порожнини в
досліджуваний матеріал. 9. Завжди
оберігати від втрат і виносу з лабораторії заразного матеріалу, живих культур
та інфікованих тварин. Всі термостати, рефрижератори і сейфи з культурами
обов’язково пломбувати. Виконання і контроль за цими правилами покладається
на завідувача лабораторії або лікаря-бактеріолога. 10. Після
закінчення всіх робіт робочі столи дезінфікуються, проводиться вологе
прибирання лабораторії з використанням дезінфікуючих розчинів. 6.3.1. Правила роботи з імерсійною системою мікроскопа 1. Підняти
конденсор Аббе до рівня предметного столика,
повністю відкрити іріс-діафрагму. 2.
Користуючись об’єктивом 8, за допомогою плоского дзеркала встановити
максимальне освітлення поля зору. 3. На
предметний столик помістити забарвлений препарат-мазок, нанести на нього
кедрову олію і закріпити клемами. 4. Повертаючи
револьвер, встановити над препаратом імерсійний об’єктив 90; під контролем
зору опустити його до занурення в краплю кедрової олії. 5. Дивлячись
в окуляр лівим оком (не закриваючи правого), спочатку макрогвинтом
знайти контури зображення, а потім мікрогвинтом
добитись максимальної чіткості, вивчити і замалювати препарат. 6. Після
закінчення роботи підняти тубус, зняти предметне скло, обережно витерти
серветкою імерсійний об’єктив від кедрової олії, повернути його в бік,
опустити тубус. 6.3.2. Темнопольна мікроскопія
Темнопольна мікроскопія
відрізняється від звичайної імерсійної світлової способом освітлення
препарату. У звичайному мікроскопі об’єкт досліджують при світлі, яке
проходить за бокового освітлення. Для мікроскопії в темному полі
використовують замість конденсора Аббе спеціальний
параболоїд-конденсор (кардіоїд-конденсор), у якому бокова поверхня
дзеркальна, а центральна частина нижньої лінзи затемнена, в результаті чого
утворюється темне поле зору. Яскраві бокові промені, відбиваючись від
дзеркальної поверхні, фокусуються в площині об’єкта, але в очі мікроскопіста не потрапляють. В об’єктив проникають лише
ті промені, які відбиваються частинками препарату завдяки заломленню або
дифракції. Отже, на темному полі зору мікробні клітини й інші дрібні частинки
виглядають дуже яскравими. Картина нагадує миготливі зірки на темному небі. Темнопольний мікроскоп дає змогу розглядати
об’єкти розміром 0,02–0,04 мкм, тобто значно менші,
ніж під звичайним світловим мікроскопом. Мікроскопію в темному полі зору
використовують для дослідження рухливості бактерій. Але при
цьому не можна добре вивчити внутрішню структуру мікроорганізмів. Для цієї
мети запропоновані видозмінені методи оптичної мікроскопії:
фазово-контрастна, аноптральна та люмінесцентна. 6.3.3. Фазово-контрастна мікроскопія Фазово-контрастна мікроскопія – спосіб мікроскопічного дослідження
прозорих, не поглинаючих світла об’єктів, який базується на підсиленні
контрасту зображення. Він полягає в тому, що живі клітини
(бактерії), слабо поглинаючи світло, все ж таки здатні змінювати фазу
проникаючих променів. У різних ділянках клітини товщина, щільність, а, отже,
й показники заломлення світла будуть неоднакові. Ці різниці у фазах ні орган
зору, ні фотоплівка не помічають. Але їх можна зробити видимими за допомогою
спеціального фазово-контрастного пристрою. Він включає конденсор з набором
кільцевих діафрагм, які забезпечують освітлення препарату повним конусом
світла, та фазово-контрастні об’єктиви. Вони відрізняються від звичайних
об’єктивів тим, що в їх головному фокусі розташовується напівпрозора фазова
пластинка у вигляді кільця. Саме вона викликає здвиг фази світла, що
проходить через неї. Це дозволяє зробити незабарвлені препарати чітко
видимими. Під час
роботи з фазово-контрастним пристроєм клітини можуть виглядати темними
(позитивний фазовий контраст) або світлими (негативний контраст) у порівнянні
з оточуючим фоном. Цей вид мікроскопії не збільшує роздільної здатності, але
дозволяє виявити нові деталі внутрішньої структури живих бактерій, стадії їх
розвитку, зміни під впливом антибіотиків та інших хіміопрепаратів. Він має й
деякі недоліки: слабка контрастність зображень, наявність сяючих ореолів
навколо досліджуваних об’єктів. Значні переваги перед фазово-контрастним
пристроєм має аноптральний мікроскоп. 6.3.4. Аноптральна мікроскопія Аноптральна мікроскопія –
різновид фазово-контрастної, за якої використовують об’єктиви зі спеціальними
пластинками, нанесеними на одну з лінз у вигляді затемненого кільця кіптяви
або міді. Це обумовлює поглинання близько 10 % світла, яке проходить через
об’єктив і робить фон поля зору сіро-коричневим. Широкий центральний отвір в
шарові кіптяви чи міді випускає з об’єктиву основну частину дифрагованого світла, в той час як темний шар кільця
відіграє роль пастки для небажаного периферійного дифрагованого
світла. За рахунок цього в значній мірі усувається ореол навколо
досліджуваних клітин. Аноптральна мікроскопія
успішно використовується під час вивчення таких малоконтрастних
живих об’єктів як бактерії, гриби, найпростіші і навіть деякі віруси. При
цьому досягається більша контрастність, роздільна здатність,
стереоскопічність і чіткість зображення. Досліджувані мікроорганізми при
цьому набувають різних відтінків: від білого до золотаво-коричневого. 6.3.5. Інтерференційна мікроскопія Інтерференційна
мікроскопія основана приблизно на тих же принципах, що й фазовоконтрастна.
Але на відміну від останньої вона дає можливість вивчати деталі прозорих
об’єктів і проводити їх кількісний аналіз. Це досягається завдяки роздвоєнню
світлового променя: один промінь проходить через
частинку об’єкта, а другий – поза нею.
В окулярі обидва промені з’єднуються. Так
визначають товщину об’єкта, концентрацію в ньому сухої речовини, вміст води,
що дає змогу зробити побічні висновки про проникність мембран, активність
ферментів, метаболізм клітин. Інтерференційну мікроскопію
використовують у цитологічних дослідженнях, при кількісному аналізі клітинних
структур живих об’єктів, наприклад, найпростіших, культур тканин тощо. 6.3.6. Люмінесцентна мікроскопія Люмінесцентна
мікроскопія останнім часом широко використовується в мікробіологічних
дослідженнях. Цей метод дозволяє спостерігати первинну або вторинну
люмінесценцію (світіння) мікроорганізмів, клітин, тканин та окремих їх
структур. Зображення в люмінесцентному мікроскопі виникає через світіння
самого препарату, яке виникає під час освітлення його короткохвильовою
частиною спектра. Метод оснований на використанні явища флуоресценції. Так як більшість
хвороботворних мікробів не мають первинної (власної) люмінесценції, їх
спочатку обробляють слабкими розчинами спеціальних барвників (флуорохромів), які зв’язуються певними структурами живих
бактерій, не завдаючи їм шкоди. Найчастіше застосовують такі флуорохроми: акридиновий
помаранчевий, аурамін, корифосфін,
ізотіоціанат флуоресцеїну, трипафлавін
та ін. Промені
світла від сильного джерела, наприклад, ртутної лампи надмірного тиску,
пропускають через синьо-фіолетовий світлофільтр. Під дією такого опромінення
забарвлені флуорохромом бактерії починають
світитися червоним, зеленим, жовтим або іншим світлом. Так, під час
забарвлення дифтерійних паличок корифосфіном вони
набувають жовто-зеленого світіння, а під час обробки аурамін-родаміном
збудник туберкульозу світиться золотаво-помаранчевим кольором. Метод люмінесцентної мікроскопії набагато чутливіший порівняно з іншими мікроскопічними
дослідженнями та дозволяє виявити таку малу кількість збудника, яку іншими
методами не знаходять. За характером люмінесценції можна диференціювати
окремі хімічні речовини, що входять до складу мікробних клітин. Люмінесцентна
мікроскопія дає кольорове зображення, високу контрастність, можливість
досліджувати як живі, так і вбиті мікроорганізми. Люмінесцентну
мікроскопію широко застосовують для виявлення антигенів і антитіл (метод імунофлуоресценції). За її допомогою можна побачити
мікроби, які містять певні антигени. Для їх виявлення необхідно мати
специфічні люмінесцентні сироватки, які викликають флуоресценцію саме даного антигена. Цей
метод успішно використовують для експрес-діагностики багатьох бактерійних і
вірусних захворювань. Для вивчення
будови мікроорганізмів на субклітинному і молекулярному рівнях, а також для
дослідження структури і архітектоніки вірусів використовують електронний
мікроскоп. Це високовольтний вакуумний прилад, у якому збільшене зображення
отримують за допомогою потоку електронів. Він має високу роздільну здатність
і може давати збільшення від 20 тис до 5 млн разів. За принципом дії розрізняють
просвічуючі (трансмісивні), скануючі
(растрові) й комбіновані електронні мікроскопи.
Принципова
схема просвічуючого електронного мікроскопа мало
чим відрізняється від звичайного оптичного. Можливості світлового мікроскопа
обмежені не якістю лінз, а великою довжиною світлових хвиль (0,29–0,8 мкм). Мала довжина хвилі електронів (0,0002 мкм і навіть менше) дозволяє значно збільшити роздільну
здатність електронного мікроскопа. Замість світла в ньому використовують
потік електронів, джерелом яких є вольфрамова нитка, що нагрівається
електричним струмом (електронна пушка). Роль лінз оптичного мікроскопа
виконує кругове електромагнітне поле. Електронна
мікроскопія вимагає спеціальної підготовки об’єктів дослідження. Необхідна
спеціальна фіксація тканин або бактерій, їх ретельне зневоднення, заливка в
епоксидні смоли, виготовлення ультратонких зрізів.
Для підвищення чіткості зображення використовують методи позитивного й
негативного контрастування та відтінення. Методи
електронної мікроскопії призвели до великих успіхів у розвитку таких наук як цитологія, бактеріологія,
генетика і, особливо, вірусологія. Успішно розвивається імунна електронна
мікроскопія, яка дає змогу визначити родову належність вірусів, що
використовується для експрес-діагностики багатьох вірусних інфекцій. 6.4. Мікроскопічне
дослідження У
лабораторній практиці частіше проводять мікроскопію фіксованих забарвлених
мазків і рідше нативних препаратів у вигляді
надавленої і висячої крапель. Їх виготовляють на заздалегідь підготовленому і
оснащеному робочому місці. На столі повинні бути лише необхідні
матеріали, інструменти і пристрої: клінічний матеріал (кров, гній, слиз,
харкотиння, сеча, випорожнення та ін.), культури мікроорганізмів у пробірках
або чашках Петрі, бактеріологічні петлі, піпетки, пінцети, штативи, предметні
скельця, газовий пальник, ізотонічний розчин хлориду натрію, розчини
барвників, лотки з рейками для фарбування мазків, промивалка з водою,
фільтрувальний папір, банка з дезрозчином для знезараження
використаних препаратів і піпеток. Доцільно в лабораторії обладнати окремий
столик для забарвлення мазків. Препарати-мазки
виготовляють на предметних скельцях, товщина яких через оптичні властивості
конденсора Аббе не повинна перебільшувати 1–1,2 мм.
Скельця необхідно заздалегідь ретельно знежирити. Для цього упродовж доби їх витримують у
концентрованій сірчаній кислоті або кип’ятять у суміші 6 % розчину двохромового калію і сірчаної кислоти, ретельно
промивають проточною водою, переносять у банку з 96
% спиртом, де вони зберігаються до використання. Можна знежирені і витримавши
в спирті, скельця витерти насухо льняною тканиною і зберігати в герметично
закритій скляній банці. Крапля води, нанесена на холодне знежирене скло,
повинна рівномірно розтікатися, а не збиратись у дрібні крапельки. 6.4.1. Виготовлення препаратів-мазків з твердого
середовища Виготовлення
мазків з твердого середовища вимагає дотримання правил та послідовності.
Знежирене предметне скельце проводять через полум’я газового пальника і після
охолодження кладуть на робоче місце. Для виготовлення мазка матеріал чи
культуру беруть бактеріологічною петлею з платинового або хромо-нікелевого
дроту довжиною 5–6 см. Петлю закріплюють у петлетримачі.
Кінець її згинають у вигляді замкнутого кільця розміром 1х1,5 м або 2х3 мм.
Для деяких робіт потрібно мати цей інструмент у вигляді голки, коли кінець не
згинають у кільце, а залишають прямим. Бактеріологічну
петлю прожарюють у полум’ї, тримаючи її як олівець вертикально у правій руці.
Два – три рази проводять через полум’я і третю частину петлетримача.
Не випускаючи петлі, лівою рукою беруть пробірку з 0,9 % стерильним розчином
хлориду натрію, а 4-им і 5-им пальцями правої руки зажимають
ватно-марлеву пробку, витягують її, і вінця
пробірки проносять через полум’я пальника. Тримають на віддалі 15–20 см від
полум’я, не випускаючи пробки. Петлю вводять у пробірку і охолоджують її,
торкаючись стінки. Занурюючи петлю в рідину, набирають краплю фізрозчину. Виймають петлю, проводять пробку і відкритий
край пробірки через полум’я, після чого її закривають і ставлять у штатив. На
центр скельця бактеріологічною петлею наносять взяту краплю ізотонічного
розчину. Петлю знову
стерилізують, у ліву руку беруть пробірку з досліджуваним матеріалом чи
культурою мікроорганізмів. Відкривають пробірку із дотриманням усіх правил,
охолоджують петлю і набирають нею невелику кількість матеріалу чи культури.
Петлю виймають, а пробірку закривають і ставлять у штатив. Взятий матеріал
(або культуру) наносять на скло біля краплі фізрозчину
і, поступово, розтираючи його та емульгуючи в краплі, готують тонкий,
рівномірний мазок округлої чи овальної форми діаметром 1–1,5 см. Після цього
петлю прожарюють і ставлять у штатив. Виготовлення мазка
з твердого матеріалу 6.4.2. Виготовлення мазків із рідкого матеріалу Виготовлення
мазків із рідкого клінічного матеріалу або з культури на рідкому
середовищі. Бактеріологічною петлею
набирають краплю досліджуваного матеріалу або культури з рідкого середовища
із дотриманням правил стерильності, як описано вище. Взятий матеріал наносять
на предметне скельце і роблять рівномірний тонкий мазок. Якщо для
забору матеріалу використовують стерильну пастерівську піпетку, її також
тримають у правій руці і проводять через полум’я перед внесенням у пробірку.
Тонкий кінчик піпетки після охолодження біля стінки пробірки занурюють у
рідкий досліджуваний матеріал чи бульйонну культуру, тримаючи верхній кінець
її відкритим. Після попадання в піпетку досліджуваного матеріалу чи культури
верхній кінець її закривають вказівним пальцем, виймають з пробірки. Останню
закривають і ставлять у штатив. На поверхню предметного скла з піпетки
випускають краплю матеріалу і опускають її в дезрозчин.
Простерилізованою бактеріологічною петлею роблять мазок. Виготовлення мазків з рідкого матеріалу 6.4.3. Виготовлення мазків із харкотиння або гною Під час готування мазків із матеріалів, які погано розтираються (гній, харкотиння), використовують два
предметних скла. Невелику кількість матеріалу стерильною бактеріологічною
петлею або пастерівською піпеткою наносять на середину знежиреного предметного скла і покривають його другим склом так, щоб 1/3 верхнього і нижнього скла залишалась вільною. Обидва скла сильно затискають між пальцями, роздавлюють дослі 6.4.4. Виготовлення мазків із крові Краплю крові наносять на край знежиреного
стерильного предметного скла. Краєм
іншого, трохи вужчого
і шліфованого скла торкаються краплі і нахиливши його під кутом 45° швидко і обережно проводять ним у напрямку до протилежного краю. Внаслідок
капілярності кров захоплюється
краєм верхнього скла і під час руху розмазується по нижньому склу. Правильно виготовлений
препарат виходить тонким, дещо
просвічується та має жовтувате забарвлення. Із крові виготовляють також препарат
"товстої краплі".
На предметне скло наносять окремо 2–3 звичайні краплі крові, злегка змішують їх скляною
паличкою, петлею або
кутом іншого предметного скла
так, щоб утворилась
плоска кров'яна пляма діаметром близько 1,5 см. Такі препарати виготовляють, зокрема
для діагностики малярії, поворотних тифів. 6.4.5. Мазки-відбитки Мазки-відбитки роблять із
органів трупів людей і тварин, харчових продуктів щільної консистенції (сир,
м'ясо, шинка, ковбаса, риба та ін.), а також з поверхні молодих колоній
грибів, актиноміцетів, рідше – бактерій. Розжареним у полум'ї
скальпелем припікають поверхню
органа або харчового
продукту. Потім стерильними
ножицями з цієї ділянки вирізають шматочок тканини. Поверхнею зрізу торкаються предметного скла у 2–4 місцях,
роблячи мазок-відбиток. Такі ж мазки-відбитки можна виготовити з ділянки шкіри або слизової оболонки. Притискання досліджуваного об'єкта до скла повинно бути строго вертикальним
тривалістю 1–2 с. Мазки-відбитки з колоній роблять на покрівних скельцях. 6.4.6. Метод роздавленої краплі
На середину
предметного скла бактеріологічною петлею або піпеткою наносять краплю молодої
(12–18 год.) теплої бульйонної культури або іншого досліджуваного матеріалу.
За густого росту культури її розбавляють фізіологічним розчином, тому що
наявність великої кількості мікробних тіл у полі зору утруднює спостереження
за окремими бактеріями та їх рухливістю. Нанесену краплю накривають покривним
скельцем, обережно накладаючи його пінцетом, щоб у надавленій краплі не
появлялись бульбашки повітря. Для цього покривне скельце краще не накладати
зверху, а ставити його ребро біля краю краплі і повільно опускати, витісняючи
повітря між предметним і покривним скельцями. Вдало зроблена крапля заповнює
весь простір між ними, але при цьому рідина не виступає за краї покривного
скельця. Якщо вона виступає, зайву її частину видаляють шматочком
фільтрувального паперу, утримуючи його пінцетом, після чого папір занурюють у
дезінфікуючий розчин. Недоліком надавленої краплі є її швидке висихання. За
необхідності довго розглядати препарат, краї покривного скла заздалегідь
змащують вазеліном.
Висяча крапля
– метод мікроскопічного дослідження живих мікроорганізмів, розроблений Р.
Кохом у 1876 р. За його допомогою можна спостерігати розмноження бактерій,
характер їх рухливості, проростання спор у вегетативні форми, явище
хемотаксису, дію фізичних і хімічних факторів, імунних сироваток тощо. Його
також широко використовують для вивчення морфології грибів, найпростіших і
спірохет. Як і в методі надавленої краплі, досліджують молоді культури,
вирощені в рідкому або на щільному середовищі. Для
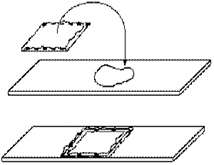
виготовлення висячої краплі необхідні спеціальні предметні скельця, в центрі
яких є напівсферичне заглиблення (лунка). Невелику краплю негустої суспензії
бактерій петлею або піпеткою наносять на середину чистого, але не знежиреного
покривного скельця. Предметне скло з лункою, краї якої попередньо змащують
вазеліном, обережно накладають на покривне скельце, слідкуючи щоб крапля
культури знаходилась в центрі заглибини, і швидко перевертають його. Крапля
повинна звисати в лунці, але не торкатись її дна.
Звідси походить назва препарату висяча крапля. Змащування країв лунки
вазеліном створює своєрідну герметичну вологу камеру. Така крапля не висихає
і придатна для спостереження протягом довгого часу. Для
збільшення контрастності досліджуваних об’єктів в надавленій чи висячій
краплях можна застосувати зажиттєве (вітальне) забарвлення. Для цього
використовують малотоксичні й майже нешкідливі барвники: метиленовий і
толуїдиновий синій, конго і нейтральний червоний, акридиновий оранжевий, янус
зелений та ін. Суспензію мікробів вносять у краплю 0,001 % водного розчину
барвника, готують надавлену або висячу краплю і мікроскопують. Можна
проводити зажиттєве забарвлення бактерій і флуорохромами.
Тоді дослідження проводять за допомогою люмінесцентної мікроскопії. 6.4.8. Висушування і фіксування препаратів мазків Виготовлені мазки висушують при кімнатній температурі
або в термостаті. Тонкі мазки швидко висихають на повітрі, більш товсті можна висушувати над полум'ям газового пальника. Предметне
скло при цьому тримають за ребра 1-им і 2-им пальцями
правої руки мазком догори. Щоб
не допустити денатурації білків бактерій і порушення їх внутрішньої структури ступінь нагрівання контролюють середнім пальцем, який знаходиться під предметним склом. У
лабораторній практиці найпоширенішим методом фіксування мазків є фламбування, тобто
фіксація в полум'ї газового пальника або спиртівки. При цьому мазок тримають
так само, як при висушуванні і тричі проводять його через полум'я. Весь
процес фіксації триває 5–6 с, а дія жару – 2 с. Більш тривале фіксування
жаром зменшує якість препарату, а недофіксований
мазок під час наступної обробки змивається і несе в собі небезпеку зараження. Під час
вивчення деяких структур мікробних клітин, а також мазків крові, відбитків
органів використовують такі фіксуючі рідини як етанол (упродовж 10–15 хв),
метанол (5 хв), ацетон (5 хв), суміш Никифорова (10–15 хв), пари формаліну
або осмієвої кислоти (декілька секунд). При такому обережному фіксуванні значно краще зберігаються і виявляються всі структури клітин і бактерій. 6.5. Забарвлення препаратів мазків Морфологію бактерій
вивчають, як правило, на зафіксованих
і забарвлених препаратах. Незабарвлені
мікроорганізми, за вийнятком грибів,
погано видно у світловому мікроскопі
через їх малу контрастність.
Для фарбування мазків у бактеріологічних лабораторіях
широко використовують анілінові
барвники. Вони поділяються
на кислі, нейтральні та основні. Останні добре забарвлюють як ядерний апарат, так і цитоплазматичні структури. Позитивно заряджена фарбуюча частина, їх молекули швидше і повніше вступають в сполуку
з негативно зарядженою бактерійною
клітиною. Кислі ж барвники фарбують мікробів значно слабше. У повсякденній
лабораторній практиці найчастіше вживають такі барвники: червоні – фуксин основний (діамантфуксин, солянокислий розанілін або парарозанілін), фуксин кислий, нейтральний червоний, сафранін, конго червоний; фіолетові – генціан-,
кристал- і метил-віолет; сині – метиленовий і толуїдиновий
синій, трипановий голубий; зелені – малахітовий, брильянтовий
зелений; жовто-коричневі – везувін,
хризоїдин та ін. 6.5.1. Прості способи
забарвлення бактерій Простий метод
забарвлення дає можливість дослідити загальну морфологію мікробів, їх
розміри, форму, кількість, локалізацію, взаємне розташування клітин тощо. Але за його
допомогою неможливо вивчати внутрішню структуру бактерій та їх різне відношення до декількох барвників. Простим забарвленням називають
таке, під час якого застосовують
лише один барвник. Найчастіше
використовують основний розведений фуксин Пфейфера і лужну метиленову синьку Леффлера. Фуксином фарбують 1–2 хв, а
синькою – 3–5 хв. Прості методи забарвлення На
зафіксований препарат наносять піпеткою таку кількість барвника, щоб він
покривав увесь мазок. Після фарбування препарат промивають водою і висушують
на повітрі, або притискають фільтрувальним папером, потім проводять над полум'ям, щоб випарувались залишки води. Якщо на препараті залишиться вода, то, з'єднавшись із імерсійною олією,
вона утворить емульсію,
яка заважатиме чіткому зображенню. Під час висушування мазків
за допомогою листків фільтрувального паперу потрібно кожного разу користуватися
новими, оскільки за повторного вживання переносяться
забарвлені бактерії з
одного мазка на інший, що
може призвести до неправильних висновків. 6.5.2. Складні методи забарвлення бактерій Складні (диференціюючі) методи забарвлення базуються на
фізико-хімічних особливостях будови мікробних клітин. Суть їх полягає у фарбуванні мазка двома барвниками, один з яких є основним, другий – доповнюючим (контрастним).
Після дії першого барвника мазок знебарвлюють кислотою, лугом, спиртом або
ацетоном. Деякі мікроорганізми
легко, інші важко знебарвлюються. Одні з них є кислото- і спиртостійкими, інші – лише кислотостійкими. Спори бактерій дуже важко піддаються дії знебарвлюючих речовин, вони водночас є і фарбостійкими об'єктами. Складні методи забарвлення вживають для
детального вивчення структури
бактерійних клітин, а також для характеристики і диференціації
мікроорганізмів. Отже,
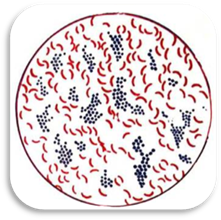
вони мають важливе діагностичне значення. У лабораторній практиці найчастіше використовують складні методи Грама, Ціля-Нільсена, Нейссера, Буррі-Гінса та ін. 6.5.2.1. Забарвлення за Грамом
Серед складних
методів фарбування він є найуніверсальнішим. Особливості
забарвлення за методом Грама дозволяють поділити всі
мікроорганізми на дві групи: грампозитивні та грамнегативні,
хоча в практиці трапляються випадки, коли одні й ті ж бактерії характеризують
як грамваріабельні. Принцип методу
полягає в тому, що клітини грампозитивних мікробів здатні утворювати міцну
сполуку з генціанвіолетом та йодом, яка не вимивається з бактерій спиртом,
отже, вони забарвлюються в темно-фіолетовий колір. У грамнегативних бактерій цей комплекс вимивається
спиртом, тому вони потім забарвлюються
фуксином у червоний колір. До грампозитивних
відносяться стафілококи, стрептококи, бацили, клостридії, дифтерійні та туберкульозні палички. Грамнегативними є нейсерії (менінго- і гонококи), кишкові палички, сальмонели, шигели, рикетсії, всі звивисті бактерії (вібріони, спірили, спірохети, лептоспіри). Техніка забарвлення: 1.На фіксований жаром мазок кладуть трохи коротшу і вужчу від предметного скла смужку фільтрувального паперу. Зверху на неї наносять достатню кількість розчину генціанвіолету (основний барвник) на 1-2 хв, зливають його і знімають папірець. 2.Після прополоскування
мазка водою наносять розчин
Люголя на 1–2 хв (до сильного потемніння препарату). 3.Зливають розчин Люголя і, не промиваючи мазок, знебарвлюють його 96° етанолом протягом 30–60 с (до відходження
сіро-фіолетових струмочків
фарби). 4.Препарат ретельно промивають водою і додатково забарвлюють фуксином Пфейфера (доповнюючий контрастний барвник) протягом 2 хв. 5.Мазок промивають водою, висушують, наносять краплю кедрової олії, мікроскопують з імерсійним об'єктивом. Мікроскопічна картина: за правильного забарвлення
грампозитивні мікроорганізми фарбуються в темно-фіолетовий колір, грамнегативні бактерії, тканини, клітини органів – у
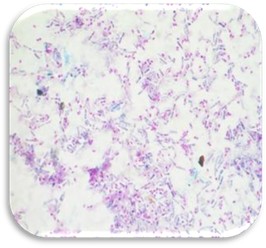
рожевий. 6.5.2.2. Забарвлення кислотостійких бактерій Кислотостійкі
мікроорганізми (збудники туберкульозу, прокази, актиноміцети та ін.) містять
велику кількість високо-молекулярних ліпідів, восків і міколової
кислоти. Вони важко фарбуються звичайними аніліновими барвниками. Але під час
забарвлення їх концентрованим феноловим фуксином Ціля
з підігріванням міцно утримують його і не знебарвлюються розчинами кислот,
лугів і спиртів. Клітини тканин, лейкоцити, слиз, інші бактерії за такої
обробки легко віддають барвник. У зв'язку з цим при додатковому забарвленні
препаратів метиленовою синькою всі ці елементи після знебарвлення мазків
фарбуються в синій колір, а кислотостійкі бактерії залишаються червоними.
Техніка забарвлення: 1. На фіксований
у полум'ї мазок із харкотиння хворого кладуть смужку фільтрувального паперу, наливають на нього фуксин Циля і забарвлюють, тричі підігріваючи до появи парів (але не доводячи до кипіння), після чого препарат із фарбою залишають ще на 1–2 хв для охолодження;
зливають барвник, знімають папірець, промивають водою. 2. Препарат знебарвлюють
5 % сірчаною або соляною
кислотою до появи жовтуватого
відтінка (10–30 с) і декілька разів промивають водою. 3. Додатково забарвлюють
мазок метиленовою синькою Леффлера, промивають водою, висушують і досліджують під мікроскопом. Мікроскопічна картина: на загальному
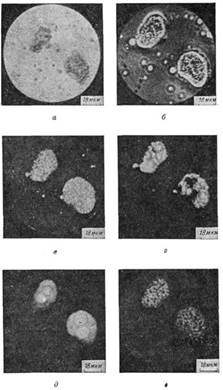
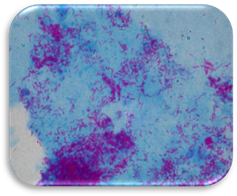
синьому (голубому) фоні кислотостійкі бактерії виглядають рубіново-червоними. Забарвлення за Романовським-Гімзою є одним із
основних і найпоширеніших
методів забарвлення мазків крові в гематології. За цим способом
добре фарбуються різні структурні елементи паразитів крові – малярійних
плазмодіїв, трипаносом, лейшманій.
Його також часто застосовують для виявлення
токсоплазм, спірохет, рикетсій,
личинок нематод тощо. Препарати-мазки фіксують
метанолом протягом 3–5 хв і висушують на повітрі. Приготовлений
розчин наносять на мазок,
а ще краще предметне скельце з мазком опускають у склянку з барвником.
Забарвлення триває від 30 хв до двох і більше годин. Товсті краплі крові фарбують упродовж 30 хв. Потім барвник зливають, препарати промивають водою і добре висушують
на повітрі у вертикальному положенні.
Мікроскопію проводять із використанням імерсійних об'єктивів. Будучи в розчині
синьо-фіолетовим, поліхромний
барвник Романовського-Гімзи
фарбує цитоплазму в голубий
колір, а ядра клітин, тіла бактерій, їх капсули, слиз
– у червоно-фіолетовий. У дифтерійних
паличок ядерні елементи забарвлюються в темний червоно-фіолетовий колір, а волютинові зерна – у
вишнево-червоний; цитоплазма має
рожевий колір. 6.5.2.3. Забарвлення капсул Капсули бактерій
містять за звичайних методів фарбування погано сприймають
барвники. Лише у препаратах-відбитках
з уражених тканин і органів,
мазках із гною, харкотиння
вони виявляються за будь-якого методу фарбування
у вигляді незабарвлених
зон (ореолів) між забарвленими тілами бактерій і субстратом. Для фарбування
самих капсул запропоновані різні
методи. Спосіб Ребігера. Нефіксований
мазок забарвлюють насиченим
розчином генціанового фіолетового у 40% формаліні упродовж 15–20 с, швидко
промивають водою і висушують.
Капсули фарбуються у червоний, а бактерії – в темно-фіолетовий
колір. Метод Гінса.
З досліджуваного матеріалу
роблять негативний
препарат за способом Буррі. Мазок фіксують сумішшю Никифорова, або метанолом, промивають водою і забарвлюють
3–5 хв за Гінсом феноловим фуксином Ціля, розведеним
1:3. Промивають водою, висушують,
мікроскопують під імерсійним об'єктивом. На
темному димчасто-сірому фоні
контрастно виділяються незабарвлені
капсули, всередині яких знаходяться яскраво-червоні тіла бактерій. Метод Гісса.
Тонкий мазок фіксують у спирт-формолі
або суміші Никифорова
(але не жаром), фарбують розчином
основного фуксину (1 ч насиченого спиртового розчину барвника + 19 ч дистильованої води) з підігріванням
до появи парів, потім залишають на 30 с для охолодження. Препарат промивають
великою кількістю розчину
мідного купоросу, висушують,
не промиваючи водою, і мікроскопують.
Капсули забарвлюються в голубий колір, тіла мікробів – у темно-червоний. Метод Романовського-Гімзи. На мазок,
фіксований метанолом або сумішшю Никифорова, наносять розведений барвник Гімзи (2 краплі на 1 мл дистильованої води), фарбують
20–30 хв, швидко змивають водою, висушують і мікроскопують. Бактерії
забарвлюються в синій колір, капсули – у блідо-рожевий. Метод постійно дає
хороші результати. Інші способи забарвлення капсул менш демонстративні. Для виявлення
спор розроблені спеціальні
методи їх забарвлення. Всі вони основані на дії протравлення, які розпушують міцні оболонки спор і полегшують проникнення барвників.
Метод
Ожешки. На
приготовлений густий незафіксований
мазок спороносної культури
бактерій наливають 0,5 % розчин соляної кислоти й підігрівають 3–4 рази до появи
парів (протрава). Препарат промивають
водою, висушують фільтрувальним
папером і фіксують у полум'ї пальника. Потім мазок забарвлюють за методом Ціля-Нільсена,
промивають водою, висушують
і мікроскопують. Тіла бактерій фарбуються в блакитний колір,
спори – в
червоний. Метод
Пешкова – простий
і надійний спосіб забарвлення спор, який не вимагає хімічних протрав і диференціювання в кислоті чи спирту. Його проводять
за таким алгоритмом: 1. Виготовляють мазок, висушують
і фіксують у полум'ї
газового ріжка, або в
спиртовому формаліні. 2. На препарат наливають
лужний метиленовий синій і доводять його до кипіння, періодично вносячи в полум'я на 15–30 с. 3. Барвник змивають
водою і додатково фарбують
0,5 % водним розчином
нейтрального червоного упродовж 30–40 с. Промивають
дистильованою водою, висушують,
розглядають за допомогою масляної імерсії. Спори виглядають синіми, або голубими, цитоплазма – рожевою. Метод
Мюллера. На зафіксований у полум'ї мазок наливають
5 % водний розчин хромової кислоти на 2–3 хв, промивають водою, висушують і забарвлюють за методом Ціля-Нільсена,
мікроскопують. Спори набувають
червоного кольору, а
цитоплазма бактерій – синього. Метод
Шеффера-Фултона. Густий мазок фіксують у полум'ї, наливають 5 % водний розчин малахітового зеленого, 3–4 рази нагрівають
до появи парів, промивають струменем проточної води 30–40 с і додатково забарвлюють 0,5 % водним розчином сафраніну, промивають водою і мікроскопують.
Тіла бактерій забарвлюються в червоний, а
спори – в
зелений колір. 6.5.2.5. Забарвлення джгутиків Забарвлення джгутиків – одна з найтонших, складних і
вимогливих бактеріоскопічних методик. Запропоновано багато складних
методів їх фарбування: Леффлера, Грея,
Морозова, Уварова, Бенін'єтті та ін. Найнадійнішим із них є метод Леффлера. Метод Леффлера. Важливою умовою
для успішного забарвлення
є виготовлення мазків із молодої (12–18 год) агарової
культури на ідеально чистих і знежирених скельцях. Бактеріологічною
петлею беруть невелику кількість культури і вносять її в 5–6 мл водопровідної
води, не емульгуючи, а залишаючи
петлю до тих пір, доки бактерії
самі розійдуться в рідині. Пастерівською піпеткою з тонко відтягнутим капіляром наносять на скельце 5–6 окремих крапель
суспензії бактерій у воді, висушують на повітрі. Фіксують дуже обережно, один раз швидко провівши препарат через полум'я. На фіксований
препарат наносять надлишок
протрави й залишають її упродовж 10–15 хв, промивають дистильованою водою
до повного видалення
протрави. Фарбують профільтрованим
фуксином Ціля
протягом 3–5 хв, промивають
водою, висушують і мікроскопують.
Тіла бактерій забарвлюються в темний червоно-коричневий колір, джгутики виглядають світлішими, такого ж відтінку. Метод Бенінєтті. Суспензію бактерій
і мазок роблять так само, як і за методом Леффлера. Протраву і забарвлення
проводять одним фарбуючим
розчином, який завжди готують перед
використанням: розчин 1 – сірчанокислого цинку 1 г, таніну 10 г, дистильованої води
100 мл; розчин 2 – насичений
спиртовий розчин генціана фіолетового. Змішують 5 мл першого
і 3 мл другого розчинів. Суміш
наносять на препарат-мазок, тричі
нагрівають до появи парів, охолоджують, добре промивають водою. Висушують і мікроскопують. Тіла бактерій фарбуються в темно-фіолетовий колір, джгутики мають більш ніжне забарвлення. 1. Що таке мікроскопічний метод дослідження? 2. Що таке бактеріологічний метод дослідження? 3. Назвіть складові частини мікроскопа?
4. Яке практичне значення темнопольної мікроскопії? 5. З якою метою застосовують фазово-контрастну мікроскопію? 6. Що досліджують інтерференційною мікроскопією? 7. Які переваги люмінісцентної мікроскопії?
8. Яке обладнання потрібне для виготовлення мазків? 11.Що таке «просте» забарвлення? 12. Як зафарбовуються бактерії за Грамом? 13. Назвіть способи фарбування для виявлення
джгутиків? |
|||||||||||