|
|
ЕПІЗООТОЛОГІЯ З МІКРОБІОЛОГІЄЮ I частина Електронний посібник |
|||||||||||||||||||||
|
|
||||||||||||||||||||||
|
5.1. Вимоги до живильних середовищ 5.2. Основні живильні середовища 5.3. Виготовлення живильних
середовищ 5.3.2. М’ясо-пептонний бульйон (МПБ) 5.3.3. М’ясо-пептонний агар (МПА) 5.3.4. Середовища з кров’ю, сироваткою або асцитичною
рідиною 5.3.5. Триптичний перевар
за Хоттінгером 5.4. Методи кількісного обліку мікроорганізмів 5.5. Методи зберігання культур мікроорганізмів 5.6. Техніка посівів мікроорганізмів 5.6.1. Посів шпателем і тампоном у чашки Петрі 5.6.3. Посів матеріалу в товщу живильного середовища 5.8. Характеристика колоній за різними ознаками 5.1. Вимоги до живильних середовищ Живильні
середовища повинні бути такими, що легко засвоюються, з певним складом
азотистих речовин, вуглеводів, вітамінів і відповідною концентрацією солей,
ізотонічними, стерильними, мати буферні властивості, оптимальну в'язкість і
певний окислювально-відновний потенціал. Мікроорганізми,
які потребують високих концентрацій солей, називають галофільними.
Вони поширені в морях, океанах, солоних озерах. Протягом
усієї історії мікробіології живильні середовища поступово вдосконалювались. У
допастерівський період як середовища для
вирощування мікроорганізмів застосовували тільки настої і відвари. Л. Пастер і К. Негелі запровадили в практику культивування
безбілкові середовища. Р. Кох і Ф. Леффлер для вирощування бактерій використовували м'ясну
воду, пептон і натрію хлорид. Це середовище – м'ясо-пептонний
бульйон (МПБ), з якого готують м'ясо-пептонний агар
(МПА), додаючи 1—2 % агару.
Агар
– твердий волокнистий матеріал, який добувають із деяких водоростей. У водних
розчинах він утворює густий гель (холодець). Агар складається з 70–75 %
полісахаридів, 2–3 % білків та інших азотовмісних речовин, 2–4 % золи.
Основними компонентами агару є високомолекулярні речовини – агароза й агаропептин. Агар
розчиняється у воді під час нагрівання і охолоджується за кімнатної
температури. Його випускають у вигляді безбарвних пластинок або порошку. Завдяки властивості агару надавати поживному субстрату
під час охолодження консистенції густого гелю і високій стійкості до
ферментативної дії мікроорганізмів його широко застосовують під час
виготовлення напіврідких, густих і сухих поживних середовищ. Розроблено
методику виготовлення синтетичного полімерного матеріалу, що використовується
для приготування густих поживних середовищ і з успіхом замінює природний
дефіцитний агар. Для
вирощування бактерій у лабораторних умовах, дослідження їх різноманітних
властивостей, тривалого зберігання використовують живильні середовища. Вони
повинні відповідати певним стандартам, створюючи оптимальні умови для росту,
розмноження й життєдіяльності мікроорганізмів. У
першу чергу, бактерії потребують азоту, вуглецю та водню для побудови власних
білків. Водень і кисень для клітин постачає вода. Джерелом азоту виступають
численні речовини, в основному, тваринного походження (м’ясо яловиче, риба,
м’ясо-кісткове борошно, казеїн), а також білкові гідролізати, пептиди,
пептони. Можна використовувати й замінники м’яса – плаценту, кров’яні
згустки, дріжджі. Отже, до складу середовищ повинні бути введені джерела
живильних речовин і вода, а також ростові фактори (вітаміни групи В,
ферменти). Універсальним джерелом їх служать екстракти з білків тваринного й
рослинного походження, білкові гідролізати. Для мікробів з більш складними
харчовими потребами до складу середовищ включають нативні
субстрати – кров, сироватку, асцитичну
рідину, яєчний жовток, шматочки печінки, нирок, мозкової тканини та ін. Середовища
повинні бути збалансованими за мікроелементним складом і містити іони заліза,
міді, марганцю, цинку, кальцію, натрію, калію, мати у своєму складі
неорганічні фосфати. Допускається
застосування речовин, які усувають дію інгібіторів росту і токсиноутворення мікробів (окремі амінокислоти, твіни,
активоване вугілля тощо). Важливим є стабілізація оптимуму рН середовища, його високої буферності
та рівень окисно-відновного потенціалу (Еh), який для аеробних мікроорганізмів досягає понад 0,08
В, а для анеробних бактерій коливається в межах
0,12–0,60 В. Середовища
повинні мати певну в’язкість, густину, мати певну вологість (до 20 % води),
бути ізотонічними, прозорими й обов’язково стерильними. 5.2. Основні живильні
середовища Численні
потреби мікроорганізмів зумовлюють велике розмаїття живильних середовищ, а
для окремих видів бактерій існують спеціальні середовища. Частину їх готують
у лабораторіях безпосередньо перед посівом, але з кожним роком з’являються
все нові й нові середовища заводського виготовлення (сухі), які здатні
задовольнити найвибагливіші потреби мікробіологів. Вони зберігаються тривалий
час, мають стандартний склад. Середовища
поділяються на природні й штучні. Як природні використовують згорнуту
сироватку, молоко, яйця, м’язову тканину. Штучні середовища створюють шляхом
комбінування різноманітних субстратів, що забезпечують ті чи інші потреби
мікроорганізмів. Їх використовують в основному для експериментального
вивчення окремих ланок метаболізму бактерій. Залежно
від своєї густини, середовища поділяються на рідкі, напіврідкі та щільні.
Напіврідкі та щільні середовища готуються з рідких, додаючи відповідно
0,3–0,7 % та 1,5–2,0 % агару. Останній – це волокнистий матеріал, який
добувають з морських водоростей. Складається він з полісахаридів (70–75 %),
білків (2–3 %), основними складниками є високомолекулярні агароза
та агаропептин. Агар розчиняється у воді за
підвищеної температури, а застигаючи, надає середовищу драглеподібної
консистенції та стійкості до ферментних систем бактерій. Саме за ці властивості
він набув широкого розповсюдження у мікробіологічній практиці. Для створення
щільних середовищ використовують також желатин (10–15 %), згорнуту сироватку крові.
Залежно
від потреб бактеріологів живильні середовища поділяються на п’ять основних
груп. Перша
група – універсальні (прості) середовища. До них
належать м’ясо-пептонний бульйон (МПБ) та м’ясо-пептонний
агар (МПА). За своїм складом, наявністю живильних речовин вони
придатні для культивування багатьох видів бактерій. Друга
група – спеціальні середовища. Вони
використовуються в тих випадках, коли мікроорганізми не ростуть на простих.
До них належить кров’яний, сироватковий агари,
сироватковий бульйон, асцитичний бульйон,
асцит-агар та інші. Третя
група – елективні середовища, на яких мікроорганізми певного виду ростуть
швидше, більш інтенсивно, опереджають у своєму розвитку інші види бактерій.
Наприклад, 1% лужна пептонна вода є елективним
середовищем для холерних вібріонів, середовища Ру
та Леффлера – для збудників дифтерії. Четверта
група – селективні середовища, які завдяки додаванню певних компонентів
(жовч, фарби, антибіотики та ін.) здатні пригнічувати розвиток одних видів
мікроорганізмів, але не впливають на інші види. Так, середовище Мюллера є
селективним для тифо-паратифозних бактерій, фуразолідоно-твіновий агар – для коринебактерій і
мікрококів. Додавання антибіотиків до складу середовищ робить їх селективними
для грибів (напр. середовище Сабуро та ін.). П’ята
група – диференціально–діагностичні середовища. Це велика група середовищ,
які дозволяють визначити певні біохімічні властивості мікроорганізмів і
проводити їх диференціацію. Вони поділяються на середовища для визначення
протеолітичних, пептолітичних, цукролітичних,
гемолітичних, ліполітичних, редукуючих
властивостей (середовища Ендо, Левіна, Плоскірєва, Гісса). Класифікація живильних середовищ Універсальні:
ПВ, МПБ, МПА Спеціальні:
цукровий МПА, МПБ, сироватковий МПА, кров’яний МПА, асцититичний
МПА Елективні:
Ру, Леффлера, 1 % лужна
ПВ Селективні:
Середовище Мюллера, фуразолідоно-твіновий агар, Сабуро Диференціально-діагностичні:
1)
для визначення цукролітичних властивостей
(середовища Гіса, Ендо,
Левіна, Плоскірева) 2)
для визначення протеолітичних властивостей (згорнута сироватка, МПЖ, кусочки
м’язів, білка курячого яйця)
3)
для визначення пептолітичних властивостей (МПБ, ПВ) 4)
для визначення гемолітичних властивостей (кров’яний МПА) 5)
для визначення редукуючих властивостей (середовища
з різними барвниками) Все
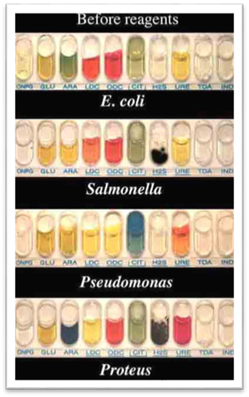
ширше застосування в мікробіологічних лабораторіях знаходять численні
комерційні тест-системи для біохімічної ідентифікації мікроорганізмів,
виготовлені на основі різноманітних диференційно-діагностичних середовищ. В
одному варіанті виконання їх вносять у спеціальні полістиролові або інші
планшети та висушують для видалення води. До них належать системи АРІ-20 для
ідентифікації стафілококів, коринебактерій, ентеробактерій,
анаеробних мікробів, Enterotest 1 і 2, російська система
ПБД (пластина біохімічна диференційна) для ідентифікації ентеробактерій.
Непогано зарекомендували себе тест-системи Roche та
інші. Інші
варіанти подібних тест-систем передбачають адсорбцію диференціюючих
субстратів на паперових або полімерних носіях. Серед них розповсюджені
системи Auxtab, Minitek, Morlok, Micro-ID. Подібні
системи зручні в користуванні, вони дозволяють одночасно дослідити широкий
спектр мікробних ознак, завжди готові до використання в будь-яких
мікробіологічних лабораторіях, вони прості й надійні, вимагають невеликих
об’ємів посівного матеріалу, тому економлять лабораторний посуд, піпетки.
Комп’ютерна обробка одержаних результатів дає змогу швидко визначити й
оцінити вид невідомого збудника. 5.3. Виготовлення живильних середовищ До
складу будь-яких середовищ входять переважно натуральні тваринні або рослинні
продукти і компоненти – м’ясо, рибне борошно, яйця, молоко, кров, дріжджовий
екстракт, картопля тощо. З них готують спеціальні напівфабрикати у вигляді
екстрактів, настоїв, ферментативних і кислотних гідролізатів (м’ясна вода,
дріжджовий екстракт, триптичний гідролізат Хоттінгера, пептон та інші), які є основою для подальшого
конструювання живильних середовищ. Крім цього, в живильні середовища додають
різні неорганічні солі залежно від потреб мікробної клітини. Як прaвило, концентрація хлориду натрію складає 5,0 г/л,
калію 0,2–0,5 г/л, інші солі додають із розрахунку 0,001 г/л. У необхідних
випадках до складу вводять вуглеводи (цукри, багатоатомні спирти),
амінокислоти, а також вітаміни.
Для
забезпечення необхідної густини середовища використовують агар-агар, який
одержують з морських водоростей. Він є зручним і необхідним компонентом
середовищ, оскільки не споживається бактеріями як ростовий субстрат.
Утворюючи у воді гель, він плавиться за температури близько 100 °С, а густіє
– 40 °С. Джерелом желатину є багаті на колаген субстрати. Серед них хрящі,
сухожилки, кістки тощо. Гель, який отримують внаслідок використання желатину,
плавиться за температури 32–34 °С і гусне – 28 °С. Проте численні мікроорганізми
здатні розщеплювати желатин, тому використання останнього як наповнювача
середовища вважається недоцільним. Найчастіше такі середовища з желатином
застосовуються для визначення протеолітичних властивостей бактерій. Виготовлення
живильних середовищ є складним динамічним процесом, який потребує уваги
бактеріолога. Цей процес складається з декількох основних етапів. Спочатку до
дистильованої води згідно з прописом додають необхідні сухі компоненти
середовища, ретельно перемішують, розчиняючи під час нагрівання. Обов’язково
встановлюють рН середовища, яке визначають або за
допомогою іонометра, або індикаторними папірцями. При цьому слід звернути
увагу, що після стерилізації реакція середовища падає на 0,2. Середовища, які
містять агар, фільтрують через ватно-марлевий фільтр у гарячому стані, рідкі
середовища – через паперові фільтри. Якщо є необхідність, їх освітляють
осадженням або за допомогою білка курячого яйця чи сироватки. Середовища
розливають у спеціальні матраци, колби, флакони і закривають ватно-марлевими
корками з паперовими ковпачками. Залежно від складу середовища використовують
різні режими стерилізації. Так, середовища, які містять вуглеводи, желатин
стерилізують в автоклаві 15 хв за температури 112 °С або текучою парою за
температури 100 °С дробно. Середовища без
вуглеводів можна стерилізувати в автоклаві затемператури
115–120 °С протягом 20 хв. Якщо до складу середовищ входять нестійкі до
температури компоненти, такі, як нативний білок,
сироватка, сечовина, то їх стерилізують або фільтруванням через бактеріальні
фільтри, або їх додають готовим у стерильне середовище. Контроль стерильності
середовищ здійснюють шляхом витримування їх у термостаті протягом декількох
діб за температури 37 °С.
Наводимо
приклади виготовлення деяких простих живильних середовищ, які найчастіше
використовують у мікробіологічній практиці і можуть бути основою для виготовлення
більш складних. Для її виготовлення
використовують свіжу яловичину, яку попередньо очищають від жиру, фасцій,
сухожилків тощо, розрізають на дрібні шматки і пропускають через м’ясорубку.
Отриманий фарш заливають водопровідною водою в співвідношенні 1:2, розмішують
і на добу залишають у прохолодному місці. Отриманий настій кип’ятять протягом
30–60 хв, періодично знімаючи накип, а потім відстоюють. Відокремлюють рідину
від фаршу, фільтрують через фільтрувальний папір або полотно і доливають
водопровідною водою до первинного об’єму, потім розливають у флакони і
стерилізують за 1 атмосфери (температура 120 °С) протягом 30 хв. Стерильна
м’ясна вода прозора, має жовтуватий колір, а на стінках флакона і на дні
утворюється осад із білків, які згорнулись. Тому за подальшого використання
середовища його знову фільтрують. Активна реакція середовища – 6,2. 5.3.2. М’ясо-пептонний бульйон (МПБ) Щоб
виготовити МПБ, до м’ясної води додають 1 % пептону і 0,5 % хлориду натрію,
встановлюють необхідне рН за допомогою 20 % розчину
NaOH і кип’ятять 30–40 хв, постійно перемішуючи.
Бульйон фільтрують через паперовий або полотняний фільтри, розливають у
флакони, пробірки, перевіряють активну реакцію середовища і стерилізують за
температури 120 °С протягом 20 хв. 5.3.3. М’ясо-пептонний агар (МПА) До
м’ясо-пептонного бульйону додають дрібно нарізаний
агар-агар (2–2,5 %). Одержану суміш кип’ятять до розчинення агар-агару,
фільтрують, встановлюють рН і розливають у флакони.
Стерилізацію проводять протягом 20 хв за температури 120 °С. 5.3.4. Середовища з кров’ю, сироваткою або асцитичною рідиною Оскільки
ці середовища не можуть довго зберігатись, їх готують безпосередньо перед
застосуванням. Для цього до розтопленого і охолодженого до температури 45–50
°С МПА додають стерильно 5–10 % свіжої або дефібринованої
крові барана, кролика або іншої тварини. Флакони з агаром ретельно
перемішують і розливають у чашки Петрі, слідкуючи за відсутністю піни. Ідентично
готують сироватковий (5–10 % сироватки крові) або асцитичний
агар (25 % асцитичної рідини). 5.3.5. Триптичний перевар за Хоттінгером Бульйон
із нього економічніший за інші м’ясо-пептонні середовища, оскільки дозволяє з однієї порції
м’яса одержати в декілька разів більше бульйону. У цьому середовищі міститься
велика кількість амінокислот, отже, підвищується його буферність,
і за рахунок цього більш стабільним є значення активної реакції середовища.
Для
виготовлення перевару беруть один кілограм м’яса
без сухожилків і жиру, порізаний на дрібні шматки розміром до 1–2 см,
занурюють у каструлю з подвійним об’ємом води, яка кипить, і кип’ятять 15–20
хв, поки м’ясо не стане сірим, що свідчить про коагуляцію білків. Його
виймають з рідини і пропускають через м’ясорубку. У рідині, яка залишилась,
встановлюють рН 8,0, опускають туди фарш і
охолоджують до 40 °С. Потім додають 10 % (до об’єму рідини) свіжої
підшлункової залози, попередньо очищеної від сполучної тканини, жиру і двічі
пропускають через м’ясорубку. Замість залози використовують сухий препарат
панкреатину (0,5 %). Одержану суміш ретельно збовтують і доводять рН до 7,8–8,0. Через 30 хв перевіряють рН. Якщо активна реакція середовища не змінюється в кислу
сторону, це свідчить про недоброякісність ферменту. Коли рН
середовища стабілізується, суміш переливають у великі бутлі, заповнюючи їх на
1/3. Додають до 3 % хлороформу, закривають посуд резиновими корками та
інтенсивно збовтують для перемішування рідин. Надлишок парів хлороформу
випускають. Через 1–2 год. знову перевіряють рН
середовища, встановлюючи його на 7,4–7,6. Отриману суміш залишають за кімнатної
температури на строк до 16 днів. Протягом перших 3–4 днів щоденно перевіряють
і коригують рН середовища, а також збовтують
флакони не менше, ніж 3 рази на добу. Пізніше цю процедуру можна не проводити
і збовтувати середовище слід не так часто. За 1–2 дні до закінчення циклу
перетравлювання збовтування середовища припиняють. Про
завершене якісне переварювання свідчать просвітління рідини, яка набуває
солом’яно-жовтого кольору, а також утворення на дні пилоподібного осаду.
Рідина легко фільтрується, її перевіряють на наявність триптофану за
допомогою проби з бромною водою (до 3–4 мл фільтрату додають 3–4 краплі
бромної води). За наявності триптофану (до 2,0–3,0 г/л) колір середовища
змінюється на рожево-фіолетовий. Визначають загальний азот, який в нормі досягає
11,0–12,0 г/л, і амінний азот (до 7,0–9,0 г/л). Гідролізат
фільтрують через паперовий або полотняний фільтр, розливають у бутлі та автоклавують за температури 120 °С протягом 30 хв. У
такому вигляді він може зберігатись тривалий час. Його
використовують для отримання бульйону Хоттінгера. З
цією метою до 100–200 мл гідролізату додають 800–900 мл дистильованої води,
0,5 % хлориду натрію та 0,2 % однозаміщеного
фосфорнокислого натрію. Доводять рН до 7,4–7,6,
розливають у флакони і стерилізують 20 хв за температури 120 °С. М’ясо-пептонний агар на основі гідролізату Хоттінгера
готують за рецептурою звичайного МПА. Сьогодні,
як правило, бактеріологи намагаються користуватися стандартними сухими
живильними середовищами, які випускає бактеріологічна промисловість. Такі
середовища дозволяють суттєво покращити результати мікробіологічних
досліджень і стандартизувати їх. Для
культивування бактерій широко застосовують безбілкові середовища, в яких
добре ростуть багато органотрофних, зокрема
патогенних видів бактерій. До цих середовищ входить багато компонентів. Культивування
в синтетичних середовищах з використанням методу мічених атомів дає змогу
детальніше диференціювати бактерії за характером їх біосинтезу. Для
диференціації прототрофних
і ауксотрофних бактерій широко
використовують селективні середовища. Прототрофи ростуть на мінімальному
середовищі, яке містить тільки солі й вуглеводи, оскільки вони самі можуть
синтезувати потрібні їм для розвитку метаболіти, тоді як ауксотрофи
потребують середовища, що містить певні амінокислоти, вітаміни й інші
речовини. В
інститутах, які виготовляють вакцини й сироватки, мікроорганізми культивують
глибинним способом, що дає змогу раціональніше використовувати поживний
субстрат і одержувати бактеріальну масу у великій кількості. Культури
вирощують у реакторах з великим об'ємом поживного середовища. Аерування досягають пропусканням струменя повітря через
товщу середовища. Метод аерування використовують і
для лабораторних досліджень з метою швидкого вирощування аеробних бактерій та
вивчення деяких процесів обміну речовин. В
умовах лабораторії анаероби вирощують у стаціонарних анаеростатах
або портативних мікроанаеростатах з розрідженням
повітря до 1–8 мм або в вакуум-ексикаторах. Культивування
анаеробів можливе в умовах заміщення кисню атмосферним азотом або іншим
інертним газом. Анаеробні умови можна створити і простішими способами: за
допомогою вазелінового масла, яке вміщують шаром до верху на живильне
середовище, або висіванням матеріалу в товщу агару. Застосовують спеціальні
скляні трубки, які заповнюють МПА і запаюють на кінцях. Вирощують анаероби
звичайно в середовищах Кітта – Тароцці,
Вільсона – Блера та ін. Культивування аеробних і анаеробних мікроорганізмів 5.4. Методи кількісного
обліку мікроорганізмів Про
зростання мікроорганізмів у природних субстратах або поживних середовищах
судять за величиною титру клітин. Титр клітин (або фагових частинок) – це кількість клітин в одиниці
об'єму.
Існують
методи, що дозволяють визначати: 1) загальну кількість мікроорганізмів у досліджуваному
матеріалі; 2) тільки кількість життєздатних клітин. Методи кількісного обліку
мікроорганізмів можуть бути розділені на прямі й непрямі. Методи прямого
підрахунку клітин під мікроскопом використовують для визначення загальної
кількості мікроорганізмів у різних матеріалах. Це такі методи, як підрахунок
у спеціальних лічильних камерах, у фіксованих мазках, на мембранних фільтрах.
Цей метод широко застосовують у дослідженнях мікрофлори води та ґрунту,
ефективність такого підрахунку, як правило, в 10–10000 разів вища, ніж
підрахунку методом висіву, оскільки багато мікроорганізмів не ростуть на
поживних середовищах і врахувати їх можна тільки під мікроскопом, це дає
можливість отримати додаткову інформацію про розміри і морфології
досліджуваного об'єкта. Основне
обмеження більшості методів цієї групи – необхідність досить високих
концентрацій клітин в одиниці досліджуваного субстрату. Визначення кількості
мікробних клітин непрямим методом. Цей метод широко
застосовують у мікробіологічних дослідженнях, оскільки дозволяє досить точно
і порівняно швидко визначити кількість клітин у культуральному
середовищі . В основі методу лежить вимірювання кількості світла, розсіяного
суспензією клітин. Живильне середовище для культивування мікроорганізмів, в
якому передбачено визначати кількість клітин по розсіюванню, має бути оптично
прозорим. Визначення
кількості життєздатних клітин шляхом висіву на поживні середовища (чашкове,
метод Коха) полягає в висіві певного обсягу досліджуваної суспензії
мікроорганізмів на агарове живильне середовище в чашках Петрі. Кожна колонія
– потомство однієї життєздатної клітини. 5.5. Методи зберігання
культур мікроорганізмів Основні
завдання зберігання культур: підтримання їх життєздатності, збереження
стабільності важливих ознак, а також будь-яких інших певних властивостей, що
представляють інтерес для науки і практики. Життєздатність
мікроорганізмів підтримується переважно такими методами: 1) періодичними
пересівами (субкультивування),
2) під мінеральним маслом, 3) висушуванням; 4) ліофілізацією;
5) в умовах низьких і ультранизьких температур. Перевагою
методу субкультивування є простота і зручний
візуальний контроль за чистотою культури або її морфологічної мінливістю, а
до недоліків слід віднести можливість зараження, короткостроковість
зберігання, трудомісткість роботи і значна витрата реактивів. Зберігання
під маслом має такі переваги: відносно тривале збереження стабільності
властивостей мікроорганізмів, скорочення витрат на пересівання, можливість
використання в будь-якій мікробіологічній лабораторії. Недолік методу –
слабка розробленість протоколів для багатьох груп бактерій. Висушені
культури мікроорганізмів легко зберігати і транспортувати, їх широко
використовують для зберігання хлібопекарських і кормових дріжджів, бактеріальних
добрив (нітрагін, азотобактерин). Переваги
методу ліофілізації.
Цей метод вважається одним з найбільш економічних та ефективних методів
тривалого зберігання мікроорганізмів. Під час його використання групи
бактерій і бактеріофагів зберігаються в життєздатному стані 30 і більше
років. Недолік методу – складна і недостатньо розроблена технологія способу
зберігання, потрібне спеціальне устаткування. Переваги
кріогенного збереження мікроорганізмів – мала ймовірність зараження культури,
збереження в стабільному стані властивостей мікроорганізмів, невеликі
тимчасові і матеріальні витрати, можливість використання заморожених культур
в якості прямого інокуляту. Недолік методу –
складна і недостатньо розроблена технологія способу зберігання, потрібне
спеціальне устаткування. 5.6. Техніка посівів мікроорганізмів Посіви проводять як з метою виділення
збудників із досліджуваного матеріалу від хворих, так і для нагромадження
чистих культур з метою подальшого їх вивчення та ідентифікації.
Техніка посівів у рідкі та на щільні живильні середовища має свої
особливості.
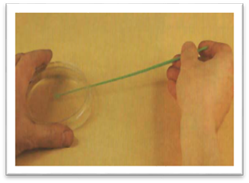
У
ліву руку беруть дві пробірки. В одній знаходиться живильне середовище
(щільне або рідке), в іншій – досліджуваний матеріал. Пробірки затискають
великим та вказівним пальцями. Для того, щоб можна було спостерігати за
вмістом пробірок, їх тримають зверху. Пробірки повинні бути дещо нахиленими,
і потрібно стежити, щоб під час відкривання їх матеріал або сторонні мікроби
з повітря та навколишніх предметів з однієї не потрапили в іншу. Корки з
пробірок виймають, тримаючи їх 4 і 5 пальцями правої руки. Трьома іншими
пальцями правої руки, як олівець, тримають бактеріологічну петлю або піпетку,
якими розподіляють досліджуваний матеріал. Техніка посіву мікробів Спочатку
стерилізують петлю у верхній частині полум’я газового пальника. Пробірки
відкривають і край їх проносять через полум’я пальника. Петлю опускають у
пробірку, де є досліджуваний матеріал, і, обережно торкаючись стінки,
охолоджують. У подальшому петлю опускають у пробірку і набирають матеріал.
Якщо він знаходиться у рідкому стані, для посіву достатньо краплі рідини, яка
затримується в кільці бактеріологічної петлі. Коли використовують мікроби, що
виросли на поверхні середовища, обережно плавним рухом набирають невелику їх
кількість, стежачи, щоб не ушкодити живильне середовище. Петлю повільно
виймають з пробірки, не торкаючись її стінок, і переносять в іншу пробірку з
середовищем. Штриховими рухами від однієї стінки пробірки до іншої, починаючи
з нижньої частини середовища, проводять посів матеріалу по скошеній поверхні
агару знизу догори. Петлю виймають з пробірки, корки і краї пробірок
проносять через полум’я і закривають. Петлю прожарюють у полум’ї, щоб знищити
мікроорганізми. Під
час посіву матеріалу на рідке живильне середовище петлю з матеріалом
занурюють у рідину. Якщо він не знімається з петлі, його обережно розтирають
на стінці пробірки й омивають середовищем. Матеріал,
який набирали пастерівською або градуйованою піпеткою, виливають у живильне
середовище, а для рівномірного розповсюдження його пробірку обережно, щоб не
замочити корок, струшують або обертають, затиснувши в долонях. Для
посіву матеріалу на щільне живильне середовище у чашках Петрі невелику
кількість матеріалу набирають стерильною петлею і втирають у поверхню
середовища біля краю чашки. Після
цього петлю стерилізують у полум’ї, щоб знищити надлишок матеріалу,
охолоджують. Наступний етап посіву починають з місця, де закінчився
попередній. Петлю кладуть горизонтально на поверхню агару, де було зроблено
посів, проводять один–два рази по поверхні і роблять посів по решті
середовища. Необхідно намагатись, щоб штрихи посіву тривали від краю до краю
чашки, не пошкоджували поверхні агару і розташовувались близько один від
одної. Цим штучно подовжується лінія посіву і створюються можливості для
одержання ізольованих колоній.
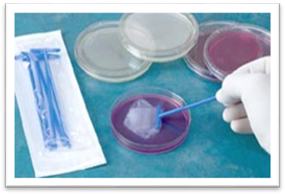
5.6.1. Посів шпателем і тампоном у чашки Петрі Матеріал
попередньо наносять на поверхню живильного середовища біля краю чашки петлею
або піпеткою. Стерильний шпатель проносять через полум’я, охолоджують,
торкаючись стінки чашки. Обережними круговими рухами, тримаючи чашку
напівзакритою, розподіляють матеріал рівномірно по поверхні середовища. Під
час посіву тампоном чашку дещо відкривають однією рукою, тампоном торкаються
поверхні агару біля краю чашки і починають проводити посів штрихами від краю
до краю чашки, втираючи обережно матеріал у поверхню середовища, не
пошкоджуючи його, поступово обертаючи тампон. Після проведення посіву чашку
обертають на 90° і повторюють посів перпендикулярно до попереднього. Під
час посіву уколом у стовпчик живильного середовища пробірку з м’ясо-пептонним агаром, желатином тощо беруть у ліву руку,
петлю з матеріалом – у праву і роблять укол до дна пробірки в середовище.
Петлю обережно виймають, а пробірку закривають. 5.6.3. Посів матеріалу в товщу живильного середовища Перед
посівом матеріал повинен бути в рідкому стані. Стерильною градуйованою
піпеткою набирають 0,1, 0,5 або 1,0 мл матеріалу і виливають його в стерильні
чашки Петрі. Після цього матеріал заливають 15–20 мл розтопленого й
охолодженого до 45–50 °С МПА. Обережно похитуючи чашку, круговими рухами по
поверхні стола перемішують у ній матеріал, досягаючи рівномірного розподілу в
середовищі. Чашку залишають закритою до повного застигання агару, а потім
перевертають догори дном. Для
того, щоб виділити чисту культуру мікроорганізмів, слід відокремити численні
бактерії, які знаходяться в матеріалі, одна від одної. Це можна досягнути за
допомогою методів, які засновані на двох принципах – механічному і
біологічному роз’єднанні бактерій. Метод
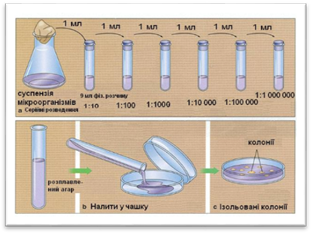
послідовних розведень, запропонований Л. Пастером, був одним із найперших,
який застосовувався для механічного роз’єднання мікроорганізмів. Він полягає
в проведенні послідовних серійних розведень матеріалу, який містить мікроби,
в стерильному рідкому живильному середовищі. Цей прийом достатньо кропіткий і
недосконалий в роботі, оскільки не дозволяє контролювати кількість мікробних
клітин, які попадають у пробірки під час розведеннь.
Цього
недоліку не має метод Коха (метод пластинчастих розведень). Р. Кох
використовував щільні живильні середовища на основі желатину або агар-агару.
Матеріал з асоціаціями різних видів бактерій розводився у декількох пробірках
з розтопленим і дещо охолодженим желатином, вміст яких пізніше виливався на
стерильні скляні пластини. Після застигання середовища воно культивувалось за
оптимальної температури. У його товщі утворювались ізольовані колонії
мікроорганізмів, які легко можуть бути перенесені на свіже живильне
середовище за допомогою платинової петлі для одержання чистої культури
бактерій.
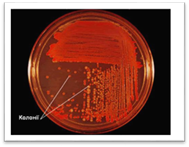
Метод
Дригальського є більш досконалим який широко розповсюджений
в повсякденній мікробіологічній практиці. Спочатку на поверхню середовища в
чашці Петрі піпеткою або петлею наносять досліджуваний матеріал. За допомогою
металевого або скляного шпателя його ретельно втирають у середовище. Чашку
під час посіву тримають привідкритою і обережно
обертають, щоб рівномірно розподілити матеріал. Не стерилізуючи шпателя,
проводять ним посів матеріалу в іншій чашці Петрі, за потреби – в третій.
Тільки після цього шпатель занурюють у дезінфікувальний
розчин або прожарюють у полум’ї пальника. На поверхні середовища в першій
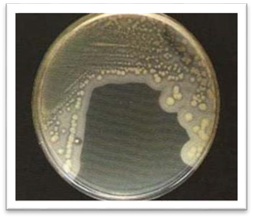
чашці спостерігаємо, як правило, суцільний ріст бактерій, у другій – густий
ріст, а в третій – ріст у вигляді ізольованих колоній. Метод
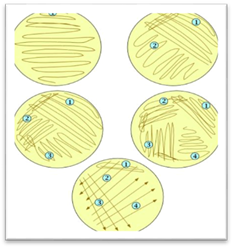
штрихових посівів сьогодні використовують у мікробіологічних лабораторіях
найчастіше. Матеріал, який містить мікроорганізми, набирають бактеріологічною
петлею і наносять на поверхню живильного середовища біля краю чашки. Знімають
надлишок матеріалу і проводять посів його паралельними штрихами від краю до
краю чашки. Через добу інкубації посівів за оптимальної температури на
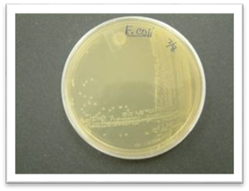
поверхні чашки виростають ізольовані колонії мікробів. Таким
чином, істотна перевага методів пластинчастих розведень Коха, Дригальського і штрихових посівів полягає в тому, що вони
створюють ізольовані колонії мікроорганізмів, які під час інокуляції на інше
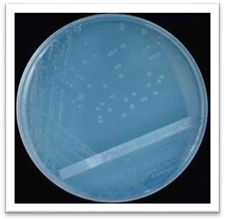
живильне середовище перетворюються в чисту культуру. 5.8. Характеристика колоній за різними ознаками Характеризувати
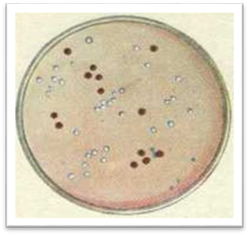
колонії можна за різними ознаками. За величиною (діаметром) їх поділяють на великі
(4–6 мм і більше), середні (2–4 мм), дрібні (1–2 мм), карликові або точкові
(менше 1 мм). Форма колоній може бути найрізноманітнішою: правильно кругла,
неправильна (амебоподібна), ризоїдна. Вони бувають
прозорими, що пропускають світло, і мутними. За
рельєфом і контуром форми у вертикальному розрізі колонії поділяють на
плоскі, опуклі, куполоподібні, краплеподібні, конусоподібні, плоскоопуклі, плоскі, що стеляться по поверхні
середовища, із вдавленим центром, з припіднятою у
вигляді соска серединою. Поверхня
колоній може бути матовою або блискучою, з глянцем, сухою або вологою,
гладенькою або шорсткою. Гладенькі колонії позначають як S-форми (smooth – гладенький), а шорсткі – R-форми (rough – шорсткий, нерівний). Форма
шорстких поверхонь також може бути різноманітною: зморшкуватою,
бородавчастою, шагреневою, мати радіальну посмугованість
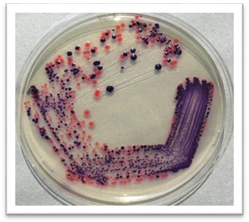
тощо. Переважна
більшість мікроорганізмів утворює безбарвні колонії або мутно-молочного
кольору. Однак деякі з них формують кольорові колонії. Їх колір визначається
пігментом, який синтезують бактерії: білі, кремові, жовті, золотисті, сині,
червоні тощо. Під
час доторкання до колонії петлею можна визначити її консистенцію:
пастоподібна, в’язка або слизова, суха, крихка тощо. На
рідких живильних середовищах бактерії також можуть рости по-різному, хоча
особливості проявів росту бідніші, ніж на щільних. Бактерії
здатні викликати дифузне помутніння середовища, колір його при цьому може не
змінюватись або набуває кольору пігменту. Такий характер росту найчастіше
спостерігається у більшості факультативно-анаеробних мікроорганізмів. Деколи
відбувається утворення осаду на дні пробірки. Він може бути крихтоподібним, гомогенним, в’язким, слизистим та ін.
Середовище над ним може залишатись прозорим або ставати мутним. Якщо мікроби
пігменту не утворюють, осад має сірувато-білий або жовтуватий колір. Подібним
чином ростуть, як правило, анаеробні бактерії. Пристінковий
ріст проявляється утворенням пластівців, зерен, прикріплених до внутрішніх
стінок пробірки. Середовище при цьому залишається прозорим. Аеробні
бактерії мають тенденцію до поверхневого росту. Часто утворюється ніжна
безбарвна або голубувата плівка у вигляді ледь помітного нальоту на поверхні,
яка зникає під час струшування або збовтування середовища. Плівка може бути
волога, товста, мати в’язку, слизисту консистенцію та прилипати до петлі,
тягнучись за нею. Однак, зустрічається й щільна, суха, крихка плівка, колір
якої залежить від пігменту, який виробляють мікроорганізми.
Питання для самоконтролю 1. З якою метою в живильні середовища додають агар? 2. Назвіть прості (універсальні) живильні середовища? 3. З якою метою застосовують спеціальні живильні
середовища? 4. Яке м'ясо використовують для
виготовлення м’ясної води? 6. Як подовжити життєдіяльність мікробів? 7. З якою метою проводять посів мікробів на
живильні середовища? |
||||||||||||||||||||||