|
|
МЕДИЧНЕ ПРАВО
ЧАСТИНА II Електронний
посібник |
|||||||||||||||||||||||||||||||||||||
|
12. Правове регулювання провадження фармацевтичної діяльності. Правовий
порядок застосування лікарських засобів |
||||||||||||||||||||||||||||||||||||||
|
1. Правові засади
фармації в Україні 2. Поняття і правовий
статус фармацевтичних працівників 3. Провадження
фармацевтичної практики. Реклама лікарських засобів 4. Юридична
відповідальність фармацевтичних працівників за професійні правопорушення 5. Патентування
лікарських засобів 6. Державний
контроль якості лікарських засобів в Україні 1. Правові засади фармації в Україні На сьогодні промислове виробництво фармацевтичної
продукції в Україні здійснюють близько 120 підприємств. Основні ознаки фармації в Україні: · значна частка імпортних медичних препаратів; · переважання серед продукції застарілих препаратів; · клінічно
неефективні лікарські засоби.
Всіх учасників фармацевтичного ринку України можна
поділити на такі основні групи:
У Державному реєстрі лікарських засобів понад 70%
становлять ліки зарубіжного виробництва.
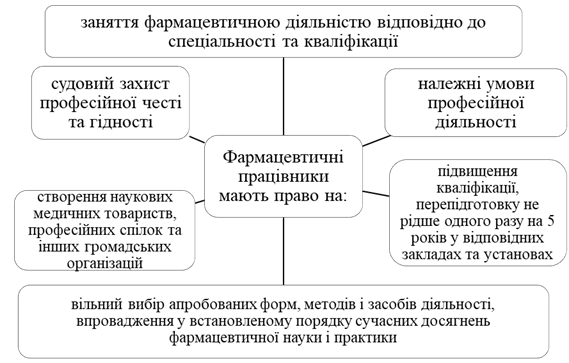
2. Поняття і правовий статус фармацевтичних працівників
Фармацевтичний сектор галузі охорони здоров’я –
сукупність суб’єктів господарювання, що здійснюють діяльність на різних
етапах обігу фармацевтичної продукції, тобто це українські та зарубіжні
виробники, дистриб’ютори та аптечні підприємства. Крім того, фармацевтичний сектор включає
лікувально-профілактичні заклади, адже в них здійснюється фармацевтичне
забезпечення пацієнтів, пацієнти також є частиною цього сектору і споживачі,
які придбавають фармацевтичну продукцію в аптечних закладах.
1. Приклад дотримання прав:
2. Приклад порушення прав
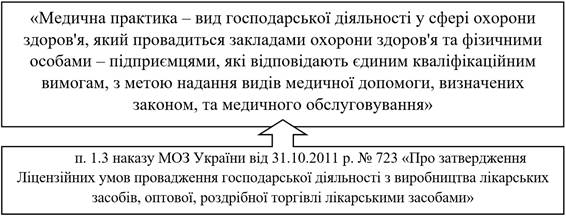
3. Провадження фармацевтичної практики. Реклама
лікарських засобів
Інформація про лікарські засоби:
Публікується у виданнях, призначених для медичних та фармацевтичних
працівників, а також у матеріалах, що розповсюджуються на спеціалізованих
семінарах, конференціях, симпозіумах з медичної тематики.
Переліком лікарських засобів, заборонених
до рекламування, є дані Державного реєстру лікарських засобів України. Критерії:
Згідно з ч.13 ст.21 Закону України «Про реламу»
положення цієї статті не поширюються на рекламу лікарських засобів і
медвиробів, «яка розміщується в спеціалізованих виданнях, призначених для
медустанов та лікарів». У той же час ніде не вказується, яке видання можна
вважати спеціалізованим. 4. Юридична відповідальність фармацевтичних працівників
за професійні правопорушення
КУпАП } Стаття 442.
Порушення обмежень, встановлених для медичних і фармацевтичних працівників
під час здійснення ними професійної діяльності Основи законодавства про охорону здоров’я, стаття 78-1 } Стаття 78-1. Обмеження, встановлені
для медичних і фармацевтичних працівників під час здійснення ними професійної
діяльності } Стаття 424. Продаж лікарських засобів без рецепта у заборонених законодавством
випадках } Стаття 18810.
Невиконання законних вимог посадових осіб органів державного контролю за
якістю лікарських засобів та умовами їх виробництва Кримінальний кодекс України } Стаття 320. Порушення встановлених правил обігу
наркотичних засобів, психотропних речовин, їх аналогів або прекурсорів } Стаття 321. Незаконне виробництво, виготовлення,
придбання, перевезення, пересилання, зберігання з метою збуту або збут
отруйних чи сильнодіючих речовин або отруйних чи сильнодіючих лікарських
засобів } Стаття 321-1. Фальсифікація лікарських засобів або обіг
фальсифікованих лікарських засобів Відомчі норми } Наказ МОЗ України
від 01 серпня 2000 р.№ 188 "Про затвердження таблиць невеликих,
великих та особливо великих розмірів наркотичних засобів, психотропних
речовин і прекурсорів, які знаходяться у незаконному обігу" } Наказ МОЗ України від 31 серпня 2007 р. № 511 "Про
затвердження Великих та особливо великих розмірів отруйних та сильнодіючих
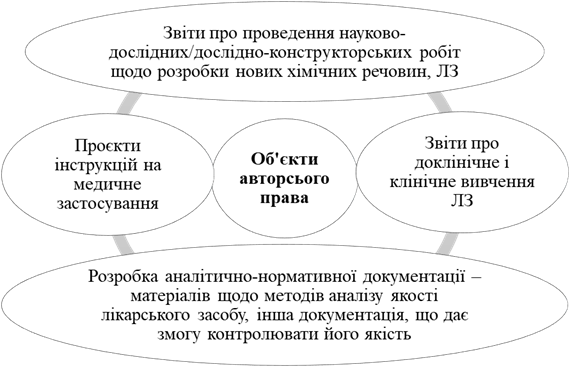
лікарських засобів, які знаходяться у незаконному обігу" 5. Патентування лікарських засобів
Корисні моделі:
Промислові зразки: зовнішній вигляд
ЛЗ (форма таблеток, упаковка тощо). Запатентувати порошок препарату як промисловий зразок –
не дозволяється, при тому що звичайними промисловими зразками у фармакології
є форма препаратів, таблеток, капсул. Форма таблеток ЛЗ постійно
вдосконалюється для зручнішого їх вживання; відповідні вдосконалення і
нововведення патентуються. Звичну для нас циліндричну форму таблеток смужкою
посередині – теж запатентовано. Винаходи. Категоріями винаходів є:
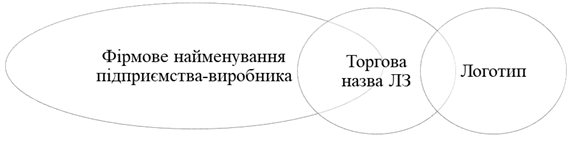
Комерційні позначення
Комерційна таємниця (ноу-хау, секрети
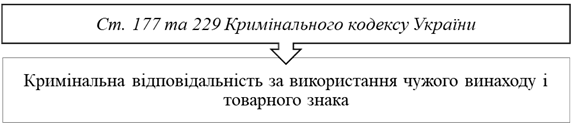
виробництва) Порушення прав ІВ: } використання об’єкта ІВ без належного дозволу власника
прав; } застосування такого продукту; } висунення на продаж, і через інтернет також; } продаж, імпорт (ввезення) та інше введення його в
цивільний оборот, } зберігання такого продукту в зазначених цілях тощо. Процедура судового захисту торгових марок має певну
специфіку, бо потребує підходу, що базується на спеціальних знаннях у галузі
хімії, фармакології та медицини.
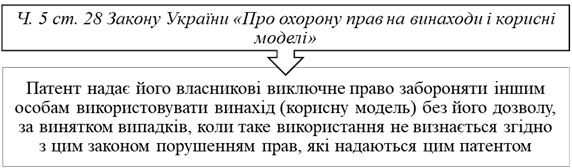
Порушенням прав власника патенту є будь-яке зазіхання
на права власника патенту,, що
тягне за собою відповідальність відповідно до норм чинного законодавства
України. Положення про захист прав ІВ на торговельну марку
міститься, передусім, у статтях 423,
424, 426, 431, 432, 495 ЦК України та у спеціальному законі України, що
стосується сфери захисту прав ІВ на торговельну марку, а саме – у ст. 16, 20, 21 Закону України «Про охорону
прав на знаки для товарів і послуг». 6. Державний контроль якості лікарських засобів в
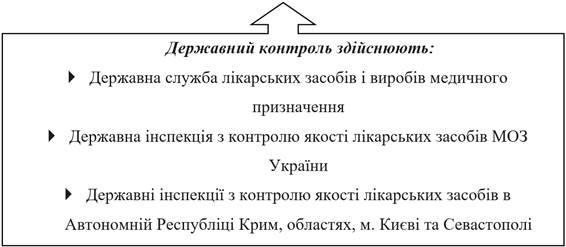
Україні Державний контроль якостi лiкарських засобiв регламентується
Законом України «Про лiкарськi засоби» роздiл 4.
Здійснюється органами виконавчої влади в межах повноважень,
визначених законодавством України.
На територію України можуть ввозити лікарські засоби: } зареєстровані в Україні; } за наявності сертифіката якості про відповідність серії
цього засобу вимогам аналітичної нормативної документації, виданого його
виробником.
Державний контроль здійснюється шляхом:
Лабораторному аналізу підлягають зразки лікарських засобів:
За результатами державного контролю посадова особа
органу державного контролю складає протокол за формою, що затверджується МОЗ
України. На підставі протоколу орган державного контролю протягом
десяти робочих днів після подання суб’єктом господарювання заяви на видачу
висновку (крім випадків, коли проведення лабораторного аналізу відповідно до
аналітичної нормативної документації передбачає триваліший строк) видає
заявнику висновок. Висновок оформляють у двох примірниках, з яких один
видають суб’єкту господарювання, другий зберігається в органі державного
контролю. У разі видачі позитивного висновку обіг ввезеного
лікарського засобу здійснюється на всій території України. У разі видачі негативного висновку вчиняються дії,
передбачені зовнішньоекономічними контрактами та (або) нормативно-правовими
актами (вилучення з обігу, утилізація, знищення тощо). Результати державного контролю можуть бути оскаржені в
установленому законодавством порядку. Спеціальні
нормативно-правові акти
Питання самоконтролю 1. Проаналізуйте законодавство у сфері забезпечення
населення лікарськими засобами. 2. Охарактеризуйте процедуру патентування лікарських
засобів. 3. Як здійснюється державний контроль якості лікарських
засобів? 4. Визначте юридичні гарантії забезпечення лікарськими засобами
і засобами медичного призначення окремих категорій населення в Україні. 5. Дайте правову оцінку права та обов’язкам
фармацевтичних працівників. |
||||||||||||||||||||||||||||||||||||||