|
|
ІНФЕКЦІЙНІ ХВОРОБИ КОНЕЙ Електронний посібник |
||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||
|
1.11. Родококова інфекція коней 1.1. Сап (Mallеus) Сап (Mallеus – лат., Morve – фр., Mürde – нім.,
Glanders and Farcy – англ.) – хронічна хвороба однокопитних тварин, що
характеризується утворенням на слизових оболонках носа, на шкірі та у
внутрішніх органах специфічних вузликів і виразок, схильних до казеозного
розпаду. До сапу сприйнятлива людина. Історична довідка Клінічні ознаки сапу були описані ще в стародавній Греції (Арістотель,
Апсірт, ІV ст. до н. е.). 1783 році. Оскандес описав зараження людини від
коня. 1881 р. Бабеш виділив збудника із гнійної виразки людини, хворої на
сап. Збудника хвороби відкрили Леффлер і Щютц – у 1882 році. У 1883 р.
Васільєв М.П. виділив збудника з крові людини, хворої на сап. У 1891 р.
незалежно один від одного Х.І. Гельман у Петербурзі, О.І. Кальнінг у Дерпті
приготували малеїн, який до нашого часу застосовують в алергічній діагностиці
сапу. У 1907 р. Щютц і Шуберт для виявлення сапу запропонували РЗК. У ХІХ ст.
та на початку ХХ ст. сап був дуже поширений у багатьох країнах світу, зокрема
Росії, де збитки, яких він завдав тільки у 1911 р., становили 0,7% наявного
поголів'я коней. Нині сап реєструється лише в Азії та Африці. З 1940 року
Україна вільна від сапу коней. Збудник хвороби – Burkholderia mallеі. Збудника сапу відносять до типу Proteobacteria, класу Beta-Proteobacteria, порядку Burkholderiales, родини Burkholderiaceae. Історично, збудник відносили до різних родів: Bacillus, Corynebacterium, Mycobacterium, Loefflerella, Pfeifferella, Malleomyces, Actinobacillus та Pseudomonas. У 1992 році на основі результатів секвенування гена
16S рРНК, показників гомології ДНК, складу клітинних
ліпідів і жирних кислот та врахування фенотипових характеристик зі складу
роду Pseudomonas було виокремлено новий рід Burkholderia. До нового роду ввійшли декілька патогенних видів
мікроорганізмів, у тому числі збудник сапу B. mallei, збудник меліоїдозу B. pseudomallei та комплекс опортуністичних патогенів B. cepacia (особливо B. cenocepacia та B. multivorans), що може викликати хронічну інфекцію, а іноді й
смертельну пневмонію та септицемію у людей, хворих на муковісцидоз (кістозний
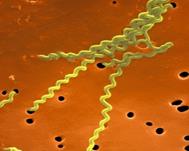
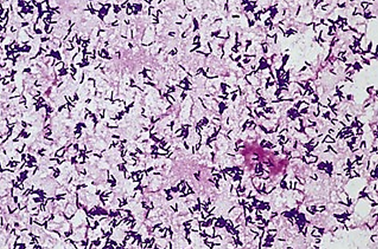
фіброз) та з послабленим імунітетом. Збудник – маленька, (1–5) – (0,3–0,8) мкм, пряма із заокругленими кінцями
нерухома бактерія (рис. 1).
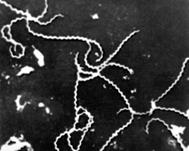
Рис. 1. Збудник сапу під мікроскопом В мазках з патологічного матеріалу та живильних середовищ збудник часто
має вигляд коротких ланцюжків чи ниток (рис. 2).
Рис. 2. Збудник
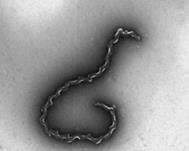
сапу в мазках з патологічного матеріалу Спор і капсул не утворює, добре забарвлюється усіма аніліновими фарбами,
за Грамом – негативно (рис. 3).
Рис. 3. Збудник сапу (фарбування за Грамом) (ttp://medicine-live.ru/atlas/micro/samples/m108u.jpg) У препаратах, забарвлених синькою Леффлера або фарбою Гімзи, добре
виявляється зернистість внутрішньої структури мікроба. У рідкому МПБ –
змутніння, пристінне кільце (2-га доба), що перетворюється у слизову плівку з
нитками донизу. На МПА – плоскі, гладенькі, напівпрозорі колонії з
перламутровим відблиском (2-га доба) (рис. 4).
Рис. 4. Колонії
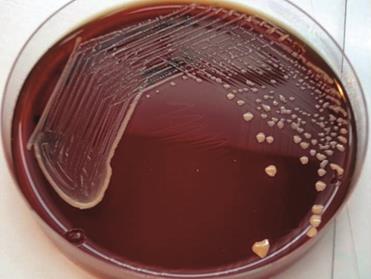
сапної палички на МПА Потім зливаються у густі нашарування тягучого слизу жовтуватого кольору. На кров’яному агарі – дрібні, коричневі, медоподібні колонії. Добре росте
на звичайних живильних середовищах з додаванням 1–5% гліцерину, зокрема на
гліцеринізованій картоплі, де збудник сапу утворює слизові колонії
брунатно-жовтого або буро-коричневого кольору. На гліцериновій картоплі – на
1-у добу дрібні, прозорі, на 2-у добу медоподібні колонії, що згодом
зливаються у суцільне коричнево-руде нашарування (рис. 5).
Рис. 5. Ріст
колоній на гліцериново-картопляному агарі Стійкість збудника незначна: у воді та гниючих матеріалах сапні бактерії
зберігаються до 30 діб, у висушених носових виділеннях – до 15 діб, у сечі –
4 год. Сонячне проміння руйнує бактерії сапу через 24 год, нагрівання до
температури 80°С – через 5 хв. Суспензія хлорного вапна з вмістом 5%
активного хлору, розчин карболової кислоти (2%-й), їдкого натру (1%-й),
лізолу чи креоліну (3%-й) надійно інактивують збудника сапу. Епізоотологія хвороби. На сап у природних умовах
хворіють однокопитні тварини: коні, осли, мули (рис.
6). лошаки (рис.
7).
Рис. 6. Мул звичайний
Рис. 7. Зовнішній вигляд лошака Доведено природну сприйнятливість до сапу верблюдів (рис. 9).
Рис. 9. Зовнішній вигляд верблюда Чутливі також хижі тварини – леви, тигри, пантери, рисі, які можуть
заражатися під час поїдання м'яса хворих коней. Серед левів, леопардів,
пантер, тигрів, рисів та інших хижих з родини котячих – летальні спалахи
(рис. 10).
Рис. 10. Чутливі
до сапу представники диких хижих тварин Бурі та білі ведмеді заражуються через м’ясо хворих (проявляються ознаки
септицемії та закінчується летально) (рис. 11).
Рис. 11. Білий та бурий ведмеді – також чутливі до сапу Із лабораторних тварин особливо чутливі до сапу коти, що гинуть у разі
гострого перебігу хвороби на 10–14-ту добу, а також морські свинки, польові
миші. Джерелом збудника інфекції є хворі коні та тварини з латентним
перебігом сапу, які виділяють сапні бактерії переважно з носовим слизом та
секретом шкірних виразок. Зараження відбувається аліментарним шляхом з інфікованим кормом, водою, а
також під час безпосереднього контакту хворих тварин зі здоровими, рідше –
аерогенним шляхом (рис. 12).
Рис. 12. Коні на пасовищі Можливе передавання збудника під час парування (рис. 13).
Рис. 13. Природне парування коней Сап поширюється серед коней повільно, оскільки під час хронічного
перебігу, особливо за латентної форми, збудник не завжди виділяється у
зовнішнє середовище. Однак у разі стійлового утримання в тісних вологих
стайнях, у погано вентильованих конюшнях, в умовах загальних годівниць і
водопою хвороба за короткий час може охопити значне поголів'я і набути
характеру стаціонарної ензоотії (рис. 14).
Рис. 14. Стійлове утримання коней в
тісних вологих стайнях У країнах, стаціонарно неблагополучних щодо сапу, інфекція часто
проявляється латентно, без прояву клінічних ознак, а в деяких інфікованих
коней навіть випадає реакція на малеїн. Завезення таких коней у благополучні
країни або в інші природно-кліматичні зони, різка зміна умов утримання,
годівлі та непомірна експлуатація можуть призвести до загострення
інфекційного процесу, раптового непередбаченого спалаху сапу серед чутливих
тварин. Патогенез. Потрапивши в організм, збудник
хвороби проникає в лімфатичні та кровоносні судини і розноситься в різні
органи й покривні оболонки. Найчастіше сапний процес локалізується в легенях
(84–100% випадків), носовій порожнині (75–95%) та шкірі (до 13%); інші органи
уражуються значно рідше. В місцях розмноження збудника розвивається
специфічний запальний процес з утворенням сапних вузликів, схильних до
розпаду з наступною інкапсуляцією та звапненням. В організмі резистентних
тварин інкапсуляція та відмежування сапних вузликів від здорової тканини
відбувається відносно швидко, інфекційний процес набуває хронічного перебігу,
можливе навіть видужування хворих коней (рис. 15).
Рис. 15. Схема
патогенезу при сапній інфекції За низької резистентності організму збудник проникає в суміжні неуражені
тканини органу, поряд з первинними осередками виникають численні вторинні
вузлики продуктивного типу. Останні, розпадаючись, зливаються і утворюють
характерний звапнений сапний фокус. Дифузні форми сапного процесу в легенях
набувають вигляду лобулярно-лобарної пневмонії з утворенням каверн і
закінчуються загибеллю тварини. В носовій порожнині некротичний розпад
вузликів призводить до утворення виразок і навіть руйнування носової
перегородки. При ураженні шкірного покриву в ділянці голови, шиї й тазових
кінцівок утворюються дрібні вузлики та гнійні виразки. В організмі особливо чутливих тварин (ослів, мулів, м'ясоїдних тварин)
розвивається міліарна форма сапу з утворенням множинних вузликів і виразок,
які розпадаються на слизових оболонках, шкірі, внутрішніх органах, зумовлюючи
характерну патологію. Перебіг інфекційного процесу в заражених тварин
супроводжується утворенням специфічних антитіл та алергізацією організму.
Алергічні реакції з'являються при сапі через 2–3 тижні після зараження і
зберігаються тривалий час, не визначаючи при цьому ступінь активності
патологічного процесу. Клінічні ознаки та перебіг
хвороби. Інкубаційний період триває 2–3 тижні. Перебіг хвороби гострий, хронічний
і латентний. За місцем основної локалізації патологічного процесу розрізняють
носову, шкірну та легеневу форми
сапу. Гострий перебіг хвороби часто
спостерігають у ослів та мулів, рідко – у коней. Характеризується гарячкою
(41–42°С), втратою апетиту, частим ниткоподібним пульсом, гіперемією слизової
оболонки носа, прискореним диханням, одно – або двобічними слизовими
виділеннями з носа, нечастим сухим кашлем (рис. 16, 17, 18).
Рис. 16. Двобічні
слизові виділення з носа у хворого на сап коня (http://www.myshared.ru/slide/762861/)
Рис. 17. Двобічні
слизові виділення з носа у хворого на сап коня (http://www.myshared.ru/slide/762861/)
Рис. 18. Гострий перебіг сапу в мула Згодом на слизовій оболонці носа з'являються дрібні жовтуваті сапні
вузлики з червоним обідком (рис. 19).
Рис. 19. Сапні ураження
слизової оболонки носа Вузлики розпадаються і перетворюються на виразки, що мають круглу або
довгасту форму, салоподібне дно, вкрите слизом з домішками гною й крові,
нерівні потовщені краї (рис. 20).
Рис. 20. Сапні виразки Виділення з носа стають кров'янисто-іхорозними, дихання – сопучим,
прискореним (рис. 21).
Рис. 21.
Кров'янисто-іхорозні виділення з носових ходів Підщелепові лімфовузли на початку хвороби припухлі, гарячі та болісні,
згодом різко збільшуються в розмірі (до величини курячого яйця), тверді,
нерухомі, горбисті (рис. 22).
Рис. 22. Підщелепові
лімфовузли на початку хвороби Сапні вузлики та гнійно-некротичні виразки виявляють також на шкірі
голови, шиї, задніх кінцівок, прецупія та мошонки, рідше – на інших ділянках
тіла. Уражені кінцівки набрякають, спостерігається кульгавість (рис. 23, 24).
Рис. 23. Уражені сапом кінцівки
Рис. 24. Сапні
вузлики та гнійно-некротичні виразки на шкірі Наприкінці 2–4-го тижня носові ходи забиваються кров'янисто-іхорозними
масами, які під час кашлю та фиркання виділяються назовні. Стан хворих тварин
різко погіршується, швидко настає виснаження. Хвороба триває 8–30 діб, потім
переходить у хронічну форму або закінчується загибеллю тварини. Для хронічного перебігу
хвороби, який частіше спостерігається у коней, характерні гарячка
непостійного типу, нечастий сухий кашель, емфізема легень, раптові носові
кровотечі, однобічне збільшення, горбистість і безболісність підщелепових
лімфовузлів, набряки в ділянці мошонки чи вимені, схуднення, втрата
працездатності, іноді слоновість однієї з задніх кінцівок. У коней на
слизовій оболонці носової порожнини виявляють дуже типові для сапу білуваті
плями або рубці зірчастої форми, що утворились внаслідок загоювання сапних
виразок. Хвороба триває від багатьох місяців до кількох років. У разі зниженої
резистентності організму хронічний перебіг може загострюватись і проявлятись
клінічною картиною сапу. Латентний перебіг сапу спостерігається в
стаціонарно неблагополучних пунктах, може тривати роками. Характеризується
повною відсутністю будь-яких клінічних ознак хвороби або функціональних
розладів. Наявність інфікованих тварин установлюють лише на основі позитивних
результатів алергічних та серологічних досліджень. У хижих тварин сап має гострий перебіг, проявляється слизово-гнійними або
кров'янистими виділеннями з носа, чханням, кульганням на одну із задніх
кінцівок (часто первинна ознака захворювання), виразками на шкірі спинки
носа, кінцівок, хвоста. Загибель настає наприкінці першого чи другого тижня
хвороби. Патологоанатомічні зміни. Якщо діагноз був установлений
зажиттєво, розтинати труп заборонено. В разі розтину виявляють сильне
виснаження загиблої тварини, на слизовій оболонці носової порожнини, в
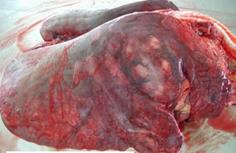
гортані та трахеї визначають виразки й рубці. Сапні вузлики частіше спостерігають у легенях, кількість їх коливається
від поодиноких до дисемінованого ураження органа (рис. 25, 26).
Рис. 25. Сапні вузлики в легенях
Рис. 26. Сапні вузлики у внутрішніх
органах У легенях при гострому перебігу хвороби виявляють також ділянки червоної
гепатизації з осередками гнійного або некротичного розпаду, при хронічному
перебігу – білуваті саркомоподібні розрощення, пронизані гнояками та
осередками звапнення. Сапні вузлики, крім легень, можуть траплятися в
селезінці, печінці, медіастинальних та перибронхіальних лімфовузлах, значно
рідше – в нирках, сім'яниках, м'язах та кістках (рис. 27).
Рис. 27. Сапні вузлики в печінці та серці Діагноз за гострого перебігу сапу, коли клінічні ознаки хвороби дуже
характерні й виражені досить чітко, не викликає труднощів і може
здійснюватись на підставі аналізу клініко-епізоотологічних даних. Лабораторні
дослідження на сап проводять у лабораторіях, які мають дозвіл на роботу зі
збудниками 2–4 групи патогенності. Дослідження здійснюють згідно з Методичними вказівками з діагностики сапу.
До бактеріологічного методу вдаються рідко, оскільки чисту культуру
збудника одержують тільки в разі гострого перебігу сапу і зі значними
труднощами (рис. 28).
Рис. 28. Схема лабораторної діагностики
сапу Для алергічної діагностики проводять очну пробу, для чого застосовують
малеїн, який вводять у кон'юнктивальний мішок у кількості 3–4 краплі,
дворазово з інтервалом 5–6 діб. У період обстеження тварин звільняють від
роботи, утримують на прив'язі, їм не можна згодовувати сухі корми, що містять
багато пилу або плісняви. Очну пробу не можна проводити в разі наявності у обстежуваних тварин
кон'юнктивіту чи іншої патології очей. У таких випадках проводять підшкірну
малеїнізацію. Очна реакція настає через 2–3 год після введення малеїну і
досягає повного розвитку через 6–8 год. Рідше спостерігають запізнілі реакції на 12–24-ту годину, а іноді й пізніше.
Тому перевірку очної реакції після першого введення малеїну проводять через
3–6–9–12 та 24 год. У разі позитивних результатів реакції розвивається
гнійний кон'юнктивіт, що проявляється набряком кон'юнктиви, почервонінням та
припуханням повіки, появою в очній щілині, по краю нижньої повіки значної
кількості гною, що спускається у вигляді шнурка з внутрішнього кута ока.
Сумнівна реакція характеризується гіперемією та набряком кон'юнктиви,
сльозотечою і незначним скупченням гною в куті ока. У разі негативної реакції
спостерігається слабке почервоніння кон'юнктиви та невелика сльозотеча (рис.
29, 30).
Рис. 29. Очна реакція на введення
малеїну: гнійний кон’юнктивіт, набряк конюнктиви,
повік
Рис. 30. Очна реакція на введення малеїну У частини коней з латентним перебігом сапу первинне введення малеїну не
супроводжується добре вираженою алергічною реакцією, відбувається тільки
сенсибілізація кон'юнктиви ока. Лише повторне введення малеїну в те саме око
через 5–7 діб викликає яскраво виражену алергічну реакцію. Перевірку очної
реакції після повторного введення малеїну проводять через 3–6–9–12 год за
тими самими показниками, що й після першого введення. У разі підшкірної малеїнізації в обстежуваного коня впродовж доби три
рази – вранці, вдень і ввечері – вимірюють температуру тіла. Результати всіх
вимірів підсумовують і ділять на кількість вимірювань. Добуте число є
показником середньої температури, яка не повинна перевищувати 38,5°С. Малеїн
вводять обстежуваній тварині в дозі 1 мл підшкірно в ділянці середньої
третини шиї або підгруддя. Температуру починають вимірювати через 6–8 год після введення малеїну
через кожні наступні 2 год впродовж 8–10 год, а потім на 24 і 36-ту годину.
Перевірку підшкірної малеїнізації проводять за показниками температурної,
місцевої та загальної реакції. У сапних коней температурна реакція починається з підвищення температури
тіла через 6–8 год після введення малеїну, досягає максимуму через 12–16 год,
утримується в межах високих показників упродовж 6–8 год, потім починає
спадати. Місцева реакція виражається в розвитку на місці введення малеїну
гарячої, болісної, напруженої припухлості, яка досягає до 24–36-ї години
розміру 10–20 см у діаметрі. Загальна реакція характеризується пригніченням,
втратою апетиту, прискоренням пульсу й дихання, фібрилярним скороченням
м'язів, прискореним виділенням сечі та калу. В окремих тварин можуть
спостерігатись кашель, вологі хрипи, виділення з носа, збільшення
підщелепових лімфовузлів. Реакцію вважають позитивною в разі, коли
спостерігається типове підвищення температури до 40°С і вище за наявності
хоча б незначної місцевої реакції. Однаковою мірою реакцію вважають позитивною,
коли є яскраво виражена місцева реакція і типовий розвиток температурної
кривої. Сумнівною реакцію визначають у тих випадках, коли температурна крива
типова, але температура не підвищується понад 39,6°С і місцева реакція
виражена слабко. Підвищення температури до 39°С за відсутності місцевої та загальної
реакцій вважають показником відсутності специфічної реакції на малеїн.
Підшкірний метод малеїнізації за діагностичною цінністю рівноцінний очній
пробі, однак складний за технікою виконання і тому до нього вдаються рідко,
лише коли немає можливості провести очну пробу або її показники недосить
чіткі. Серологічна діагностика сапу включає постановку пластинчатої реакції аглютинації (РА) з сапним
кольоровим антигеном або реакцію
зв’язування комплементу (РЗК). Діагноз на сап вважають встановленим в таких випадках: –
виявлення характерних
для сапу змін у внутрішніх органах і тканинах; –
виділення культури із
патологічного матеріалу з властивостями, характерними для збудника сапу; –
отримання позитивних результатів
біологічного дослідження, навіть якщо культури збудника із вихідного
матеріалу не виділені. Диференційна діагностика. Передбачає необхідність
відрізняти носову форму сапу від миту та шкірну форму від епізоотичного
лімфангоїту. Під час захворювання на мит розвивається гнійне запалення
слизової оболонки носової порожнини без утворення виразок, супроводжується
абсцедуванням підщелепових лімфовузлів. Під час мікроскопічного дослідження
гною виявляють збудник хвороби – митний стрептокок. У разі епізоотичного
лімфангоїту в досліджуваному гною з виразок виявляють криптококи. В усіх
сумнівних випадках проводять очну малеїнізацію коней. Лікування заборонене у зв'язку з його
високою потенційною небезпекою для людини. Інфікованих збудником сапу коней знищують. Імунітет при сапі не вивчений.
Доведено, що в стаціонарно неблагополучних зонах тварини набувають значної
стійкості до інфекції, а в табунах хворіє лише незначна частина
сприйнятливого поголів'я. Усі спроби виготовлення вакцини та гіперімунної сироватки
проти сапу закінчились невдачею. Профілактика та заходи боротьби при сапі регламентовані чинним
ветеринарним законодавством, а саме: Інструкцією щодо профілактики сапу
в Україні від 21 жовтня 2010 року. Профілактика
досягається запобіганням занесенню збудника в Україну та систематичним
контролем за благополуччям поголів’я. Усіх дорослих коней на території
держави обстежують на сап один раз на рік шляхом клінічного огляду і
дослідженням сироваток крові в реакції аглютинації (РА) в акредитованій ДЛВМ. У разі підозри щодо захворювання на сап передбачається контрольний
діагностичний забій, патологоанатомічне та лабораторне дослідження
патологічного матеріалу. При комісійному підтвердженні діагнозу негайно
знищують усю групу (табун) тварин, у якій виявлені інфіковані тварини,
організовують карантинні заходи в осередку інфекції та в неблагополучній
зоні. Для дезінфекції зовнішнього середовища застосовують 10–20% розчини
хлорного вапна, що містять 3% активного хлору, 20% суспензію свіжегашеного
вапна, 4% гарячий розчин їдкого натру, 5% розчин лізолу з розрахунку 1 л/м2
за 2-годинної експозиції. Гній спалюють. Рідкі стічні води засипають хлорним
вапном із розрахунку 200 г/л і ретельно перемішують. Господарство оголошують
благополучним щодо сапу через 2 міс. після знищення інфікованих тварин і
тварин, що з ними контактували, та проведення всього комплексу остаточних
заходів. 1.2. Мит (Adenitis
eguorum)
Мит (Adenitis eguorum) – гостре контагіозне
захворювання коней, що характеризується гарячкою, катарально-гнійним
запаленням слизової оболонки носоглотки та гнійними абсцесами реґіонарних
лімфатичних вузлів, переважно підщелепових. Історична довідка Вперше клінічну картину миту описав у 1664 р. французький учений
Золлейзель. Збудник хвороби був виявлений Шютцем, Ієнсеном, Зандом (1888).
Експериментальним зараженням лошат культурою стрептокока І.Я. Садовський
(1945) поклав кінець багаторічній дискусії відносно первинної ролі
Streptococcus egui в етіології миту. Мит є досить поширеним захворюванням
коней у країнах з помірним і холодним кліматом. Хвороба завдає значних
економічних збитків конярству в зв'язку із затримкою розвитку лошат, втратою
працездатності дорослих коней, витратами на лікування та догляд за хворими
тваринами. В Україні мит коней реєструється спорадичними випадками, наприклад у 1988 році у Львівській і Волинській, у 1989 році – у
Дніпропетровській і Кіровоградській, у 1995 році – у Вінницькій і Луганській
областях. Клінічний прояв хвороби у більшості випадків проявляється після
завезення з різних господарств. Збудник хвороби – Streptococcus egui (митний стрептокок) – у мазках з патологічного
матеріалу виявляється у вигляді звивистих ланцюжків різної довжини, що
складаються з багатьох ледь сплющених поперечно, окремих коків розміром від
0,4 до 1 мкм (рис. 31).
Рис. 31. Збудник миту Митний стрептокок нерухомий, спор не утворює. В організмі тварин та на живильних
середовищах свіжовиділені стрептококи мають капсулу, яка добре виявляється
під час забарвлення за методом Буррі. У культурах, одержаних на звичайних живильних середовищах з добавлянням
кінської сироватки крові або глюкози, митний стрептокок утворює порівняно
короткі ланцюжки, які добре забарвлюються усіма аніліновими фарбами, за
Грамом – позитивно (рис. 32).
Рис. 32. Митний стрептокок (фарбування за
Грамом) Митний стрептокок продукує гемотоксин, лейкотоксин та агресини. На
кров'яному агарі спричинює гемоліз (рис. 33).
Рис. 33. Колонії
митного стрептококу на кров'яному агарі Збудник хвороби досить стійкий у зовнішньому середовищі. У сухому гною
зберігається не менш ніж один рік, на підлозі стаєнь – до 9 міс, у гноївці –
до 4 тижнів, у воді – до 9 діб, у сіні, соломі – 18–22 доби, на шерсті коней
– до 30 діб. Нагрівання до температурт 70 – 75°С руйнує митний стрептокок
через 1 год, сонячне випромінювання – через 6–8 год, кип'ятіння – миттєво.
Розчини формаліну (2%-й), карболової кислоти (5%-й) та емульсія креоліну
(3%-на) інактивують збудника впродовж 10–15 хв. Епізоотологія хвороби До миту сприйнятливі лише коні
віком переважно від 6 міс до 5 років. Рідко захворювання відмічають у
лошат-сисунів 1–2-місячного віку та дорослих коней (рис. 34).
Рис. 34 Сприйнятливі до миту коні До експериментального зараження чутливі кошенята й білі миші. Джерелом збудника хвороби можуть бути як клінічно хворі коні, так і
перехворілі тварини, в яких митний стрептокок тривалий час міститься на
слизових оболонках верхніх дихальних шляхів. Установлено також носійство
стрептокока у здорових коней, що не хворіли на мит, чим пояснюються випадки
спонтанної появи хвороби в благополучному господарстві, без занесення
збудника ззовні. З організму хворих коней збудник виділяється переважно з
носовим слизом і гноєм з абсцесів. Природне зараження здійснюється через корми
та воду, забруднені виділеннями хворих тварин (рис. 35, 36).
Рис. 35. Аліментарне зараження митом
Рис. 36. Можливе зараження митом через
воду Доведено можливість повітряно-краплинної інфекції. Зараження можливе також за безпосереднього контакту здорових коней з
хворими. Поява хвороби в благополучних господарствах зазвичай пов'язана з
уведенням нових тварин, однак можливі випадки спонтанного захворювання
молодняку внаслідок різкого зниження природної опірності організму та
наявності носійства митного стрептокока у здорових коней. Мит спостерігається
частіше в холодну пору року (взимку, рано навесні) і здебільшого проходить
легко, у вигляді спорадичних випадків та незначних ензоотій. Одужання настає
через 2–4 тижні. Летальність не перевищує 5%. Проте за несприятливих умов утримання
(темні, холодні, без достатньої вентиляції стайні) та неповноцінної годівлі
(авітамінози, білкове та мінеральне голодування), тривалих перегонів молодняку,
непомірної експлуатації коней захворювання може набувати значного поширення і
тяжкого перебігу. В таких випадках ензоотія, починаючись із захворювання
найбільш ослаблених лошат, упродовж 2–3 міс. охоплює майже все поголів'я
чутливих тварин. Летальність при цьому досягає 30–70%. Патогенез. Потрапивши на слизову
оболонку носоглотки, митний стрептокок починає розмножуватись, спричинюючи
запальний процес, який супроводжується слизисто-серозним, а згодом гнійним
виділенням з носа. Внаслідок гострого запального набряку глотки приймання
корму та води утруднюється, виникає задишка, кашель. Надалі стрептококи лімфогенним шляхом заносяться в підщелепові
лімфовузли, спричинюють їх гнійне запалення, утворення абсцесів. Лімфовузли швидко збільшуються в розмірі, стають щільними, гарячими,
болючими. Через 6–10 діб абсцеси розм'якшуються і прориваються, як правило,
назовні, загальний стан тварини поліпшується, температура тіла знижується до
норми. Згодом поверхня абсцесів заповнюється грануляційною тканиною, через
2–3 тижні настає видужування тварини. Такий перебіг інфекційного процесу є
характерним для типової форми миту. Проте у лошат з низькою резистентністю
мит інколи проявляється в метастатичній формі. У таких випадках збудник хвороби лімфогенним шляхом проникає в
заглоткові, привушні, глибокі шийні лімфовузли й спричинює їх гнійне
запалення. У разі проникнення митного стрептокока в кров виникають
метастатичні абсцеси в легенях, печінці, нирках та інших органах.
Всмоктування токсинів збудника і продуктів розпаду тканин з осередків
запалення призводить до порушення обміну речовин, виникнення пропасниці,
лейкоцитозу та ослаблення серцевої діяльності. Метастатична форма миту,
особливо з ураженням внутрішніх органів, часто закінчується летально (рис.
37).
Рис. 37.
Дворічний поні, хворий на мит. Він абсолютно
дикий і тому важко піддається лікуванню Клінічні ознаки та перебіг
хвороби Інкубаційний період триває 4–12 діб. Перебіг хвороби гострий, у разі
ускладнення – підгострий. Розрізняють типову, абортивну (атипову) та
метастатичну (ускладнену) форми миту. Типова
форма хвороби проявляється підвищенням температури до 40–41°С,
пригніченням, гіперемією кон'юнктиви очей та слизової оболонки носової
порожнини, двобічним виділенням з носа слизисто-гнійного ексудату,
збільшенням та болісністю реґіонарних лімфовузлів, набряком у підщелеповій
ділянці (рис. 38).
Рис. 38.
Збільшення лімфатичних вузлів в ділянці нижньої щелепи Спостерігається глухий кашель, дихання стає хрипким, приймання кормів
утруднене, тварина стоїть, широко розставивши передні кінцівки, з витягнутою
вперед шиєю. Уражені лімфовузли починають флуктувати, абсцеси розкриваються,
з них виділяється значна кількість вершкоподібного гною. Згодом поверхня
абсцесу починає вкриватись грануляційною тканиною, загальний стан хворої
тварини поліпшується, поступово настає видужування. Тривалість хвороби –
15–25 діб (рис. 39, 40, 41).
Рис. 39. Нагноєння підщелепових
лімфатичних вузлів
Рис. 40. Гнійне запалення підщелепових
вузлів при миті
Рис. 41. Гнійне запалення підщелепових лімфатичних вузлів при миті у коня Абортивна (атипова) форма хвороби найчастіше спостерігається у підсисних
лошат і проходить без нагноєння підщелепових лімфовузлів. Виявляється
субфебрильна температура тіла (39–39,5°С), незначне збільшення підщелепових лімфовузлів,
катаральне запалення носоглотки, слизове, значно рідше слизисто-гнійне
виділення з носа, порівняно швидке одужання (рис. 42).
Рис. 42. Носові
виділення при миті Тривалість хвороби – 5–7 діб. Метастатична ускладнена форма хвороби проходить дуже тяжко.
Спостерігається утворення абсцесів не тільки в підщелепових, а й у привушних,
заглоткових, шийних, передлопаткових, перибронхіальних, медіастинальних,
брижових та інших лімфовузлах (рис. 43).
Рис. 43.
Метастатична ускладнена форма хвороби Абсцеси можуть виникнути у внутрішніх органах, спинному й головному
мозку, придаткових порожнинах голови з розвитком різних симптомів залежно від
локалізації процесу – менінгіт, оглум, раптова сліпота, гайморит, хронічний
розлад травлення. Виявляється гнійне запалення суглобів. Абсцеси нерідко
розкриваються в порожнину глотки й повітроносних мішків, носолобові пазухи і
спричинюють пневмонію, перитоніт та інші тяжкі ускладнення (рис. 44).
Рис. 44. Ураження голови коня при миті Хвороба триває кілька тижнів, супроводжується гарячкою і часто (50–70%)
закінчується загибеллю тварини внаслідок розвитку піємії та септицемії. У
разі зараження в кобил під час парування розвивається гнійне запалення
слизової оболонки піхви із залученням до запального процесу регіонарних
лімфовузлів та вимені. У хворих тварин виявляються гарячка, значні виділення
з піхви, утворення абсцесів у періанальних лімфовузлах та вимені. У
жеребців-плідників хвороба супроводжується гострим гнійним запаленням
слизової оболонки головки статевого члена, катаральним запаленням
сечовипускального каналу й сечового міхура, орхітом та гнійним запаленням
пахових лімфовузлів. Іноді, мит у 1–2% ускладнюється петехіальною гарячкою (рис. 45)
(кровоп’ятниста хвороба, Morbus maculosus). Виникає вона в сильно ослаблених
коней при затяжному перебігу мита. Хвороба спочатку проявляється утворенням
холодних, щільних, безболісних припухлостей в ділянці нижньої частини голови.
У наступні дні розвиваються великі застійні набряки кінцівок, підгрудка і
живота. Припухлості на шкірі тулуба іноді нагадують кропив'яний висип. На слизовій
оболонці носа і кон'юнктиви з'являються точкові та плямисті крововиливи.
Рясні носові виділення набувають червонувато-коричневого кольору, видихуване
повітря набуває гнильного запаху. Відмічається кров’яниста сльозотеча,
кон'юнктива жовтіє. Температура тіла у тварини підвищується до 40–41°С;
виникає сильна задишка; ніздрі широко розкриті, часом наступають ознаки
задухи; тварина потіє. При сприятливому результаті одужання настає на 8–14-й
день, при злоякісному – може настати смерть на 3–7-й день хвороби.
Рис. 45.
«Кровоп’ятниста хвороба» – ускладнення при миті, що
характеризується опуханням голови, нижньої частини черевної стінки Патологоанатомічні зміни. Характеризуються гнійно-катаральним
запаленням слизової оболонки носової порожнини, глотки, придаткових порожнин
голови. В лімфатичних вузлах, вимені та внутрішніх органах грудної порожнини
виявляються гнійні фокуси різного розміру, заповнені вершкоподібним гноєм.
Спостерігаються також дегенеративні зміни в печінці, нирках, міокарді, а при
сепсисі – крововиливи на серозних оболонках і в м'язі серця. Митна
бронхопневмонія характеризується фокусним чи розлитим гнійним запаленням
легень з охопленням передніх і частково задніх часток цього органа. Діагноз. У разі типового перебігу
хвороби діагноз установлюють на підставі характерної клінічної картини. При
абортивній формі вдаються до мікроскопічного дослідження гною із
свіжорозтятих абсцесів у підщелеповій ділянці. Діагноз метастатичного миту,
що супроводжується ураженням зовнішніх лімфовузлів, не викликає труднощів.
При локалізації гнійних фокусів у внутрішніх органах проводять лабораторні
дослідження патологічного матеріалу, взятого від хворих та загиблих тварин. Лабораторна діагностика. Для зажиттєвої діагностики в
лабораторію направляють вміст нерозкритих уражених підщелепових лімфатичних
вузлів, який відбирають під час їх пункції стерильною голкою великого
діаметра. Від трупів загиблих коней направляють шматочки печінки, селезінки,
легень, кров із серця, гній з абсцесів уражених внутрішніх органів.
Патологічний матеріал має бути якомога свіжішим і відібраним з організму
коней, що не піддавались лікуванню. Лабораторні дослідження включають
мікроскопію мазків з патологічного матеріалу, посіви на живильні середовища,
а в разі потреби – зараження лабораторних тварин. Мазки для мікроскопічного дослідження готують із вмісту абсцесів, носових
виділень, паренхіматозних органів, крові, забарвлюють за Грамом або
Романовським – Гімза. У разі позитивних результатів у мазках з крові серця та
органів виявляють поодинокі або попарно розташовані стрептококи, іноді у
вигляді коротких ланцюжків, тоді як у мазках із гною збудник хвороби має
вигляд довгих звивистих ланцюгів (рис. 46).
Рис. 46.
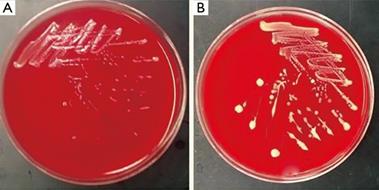
Позитивні результати мікроскопії та підозрілі клінічні ознаки миту У посівах на МПБ і МПА з 10% сироватки крові коня і 1% глюкози ріст
Streptococcus egui супроводжується помутнінням середовища, утворенням ніжних
пухких пластівців, які через 3–5 діб осідають на дно, спричинюючи
просвітлення бульйону. На агарі митний стрептокок виростає у вигляді
маленьких слизистих колоній, які згодом мутнішають і набувають сіро-білого
кольору. На кров'яному агарі стрептококи утворюють росинчасті колонії,
оточені зоною прозорого гемолізу (рис. 47).
Рис. 47. Колонії
Streptococcus equi на кров'яному агарі У тих випадках, коли під час бактеріологічних досліджень не одержано
чітких результатів з виділення та ідентифікації культури, проводять біопробу
на двох білих мишах, яких підшкірно заражають патологічним матеріалом або
виділеною культурою. У разі наявності вірулентного збудника миші гинуть через
2–7 діб після зараження. Лабораторний діагноз на мит вважають установленим
після одержання одного з таких показників: виявлення в мазках з вихідного
матеріалу стрептококів, характерних для миту (за наявності типової клінічної
картини); виділення культури з властивостями, характерними для збудника миту;
загибелі хоча б однієї із двох білих мишей, заражених вихідним матеріалом, з наступним
виділенням від неї культури з властивостями, характерними для збудника миту,
якщо навіть у посівах з вихідного матеріалу культури збудника не виділено.
Термін дослідження – до 10 діб. Диференціальна діагностика. Передбачає виключення
гострого сапу, незаразного риніту й фарингіту. Під час сапу не буває
нагноєння підщелепових лімфовузлів, на слизовій оболонці носа виявляють
специфічні сапні вузлики та виразки. За потреби проводять серологічні та алергічні дослідження на сап. Гнійний
риніт і фарингіт виникають спорадично, не супроводжуються двобічним ураженням
підщелепових лімфовузлів. Лікування. Хворих і підозрюваних щодо
захворювання коней негайно ізолюють в окремі сухі, теплі приміщення без
протягів, забезпечують поживними легкоперетравними кормами (травою, м'яким
сіном, плющеним зернофуражем, коренеплодами, в разі утрудненого ковтання –
бовтанкою з відвійок). Застосовують місцеве і загальне лікування. Щодня
зрошують порожнину носа теплими розчинами перманганату калію (1 : 1000),
фурациліну (1 : 5000), риванолу (1 : 1000), натрію гідрокарбонату (2%-й),
лізолу (0,5–1%-й). Ці розчини, крім механічного видалення гнійного ексудату,
чинять протизапальну та антисептичну дії. Для прискорення дозрівання абсцесів
на ділянку підщелепових лімфовузлів накладають зігрівальну пов'язку. Дозрілі
(флуктуючі) абсцеси розрізають, гній видаляють, порожнину промивають різними
антисептичними розчинами, а потім зрошують йодоформним ефіром (1 : 10) або
20%-м розчином АСД-Ф2. Добрий терапевтичний ефект має також лінімент Вишневського. При типовій
формі миту після розтину абсцесу температура тіла швидко знижується до норми,
поліпшується загальний стан, тварина одужує. Рекомендуються також засоби
загальної терапії. Внутрішньом'язово вводять пеніцилін у дозі 2 тис. од/кг
маси в 0,5%-му розчині новокаїну, біцилін-3 в дозі 10–20 тис. ОД/кг маси по
одному разу на добу 5–7 діб підряд. Можна застосовувати й інші антибіотики
після встановлення чутливості до них митного стрептокока. Терапевтична дія
антибіотиків значно підсилюється у разі використання їх разом з аутокров'ю чи
цитратною кров'ю перехворілих тварин, які вводять підшкірно в дозі 20–70 мл
2–3 рази через кожні 3–4 доби. Разом з антибіотиками призначають
сульфаніламідні препарати (норсульфазол, сульфадимезин) у дозі 10–20 г на добу
з кормами чи водою. Усі препарати використовують до повного видужування. При метастатичному
миті, крім того, внутрішньовенно вводять 4–5 діб підряд 33%-й розчин спирту в
30%-му водному розчині глюкози з добавлянням 1% норсульфазолу по 150–200 мл
на день, а також 25 мл розчину Люголя. Внутрішньовенно вводять по 200–300 мл
камфорної сироватки за Кадиковим і 100 мл 40%-го розчину уротропіну. Як
специфічний засіб лікування застосовують протимитний антивірус (фільтрат
18–20-добової бульйонної культури). Препарат у дозі 50–100 мл вводять
підшкірно в кількох місцях у ділянці шиї та в запалені лімфовузли. Якщо
поліпшення не настає, антивірус ін’єкують повторно через 2–4 доби. У разі
розвитку сильного запалення набряку в ділянці глотки, який супроводжується
асфіксією, проводять трахеотомію. При ускладненні миту підшкірно вводять
20%-й розчин кофеїну в дозі 20 мл, внутрішньовенно – 100 мл 10%-го розчину
хлориду кальцію, 100 мл 40%-го розчину уротропіну. В питну воду додають
соляну кислоту (10 мл на відро). Імунітет. Після перехворювання на мит,
коні набувають стійкого тривалого імунітету. В коней віком понад 5 років
стійкість до митного стрептокока формується без перехворювання, внаслідок
тривалої прихованої імунізації стрептококами, які постійно знаходяться на слизовій
оболонці носоглотки. Засобів специфічної профілактики миту не розроблено (рис. 48).
Рис. 48. Запобіжні заходи за миту коней Профілактика та заходи боротьби. Для профілактики миту
потрібно забезпечувати молодняк повноцінною годівлею, утримувати в сухих,
добре вентильованих приміщеннях, влаштовувати щоденний моціон, постійно
охороняти лошат від впливу простудних факторів (протяги, напування з холодних
вододжерел, перебування під холодним дощем). Щоб запобігти занесенню збудника
миту, комплектування конярських господарств і придбання фуражу слід проводити
лише з благополучних племінних ферм. Після прибуття коней витримують 30 діб у
профілактичному карантині, під час якого ретельно досліджують на відсутність
інфекційних хвороб. Лошат слід утримувати окремо від дорослих коней, які
можуть стати для них джерелом збудника миту. Не рідше одного разу на місяць
треба проводити клінічний огляд усіх коней, профілактичну дезінфекцію
конюшень. У разі появи миту конеферму оголошують неблагополучною, запроваджують
карантинні обмеження. Забороняють виводити з неблагополучної ферми коней і
вивозити фураж, перегруповувати коней всередині господарства. Проводять
поголовний клінічний огляд і термометрію всіх коней. Хворих і підозрюваних
щодо захворювання коней ізолюють і лікують, решту щодня обстежують.
Організовують індивідуальне утримання, годівлю та напування здорових коней.
Денники й станки, де стояли хворі коні, територію навколо конюшень добре
знезаражують. Особливо ретельно очищають і дезінфікують забруднені гноєм
предмети догляду, збрую, годівниці. Гній і підстилку обливають свіжогашеним
або хлорним вапном. Надалі дезінфекцію проводять не рідше одного разу на
тиждень, в ізоляторах – щодня. Стайні, де перебували хворі й підозрювані щодо захворювання тварини,
предмети догляду та реманент дезінфікують 2%-м розчином формальдегіду або
гарячим 5%-м розчином їдкого натру. Гній знезаражують біотермічним способом.
Здорових коней неблагополучної ферми використовують на роботах за умови
виключення контакту їх з кіньми неблагополучних ферм. Після видужування та
обов'язкової 2-тижневої ізоляції коней піддають ретельній дезобробці,
забезпечують повноцінними кормами, поступово залучають до роботи.
Господарство оголошують благополучним і знімають обмеження через 15 діб після
видужування останнього хворого коня та проведення остаточних
ветеринарно-санітарних заходів (поголовний клінічний огляд, остаточна
дезінфекція стаєнь). 1.3. Епізоотичний лімфангоїт (Lymphangitis
epizootica) Епізоотичний
лімфангоїт (лімфангіт) (Lymphangitis epizootica, африканський сап, бластомікоз, гістобласмоз) –
хронічна хвороба однокопитних тварин, що характеризується гнійним запаленням лімфатичних
судин шкіри й підшкірної клітковини та реґіонарних лімфовузлів. Історична довідка Збудник хвороби був виявлений у 1873 р. італійським ученим Рівольта в
гною виразок тварин, підозрюваних щодо захворювання на сап. Хворобу вперше
описали Рівольта і Міччелоне в 1883 році. У Росії в 1897 р. М.Г. Тарковський
опублікував наукову роботу, в якій чітко провів диференціацію епізоотичного
лімфангоїту від сапу. У роки Першої світової війни захворювання набуло
значного поширення на Балканах, під час другої світової війни знову з'явилось
у країнах Середньої Європи, спостерігалось також у колишньому Радянському
Союзі. Нині хвороба у вигляді спорадичних випадків продовжує реєструватися в
низці країн Азії та Африки. Економічні збитки, яких завдає хвороба, визначаються
значними втратами, пов'язаними з вимушеним забоєм інфікованих тварин,
проведенням карантинно-ліквідаційних і профілактичних ветеринарно-санітарних
заходів. Збудник хвороби – грибок Histoplasma farciminosum (Crуptococcus farciminosus) – в
організмі тварин трапляється тільки у формі криптококів (рис. 49, 50).
Рис. 49. Криптококи Histoplasma farciminosum У міцелярній формі грибок знаходиться в зовнішньому оточенні та під час вирощування
його на спеціальних живильних середовищах. У мазках з гною виразок збудник
хвороби має вигляд овальних клітин – криптококів розміром (3–4) – (2,4–3,6)
мкм, з чітко вираженою двоконтурною оболонкою та цитоплазматичними
включеннями. Криптококи часто розміщуються всередині лейкоцитів або купками
чи поодинці поза клітинами.
Рис. 50.
Криптококи Histoplasma farciminosum, зафаготиповані
макрофагами Забарвлюються усіма аніліновими фарбами, за Грамом – позитивно. Для
лабораторних тварин грибок не патогенний. Криптококи культивують на
спеціальних живильних середовищах (агар Сабуро з кров'ю, кров'яний агар) в
атмосфері, що містить 15% СО2 (рис. 51).
Рис. 51.
Грамнегативний мазок культури Histoplasma farciminosum з вузлика коня, хворого на
епізоотичний лімфангіт У культурі криптококи мають круглу або овальну форму, інколи зустрічаються
хламідоспори та короткі нитки міцелію (рис. 52).
Рис. 52. Хламідоспори та короткі нитки міцелію Міцелярна форма грибка вирощується на агарі Сабуро, пептонно-печінковому
агарі, яєчних середовищах, краще з додаванням 2% глюкози, 1% гліцерину та
конячої чи бичачої крові за температури 22–30°С. Ріст грибка виявляється
через 15–20 діб у вигляді сіро-жовтих пухких нальотів на поверхні живильних
середовищ. Згодом колонії грибка стають щільними, складчастими, набувають
жовто-брунатного кольору (рис. 53).
Рис. 53. Колонії
H. farciminosum на агарі після 42 діб
інкубації за температури 26°C Під час мікроскопічних досліджень виявляють септований міцелій і
хламідоспори збудника хвороби. Міцелярні форми грибка в замороженій культурі,
а також у гною та землі зберігаються до 3 міс. Пряме сонячне проміння
інактивує грибок через 10 діб, а нагрівання до 60°С – через 5 хв.
Криптококова форма грибка більш стійка і не руйнується в угноєній землі за
температури 30°С впродовж 11–18 діб, у піску – 2–3 міс., у сухому стерильному
гною – 9 міс. і довше. Епізоотологія хвороби. До захворювання сприйнятливі
однокопитні тварини – коні, мули, віслюки, лошаки, іноді верблюди.
Епізоотичний лімфангоїт частіше вражає дорослих тварин, а лошата, незважаючи
на контакт з хворими кіньми, хворіють рідко. Джерелом збудника хвороби є
хворі тварини, які виділяють величезну кількість криптококів разом з гноєм
абсцесів і виразок. Факторами передавання збудника є гній, підстилка, сіно,
предмети догляду за тваринами, контаміновані гноєм. Зараження виникає
переважно в разі використання знеособлених предметів догляду та збруї, що
були контаміновані гноєм хворих коней, а також за спільного утримання
здорових тварин з хворими. Захворювання спостерігається впродовж усього року, однак частіше восени
та взимку. Хвороба поширюється повільно, трапляється спорадично або у вигляді
невеликих спалахів. Проте в разі незадовільних умов утримання та експлуатації коней
(відсутність індивідуального догляду за кіньми, тяжкі травми шкірного
покриву, випасання по жорсткій траві, чагарниках, надмірна робота) хвороба
може набувати швидкого поширення і злоякісного прояву. Летальність
коливається в межах 10–50%. Патогенез. На місці проникнення збудника
(холка, спина, голова, кінцівки) виникає специфічний запальний процес з
ураженням лімфатичних судин та утворенням вузликів і гнійних фокусів
завбільшки з просяне зерно чи горошину. В резистентному організмі подальше
поширення патологічного процесу не відбувається, гнійні фокуси розсмоктуються
або інкапсулюються, виразки швидко загоюються. У разі зниження резистентності
організму збудник проникає в підшкірну клітковину, зумовлює виникнення
численних нових гнійних фокусів розміром від лісового горіха до гусячого
яйця. Після їх розкривання утворюються глибокі виразки, які, зливаючись,
уражають значні ділянки шкіри, слизових оболонок дихальних шляхів, рота,
статевих органів (рис. 54, 55).
Рис. 54. Ураження лімфатичних судин
Рис. 55. Ураження
лімфатичних судин та утворення
вузликів і гнійних фокусів Одночасно вражаються реґіонарні лімфовузли, які збільшуються в розмірі,
стають щільними й болісними, в них утворюються гнійні фокуси та нориці. Нерідко захворювання ускладнюється умовно-патогенною мікрофлорою. В разі
проникнення криптококів у кров відбувається генералізація процесу, виникнення
гнійних фокусів у внутрішніх органах, що зумовлює сепсис і швидку загибель
тварини. Клінічні ознаки та перебіг
хвороби. Інкубаційний період триває 1–3 міс. Перебіг хвороби – хронічний.
Розрізняють дві форми хвороби – доброякісну та злоякісну. За доброякісної форми хвороби ураження у
вигляді дрібних плоских круглих вузликів, що виступають над поверхнею шкіри,
спостерігаються тільки у верхньому мальпігієвому шарі шкіри в ділянці холки,
спини, шиї та голови, рідше – в ділянках мошонки, прецупія та на слизових
оболонках. Згодом вузлики перетворюються на гнійні фокуси, які розкриваються
і оголюють поверхневі виразки, що швидко загоюються без утворення глибоких
рубців (рис. 56, 57, 58).
Рис. 56. Ураження
кінцівок коня, хворого на епізоотичний лімфангіт
Рис. 57. Шкірні
виразки на голові коня, хворого на епізоотичний лімфангіт Підшкірні лімфатичні судини при цьому не уражуються. В інших випадках
ураження локалізуються в шкірі, вузлики бувають розміром від горошини до
лісового горіха,тверді й болісні при пальпації.
Рис. 58. Вузли і
виразки на шкірі тулуба коня, розташовані за
ходом лімфатичних вузлів Поступово вузлики в центрі розм'якшуються і розкриваються з виділенням
назовні жовтувато-зеленого гною. На їх місці утворюються круглі або овальні
кратероподібні виразки, які повільно загоюються. Поступово з'являються і
повільно загоюються нові ураження, іноді із залученням лімфатичних судин та
вузлів, по ходу яких виявляються шнури та потовщення. Загальний стан тварини
та її вгодованість не порушуються. Ураження слизових оболонок носової й ротової порожнин, зовнішніх статевих
органів супроводжується гіперемією, слизисто-гнійними виділеннями, утворенням
сірувато-жовтих вузликів, які найчастіше розсмоктуються, а виразки, в разі їх
утворення та розкриття, незабаром загоюються. Виявляється також збільшення
підщелепових лімфовузлів, які стають твердими та бугристими. Хвороба триває
3–6 міс. і більше, закінчується видужуванням. За злоякісної форми хвороби ураження
спостерігаються не лише в шкірі, а й у підшкірній клітковині, лімфатичних
судинах та лімфатичних вузлах, по ходу яких утворюється велика кількість
вузлів з наступним розвитком гнійних виразок (рис. 59).
Рис. 59.
Генералізоване ураження шкіри кінцівки У хворих тварин визначаються гарячка, пригніченість, порушення апетиту. Тривалість хвороби – 6–8 міс., іноді рік і більше. Нерідко хвороба
ускладнюється гноєтворною мікрофлорою, яка зумовлює піємію або сепсис. Іноді
на кінцівках спостерігається розростання сполучної тканини, так звана
«слоновість», з утворенням багатьох виразок, що не загоюються. Злоякісна
форма хвороби майже не піддається лікуванню і часто закінчується загибеллю
тварини. Патологоанатомічні зміни. Під час розтину трупів за
ходом уражених лімфатичних судин виявляють різного розміру вузли, гнійні
фокуси та виразки. Сірувато-жовті вузлики та виразки спостерігаються і на
слизових оболонках носової порожнини, гортані, трахеї, статевих органів. За
злоякісної форми гнійні фокуси виявляються також у легенях, печінці,
селезінці та нирках (рис. 60).
Рис. 60.
Гістопатологічний розріз шкірного вузлика коня, хворого на
епізоотичний лімфангіт Діагноз установлюють на основі епізоотологічних даних, клінічних ознак
хвороби та результатів лабораторних досліджень. Лабораторна діагностика. Передбачає мікроскопічні й
бактеріологічні дослідження патологічного матеріалу для виділення та
ідентифікації збудника хвороби. Для дослідження в лабораторію у стерильних
пробірках направляють проби гною, відібраного з нерозкритих гнійних фокусів
та виразок. Наявність у гною криптококів підтверджує клініко-епізоотологічний
діагноз. Диференційна діагностика. Потребує виключення сапу та
виразкового лімфангоїту. Проводять алергічну пробу (офтальмопробу) на сап та
бактеріологічні дослідження для виключення збудника псевдотуберкульозу. Лікування не проводять. Хворих та
підозрюваних щодо захворювання чи зараження тварин знищують і спалюють разом
зі шкурою. Імунітет. Після перехворювання коні
набувають тривалого імунітету. Специфічних засобів профілактики епізоотичного
лімфангоїту не розроблено. Профілактика та заходи боротьби. Для запобігання появі
епізоотичного лімфангоїту потрібно постійно стежити за епізоотичним станом
тих держав і територій, звідки завозять коней. Новоприбулих тварин слід
витримувати в профілактичному карантині й досліджувати за всіма тестами,
передбаченими відповідними інструктивними документами. У спеціалізованих
господарствах з розведення та експлуатації коней важливо стежити за
виконанням вимог відносно індивідуального утримання і закріплення за кожним
конем збруї та предметів догляду. Шкіру коней треба постійно підтримувати в
чистому стані й запобігати травмам, ретельно припасовуючи збрую. Стайні,
збрую, інвентар та предмети догляду потрібно утримувати в чистоті, піддавати
профілактичній дезінфекції. У разі появи захворювання в господарстві запроваджують карантинні
обмеження. Хворих і підозрюваних щодо захворювання коней знищують. Гній,
підстилку та залишки кормів від них спалюють. Підозрюваних у зараженні коней, яких утримували в неблагополучному
приміщенні, через кожні 5 діб клінічно обстежують. Стайні, конов'язі та
загони, в яких утримували хворих і підозрюваних щодо захворювання коней,
ретельно очищають і дезінфікують гарячим 10%-м розчином сірчано-карболової
суміші, просвітленим розчином хлорного вапна, що містить 5% активного хлору,
5%-м розчином формаліну. Збрую очищають і дезінфікують у параформалінових
камерах або 5%-м розчином формаліну. Карантин з господарства знімають через 3
міс. після знищення останнього хворого коня, проведення остаточного очищення
та дезінфекції приміщень і стаєнь. 1.4. Контагіозний метрит (Metritis contagiosa equorum) Контагіозний метрит – висококонтагіозна
хвороба коней, що характеризується вагінітом, втратою відтворювальної функції
у кобил. Історична довідка Хворобу вперше встановили у 1976 р. в Ірландії. У
наступні роки контагіозний метрит зареєстровано в 10-ти країнах Західної
Європи, США, Австралії, Японії. На теренах колишнього Радянського Союзу цю
інфекцію не реєструють. Етіологія. Збудник – гемофільна бактерія, Taylorella
equigenitalis (Haemophilis equigent), що належить до родини Pasteurellaceae,
роду Haemophilus, який нараховує 16 видів. Серед захворювань, що викликають
ці бактерії, найбільш актуальними є гемофільозний полісерозит, гемофільозна
плевропневмонія свиней і контагіозний метрит. Taylorella equigenitalis –
грамнегативна рухлива паличка або кокобактерія, довжиною 5–6 мкм. Збудник
культивується в атмосфері, що містить 5–10% С02, або в анаеробних
умовах за температури 35–37°С. На спеціальних живильних середовищах –
шоколадний і сироватковий МПА, тіогліколевий агар. Ріст колоній
спостерігається не раніше ніж через 48 годин (рис. 61). Рис.
61. Колонії Haemophilis equigent на шоколадному агарі Збудник чутливий до кислого середовища,
антибіотиків. Пеніцилін, ампіцилін, тетрациклін, еритроміцин та ін.
проявляють бактерицидну дію. Епізоотологія. Найчастіше хворіють чистопородні коні.
Зараження відбувається від жеребців під час парування, а також через предмети
догляду, при гінекологічному обстеженні. Заражені жеребці, кобили тривалий
час до наступного парувального сезону залишаються джерелом збудника інфекції.
Лошата, які заражені збудником при родах, залишаються безсимптомними
бактеріоносіями до досягнення ними статевої зрілості. У перехворілих
жеребців-виробників бактерії знаходяться в каналі пеніса і препуція впродовж
декількох років. Патогенез. Збудник проникає в організм через слизові
оболонки статевих органів, розмножується в епітелії статевих шляхів, що
призводить до розвитку сальпінгіту, дифузного ендометриту і вагініту. Клінічні симптоми в більшості
випадків не виражені. У кобил хвороба супроводжується розвитком вагініту.
Інфекційний процес часто ускладнюється секундарною мікрофлорою з розвитком
гнійного процесу. Патологоанатомічні зміни. В
експериментально заражених кобил на розтині знаходили сальпінгіт, цервіцит,
дифузний ендометрит і вагініт. При ускладненнях первинної інфекції вторинною
мікрофлорою знаходять гнійне запалення в органах відтворення. Діагностика. Бактеріоносіїв виявляють бактеріологічними
дослідженнями слизу із статевих органів. Кров від кобил досліджують за РЗК.
Дослідження рекомендується проводити 2 рази на початку охоти і повторно через
7–14 днів. Контагіозний метрит диференціюють від запальних
процесів, що викликаються протеєм, клебсіелами та іншою мікрофлорою. Для серологічної діагностики використовують
реакцію пасивної гемаглютинації, імуноферментний метод, реакцію пригнічення росту.
Серологічна діагностика можлива тільки в кобил у період гострої фази інфекції
і не дає результатів у кобил-хроніків і жеребців. Лікування. Для лікування використовують ампіцилін
парентерально з одночасним промиванням матки і піхви тим же антибіотиком у
дозі 3–4 г щоденно впродовж двох тижнів. Вводять також 5 днів неоміцин. Для попередження тривалого бактеріоносійства
лікування антибіотиками повинно бути інтенсивним. Жеребців лікують шляхом промиванням препуція,
статевого члена і статевого каналу розчинами антибіотиків. Імунітет при контагіозному метриті не вивчений.
Засоби специфічної профілактики не розроблені. Заходи профілактики і боротьби. Запобіжні заходи
проти контагіозного метриту мають загальний характер і спрямовані на запобігання
занесенно збудника інфекції під час завезення коней ззовні. На всіх
новозавезених коней оформляють ветеринарний сертифікат, у якому вказано про результати
досліджень на контагіозний метрит. Коней, що надійшли в господарство, витримують у 30-денному
профілактичному карантині. Позитивно реагуючих коней в країну не допускають.
У країнах, які неблагополучні щодо контагіозного метриту, все поголів'я
племінних коней досліджують перед початком і після завершення парувального
періоду. Під час виникнення захворювання заборонено
виводити коней з господарства до того часу, доки на всіх коней не буде
отримано від'ємний результат бактеріологічного дослідження. Хворих коней
ізолюють і лікують. 1.5. Cальмонельозний аборт (Abortus salmonellosis equorum) Сальмонельозний аборт – інфекційна хвороба жеребних кобил, що проявляється абортами або народженням недоношених лошат. Історична
довідка Хвороба відома в Європі ще з XVIII ст.
Сальмонельозний аборт кобил зустрічається у багатьох країнах Європи, Азії та
Америки, зокрема і в нашій країні. Збитки від хвороби виникають внаслідок
втрати молодняку та порушення племінної роботи. Етіологія.
Збудник хвороби – Salmonella abortus equi рухома, поліморфна паличка із
заокругленими краями, спор не утворює. За Грамом фарбується негативно (рис.
61. А).
Рис. 61. А. Salmonella abortus equi – фарбування за Грамом Росте на звичайних живильних
середовищах, аероб, величиною 1–4 х 0,8 мкм. На МПА утворюються невеликі 1–4
мм круглі з рівними краями колонії, сіро-білого кольору з голубуватим
відтінком; у деяких – по краю колонії випуклий слизовий вал; в МПБ –
інтенсивне помутніння з осадом на дні та поверхневою плівкою або пристінним
кільцем. На середовищі Ендо – прозорі круглі колонії з
рожевим відтінком (рис. 62).
Рис. 62. Колонії сальмонел на агарі Ендо (білі
стрілки) На середовищі Левіна – прозорі круглі колонії з
голубуватим відтінком; На середов. Плоскірєва – безколірні, плоскі,
мутнуваті колонії. На вісьмут-сульфітному агарі – круглі чорні
колонії з металевим блиском (рис. 63).
Рис. 63. Ріст
сальмонел на вісьмут – сульфітному агарі Біохімічні властивості сальмонел: • не ферментують сахарозу, не розкладають
лактозу, не розщепляють сечовину, не утворюють індолу, утворюють сірководень; • ферментують манніт, глюкозу з утворенням
газу. Збудник продукує ферменти, екзо
– і ендотоксини. Поки що добре вивчено ендотоксин. Він термостабільний,
витримує температуру 120°С протягом однієї години. При оральному і
парентеральному зараженні у тварин викликає пронос, судоми, паралічі і смерть
через 12–24 год. Антигенна структура сальмонел Антигенна структура складається з соматичного О-антигену
або джгутикового Н- антигену. О- антиген розташований на поверхні клітини і є
термостабільним комплексом. За О – АГ ділять на серогрупи і на підставі
спільних соматичних антигенів розділяють на 14 серогруп: A, B, C, D, а за
Н-АГ – на серотипи. Для визначення серовару сальмонел
використовують полі- та моновалентні О-сироватки і монорецепторні Н-
сироватки. Біопробу проводять на білих
мишах шляхом внутрішньочеревного зараження. Сальмонели досить стійкі до
фізико-хімічних чинників. У гною, воді, ґрунті зберігаються 9–10 місяців, де
можуть розмножуватись. У замороженому стані зберігаються 5 місяців,
нагрівання до 70–75°С витримують до 30 хвилин, у кімнатній пилюці
зберігаються до 3-х місяців, у сухих фекальних масах – до 4-х років. 3%-ний
розчин їдкого лугу, хлорне вапно, яке містить 5% активного хлору, 20% -на
суспензія свіжогашеного вапна, 3–5%-ий розчин формальдегіду надійно
знезаражує інфіковане приміщення при експозиції не менше 1 год. Епізоотологія. До сальмонельозу сприятливі
жеребні кобили, часто в молодому віці. Лошата можуть заражатися
внутрішньоутробно і хворіють з моменту народження. Лошата 2–3-тижневого віку
хворіють рідко. Джерелом збудника інфекції є
кобили, що абортували, які з плодом, його оболонками, навколоплідними водами
та витіками з піхви виділяють безліч сальмонел. Бактеріоносіями можуть бути
жеребці, робочі коні, лошата. Фактори передачі збудника –
інфіковані корми, вода, предмети догляду. Зараження відбувається аліментарним
або статевим шляхом. Поширенню хвороби сприяють погані умови утримання і
годівлі. Патогенез. При пониженій резистентності
організму (годівля, утримання) жеребних кобил сальмонели з кишок проникають у
кров, заносяться в різні органи, зокрема в матку, тканини плоду, плодові
оболонки, де розмножуються; ендотокосини сальмонел викликають катаральне
запалення слизової оболонки матки, плодових оболонок і самого плоду.
Внаслідок чого виникає аборт або народжується нежиттєздатне лоша. Клінічні ознаки. Інкубаційний період у кобил
триває 2–3 тижні. Аборт найчастіше буває на 4–8 місяці жеребності і настає
несподівано. У деяких випадках незадовго до аборту в кобил спостерігається
короткочасна гарячка, неспокій, пітливість, набрякання вим’я та виділення з
піхви. Плід виходить разом з плодовими оболонками (рис. 64).
Рис. 64. Сальмонельозний аборт у кобил Після аборту в кобил
спостерігається підвищення температури тіла та витікання слизу з піхви, що
триває 1–2 тижні. Хвороба може ускладнюватись метритами, артритами і
бурситами. Сальмонельоз лошат при
внутрішньоутробному зараженні протікає гостро. Температура тіла підвищується
до 40–41°С, появляється пронос зі слиззю. Загальний стан пригнічений, хворі
лошата лежать, не можуть рухатись і ссати. Часто у них знаходять артрити і
вони гинуть від септицемії. У старших лошат хвороба
протікає довше, проявляється кульгавістю, артритами, вони поступово худнуть і
відстають у рості. Патологоанатомічні зміни. Оболонка плода набрякла, на ній є крововиливи. Шкіра, підшкірна
клітковина і слизові оболонки жовтяничні; у хоріоні гнійно-некротичні вогнища
(рис. 65).
Рис. 65. Абортований плід при сальмонельозі Легені набряклі, множинні
крововиливи, лімфатичні вузли соковиті та набряклі. Селезінка збільшена у 2–3
рази, з множинними крововиливами. У старших лошат – геморагічний
або дифтеритичний ентероколіт. Діагноз ставлять на підставі
епізоотологічних даних, клінічних ознак, патологічних змін, результатів
бактеріологічного дослідження (рис. 66).
Рис. 66.
Середовище Плоскірєва – жовті колонії сальмонел Як допоміжний тест застосовують
РА. Кров для дослідження беруть від кобил на 8–10 день після аборту.
Позитивним вважають титр 1–600. Диференційний діагноз. Сальмонельозний аборт треба диференціювати від ринопневмонії, вірусного артеріїту,
у лошат – стрептококової інфекції і колібактеріозу. При ринопневмонії
в основному уражаються верхні
дихальні шляхи (респіраторна форма), генітальні шляхи, а також нервова
система (паралічі у кобил). При вірусному артеріїті типовими ознаками є гіперемія оболонок носової порожнини,
кон'юнктивіти, так зване „червоне око", сильні ін'єкції судин склери,
аборт у першій половині вагітності. Хвороба у нас не реєструється. Стрептококова інфекція у лошат
характеризується гнійним ураженням пуповини і суглобів, метастатичними
абсцесами, діареєю, гнійним виділенням з очей, пневмоніями. Лікування. Порожнину матки зрошують
3–4%-им розчином іхтіолу. Для посилення тонусу матки підшкірно вводять
0,5%-ий розчин прозеріну – 2–3 мл. Внутрішньовенно вводять 5%-ий розчин
норсульфазолу в дозі по 0,0025–0,005 г/кг маси 2 рази в день 3 дні підряд.
Вводять антибіотики. Імунітет. У кобил, які абортували, повторний
аборт сальмонельозної етіології буває дуже рідко. Це свідчить про наявність
імунітету. Із специфічних засобів профілактики є жива вакцина АЗВІ, яка після
одноразового застосування створює імунітет до одного року. Профілактика і заходи боротьби. Закуплених коней карантинують,
усувають недоліки в утриманні, догляді, годівлі та експлуатації жеребних
кобил. При абортах або народженні хворих лошат кобил і лошат ізолюють,
проводять дезінфекцію стайні 2 %-ним розчином їдкого натрію. Плід, оболонки,
залишки корму знищують. Кобил, які абортували, допускають до парування не
раніше ніж через 2 місяці після аборту, їх осіменяють штучно. При масових абортах кобил
відокремлюють в окремий табун, утримують і випасають їх ізольовано. Спаровують їх з жеребцями, яких
не використовують для парування здорових кобил. Організовують добре утримання
і годівлю жеребних кобил. 1.6. Правець (Tetanus) Правець (Tetanus, стовбняк) – гостра
неконтагіозна ранова токсикоінфекція різних видів тварин, зокрема і коней, що
характеризується підвищеною рефлекторною збудливістю і тривалим судомним
скороченням скелетних м'язів. На правець смертельно хворіє людина. Історична довідка Клінічну картину правця у людини описав ще Гіппократ у IV ст. до н. е.
Проте тільки в 1884 р. Ніколайєру вдалося викликати експериментальну інфекцію
в дослідних тварин (кроликів, морських свинок та мишей), введенням їм під
шкіру водної суспензії із садової землі. Чисту культуру збудника хвороби
виділив в 1889 р. Кітазато. Існування правцевого токсину виявив у 1890 р. К.
Фабер, властивості токсину детально вивчили Вайяром та Венсаном. У 1890 р.
Берінг і Кітазато розробили методику виготовлення на конях анатоксичної
сироватки для пасивної профілактики правця. Рамон (1927) вперше виготовив
формалінізований анатоксин, який впродовж десятиріч успішно використовується
для активної імунізації людей і тварин. Етіологія. Збудник – Clostridium tetani –
паличка довжиною 2–8 мкм, діаметром 0,3–0,5 мкм у молодих культурах деколи
утворює нитки довжиною до 10 мкм. Утворює спори, розташовані термінально, і
має вигляд барабанної палички (рис. 67).
Рис. 67. Збудник
Clostridium tetani Капсул не утворює, рухомий, фарбується
за Грамом, в старих культурах грамнегативний (рис. 68, 71). Облігатний
анаероб, культивують на середовищі Кітта-Тароцці та в анаеробних приладах
(рис. 69, 70).
Рис. 68. Збудник
Clostridium tetani – фарбування за Грамом
Рис. 69.
Ексікатор
Рис. 70. Анаеростат
Рис. 71. Збудник Clostridium tetani – фарбування за Грамом Вегетативні форми мікроба
малостійкі до фізичних і хімічних факторів, але спорові дуже стійкі до
високої температури і хімічних речовин. Під час кип'ятіння спори
знешкоджуються протягом 1–3 год, водяна пара за температури 115°С руйнує їх
за 5 хв. Збудник правця утворює
екзотоксин, який складається з таких токсичних речовин: тетанспазміну,
тетанолізину, фібринолізину, рибонуклеази, основними з яких є два перших.
Тетаноспазмін діє на нервову тканину і викликає судорожне скорочення м'язів,
а тетанолізин (гемотоксин) викликає гемоліз еритроцитів. Під дією формальдегіду і йоду
токсин втрачає токсичні властивості, але зберігає антигенні, перетворюючись у
токсоїд-анатоксин. У споровій формі збудник виявляє досить високу резистентність у сухому
калі, сухому ґрунті, на контамінованій поверхні різних предметів, захищених
від світла, зберігається роками. Пряме сонячне випромінювання руйнує спори
тільки через 30 діб, кип'ятіння – через 1–3 год, сухий жар за температури
115°С – через 20 хв. Спори стійкі відносно різних дезінфектантів: 1%-й розчин
формальдегіду, 5%-й розчин фенолу інактивують їх лише через 6–15 год, 5%-й
розчин креоліну – через 5 год, 3%-й розчин формаліну – через 24 год. Епізоотологія хвороби. До правцевого токсину дуже
чутливі коні, морські свинки, миші, значно менше – велика рогата худоба,
вівці, кози та свині. Птиця рідко хворіє на правець. Собаки та холоднокровні
тварини до цієї хвороби несприйнятливі. Молоді тварини чутливіші, ніж
дорослі. Хвороба не контагіозна, проявляється спорадично. Розвитку хвороби
сприяє сильне охолодження або перегрівання тварин. Джерелом збудника інфекції
є здорові тварини, які виділяють його з фекаліями і контамінують ґрунт, де
спори правця можуть зберігатися до 11 років.
Поширення
збудника правцю в природі Зараження тварин відбувається внаслідок проникнення спор у глибокі рвані
рани з розчавленими тканинами, крововиливами, некрозами, в яких створюються
сприятливі анаеробні умови для розмноження бацил. Коні здебільшого хворіють на правець при глибоких ураженнях цвяхом у
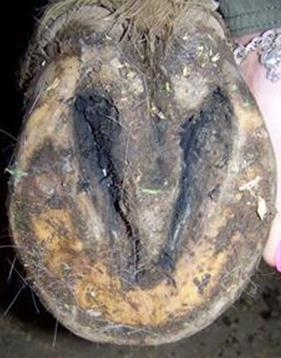
ділянці підошви копита, при ударах, засічках, заковуванні, а також кастрації
без дотримання правил асептики (рис. 72).
Рис. 72. Цвях у копиті коня Патогенез. Основна патогенетична роль
при захворюванні на правець належить екзотоксину, насамперед тетаноспазміну,
який інтенсивно синтезується під час розмноження правцевих бацил в анаеробних
умовах глибоких ран. Екзотоксин уражає рухові нервові центри, спинний і головний мозок,
зумовлює основні симптоми хвороби, що виявляються довготривалими тонічними
судомами скелетних м'язів і підвищенням їх рефлекторної збудливості. Судоми
спричинюють розлад дихання, настає гіпоксія, метаболічний ацидоз. Тварина
гине внаслідок паралічу серця або асфіксії. Під час хвороби бацили правця в
організмі не поширюються, а залишаються і розмножуються лише в глибині рани. Клінічні ознаки та перебіг
хвороби. Інкубаційний період триває 6–20 діб. Перебіг хвороби в усіх видів
тварин гострий. Тяжкість клінічного прояву правця значною мірою зумовлюється
рівнем видової сприйнятливості тварини до збудника хвороби (рис. 73, 74).
Рис. 73. Кінь з
ознаками правця
Рис. 74.
Випадіння третьої повіки У коней спочатку спостерігається певна напруженість у рухах, утруднення в
прийманні та пережовуванні корму, випадання третьої повіки під час підіймання
голови. Невдовзі розвиваються судоми всіх м'язів тіла, настає загальне
заціпеніння.
Судоми м’язів
тіла та загальне заціпеніння при правці
Клінічка картина
правця у коня
Випадання третьої
повіки і ходульна хода у коня
Випадання третьої
повіки та тетанічна стійка у лошати при правці Кінь стоїть нерухомо на одному й тому самому місці з широко розставленими
кінцівками, витягнутою вперед головою та загнутою догори шиєю (рис. 75, 76).
Рис. 75. Кінь, хворий на правець Живіт підтягнутий, спина судорожно увігнута, хвіст трохи піднятий.
Рис. 76. Кінь, хворий на правець Вуха нерухомі, зіниці й ніздрі розширені, щелепи судорожно стиснуті
(тризм). Пальпацією виявляються дуже тверді напружені м'язи, що рельєфно виступають
під шкірою. У хворої тварини різко виражене рефлекторне збудження, що
зумовлює появу судом навіть у разі незначного шуму, легкого дотику до шкіри.
Приймання корму стає неможливим внаслідок тризму м'язів; виділення калу
утруднене. Під час захворювання на правець температура тіла нормальна (в
агональному стані підвищується до 42°С), пульс і дихання прискорені. Загибель
настає через 2–12 діб, причому температура тіла перед загибеллю може
підвищуватися до 43°С.
Клінічні ознаки
перед загибеллю Патологоанатомічні зміни. Трупне задубіння виражене добре
(рис. 77).
Рис. 77. Труп
коня, хворого на правець М'язи мають вигляд вареного м'яса, пронизані крововиливами. Відмічаються
дегенеративні зміни в печінці та нирках. Легені гіперемійовані, набряклі.
Спостерігаються крововиливи на епікарді, в м'язах серця, плеврі. Оболонки
головного й спинного мозку гіперемійовані, вкриті дрібними крововиливами. Діагноз на правець ґрунтується на підставі типових клінічних ознак
хвороби, до лабораторних досліджень вдаються лише у виняткових випадках. Лабораторна діагностика. У лабораторію для дослідження
надсилають рановий ексудат, шматочки ураженої тканини, які відбирають з
глибини рани. Від загиблих тварин надсилають шматочки тканин з місць уражень,
а також печінки і селезінки, кров (5–10 мл). Лабораторні дослідження
передбачають виявлення правцевого токсину та виділення культури збудника з
наступним дослідженням на токсичність. Для виявлення правцевого токсину
проводять підшкірне зараження фільтратом з патологічного матеріалу 2–3 білих
мишей або 2 морських свинок. У разі наявності токсину через 48–96 год у
заражених тварин розвиваються характерні ознаки хвороби, які супроводжуються
тетанічним скороченням м'язів, спочатку окремих груп, а потім усієї
мускулатури тіла. Лабораторні тварини гинуть у характерній позі з витягнутими
вперед лапками і викривленням хребта в бік тієї лапки, в яку вводили
патологічний матеріал (рис. 78).
Рис. 78.
Ригідність хвоста і лапки, тетанічні судоми і загибель мишки при
введенні дослідного матеріалу з токсином Cl.tetani У разі виявлення в патологічному матеріалі правцевого токсину подальші
дослідження не проводять. Якщо результати досліджень з виявлення токсину негативні,
проводять висіви патологічного матеріалу на середовище Кітт-Тароцці з
наступним визначенням токсичності виділеної культури для мишей та морських
свинок. Діагноз на правець вважають установленим у разі виявлення правцевого
токсину в досліджуваному матеріалі без виділення культури або виділення з
патологічного матеріалу культури з властивостями, характерними для збудника
правця, яка продукує токсин. Термін дослідження – 15 діб. Диференційна діагностика. Передбачає необхідність виключення
сказу, м'язового ревматизму, менінгіту. Сказ характеризується значною
агресивністю тварин, паралічем нижньої щелепи, слинотечою, відсутністю
тризму. При м'язовому ревматизмі у хворих тварин не спостерігається
підвищення рефлекторного збудження, м'язи дуже напружені й болісні. Для
менінгіту характерні параліч і загальне пригнічення, тризму не буває. Лікування. Ефективне лише за умови
раннього застосування протиправцевої антитоксичної сироватки, оскільки після
взаємодії з клітинами нервової системи нейтралізація правцевого екзотоксину
неможлива. Протиправцеву антитоксичну сироватку вводять внутрішньовенно або
підшкірно в дозі 80 тис. АО великим тваринам, 40 тис. АО – дрібним та молодим
тваринам до повного видужання. Рекомендується також спинномозкове введення
сироватки під наркозом. Обов'язково здійснюють ретельну антисептичну обробку
рани, застосовують різні сульфаніламідні препарати та антибіотики. Ротову
порожнину промивають підкисленою оцтом водою, пряму кишку очищають від калу.
Для послаблення судорожних скорочень м'язів щодня у вигляді клізми
застосовують 30–50 мл хлоралгідрату в 300–500 мл крохмального слизу або
підшкірно 50 мл 30%-го розчину сульфату магнезії. Корисним виявляється
внутрішньом'язове введення 2–3 рази на день 50–80 мл 96%-го алкоголю в 1 л
5%-го розчину глюкози. Показані заспокійливі препарати та ліки для
підтримання серцевої діяльності. Хвору тварину слід утримувати в ізольованому
темному приміщенні, забезпечуючи їй спокій та повноцінну годівлю. Імунітет. Після перехворювання на
правець тварина набуває стійкого антитоксичного імунітету. Для активної
імунізації використовують концентрований правцевий анатоксин, який вводять у
ділянці верхньої третини шиї підшкірно в дозі 1 мл великим тваринам і 0,5 мл
молодняку та дрібним тваринам. Імунітет формується через 21–30 діб і
зберігається понад один рік, а у коней – упродовж 5 років. Профілактика та заходи боротьби. Офіційних нормативно-правових документів, що
регламентують ветеринарно-санітарні заходи щодо правця у коней в Україні
немає. Проте, враховуючи, що є дуже великий ризик зараження коней через часті
поранення та контакт із ґрунтом, рекомендовано проводити профілактичне
щеплення всіх особин в усіх регіонах України. Для вакцинації
жеребців-плідників, спортивних коней і тварин, яких часто вивозять за кордон,
використовують переважно полівалентні вакцини проти грипу та правця
(«Флюеквін Т», «Дуваксин IE-T», «Нобі-Еквенза Т»). При цьому ревакцинацію
проти правця роблять кожні 12 місяців. До того ж, в Україні зареєстрована
моновалентна вакцина проти правця тварин «Клотеїд-4» (Cloteid-4) виробництва
АТ «Біовета» (Чехія), яку застосовують із профілактичною метою з 3-місячного
віку (основне дворазове щеплення з інтервалом у 3 тижні), ревакцинація –
кожні 4 роки (рис. 79).
Рис. 79. Моновалентна вакцина проти
правця тварин «Клотеїд-4» Щоб запобігти захворюванню тварин на правець, слід чітко дотримуватися
вимог асептики й антисептики під час хірургічних операцій та різних ін'єкцій,
а в разі травм – своєчасно й правильно обробляти рани. При глибоких рваних
ранах, засічках, опіках, тяжких пологах потрібно вводити протиправцеву
антитоксичну сироватку. Для закріплення пасивного імунітету рекомендується
одночасне застосування специфічної сироватки та концентрованого правцевого
анатоксину (рис. 80).
Рис. 80.
Концентрований правцевий анатоксин У неблагополучних пунктах, де спостерігаються часті випадки захворювання
на правець, слід регулярно проводити імунізацію всіх сприйнятливих тварин
концентрованим правцевим анатоксином. Планові профілактичні щеплення проти
правця є обов'язковими на кінних заводах.
Профілактика
правцю Для дезінфекції приміщень, в яких знаходилися хворі та підозрювані щодо
захворювання на правець тварини, застосовують 3%-й розчин формаліну, 5%-й
розчин карболової кислоти, 5%-й розчин креоліну, 10%-й розчин хлорного вапна. 1.7.
Ботулізм (Botulismus)
Ботулізм (Botulismus) – гостре кормове отруєння
тварин, що спричинюється токсином бацили ботулінусу і проявляється паралічем
глотки, язика та нижньої щелепи й ослабленням тонусу скелетних м'язів. До
токсину ботулінусу надзвичайно чутлива людина. Історична довідка Захворювання людини на ботулізм було описане ще в 1735 р. під назвою
«отруєння ковбасною отрутою». У 1820 р. Ю. Кернер вивчив симптоми «ковбасної
отрути» в людини, назвавши хворобу ботулізмом (лат. Botulus – ковбаса).
Ван-Ергенгем у 1894 р. виділив від померлої після отруєння шинкою людини
спороутворювальну анаеробну бацилу і назвав її Bacillus botulinus. Левкс
(1912 р.) установив, що існують два серологічно різні типи бацили ботулінусу:
тип А і тип В. У 1922 р. Бенгсон виявив Bacillus botulіnus типу С. Нині
відомо 7 типів бацил ботулінусу – А, В, С, D, E, F та V, що різняться між
собою в токсигенному та імунобіологічному відношеннях (А.А. Глушков, 1984
р.). У 1922 р. Седон виділив Bac. botulinus при бульбарному паралічі великої
рогатої худоби, а І.А. Дукалов (1920 р.) ізолював збудника хвороби з трупа
коня, який загинув з ознаками кормової інтоксикації. Ботулізм спостерігається
майже у всіх країнах світу. Трапляється рідко, але супроводжується високою
летальністю – 70–95%. Збудник хвороби – Clostridium botulinum – велика (2,5–10) – (0,3–0,8) мкм,
малорухлива, анаеробна безкапсульна паличка із заокругленими кінцями (рис.
81).
Рис. 81. Морфологічні
та культуральні властивості Clostridium botulinum Фарбується за Грамом позитивно (рис. 82).
Рис. 82.
Clostridium botulinum – фарбування за Грамом В старих культурах виявляється у вигляді довгих ниток і різних
поліморфних форм. Утворює овальні спори, які містяться по краях бацили, що
надає їй характерного вигляду тенісної ракетки (рис. 83, 84).
Рис. 83. Спори Clostridium botulinum
Рис. 84. Спори Clostridium botulinum Спори мають високу стійкість, витримують кип'ятіння упродовж 6 год.
Руйнуються за температури 105°С лише через 2 год, при 120°С – через 10 хв,
під дією 10%-го розчину хлоридної (соляної) кислоти – через 1 год, 5%-го
розчину формаліну – через 24 год. Значний інактивувальний ефект дає гамма- і
ультрафіолетове опромінення. Для культивування Cl. botulinum використовують живильні середовища для
анаеробів. Ріст бацили на середовищі Кітт-Тароцці супроводжується
помутнінням, газоутворенням з характерним запахом згірклого масла, випаданням
осаду. В чашках Петрі з глюкозо-кров'яним агаром Цейсслера через 1–2 доби
утворюються маленькі прозорі колонії-росинки з рівними або порізаними краями,
гладенькою чи зернистою поверхнею, оточені зоною гемолізу (рис. 85).
Рис. 85.
Ріст Cl. вotulinum на глюкозо-кров’яному Основною біологічною властивістю збудника ботулізму є здатність в умовах
анаеробіозу, підвищеної вологості та нейтральної або слабколужної реакції
утворювати на живильних середовищах, харчових продуктах і кормах надзвичайно
сильні токсини. Оптимальною температурою для утворення токсину є 25–38°С.
Максимум токсиноутворення спостерігається на 5–9-ту добу. Залежно від
антигенних особливостей токсину розрізняють 7 типів збудника ботулізму – A,
B, C, D, E, F, V. Культурально-морфологічні властивості усіх типів, а також
їх патофізіологічний вплив на організм тварин майже однакові. Відмінність
полягає лише в чутливості різних видів тварин до різних типів токсинів.
Захворювання у коней найчастіше спричинюється токсинами типу В і D, рідко –
типу А і С; у великої рогатої худоби та овець – С і D; норок і птиці – типу
С. Серед експериментальних тварин до ботулінічного токсину найчутливішими є
білі миші та морські свинки. Токсини ботулінусу стійкі проти дії соляної
кислоти, шлункового соку та ферментів травлення. Ботулінічні токсини
нейтралізуються лише типовими антисироватками, руйнуються кип'ятінням у
рідких середовищах – через 15–20 хв, у щільних субстратах (м'ясо, риба) – не
менш ніж через 2 год, а також у сильнолужному середовищі (рН > 8,5).
Зерновий фураж, що містить токсин ботулінусу, знешкоджується 1%-м розчином
їдкого натру лише через 3–6 год. Спори ботулінусу за температури 100°С
руйнуються лише через 5 год. Бацили ботулінусу не розмножуються в кормах при
кислій реакції (рН=3,0 – 4,0), а також при концентрації кухонної солі понад
10%. Епізоотологія хвороби. На ботулізм частіше хворіють
коні й птиця, рідше – рогата худоба та хутрові звірі. Значна стійкість до
токсину ботулінусу властива свиням, диким гризунам, хижакам, собакам, котам. У
сільськогосподарських тварин захворювання найчастіше спостерігається після
згодовування контамінованого спорами ботулінусу недоброякісного силосу,
затхлих, промоклих концентрованих кормів, ураженого пліснявою сіна,
зіпсованих овочів, коренеплодів. У господарстві хвороба проявляється спорадично або у вигляді ензоотії.
Тривалість спалаху хвороби – 8–12 діб. Максимальне виділення хворих тварин
спостерігається у перші 3-и доби, потім захворювання різко йде на спад.
Летальність дуже висока, може досягати 95%. Патогенез. Клостридії ботулізму та
ботулінічний токсин надходять у кишечник тварин з токсичним кормом. Всисання
токсину в кров відбувається крізь стінку тонкого відділу кишок дуже швидко і
вже через 20 хв токсин у значній кількості виявляється в легенях, печінці,
серці, мозку, жовчі, сечі. Постійне і сильне подразнення токсином ботулінусу
периферичних рецепторів і рухових гангліїв спричинює руйнування центрів
довгастого мозку, що призводить до паралічу м'язів глотки, язика та нижньої
щелепи. Порушення токсином нейром'язових зв'язків спричинює розслаблення
м'язів, падіння м'язового тонусу, параліч серцевого м'яза, асфіксію та
загибель тварини. Клінічні ознаки та перебіг
хвороби. Інкубаційний період триває від 24 год до 10–12 діб. Перебіг хвороби
гострий або підгострий. Характерною ознакою ботулізму є так званий «синдром бульбарного
паралічу», за якого спостерігається параліч м'язів глотки, язика, нижньої
щелепи, а також різке розслаблення тонусу скелетних м'язів (рис. 86).
Ботулізм супроводжується нормальною або навіть зниженою температурою тіла,
збереженням рефлексів і свідомості, відсутністю суттєвих змін у крові.
Рис. 86. Кінь з
раптовою втратою ваги, висиханням
слизової оболонки носа і утрудненням при ковтанні У коней ботулізм може набувати блискавичного перебігу і закінчуватися
раптовою смертю без будь-яких попередніх ознак хвороби.
Прояв нервових
явищ при ботулізмі у коня За гострого перебігу хвороба триває 1,5–2 доби. Ранньою ознакою хвороби є
порушення акту жування, слинотеча, часте позіхання, легкі коліки. Згодом
з'являються ознаки паралічу м'язів глотки, а невдовзі – парезу і паралічу
нижньої щелепи та язика. Потяг до корму зберігається, відмічається спрага.
Однак тварина не в змозі проковтнути корм, довго його пережовує і тримає в
роті.
Параліч жувальних
м’язів Спроби пити воду закінчуються витіканням її назад через носові ходи.
Кінчик язика виступає з рота, часто затискається між зубами, згодом
вивалюється з ротової порожнини, набрякає, вільно висить при відвислій
паралізованій нижній щелепі. Зіниці очей розширені, верхні повіки опущені.
Кон'юнктива на початку хвороби гіперемійована, а потім стає жовтяничною. У
зв'язку з різким розслабленням скелетних м'язів тварина пересувається з
великими труднощами, а наприкінці захворювання повністю втрачає здатність
триматись на ногах.
М’язове тремтіння
в результаті ураження ЦНС Пульс і дихання прискорені, кров'яний тиск знижений, перистальтика
ослаблена. Проте всі рефлекси, в тому числі корнеальний, вушний та анальний,
зберігаються. Хвороба триває 1–5 діб. Летальність може досягати 90–95%. При
підгострому перебігу хвороба затягується від 2 до 7 діб. Симптоми такі
самі, що й при гострій формі, однак більш різко виражений параліч глотки та
язика. Патологоанатомічні зміни. Не характерні. При розтині
трупів виявляють запалення серозних покривів очеревини, гіперемію та
крововиливи в легенях, крововиливи в нирках та серці. Судини оболонок
головного мозку переповнені кров'ю, скелетні м'язи мають сіруватий колір,
м'які, легко розриваються. Діагноз установлюють на основі анамнезу про згодовування зіпсованого
корму, характерних клінічних ознак хвороби, а також результатів лабораторних
досліджень. Лабораторна діагностика. Для дослідження в лабораторію
надсилають проби зіпсованих кормів (забруднений землею силос, недоброякісні
відвійки і зерно, комбікорм, м'ясні та рибні відходи), які відбирають з тих
місць, звідки їх брали для згодовування тваринам перед захворюванням.
Одночасно в широкогорлі банки з темного скла відбирають вміст шлунка й
товстих кишок (100–200 г) та шматочки печінки загиблих тварин, а в пробірки –
кров і сечу хворих тварин. У лабораторії патологічний матеріал досліджують на
виявлення токсину ботулінусу в кормах і організмі тварин, проводять
визначення типу токсину, а також виділення культури збудника та визначення її
токсигенних властивостей на білих мишах (рис. 87).
Рис. 87.
«Осина талія», параліч і загибель мишки при введенні токсину Cl. Botulinum Діагноз на ботулізм вважають установленим у разі виявлення токсину ботулінусу
в досліджуваному матеріалі, а також при виділенні з патологічного матеріалу
культури з властивостями, характерними для збудника ботулізму, з наступним
визначенням її токсичності біологічним методом. Диференційна діагностика. Передбачає необхідність
виключення у коней – сказу, інфекційного енцефаломієліту,
стахіботріотоксикозу. Для цього проводять аналіз епізоотологічних, клінічних,
патологоанатомічних даних, а також лабораторні дослідження. Лікування. У разі появи хвороби негайно
вилучають з раціону підозрювані щодо наявності токсину корми. Хворих тварин
забезпечують м'якою підстилкою, лежачих тварин два рази на день перевертають,
щоб запобігти розвитку пролежнів. На початку хвороби ефективним є
застосування антиботулінової сироватки, яку вводять внутрішньовенно у великих
дозах (коням до 600 тис. МО) (рис. 88).
Рис. 88.
Сироватка протиботулінова Застосовують також швидкодіючі проносні препарати (ареколін, пілокарпін, езерин),
теплі клізми. Шлунок промивають 5%-м розчином соди, через зонд вводять 10–15
л води з глюкозою. У пізні стадії хвороби показано внутрішньовенне введення
10%-го розчину хлориду натрію в дозі 100–150 мл 2 рази на день, 50%-го
розчину глюкози в дозі 100 мл щодня впродовж 5–7 діб. Рекомендується очищення
прямої кишки від калу, застосування серцевих засобів. Імунітет. При ботулізмі має антитоксичний
характер. Встановлено можливість імунізації тварин специфічними анатоксинами.
Нині вакцинують лише норок, оскільки в інших видів тварин ботулізм
трапляється рідко. Профілактика та заходи
боротьби. Мають бути спрямовані на забезпечення тварин доброякісними кормами. Слід
дотримуватися технології правильної заготівлі та зберігання кормів відповідно
до агротехнічних вимог, не допускати забруднення зернових кормів та силосу
землею, фекаліями, трупами гризунів. Для згодовування слід використовувати
корми, якісні за запахом, кольором і консистенцією. Корми тваринного
походження можна згодовувати тваринам лише після ретельного проварювання
тривалістю не менш ніж 2 години. У разі виникнення ботулізму хворих та
підозрюваних щодо захворювання на ботулізм тварин ізолюють і лікують. З
раціону негайно виключають підозрілі на наявність токсину ботулінусу корми. Трупи загиблих тварин знищують разом зі шкурами. Забій на м'ясо хворих
тварин забороняється. 1.8. Сибірка
(Аnthrax)
Сибірка (Anthrax, сибірська виразка,
телій) – гостре інфекційне захворювання усіх видів сільськогосподарських, в
тому числі і коней, домашніх і диких тварин, що характеризується гарячкою,
септицемією, інтоксикацією організму, серозно-геморагічним запаленням
підшкірної та субсерозної сполучної тканин і внутрішніх органів, утворенням
набряків і карбункулів. На сибірку хворіє людина. Історична довідка Сибірка була відома людству з глибокої давнини і сприймалась як «божа
кара за гріхи», «діяльність злого духу» тощо. Описана у старовинних
історичних рукописах Греції та Риму. В середні віки спустошливі епізоотії
сибірки багаторазово виникали в багатьох країнах Європи. Починаючи з 978 р.,
повідомлення про сибірку з'являються в Росії. А. Ешке (1758 р.) та М.
Ножевщиков (1762 р.), які працювали в Сибіру лікарями, першими зробили
науковий опис цієї хвороби в людини. У Західній Європі аналогічну працю
опублікував у 1766 р. Мораном. С.С. Андрієвський – Прокопович у 1789 р.
встановив тотожність захворювань у людини й тварин, переконливо довів
заразність хвороби, штучно заразивши себе патологічним матеріалом з
карбункула хворої людини, і запропонував називати хворобу «сибірська виразка»
(«сибірська язва»). Етіологію хвороби встановили лише в середині ХІХ ст., після того, як
Поллендер (1849 р.) у Німеччині, Давен і Райє (1850 р.) у Франції та Ф.
Брауель (1855 р.) у Росії виявили незалежно один від одного специфічні палички
сибірки. У 1875 р. Р. Кох виділив збудника хвороби в чистій культурі й довів,
що за несприятливих умов утворюються спори. Асколі в 1877 р. для діагностики
сибірки запропонував реакцію преципітації. Наступний період ознаменувався успішною вакцинацією Л. Пастером (1881 р.)
тварин ослабленою культурою збудника та виготовленням Л.С. Ценьковським (1882
р.) цієї вакцини в Росії, що впродовж багатьох десятирічь забезпечувало
надійний захист тварин від сибірки. Подальші вдосконалення біологічних
препаратів сприяли створенню в 1944 р. М.М. Гінзбургом вакцини СТІ з
безкапсульного штаму збудника та в 1953 р. С.Г. Колесовим –
гідроксидалюмінієвої вакцини ДНК. Нині сибірка на території європейських країн і США трапляється у вигляді
спорадичних випадків та невеликих епізоотій. На Африканському та Азійському
континентах хвороба реєструється серед 54 видів тварин, часто набуває
епізоотичного поширення. В Україні ситуація щодо сибірки досить складна, пов'язана з наявністю
старих неблагополучних захоронень тварин, що створює постійну потенційну
загрозу відносно появи хвороби серед тварин і людей (А.І. Завірюха, П.І.
Вербицький, 2001 р.). Боротьба із сибіркою потребує значних коштів на
проведення суворих карантинно-обмежувальних та лікувальних заходів у разі
виникнення хвороби, щорічних запобіжних щеплень усіх сприйнятливих до неї
тварин, організацію ветеринарносанітарних заходів у стаціонарних осередках. Збудник хвороби – Bacillus anthracis – нерухома грам-позитивна аеробна
спороутворююча паличка розміром (5–8) – (1–1,5) мкм. Вегетативна форма
антраксової бацили добре забарвлюється метиленовим синім, фуксином Ціля або
за Пєшковим, капсули - за Романовським - Гімза. У мазках з крові та органів
загиблих тварин бацили сибірки розміщені поодиноко, попарно або короткими
ланцюжками з 2–4 паличок з прямими, різко обрубаними кінцями, що оточені
капсулою (рис. 89).
Рис. 89. Бацили
сибірки У культурах на живильних середовищах бацили утворюють довгі ланцюжки (рис.
90).
Рис. 90. Довгі
ланцюги бацили сибірки Характерною особливістю збудника сибірки є здатність до спороутворення. Спори
мають овальну або кулясту форму, утворюються в розтятих трупах і зовнішньому
середовищі за умов обов'язкового доступу кисню й температури 15–42°С. В
організмі хворої тварини і в нерозтятому трупі спори не утворюються. Бацили
сибірки добре культивуються в аеробних умовах на звичайних живильних
середовищах за температури 35–37°С, рН=2–7,6. За температури менш ніж 12°С і
понад 43°С ріст бацил припиняється. На агарі в чашках Петрі через 16–24 год
після висівання патологічного матеріалу утворюються сірувато-білі колонії
R-форми з характерними виростами – «локонами» по периферії, що стало приводом
дати антраксовим колоніям назву « голова медузи» (рис. 91).
Рис. 91.
Антраксова колонія – « голова медузи» При вирощуванні на середовищах з пеніциліном бацили набувають форми кулі,
а при складанні в ланцюжок мають вигляд «перлового намиста», феномен якого
враховують під час установлення діагнозу (рис. 92).
Рис. 92. Ріст
збудника сибірки на пеніциліновому середовищі У бульйоні антраксові бацили ростуть у вигляді ватних пластівців, які
через добу випадають в осад на дно пробірки (рис. 93).
Рис. 93. Ріст
збудника сибірки на МПА, МПБ На желатині за уколом через 2–5 діб утворюється білуватий стрижень, від
якого відгалужуються ніжні паростки, довші та густіші у верхніх шарах
середовища порівняно з нижчими, що нагадує перевернуту ялинку (рис. 94).
Рис. 94. Ріст
збудника сибірки в желатині На кров'яному агарі бацили антраксу, на відміну від антракоїдних і
псевдоантракоїдних сапрофітів, не утворюють зону гемолізу (рис. 95).
Рис. 95.
Ріст Bacillus anthracis на кров’яному агарі Вегетативна форма антраксової бацили не стійка до впливу різних фізичних
і хімічних факторів. У нерозтятому трупі літньої пори бацили інактивуються
через 1–3 доби, при гнитті – через декілька годин. У висушених мазках крові
бацили залишаються вірулентними до 20 діб, у воді – до 60 діб. Під час
нагрівання до температури 55°С антраксова культура руйнується через 40 хв, до
65°С – 5 хв, до 70°С – 2–4 хв, до 80°С – через 1 хв. За температури мінус
24°С бацили залишаються життєздатними 12 діб, – 10,6°С – 24 доби, 130–180°С –
кілька годин. Сонячне випромінювання вбиває бацили у вологому середовищі
через 14 год, у сухому – 8 год. На противагу цьому спори антраксової палички
надзвичайно стійкі у зовнішньому середовищі, десятиліттями зберігаються в
ґрунті, роками у воді; резистентні до гниття й висушування. Сухий жар вбиває
їх при 140°С лише через 3 год, кип'ятіння – через 40–60 хв, сонячне
випромінювання – через 2–5 діб. Спори не руйнуються під час дубіння шкур,
висушування та засолювання м'яса. Епізоотологія хвороби. На сибірку частіше хворіють
вівці, велика рогата худоба, коні, північні олені. Сприйнятливі до хвороби
також дикі жуйні тварини, вовки, лисиці, тигри, леви, пантери, слони.
Малочутливими є свині, буйволи та верблюди. Собаки й свійська птиця до
сибірки не сприйнятливі. З лабораторних тварин заражаються й гинуть білі
миші, морські свинки, кролі та голуби. Джерелом збудника інфекції є хворі тварини, що виділяють у зовнішнє
середовище з кров'янистою рідиною, фекаліями, сечею, молоком, слиною безліч бацил
сибірки. Особливо небезпечними є несвоєчасно й неправильно прибрані розтяті
трупи загиблих від сибірки тварин та їхні шкіра, шерсть, щетина, кістки,
роги, які зумовлюють контамінацію спорами пасовищ, водопоїв, ґрунту, скотних
дворів і формування тривалих осередків сибірки (рис. 96).
Рис. 96. Трупи
тварин – потужний фактор передачі збудника сибірки Хижі тварини та різні птахи можуть переносити частини інфікованого трупа
на значні відстані й сприяти поширенню сибірки. Собаки здатні заносити кістки
та залишки трупа безпосередньо на територію господарств і ферм. Небезпечними
осередками сибірки є старі забуті захоронення загиблих від сибірки тварин,
звідки спори можуть виноситися на поверхню ґрунту під час весняного паводку
та сильних дощів. Причиною виникнення сибірки взимку може бути зібране з
неблагополучних луків і пасовищ сіно. Спори сибірки можуть виноситися на поверхню землі під час меліоративних,
будівельних та інших земляних робіт у місцях давніх захоронень тварин. Значну
небезпеку становлять незнезаражені корми та добрива тваринного походження, а
також стічні води м'ясокомбінатів і шкіропереробних заводів. Переносниками збудника сибірки можуть бути кровосисні комахи. Спонтанне зараження травоїдних тварин здебільшого відбувається через
травний канал у разі поїдання контамінованого спорами сибірки корму, пиття
води, забрудненої спорами збудника хвороби, під час укусів інфікованими
жалкими комахами; значно рідше – під час вдихання пилу зі спорами сибірки.
Після видужання тварини не залишаються бацилоносіями, тому спільне утримання
зі здоровими тваринами не призводить до їх зараження. Для сибірки характерна стаціонарність осередків, яка зумовлюється
тривалим збереженням спор у землі, а також весняно-літня сезонність, що
пов'язано зі збільшенням контакту тварин із забрудненими спорами збудника
пасовищами, а також з кровосисними та жалкими комахами. Вірогідність
виникнення захворювань значно зростає в засуху, коли нестача зелених кормів
змушує тварин поїдати сухі рослини разом із землею, в якій можуть знаходитися
спори. Взимку хвороба виникає тільки в разі згодовування раніше
контамінованих сибірковими спорами кормів (сіна, соломи). Патогенез. Після проникнення в організм
чутливої тварини збудник сибірки потрапляє в лімфатичну систему, швидко
розмножується і заноситься в лімфовузли. Потім проникає в кров і розноситься
по всьому організму, фіксуючися головним чином у селезінці, печінці та
легенях.
Патогенез сибірки
Механізм
інтоксикації при сибірці Тут бацили сибірки розмножуються в елементах лімфоїдно-макрофагальної
системи, створюють захисні капсули і виробляють ендотоксини, які паралізують
фагоцитарну діяльність лейкоцитів, руйнують клітини ретикулоендотеліальної
системи. Після цього збудник знову мігрує в кров, зумовлюючи тяжку
інтоксикацію, септицемію і загибель тварини. Клінічні ознаки та перебіг
хвороби. Інкубаційний період триває 1–3 доби. Перебіг хвороби – блискавичний
(надгострий), гострий, підгострий і хронічний. У різних видів тварин
розрізняють септичну, карбункульозну, кишкову, легеневу та ангінозну форми
хвороби. У коней гострий перебіг хвороби
супроводжується підвищенням температури тіла до 41–42°С, сильним ознобом,
прискоренням пульсу й дихання, ціанозом слизових оболонок рота й носа,
пригніченням, спрагою, занепокоєнням, судомними скороченнями окремих м'язів.
Тварина лежить, відмовляється приймати корми. У коней спостерігається
гарячка, синюшність слизових оболонок, задишка, коліки, м'язовий дрож. Сеча
стає кров'янистою, фекалії рідкими, з домішкою крові. В агональній стадії
визначаються судоми, кров'янисті виділення з природних отворів, асфіксія,
кома. Септична форма сибірки може розвиватися
відразу після зараження дуже слабкої тварини або після проникнення в організм
значної кількості високовірулентного збудника. Септична форма зумовлює
блискавичний перебіг хвороби і загибель тварини впродовж кількох перших
годин. Здебільшого септична форма виявляється в кінці хвороби на фоні різкого
пригнічення захисних сил організму, розвитку септицемії та інтоксикації
організму. Карбункульозна (шкірна) форма сибірки супроводжується появою в ділянці черева,
мошонки, вимені, під щелепами гарячих, запальних набряків, що швидко
збільшуються в розмірах і згодом стають холодними, твердими, безболісними.
Шкіра, починаючи з центра ураженої ділянки, чорніє, некротизується з
утворенням виразок з нерівними краями. На слизовій оболонці піднебіння,
внутрішньої поверхні губ, на язику можуть утворюватися пухлини завбільшки з
куряче яйце, з яких витікає рідина темного кольору. Карбункульозну форму
часто реєструють у коней, особливо в лісових місцевостях (рис. 97).
Рис. 97.
Карбункульозна форма сибірки Кишкова форма сибірки характеризується
високою температурою та розладом функцій травного каналу (коліки, пронос,
запор). Легенева форма сибірки перебігає у
вигляді пневмонії й гострого набряку легень, трапляється рідко. Патологоанатомічні зміни. Розтинати труп при підозрі на
сибірку категорично забороняється! У разі випадкового розтину виявляються досить характерні
патологоанатомічні зміни, які виражені то краще, що повільнішим був перебіг
хвороби. Труп здутий, швидко розкладається. Трупне задубіння не виражене або
виражене дуже слабко (рис. 98).
Рис. 98. Труп коня,
підозрілий щодо сибірки З природних отворів виділяється піниста кров'яниста рідина. Кров густа,
дьогтеподібна, чорно-червоного кольору, не згортається. У підшкірній та
м'язовій клітковині, а також у ділянці нирок і брижів виявляються драглисті
інфільтрати та крововиливи. М'язи мають темно-червоний колір, в'ялу
консистенцію. У черевній і грудній порожнинах, а також в осерді
(навколосерцевій сумці) міститься значна кількість серозно-геморагічного
ексудату. Селезінка різко збільшена, в'яла, дає великі зіскрібки
дьогтеподібної консистенції. Лімфатичні вузли значно збільшені, переповнені
темно-червоною кров'ю. Легені, печінка та нирки набряклі, збільшені в
розмірі, переповнені темною кров'ю, пронизані крапчастими крововиливами.
Серце переповнене незгорнутою кров'ю, на ендокарді виявляються крапчасті
крововиливи. Слизова оболонка тонкого відділу кишечника набрякла,
гіперемійована, вкрита множинними крововиливами, особливо в ділянці пейєрових
бляшок і фолікулів. Діагноз на сибірку встановлюють на підставі аналізу епізоотичної
ситуації, клінічних ознак хвороби, патологоанатомічних змін (у разі
випадкового розтину трупа), а також результатів лабораторних досліджень. Лабораторна діагностика. Лабораторна діагностика сибірки
здійснюється згідно з Методичними рекомендаціями. У лабораторію для дослідження надсилають мазки крові, відібраної з
поверхневих вен вуха відразу після загибелі тварини, оскільки збудник
з'являється в крові незадовго до смерті і швидко руйнується під час гнильного
розкладання трупа. Краще виготовляти на скельцях мазки більшої товщини, щоб з
них можна було робити посіви на живильні середовища і здійснювати зараження
лабораторних тварин. У разі необхідності для дослідження відрізають вухо з
того боку, на якому лежав труп, та шматочки шкіри розміром 5–5 см для
проведення реакції преципітації. В разі потреби до лабораторії надсилають
вовну, шерсть, щетину, хутрову сировину. Під час виникнення підозри на
сибірку розтин трупа (крім свиней) припиняють і на дослідження направляють
частину селезінки. Бактеріологічна діагностика патологічного матеріалу на
сибірку включає мікроскопічні дослідження, посіви на живильні середовища,
ідентифікацію виділеної культури, зараження лабораторних тварин. При мікроскопії забарвлених за Грамом мазків крові та патологічного
матеріалу із свіжого трупа антраксові бацили виявляються під мікроскопом у
вигляді характерних товстих, коротких, з прямими, ніби обрізаними кінцями,
ізольованих паличок та коротких ланцюжків з 2–4 паличок, що оточені капсулою
(рис. 99).
Рис. 99. Збудники
сибірки, оточені капсулою – фарбування за Міхіним На основі результатів мікроскопічного дослідження негайно видають
попередній висновок, який обов'язково має бути підтверджений бактеріологічним
дослідженням. З цією метою виконують посіви на м'ясо-пептонний агар у
пробірках (за умови, що патологічний матеріал свіжий і чистий) або на
м'ясо-пептонний агар у чашках Петрі, якщо під час попереднього
мікроскопічного дослідження виявлено наявність сторонньої мікрофлори. В
останньому випадку недоцільними є також посіви патологічного матеріалу на
бульйон та желатину в зв'язку з повною відсутністю конкурентних можливостей в
антраксових бацил. Посіви на агарі вирощують упродовж 18–24 год, потім досліджують
неозброєним оком та за малого збільшення мікроскопа. При характерному рості
антраксових бацил утворюються плоскі, сірі, шорсткуваті колонії з
бахромчастими кучерявими відростками. Типові та сумнівні колонії відбирають
для ідентифікації й подальшого пересівання на різні живильні середовища.
Ідентифікацію виділеної антраксової бацили проводять на підставі характерного
росту на живильних середовищах, специфічної морфології, капсулоутворення,
лізабельності фагом, тесту «перлового намиста», відсутності гемолітичної
активності, методами ПЛР, МФА, а також результатів біологічних досліджень
(рис. 100).
Рис. 100.
Виявлення та ідентифікація Bacillus anthracis МФА Зараження лабораторних тварин патологічним матеріалом обов'язково
здійснюють у день надходження його до лабораторії. Для цього 10%-ву суспензію патологічного матеріалу вводять підшкірно двом
білим мишам у дозі 0,1–0,2 мл або двом морським свинкам у дозі 0,5–1 мл.
Загибель лабораторних тварин спостерігається в перші 3-и доби після
зараження, досліджують їхню кров із серця та паренхіматозні органи. Дослідження шкірної сировини і несвіжого патологічного матеріалу
проводять за реакцією кільце преципітації за Асколі. Реакцію вважають
позитивною, якщо на межі двох компонентів з'являється тонке білувате кільця
преципітації. У разі необхідності комплекс лабораторних досліджень на сибірку
доповнюють використанням бактеріофага, імунофлуоресцентного тесту, феномену
«перлового намиста». Діагноз на сибірку вважається установленим у разі виділення з
патологічного матеріалу культури з властивостями, характерними для збудника
сибірки, та загибелі хоча б однієї лабораторної тварини. Позитивний діагноз установлюють також у разі відсутності в посівах з
патологічного матеріалу росту культури, але загибелі хоча б однієї
лабораторної тварини з двох заражених і виділення з її органів культури з
властивостями, характерними для збудника сибірки. Позитивна реакція
преципітації під час дослідження гнильного патологічного матеріалу також є
підставою для встановлення діагнозу. Диференційна діагностика. Передбачає необхідність
відрізняти сибірку у коней від пастерельозу, бабезіозу. При пастерельозі
основні зміни спостерігаються в легенях і виявляються у вигляді
крупозно-геморагічної пневмонії з осередками некрозу. Драглеподібний набряк у
ділянці гортані не супроводжується геморагічною інфільтрацією.
Бактеріологічними дослідженнями виявляється грамнегативна овоїдна паличка.
Бабезіози встановлюють дослідженнями мазків крові на наявність
кровопаразитів. Лікування. Проводять гіперімунною
протисибірковою сироваткою або гаммаглобуліном у поєднанні з антибіотиками
(пеніцилін, біцилін, стрептоміцин, левоміцетин, біоміцин). Сироватку
застосовують підшкірно в лікувальних дозах: для коней – 100–200 мл. Не
рекомендується вводити в одне й те саме місце більш ніж 20 мл сироватки. У
тяжких випадках сироватку після попереднього підігрівання до 37–38°С вводять
внутрішньовенно. Якщо впродовж наступних 8–12 год температура тіла не
знижується, сироватку вводять у лікувальній дозі повторно. При карбункульозній формі сибірки сироватку вводять додатково під шкіру в
місці локалізації запального набряку. Гаммаглобулін застосовують у дозах для
коней – 40–80 мл. У разі тяжкого перебігу хвороби гаммаглобулін підігрівають
до температури 37–38°С і вводять внутрішньовенно. Одночасно проводять
внутрішньом'язове або підшкірне введення антибіотиків: пеніциліну по 500 тис.
од на 100 кг маси через 4 год, три рази на добу; амоксицилін (15%-й) – по 1
мл на кожні 15 кг маси один раз на день упродовж 3–5 діб; канаміцин (25%-й) –
один раз на день упродовж 5–10 діб у дозах: великій рогатій худобі та коням –
по 2 мл на 100 кг маси, телятам і лошатам – по 2 мл на 50 кг маси, вівцям,
свиням – по 2 мл на 50 кг маси, собакам, котам – по 0,1 мл на 1 кг маси;
тилозин (20%-й) – внутрішньом'язово або підшкірно один раз на день упродовж
3–5 діб у дозах: великій рогатій худобі – по 3–5 мл на 100 кг маси, свиням –
по 1–2,5 мл на 50 кг маси, собакам – по 1 мл на 10 кг маси. Через 14 діб
після видужання їх щеплюють протисибірковою вакциною. Забороняється використання протисибіркових вакцин одночасно з іншими
біологічними чи хімічними препаратами. Вимушені щеплення проводяться
незалежно від наявності в господарстві інших інфекційних захворювань. Не
дозволяється вакцинувати виснажених, клінічно хворих тварин і тварин з підвищеною
температурою тіла, а також самок в останній місяць вагітності. Заходи профілактики та боротьби
з сибіркою. Ветеринарно-санітарні
заходи регламентує «Інструкція про
заходи з профілактики та боротьби з сибіркою тварин» (наказ Державного департаменту ветеринарної медицини
Мінагропрому України від 25.01.00 р. №4.
Загальні ветеринарно-санітарні заходи профілактики сибірки. Передбачають
проведення робіт з огородження й утримання в належному стані
скотомогильників, старих захоронень худоби, біотермічних ям, знезараження
ґрунту в місцях поховань сибіркових трупів; організацію постійного нагляду за
санітарним станом місць скупчення худоби, заготівлі, переробки та зберігання
продуктів і сировини тваринного походження; суворе додержання правил
утримання та внутрішньогосподарського забою худоби на м'ясо; заборону
реалізації м'яса та інших продуктів забою для споживчих потреб людей і на
корм тваринам без дозволу ветеринарного спеціаліста; чітке дотримання
існуючих положень під час проведення агрогідромеліоративних, розвідувальних,
будівельних та інших земляних робіт. Заходи в неблагополучних щодо сибірки пунктах і на загрозливій території.
Основою протиепізоотичних заходів у неблагополучних осередках є здійснення
комплексу ветеринарно-санітарних заходів та профілактичних щеплень тварин.
Виявляють і беруть на облік неблагополучні пасовища, водопої, місця всіх
старих і чинних скотомогильників, біотермічних ям, окремих місць давніх
поховань тварин. Здійснюється контроль за проведенням робіт з їх огородження
й утримання у відповідному санітарному стані. Не допускається випасання
тварин і використання водних джерел у зонах старих поховань тварин, у місцях
розміщення підприємств із заготівлі, зберігання та переробки тваринної
сировини, а також на ділянках пасовищ, де мали місце зараження й загибель
тварин з нез'ясованих причин. Чітко виконуються санітарні вимоги щодо
своєчасного прибирання та утилізації трупів. Залежно від місцевих умов і епізоотичного стану неблагополучного пункту
організовуються осушування боліт, заболочених пасовищ та сіножатей.
Проведення агромеліоративних, гідромеліоративних, будівельних та інших
земляних робіт здійснюється за погодженням з державними інспекторами
ветеринарної медицини. Утримуються у належному ветеринарно-санітарному стані
тваринницькі приміщення, скотні двори й загони, регулярно здійснюють їх
профілактичну дезінфекцію, дератизацію та дезінсекцію, проводять знезараження
інвентарю та предметів догляду за тваринами. Організовується постійний нагляд
за переміщенням тварин, санітарним станом місць їх скупчення, заготівлею,
зберіганням продуктів та сировини тваринного походження. Здійснюється
контроль за неухильним виконанням ветеринарно-санітарних правил утримання
тварин, внутрішньогосподарського чи подвірного забою тварин на м'ясо,
реалізацією м'яса та інших продуктів, у тому числі від вимушено забитих
тварин. Регулярно проводиться роз'яснювальна робота серед населення і
працівників тваринництва про небезпеку сибірки для людини, а також про заходи
її профілактики. Профілактичне
щеплення коней проти сибірки у благополучних пунктах проводять з 9-місячного
віку (в особливих випадках – з 3-місячного) один раз на рік. Ще власникам
коней слід пам’ятати, що за 10 діб до та протягом 10 діб після вакцинації
переміщувати коней категорично заборонено. Щеплення роблять
лише лікарі ветеринарної медицини, які працюють у державних установах
ветеринарної медицини. В Україні зареєстровано дві вакцини проти сибірки: 1. Вакцина жива
спорова проти сибірки тварин зі штаму «СБ» (рідка) ви-робництва Сумської
біофабрики. (рис. 101).
2. Вакцина жива проти
сибірки тварин зі штаму К-79Z виробництва Херсонського
державного підприємства «Біологічна фабрика» (рис. 102). Заходи в разі підозри в
захворюванні тварин на сибірку. У разі раптової загибелі або захворювання тварини, що супроводжується
високою температурою, утворенням на тілі гарячих пухлин, які швидко
збільшуються в розмірі, та набряків у ділянці підгруддя, шиї, черева, появою
кольок і кров'янистих пінистих випорожнень під час агонії терміново
повідомляють про це реґіонарну установу ветеринарної медицини. Ветеринарний
спеціаліст має негайно прибути на місце, провести клінічний огляд і
термометрію всього поголів'я, організувати ізоляцію та лікування хворих і
підозрюваних щодо захворювання на сибірку тварин, відібрати патологічний
матеріал від загиблих або вимушено забитих тварин і терміново направити його
нарочним у лабораторію ветеринарної медицини. В разі підозри на сибірку розтинати труп заборонено, для дослідження
направляють вухо загиблої тварини. Якщо підозра на сибірку виникла в процесі
випадкового розтину трупа або розбирання туші, для лабораторного дослідження
відбирають селезінку та реґіонарні лімфовузли. Трупи хутрових звірів
направляють цілими. В разі позитивних результатів мікроскопічного дослідження
лабораторія ветеринарної медицини негайно повідомляє про це головного
державного інспектора і ветеринарну службу господарства. Вжити заходів щодо ліквідації сибірки. У місцях виникнення хвороби
встановлюється карантин, межі неблагополучного пункту, який підлягає карантинуванню,
та загрозлива зона (рис. 103).
Рис. 103.
Карантинні заходи при виникненні сибірки За умови карантину на території неблагополучного пункту заборонено
введення, ввезення, виведення та вивезення поза її межі тварин усіх видів;
заготівля й вивезення продуктів та сировини тваринного походження;
перегрупування тварин у господарстві; використання молока від хворих тварин;
забій на м'ясо; розтинання трупів і зняття шкур із загиблих тварин;
проведення хірургічних операцій (крім невідкладних); вхід на неблагополучну
ферму (господарство) стороннім особам; в'їзд на територію транспорту, не
пов'язаного з обслуговуванням цієї ферми (господарства); спільний водопій
тварин зі ставків та інших водойм; торгівля тваринами й продуктами
тваринництва в межах загрозливої зони; проведення в цих межах ярмарків,
виставок та інших заходів, пов'язаних зі скупченням людей і тварин. Для своєчасного проведення протиепідемічних заходів щодо сибірки негайно
повідомляють санітарно-епідеміологічну службу. Для догляду за хворими тваринами закріплюють окрему обслугу, яку
забезпечують спецодягом. Лікар ветеринарної медицини після огляду всіх тварин у неблагополучному
пункті розділяє їх на дві групи. До першої групи відносять хворих і
підозрюваних щодо захворювання на сибірку тварин, які мають клінічні ознаки
захворювання. До другої групи відносять підозрюваних у зараженні сибіркою
тварин, тобто решту тварин, в яких не проявляються ознаки захворювання на
сибірку, але які знаходяться у стаді (отарі, дворі), де встановлено це
захворювання. Тварин першої групи лікують і через 14 діб після клінічного
видужання щеплюють протисибірковою вакциною. Трупи, гній, підстилку, залишки
фуражу знешкоджують спалюванням. Закопувати трупи категорично заборонено.
Приміщення та місця перебування хворих на сибірку тварин ретельно
дезінфікують. Тварин другої групи щеплюють протисибірковою вакциною згідно з
настановою щодо її застосування. Дезінфекційні заходи. Для дезінфекції приміщення, в
якому знаходилися хворі на сибірку тварини, використовуються розчини хлорного
вапна з вмістом активного хлору 5%, 4%-й розчин формальдегіду і 10%-й розчин
їдкого натру. Дезінфекцію приміщень проводять за відсутності тварин, після
ретельного механічного очищення всіх поверхонь і обладнання, спалювання
відходів виробництва, а також гною. Наступну дезінфекцію неблагополучного приміщення здійснюють щоразу після
знаходження нової хворої тварини і повторюють через кожні 10 діб до
проведення остаточної дезінфекції та зняття карантину. Крім того, щодня під час ранкового прибирання проводять дезінфекцію
проходів у неблагополучному тваринному дворі, для чого використовують
дезінфектанти без запаху й подразливої дії. У станку, де утримувалась хвора
або загибла тварина, знімають і спалюють дерев'яну підлогу й перегородки.
Землю ретельно обпалюють, заливають розчином хлорного вапна з вмістом
активного хлору 5% із розрахунку 10 л/м2, перекопують на глибину
не менш ніж 25 см, перемішують із сухим хлорним вапном з вмістом у ньому не
менш ніж 25% активного хлору із розрахунку 3-и частини землі й 1-а частина
хлорного вапна, зволожують водою і захоронюють на скотомогильнику. Гній,
підстилку та залишки кормів зволожують 10%-м гарячим розчином їдкого натру, а
потім спалюють. Гноївку в гноєзбірнику змішують із сухим хлорним вапном, у
якому міститься не менш ніж 25 % активного хлору, з розрахунку 1 кг вапна на
кожні 20 л гноївки. Дезінфекцію в ізоляторі проводять щодня 10%-м розчином їдкого натру.
Спецодяг, відра, щітки та інший інвентар знезаражують зануренням у 2%-й
активований розчин хлораміну, 4%-й розчин формальдегіду на 4 год або
кип'ятінням у 2%-му розчині кальцинованої соди не менш ніж 90 хв. У місцях
утримання худоби під час перегонів та перетримування тварин, серед яких
виявлено захворювання на сибірку, здійснюють ретельне механічне очищення та
дезінфекцію поверхні землі 10%-м розчином їдкого натру або 4%-м розчином
формальдегіду, 5%-м проясненим розчином хлорного вапна. Зняття карантину. Карантин знімають через 15 діб
після останнього випадку загибелі або видужання хворої на сибірку тварини за
умови відсутності у тварин реакції на щеплення вакциною та повноти виконання
всього комплексу ветеринарно-санітарних заходів. 1.9.
Некробактеріоз (Necrobacteriosis)
Некробактеріоз (Necrobacteriosis) – підгостра
або хронічна інфекційна хвороба всіх видів свійських, в тому числі і коней,
більшості диких тварин, птахів, що характеризується гнійно-некротичним
ураженням шкіри та прилеглих до неї сполучної й м'язової тканин, головним
чином на нижніх частинах кінцівок, а також слизових оболонок ротової та
черевної порожнин і дихальних шляхів, іноді паренхіматозних і статевих
органів. Хворіє також людина. Історична довідка Некробактеріоз відомий здавна і залежно від форми перебігу в різних видів
тварин був описаний під назвою «гангренозний мокрець» – у коней, «копитна
хвороба» і «парша губ» – у овець, «дифтерія телят», «некротичний стоматит
поросят», «копитка» – у північних оленів. У 1881 р. Р. Кох виділив Bac.
necrophorum з рогівки барана, а Ф. Леффлер (1884 р.) виділив її при дифтерії
телят і описав. У 1890 р. Банг уперше одержав чисту культуру цього
мікроорганізму. Проте минуло ще майже півстоліття, доки Bac. necrophorum, яку
вважали супутнім мікробом, була визнана збудником цієї хвороби. Некробактеріоз спостерігається майже в усіх країнах світу, в Україні
частіше діагностується серед великої рогатої худоби. Економічні збитки, яких
завдає некробактеріоз, досить значні і пов'язані з високою летальністю, яка
серед поросят може досягати 50–60%, курчат – 75–80%, ягнят – 80%, дорослих
тварин – 12–30%. Збудник хвороби – Fusobacterium necrophorum, який дуже поширений у зовнішньому
середовищі. Це анаеробний, нерухомий, грамнегативний, надзвичайно поліморфний
мікроорганізм. Спор і капсул не утворює. Добре забарвлюється фуксином Ціля,
синькою Леффлера, а також за Муромцевим. У мазках – відбитках з
інкапсульованих осередків, хронічних уражень, а також у мазках із старих
культур фузобактерії мають форму коротких паличок розміром (0,4–0,7) –
(0,3–0,5) мкм, які забарвлюються нерівномірно, зернисто, інтенсивніше на
кінцях (рис. 104).
Рис. 104. Збудник
некробактеріозу – фарбування за Грамом У мазках із патологічного матеріалу і молодих культур збудник
спостерігається у вигляді довгих переплетених ниток із 60–80 члеників, які
часто мають інтенсивно забарвлені колбоподібні потовщення та кулясті здуття. Фузобактерії
культивують в анаеробних умовах на середовищі Кітт-Тароцці, бульйоні Мартена,
печінковому бульйоні Хоттінгера, глюкозо-кров'яному агарі Цейсслера,
сироватковому агарі, мозковому середовищі при температурі – 36–37°С,
рН=7,4–7,6, вакуумі – до 4–10 мм рт. ст. У посівах на бульйоні Кітт – Тароцці
ріст бактерій спостерігається через 1–2 доби і супроводжується інтенсивним
помутнінням з наступним проясненням та утворенням осаду (рис. 105).
Рис. 105. Ріст у
посівах на бульйоні Кітта-Тароцці На сироватковому агарі через 48–72 год виростають білі ніжного кольору
круглі, іноді з відростками колонії діаметром 2–3 мм. На поверхні
глюкозо-кров'яного агару Цейсслера спостерігаються дрібні безбарвні колонії з
рівними краями (рис. 106).
Рис. 106. Ріст на
глюкозо-кров'яному агарі Цейсслера На мозковому середовищі відбувається інтенсивне помутніння і почорніння
(не постійно). Фузобактерії – відносно нестійкі мікроорганізми, але можуть довгий час
зберігатися в об'єктах зовнішнього середовища: у замороженому стані
залишаються життєздатними 30–40 діб, у гною – 50 діб, у ґрунті – 20–40 діб, у
сечі – 15 діб, у воді – 15 діб. Під час кип'ятіння руйнуються через 1 хв,
нагрівання до 65°С – через 15 хв, до 70°С – через 10 хв. Інактивуються під
дією сонячного випромінювання через 8–9 год, при висушуванні – через 1–4
доби. Епізоотологія хвороби. У природних умовах на некробактеріоз
хворіють вівці, північні олені, велика рогата худоба, коні, свині, собаки,
кролі, птиця, багато диких тварин. Більш сприйнятливі до хвороби молоді
тварини, але ягнята до відлучення від вівцематок не хворіють. Джерелом
збудника інфекції є хворі та перехворілі на некробактеріоз тварини –
бактеріоносії, а також здорові тварини, особливо жуйні, в рубці яких
фузобактерії є постійними мешканцями. В навколишнє середовище збудник
некробактеріозу виділяється з фекаліями, слиною, відторгнутими некротизованими
тканинами і контамінує гній, ґрунт, пасовиська, вигули, водойми. Зараження
тварин відбувається під час потрапляння збудника хвороби на травмовані
ділянки шкіри або слизової оболонки травного каналу, які з'являються за
випасання тварин на низинних багнистих пасовищах, по стерні, а також під час
утримання в тваринницьких приміщеннях на мокрій підстилці, згодовування
колючих трав, тривалого перегону по твердому, кам'янистому ґрунту. Некробактеріоз реєструється як у пасовищний, так і в стійловий період (рис.
107).
Рис. 107. Умови
виникнення некробактеріозу Некробактеріоз може ускладнювати перебіг різних захворювань вірусної або гельмінтозної
етіології. За несприятливих ветеринарно-санітарних умов некробактеріоз часто
набуває стаціонарного характеру і вражає різні види тварин. Стаціонарності
захворювання сприяють також тривале бактеріоносійство при хронічному перебігу
хвороби, несвоєчасна ізоляція та лікування хворих тварин. Патогенез. Вирішальну роль у виникненні
й розвитку некробактеріозу відіграє зниження природної резистентності
організму під впливом різних несприятливих факторів, а також травмування
тканин, що забезпечує необхідні умови для проникнення й розмноження збудника
хвороби (рис. 108).
Рис. 108. Травма
– провокуючий фактор У первинному осередку спостерігаються некротичні ураження тканин і утворення
виразок, що зумовлює виникнення у хворих тварин місцевих функціональних
розладів (кульгання). Клінічні ознаки та перебіг
хвороби. Інкубаційний період триває 1–3 доби. У молодих тварин перебіг хвороби
гострий, у дорослих – підгострий або хронічний. Розрізняють доброякісну і
злоякісну форми хвороби. У коней некробактеріоз проходить підгостро, іноді хронічно, в
доброякісній або злоякісній формі. При доброякісній
формі спостерігається обмежений некроз шкіри та підшкірної клітковини з
наступним утворенням рубцевої тканини (рис. 109, 110).
Рис. 109.
Ураження вінчика при некробактеріозі
Рис. 110. Ураження кінцівки при некробактеріозі При злоякісній формі в місцях
ураження розвивається гнійно-некротична флегмона з некрозом хрящів,
сухожилків, зв'язок та утворенням секвестрів. Виявляється висока температура
тіла, сильне пригнічення, відмова від корму, прискорення пульсу та дихання,
часті випадки ускладнення гнійно-некротичною пневмонією, що призводить до
загибелі тварини (рис. 111).
Рис. 111. Гнійно-некротичні ураження
копита при некробактеріозі Патологоанатомічні зміни. Трупи загиблих тварин
виснажені. В центрі запального процесу виявляються гнійно-некротичні маси, по
периферії – інфільтрація підшкірної клітковини. Окремі ділянки ураженої шкіри
також інфільтровані, забарвлені в темний колір, крихкуваті. В тяжких випадках
спостерігається глибокий некротичний розпад м'язової тканини з оголенням
сухожилків, зв'язок та суглобів, відлущення рогового шару, стоншення і
деформація стінки копитець. У легенях на розрізі виявляються різної форми й
розміру осередки гнійно-некротичного розпаду тканини. Плевра потовщена,
вкрита фібринозними нашаруваннями. В печінці, нирках, головному мозку
трапляються осередки некрозу світло-жовтого кольору, іноді абсцеси. Лімфовузли
гіперемійовані, збільшені в розмірах. Діагноз на некробактеріоз установлюють на підставі характерних клінічних
ознак хвороби та результатів лабораторних досліджень. До уваги беруть також
епізоотологічні дані й патологоанатомічні зміни. Лабораторна діагностика. Для дослідження в лабораторію
надсилають уражені тканини та шматочки паренхіматозних органів з некротичними
осередками від тварин. Для прижиттєвої діагностики відбирають зіскрібки патологічного матеріалу
на межі здорової та некротизованої тканин. У лабораторії проводять
мікроскопію мазків з патологічного матеріалу, посіви на живильні середовища,
зараження кролів. У разі позитивних результатів у забарвлених за Грамом
мазках зіскрібків із патологічного матеріалу виявляють грамнегативні довгі
зернисті палички й нитки, із старих уражень – короткі палички та коки. У
посівах на бульйоні Кітт – Тароцці фузобактерії через 13–24 год зумовлюють
інтенсивне помутніння живильного середовища без утворення газу. В чашках
Петрі з сироватково-глюкозним агаром упродовж 48–72 год з'являються
характерні дрібні колонії збудника. Біопробу ставлять на кролях, яким
підшкірно вводять 10%-ву суспензію патологічного матеріалу або 24-годинну
бульйонну культуру фузобактерій. За наявності у введеному матеріалі збудника
некробактеріозу в кроликів через 3–4 доби на місці ін'єкції спостерігається
некроз. Термін дослідження – до 10 діб. Лікування. Хворих тварин ізолюють і
лікують комплексним методом. Проводять ретельну хірургічну обробку уражених
ділянок шкіри та слизових оболонок з використанням бактерицидних і
дезінфекційних препаратів у вигляді мазей, присипок, емульсій. Для загального
лікування використовують пролонговані антибіотики (біцилін-3–5, дибіоміцин,
дитетрациклін), які на риб'ячому жирі або олії вводять внутрішньом'язово.
Одночасно застосовують сульфаніламідні препарати. Імунітет. Після перехворювання на
некробактеріоз не утворюється. Ефективних вакцин проти некробактеріозу для
коней не запропоновано. Розроблені вакцини для великої рогатої худоби та
овець. Профілактика та заходи
боротьби. Для запобігання некробактеріозу потрібно оберігати тварин від травматизму
кінцівок, своєчасно обробляти рани, створювати відповідні до зоогігієнічних
нормативів умови утримання й годівлі, особливо при пологах, регулярно очищати
й дезінфікувати тваринницькі приміщення, обладнувати місця водопою, вигульних
двориків, літніх таборів, перегонів, виконувати необхідні меліоративні роботи
на пасовищах. Слід уникати тривалого випасання тварин на низинних,
заболочених пасовищах, стомливих перегонів твердими кам'янистими дорогами.
Особливу увагу потрібно звертати на своєчасне обрізання й розчищення копит,
обрізування відшарованого рогу (рис. 112).
Рис. 112.
Розчищення копит у коня
Розчистка копит Не рідше одного разу на 2 міс. слід здійснювати ветеринарний огляд тварин
та розчищення копит і не менш ніж два рази на рік проводити профілактичну
обробку копит 5–10%-м розчином формаліну, 10–20%-м розчином мідного купоросу
або 5%-м розчином параформу з інтервалом 5–7 діб. У разі виникнення некробактеріозу ферму оголошують неблагополучною щодо
цього захворювання і запроваджують певні обмеження. Проводять клінічний огляд
усього поголів'я, ізоляцію та лікування хворих тварин, дезінфекцію приміщень.
Трупи загиблих тварин після зняття шкури спалюють. У пасовищний період для
тварин неблагополучної ферми виділяють окрему ділянку. Клінічно здорових
тварин пропускають через ніжні ванни з 5–10%-м розчином формаліну або
10–20%-м розчином мідного купоросу через кожні 5–7 діб. Карантинні обмеження з неблагополучного щодо некробактеріозу господарства
(ферми, двору) знімають через 30 діб після припинення хвороби, здійснення
остаточної дезінфекції та вжиття’2345 усіх заходів, передбачених чинною
інструкцією. Для дезінфекції приміщень використовується 4–5%-й розчин їдкого натру,
2%-й розчин формаліну, розчин хлорного вапна, який містить 3% активного
хлору, 10%-ву емульсію дезінфекційного креоліну, 20 %-ву суспензію гашеного
вапна. Гній знезаражується біотермічним способом. Для надійного знезараження
неблагополучного пасовища його не використовують для випасання тварин
упродовж 2 місяців. 1.10. Лептоспіроз (Leptospirosis) Лептоспіроз – інфекційна хвороба багатьох видів тварин, в тому числі і коней,
людини, яка проявляється короткочасним підвищенням температури тіла з
наявністю анемії, жовтяниці, гемоглобінурії, геморагічного діатезу, некрозу
слизових оболонок та шкіри, а також абортами. Історична
довідка Вперше лептоспіроз у людей
описав А.Вайль (Weil) 1886 p. У 1914–1915 роках японці Ікадо, Ідо та інші
виділили із крові людини, яка хворіла на інфекційну жовтяницю, спірохету і в
умовах експерименту відтворили захворювання на морських свинках. Збудника
назвали Spirocheta icterohaemorrhagiae. Лептоспіроз коней
реєструється в багатьох країнах Європи, Азії, Америки. В колишньому
Радянському Союзі етіологічну роль лептоспір у виникненні захворювання у
коней вперше довели С.Я. Любашенко і Л.С. Новікова в 1947 р. Лептоспіроз
у коней розповсюджений по всій території України, протікає у формі
субімунізуючої інфекції, в окремих господарствах відмічається клінічний прояв
хвороби, який характеризується кон’юнктивітами, ринітами, кератитами,
абортами на останньому місяці жеребності, розвитком сліпоти в окремих тварин. Етіологія. Збудника лептоспірозу відносять до родини Spirochaetaceae роду
Leptospira (грецькою лептос – дрібний, спейра – спіраль). Група патогенних
лептоспір має 23 серологічні групи і понад 202 серотипи. У коней найчастіше
виділяють лептоспіри таких серологічних типів: L.pomona, L. grippothyphasa,
L. hebdomadis, L. icterohaemorrhagiae. Усі лептоспіри морфологічно не відрізняються між собою. Їх можна
спостерігати в „темному полі" мікроскопа. Це тонкі нитки, довжиною 5–18
мкм, діаметром 0,06–0,15мкм, на кінцях мають потовщення у вигляді ґудзика,
рухаються (рис. 113).
Рис. 113. Лептоспіри під час мікроскопічного дослідження Лептоспіри зафарбовуються
за методом Романовського-Гімза. Культивують лептоспіри за температури 28–30ºС,
рН 7,0–7,4 на елективних рідких середовищах Уленгута, Терських, Любашенка.
Культури ростуть повільно, впродовж 7–10 днів, іноді довше. Типову
ідентифікацію лептоспір здійснюють за допомогою серологічних реакцій (РMА,
РА, РЗК) (рис. 114).
Рис. 114. Відбір крові у коня для серологічних досліджень До експериментального
зараження чутливі золотисті ховрахи, морські свинки 3–4-тижневого віку,
8–10-денні кроленята. Лептоспіри у навколишньому
середовищі добре зберігаються, а у воді, намулі, вологій землі, якщо рН
близька до нейтральної, навіть можуть розмножуватися за відповідної температури.
Під час висихання лептоспіри гинуть у сухому ґрунті втрачають здатність
рухатися через 30 хв, гинуть через 2–12 год. Пряме сонячне проміння знищує їх
протягом 1,5–2 год, під час нагрівання до температури 52–56°С вони руйнуються
протягом 30 хв, а за 76–96°С миттєво. До низьких температур лептоспіри дуже
стійкі, переносять зиму в незамерзлих шарах води і в льоду, не втрачають
життєздатності під час замерзання і розморожування. До дезінфікувальних
речовин лептоспіри чутливі. Глак, формальдегід знищує їх у розведеннях 1:500
(0,25%), розчин з вмістом 0,25% активного хлору – за 5 хв, а 1% розчин їдкого
натру – миттєво. Епізоотологія.
Коні хворіють лептоспірозом
відносно рідко. Хвороба у них проявляється спорадично або невеликими
ензоотичними спалахами. Сприйнятливі коні всіх вікових груп, але частіше
хворіють тварини віком від 2-ох до 7-и років. У молодих тварин хвороба
проходить важче, ніж у дорослих. Джерелом збудника інфекції
є хворі і перехворілі лептоспірозом коні, які виділяють збудника у навколишнє
середовище головним чином з сечею. Лептоспіроносійство у коней, що
перехворіли лептоспірозом, може тривати до семи місяців. Резервуаром патогенних
лептоспір у природі є дрібні дикі ссавці – лептоспіроносії (польові миші,
щурі, сумчасті, комахоїдні), хижі тварини, які постійно поселяються на певній
території і формують природні осередки інфекції. Щурі та миші залишаються
довічними лептоспіроносіями (рис. 115).
Рис. 115. Щур – потенційний
лептоспіроносій Найбільш активними
факторами передачі збудника інфекції при лептоспірозі є водоймища, що
забруднені сечею хворих тварин. Особливо небезпечні стоячі водойми,
заболочені луги.
Випас коней на заболочених луках Передача збудників також
відбувається через корми, підстилку, забруднені виділеннями хворих. Зараження коней найчастіше
відбувається під час водопою або поїдання інфікованих кормів (рис. 116).
Рис. 116. Зараження лептоспірозом через воду Можливе зараження через
пошкоджену шкіру. Спалахи лептоспірозу серед коней спостерігаються переважно
в літньо-осінній пасовищний період, але окремі випадки захворювання можливі
впродовж всього року. Патогенез. Після проникнення в організм лептоспіри течією крові заносяться в
печінку, наднирники, нирки. Розмноження і накопичення лептоспір у крові,
внутрішніх органах і тканинах викликає підвищення температури тіла. З 3–5-го
дня хвороби в крові тварин появляються антитіла, в результаті лептоспіри
через 7 днів зникають з крові. На 12-ий день вони
з'являються в ниркових канальцях, там розмножуються і виділяються з сечею. Ендотоксини лептоспір руйнують
еритроцити і клітини паренхіматозних органів, що обумовлює появу
патологоанатомічних, біохімічних, гематологічних та інших змін. У результаті
руйнування еритроцитів у тварин розвивається анемія, в крові накопичується
велика кількість гемоглобіну, з якого утворюється білірубін. Білірубін, який
адсорбується тканинами, викликає жовтяницю. Внаслідок порушення фільтраційної
здатності нирок у сечі з'являється гемоглобін, а деколи еритроцити, настає
гемоглобінурія або гематурія. Уражається ендотелій капілярів різних органів і
тканин, тому підвищується проникливість стінок судин, з'являються крововиливи
в нирках, легенях, під ендокардом, епікардом, на слизових оболонках
шлункового тракту, в шкірі. Порушується живлення тканин, з'являються некрози. В результаті
ураження плаценти і дії токсичних речовин на плід настають аборти. Порушується також функція
нервової системи, розвивається гепатоенцефалічний синдром, білірубін, діючи
на центр терморегуляції, спричиняє зниження температури тіла хворої тварини,
а при дії на центр блукаючого нерва виникає атонія шлунково-кишкового тракту. Хвороба може закінчитися
смертю тварини в результаті серцевої недостатності або уремії при важкому
ураженні нирок. Клінічні
ознаки. Інкубаційний період триває
від 2 до 20 діб. Перебіг хвороби гострий, підгострий і хронічний. При гострому перебігу
хвороби підвищується температура тіла до 39,5–40,5°С. Кінь швидко втомлюється
на роботі, відмовляється від корму. Видимі слизові оболонки стають
жовтяничними, сечовиділення часте, утруднене, сеча темно-жовтого кольору.
Періодично виникають короткочасна діарея і ознаки кольок. Пульс і дихання
прискорені. Виникають некрози на слизовій ротової порожнини, носа, шкірі губ,
тулуба (рис. 117).
Рис. 117. Клінічні ознаки лептоспірозу у коня Жеребні кобили абортують.
Кількість еритроцитів і гемоглобуліну знижується, ШОЕ прискорене. Характерною
ознакою є лейкоцитоз – 12–20 тис. на 1мм, який утримується протягом всього
перебігу хвороби, до 18 днів. Бактерії, циркулюючи у
крові, можуть викликати увеїт або сліпоту (найпоширеніша причина сліпоти у
коней), а також викидні та ниркова недостатність.
Рис. 118. Органи ураження лептоспірами у коней
Рис. 119. Ознаки сліпоти у коня, як одна з основних ознак
лептоспірозу Підгостра форма характеризується
такими ж ознаками як гостра, тільки перебіг хвороби повільнішій. Гарячка має
рецедивний характер, тривалість рецедивів 2–3 дні. В цей період посилюються
ознаки жовтяниці видимих слизових оболонок, а під час ремісій спостерігається
їх блідість. Некрози знаходять у ділянці губ, шиї, спини, путових суглобів.
Хворі коні поступово худнуть, апетит у них понижений. Тривалість хвороби до
30 днів. Хронічний перебіг
лептоспірозу супроводжується періодичними приступами гарячки, з тривалими
ремісіями. Ознаки захворювання проявляються більш виразно в період рецедивів
хвороби через 2–3 місяці. Слизові оболонки очей і ротової порожнини анемічні,
але в період підвищення температури набувають жовтяничного відтінку. У деяких
коней уражається кон'юнктива, розвивається кератит, ірит, помутніння
кришталика. Патологоанатомічні
зміни. На шкірі трупа видно
вогнища некрозу. Слизові оболонки і тканини жовтяничні, в черевній та грудній
порожнинах накопичення транссудату, крововиливи в підшкірній клітковині, на
слизових оболонках кишок, у легенях, нирках, селезінці. Печінка збільшена,
в'яла, нерівномірно зафарбована, глинисто-червоного кольору з некротичними
вогнищами та крововиливами. Нирки збільшені в об'ємі, під капсулою
крововиливи, межа між кірковим і мозковим шарами згладжена. На поверхні нирок
виявляють некротичні вогнища, крапчасті або плямисті крововиливи. Селезінка
майже незмінна, іноді трохи збільшена. Легені набряклі, в серці під епі- та
ендокардом крапчасті крововиливи. Кров водяниста, погано згортається. Сечовий
міхур переповнений сечею темно-вишневого кольору, на слизовій оболонці
крапчасті й смугасті крововиливи. Головний мозок набряклий, судини ін'єковані
кров'ю. Діагностика. Діагноз на лептоспіроз ставлять на підставі епізоотологічних даних, клінічних ознак, патологоанатомічних змін і результатів бактеріологічних серологічних та гістологічних досліджень. Серологічну діагностику лептоспірозу засновано на виявленні специфічних антитіл у крові реакцією РМА.
Лабораторна діагностика. Наявність лептоспір в полі зору мікроскопа Діагноз на лептоспіроз
вважають встановленим, а господарство неблагополучним у таких випадках: • при виділенні культури з
патологічного матеріалу або з органів заражених лабораторних тварин; • коли виявлено лептоспір під
час мікроскопічного дослідження в крові або суспензії з органів тварин, в
абортованому плоді, сечі або органах лабораторних тварин, що загинули після зараження
досліджуваним матеріалом; • під час виявлення антитіл у
сироватці крові у більш ніж 20% досліджених у титрі 1:50 у невакцинованих, та
1:100 і більше у вакцинованих. Якщо виявлено меншу кількість позитивних
реакцій, проводять мікроскопію сечі. При негативних результатах через 15–30
днів повторно досліджують сироватку крові і сечу тих самих тварин; при
виявленні лептоспір чи антитіл при повторному дослідженні у тварин, які не
мали їх при попередньому дослідженні, чи наростанні титру антитіл у п'ять і
більше разів. Лептоспіроз вважають
причиною аборту, якщо виявлено: а) лептоспіри в органах
плоду або навколоплідних водах; б) антитіла до лептоспір у
сироватці крові в РМА у розведенні 1:5 та більше. Лептоспіроз вважають
причиною загибелі тварин за наявності клінічних ознак у хворих тварин і
патологоанатомічних змін, характерних для цієї хвороби, підтверджених
виявленням лептоспір у крові чи паренхіматозних органах. Диференційний
діагноз. Лептоспіроз коней потрібно
диференціювати від інфекційної анемії, піроплазмідозів. Інфекційну анемію
диференціюють на підставі негативних серологічних показників на лептоспіроз і
відсутності лікувальної ефективності протилептоспірозної сироватки.
Піроплазмідози виключають дослідженням периферичної крові на наявність паразитів. Лікування. Хворих на лептоспіроз тварин ізолюють і лікують. Для цього
використовують полівалентну гіперімунну протилептоспірозну сироватку
одночасно з антибіотиком – стрептоміцин-сульфатом. Сироватку вводять
підшкірно у дозах 20–120 мл залежно від віку тварин (рис. 120).
Рис. 120. Полівалентна гіперімунна протилептоспірозна сироватка Стрептоміцин-сульфат
внутрішньом'язово по 25 тис. од/кг маси тіла з інтервалом 12 годин протягом
чотирьох – п'яти днів. Одночасно проводять симптоматичне лікування:
внутрішньовенно вводять 40% розчин глюкози (30–120 мл), перорально дають
глауберову сіль – 200–300 г, гексаметилс-нтетрамін (уротропін) 5–20 г,
підшкірно вводять кофеїн 2–5 г, промивають ротову порожнину розчином
перманганату калію (1:1000), ураження шкіри
змазують іхтіоловою маззю, борним вазеліном. Хворим тваринам покращують умови
годівлі, утримання. Імунітет. У перехворілих тварин утворюється спочатку нестерильний, а потім
стерильний імунітет до збудника того типу, який викликав захворювання. Тому
для активної імунізації тварин використовують полівалентну вакцину (з
відповідних серогруп). Для пасивної імунізації
застосовують полівалентну сироватку проти лептоспірозу сільськогосподарських
і промислових тварин. Заходи
профілактики і боротьби. Ветеринарно-санітарні заходи регулює Інструкція про
заходи профілактики та оздоровлення тварин від лептоспірозу (наказ Головного
управління ветеринарної медицини держветінспекцією Мінсільгосппроду України
від 15.03.94. №5). Діагностику хвороби регламентує Настанова з лабораторної
діагностики лептоспірозу затверджена начальником Головного управління
ветмедицини держветінспекції Мінсільгосппроду України 11.01.97 р., №15-14/2. Вакцинацію коней проти
лептоспірозу проводять відповідно до настанов із застосування вакцин з тими
серотипами і сероварами, які виявлені в процесі діагностики у тварин
конкретного господарства: • в
неблагополучних з лептоспірозу господарствах; • у господарствах,
де поголів’я коней комплектують без лабораторних досліджень на лептоспіроз; • коли випасають
тварин на пасовищах у зоні природного вогнища лептоспір; • в разі виявлення
в господарстві коней, сироватка крові яких реагує в реакції мікроаглютинації
(РМА). В Україні зареєстровані
такі вакцини проти цієї хвороби: 1. Вакцина проти
лептоспірозу тварин моновалентна. Виробник – Сумська біофабрика. 2. Вакцина проти
лептоспірозу тварин полівалентна серогруп: помона, та- расові,
іктерогеморагія, канікола. Виробник – Сумська біофабрика. 3. Вакцина
полівалентна «ВГНКІ» проти лептоспірозу тварин серогруп: помона,
іктерогеморагія, тарасові. Виробник – Армавірська біофабрика (Росія) (рис.
121).
Рис. 121. Вакцина полівалентна «ВГНКІ»
проти лептоспірозу 4. Вакцина
полівалентна «ВГНКІ» проти лептоспірозу тварин серогруп: грипотифоза, помона,
тарасові, сейро (харджіо). Виробник – Армавірська біофаб рика (Росія) (рис.
122).
Рис. 122. Вакцина полівалентна «ВГНКІ»
проти лептоспірозу тварин 5. Полівалентна
вакцина проти лептоспірозу тварин двох варіантів. Виробник – ТОВ «Алтекс» ЗАТ
НПАП «Новогалещинська біофабрика». Перший варіант вакцини виготовляють з
використанням серогруп помона, тарасові, іктерогеморагія, канікола, а другий
– помона, тарасові, грипотифоза, сейро (рис. 123).
Рис. 123. Полівалентна вакцина проти лептоспірозу
тварин двох варіантів. Виробник – ТОВ «Алтекс» Зазвичай
вакцинацію проводять раз на рік одноразово. Вона запобігає захворюванням,
абортам лептоспірозної етіології, а також формуванню лептоспіроносійства.
Імунізація частини поголів’я не припиняє епізоотичного процесу в
господарстві, адже постійно залишаються сприйнятливі до лептоспірозу тварини.
У регіонах, стаціонарно неблагополучних щодо лептоспірозу, необхідно на
10–14-й день після вакцинації досліджувати сироватку крові коней в РМА, а в
разі виявлення особин з титрами 1:200 і вище – обробити їх антибіотиками
(стрептоміцину сульфат, фармазин-200, інтраміцин, пенбекс або цефазолін). За стабільного
епізоотичного благополуччя у господарстві (стайні або клубі) щодо
лептоспірозу та обмежень у переміщенні коней (участь у змаганнях тощо) їх
можна не вакцинувати, а контролювати епізоотичний стан шляхом проведення
щорічних моніторингових серологічних досліджень крові в акредитованій ДЛВМ Для запобігання занесенню лептоспірозу
в господарстві, потрібно проводити профілактичне карантинування тварин, що
надходять в господарство, і досліджувати їх сироватку крові за РМА на
лептоспіроз. У підозрілих щодо захворювання тварин досліджують сечу на
виявлення в ній лептоспір. Під час встановлення
діагнозу на лептоспіроз господарство оголошують неблагополучним, вводять
карантинні обмеження. Хворих і підозрілих у захворюванні тварин ізолюють і
лікують. Всіх інших коней дворазово вакцинують. У приміщеннях, де знаходилися
хворі тварини, проводять дезінфекцію через кожні 10 діб упродовж усього
періоду зараження лептоспірозом. Для дезінфекції використовують освітлений
розчин хлорного вапна з вмістом 3% активного хлору, 2%-й розчин
формальдегіду, 2%-й гарячий розчин їдкого натру. Гній підлягає біотермічному
знезараженню. Після проведення всіх
передбачених інструкцією ветеринарних заходів та за відсутності хворих тварин
і тварин-лептоспіроносіїв господарство вважається оздоровленим від
лептоспірозу. Перед зняттям карантинних обмежень, через 1–місяці після вжиття
заходів, за РМА досліджують не менше 50 проб сироваток крові молодняку (не
повинно бути позитивних реакцій) і не менше 100 проб сечі від кожної тисячі
дорослих тварин, але не менш ніж від 100 тварин, серед яких не повинно бути лептоспіроносіїв.
РМА у дорослих тварин може залишатися позитивною. Повторне обстеження на
лептоспіроз у раніше неблагополучних господарствах проводять через шість
місяців після зняття карантинних обмежень. 1.11. Родококова інфекція коней (Rhodococcus equi) Родококова інфекція коней (Rhodococcus equi, нокардіоформна інфекція
коней) – характеризується ураженням органів дихання лошат (бронхопневмонія),
протікає у вигляді масового захворювання зі значним відходом або у формі
змішаної інфекції (спільно з гнійним, митним стрептококами), викликає
ураження суглобів ( «суглоболам»). Родококова інфекція коней характеризується
розвитком інфекції в 1–6-місячних лошат, з найбільшою маніфестацією клінічних
ознак у віці від 4 до 12 тижнів. Захворювання проявляється респіраторною
(гнійні бронхопневмонії) та, рідше, кишковою (виразкові тифлоколіти,
мезентеріальні лімфаденопатії) формами, які можуть бути первинні або вторинні
відносно одна одної. Родококова інфекція у дорослих коней
зустрічається дуже рідко. На території України родококова інфекція
коней офіційно не реєструється і дослідження в цьому напрямку не проводяться.
Збудник – Rhodococcus
equi (раніше відома як Corynebacterium equi або Mycobacterium equi) – поліморфна, коротка, нерухома, грампозитивна аеробна бактерія, яка
залежно від умов навколишнього середовища та фази життєвого циклу може
приймати форму кока або палички. Належить до групи нокардіоморфних актиноміцетів
родини Nocardiaceae, ряд Actinomycetales, в
яку входять
4 підгрупи.
Підгрупа 1 об'єднує бактерії,
які містять міколові кислоти та включає в себе 4 роди: Gordona,
Nocfridia, Rhodococcus,
Tsukamurella. Факультативний
внутрішньоклітинний патоген макрофагів є однією з найважливіших причин виникнення
захворювань у лошат між 3-тижневим і 6-місячним віком, а у більшості лошат
клінічні ознаки проявляються до 4-місячного віку. Він є сапрофітним мешканцем
грунту.
Рис. 124. R. equi в мазку гною із абсцеса
легень при гнійній бронхопневмонії в лошати (Фарбування за Грамом, × 1000) У патологічному матеріалі збудник
виявляється у вигляді мікрококів, в мазках з агарових культур – стрептокока
з двох-чотирьох
члеників, у
мазках з бульйонної культури
– у вигляді подовженої палички. Під час фарбування за
Романовським-Гімзою виявляється капсула. На відміну від диплокока (якому
потрібна сироватка в середовищі) добре росте на звичайних поживних
середовищах: на агарі – у вигляді великих слизових колоній, в бульйоні
утворює каламуть, осад і плівку. Не розкладає глюкозу, маніт, не розріджує
желатину і не згортає молоко.
Рис. 125. Ріст R. Equi на кров’яному агарі
Рис. 126. (А, В). Колонії на пластинці в крові, інкубація протягом 24 и 48 годин відповідно Бактерія R. equi є факультативним внутрішньоклітинним
патогеном, що має здатність вражати макрофаги коней. Внутрішньоклітинна
персистенція в альвеолярних макрофагах з наступним їх руйнуванням лежить в
основі патогенності цього мікроорганізму. При цьому тривалість
внутрішньоклітинного перебування збудника в макрофагах пропорційна їх
лізосомальній активності. Вірулентність мікроорганізму обумовлена наявністю
80–90 кб плазміди, що кодує сім протеїнів (virulence associated protein),
позначених як VapA, VapC-VapH. Родококи з різним генетичним складом поширені
в довкіллі, проте небезпечними для коней є представники, які синтезують VapA
вірулентні протеїни. Епізоотологія. До збудника сприйнятливі лошата, дорослі коні,
лабораторні тварини. Незважаючи на те що збудник поширений скрізь,
інфекція може реєструватися або у вигляді ензоотії, спорадичних випадків, або
не реєструватися зовсім. Ця інформація свідчить, що у
виникненні захворювання мають значення кислотність ґрунту, температура,
запиленість приміщень та інші фактори (S. Giguere, A.J. Prescott, 1999). Ураження органів дихання у лошат з подібною симптоматикою може бути викликано низкою
бактеріальних збудників, які є причиною самостійних первинних інфекцій. Однією з важливих причин бронхопневмонії у
лошат перших шести місяців життя є інфекція Rodococcus equi. Вторинна інфекція може бути представлена Bordetella bronchiseptica, Streptococcus zooepidemicus, Diplococcus pneumoniae, Pseudomonas aeroginosa, В-гемолітичним стрептококом, а також деякими видами патогенних грибів, мікоплазмами, хламідіями. В результаті недотримання зоогігієнічних
норм утримання коней, несвоєчасної дезінфекції стаєнь, недостатньо точної вентиляції в приміщенні
накопичується бактеріальна мікрофлора і зростає її роль в інфекційному
процесі. R. equi знаходить сприятливе середовище для свого
розвитку в кишечнику лошат. Незважаючи на те, що R. equi виділяють в районах з незначним поголів'ям
коней, найбільш часто його виявляють у місцях інтенсивного конярства з
кислими ґрунтами. У цих районах під час дослідження калових
мас коней відмічають високий вміст органічних жирних кислот – ацетооцтової і пропіонової, які підсилюють ріст збудника в кишечнику лошат у віці до 3 міс. Збудник у великих кількостях знаходиться в ґрунті, траві, приміщеннях. Мікроорганізм у кишечник
лошат проникає із забрудненою травою. Респіраторна
форма інфекції виникає під час вдихання збудника з пилом. Хвороба характеризується вираженою сезонністю.
Захворюваність лошат 100%. Епізоотичний процес плавно розвивається з початку
року (кінець січня – середина лютого) і залежить від початку сезону
вижеребки. Це свідчить про значну роль лошат поточного року народження в
епізоотичному процесі, що обумовлено їх чутливістю до збудника. Прослідковується залежність характеру перебігу інфекційного
процесу та смертності хворих лошат від пори народження. У лошат, народжених у
січні – березні, спостерігається легкий перебіг родококової пневмонії, а
також зниження летальних випадків у порівнянні з лошатами, народженими в
квітні – червні. Пік епізоотичного процесу припадає на травень –
червень, що пов’язано з жаркими і посушливими кліматичними умовами в цей
період року, а також максимальною скупченістю лошат з конематками на вигулах,
що сприяє постійному перезараженню. Причиною є те, що родокок є сапрофітним
мікроорганізмом і може тривалий час мешкати у ґрунті, а постійна контамінація
навколишнього середовища фекаліями інфікованих лошат і дорослих коней-носіїв
у поєднанні з посухою спричинюють умови для вдихання контамінованих часток
пилу, як визначального фактора зараження лошат. Потрібно відмітити, що лошата
хворі на родококову пневмонію, важко переносять спеку, можливо, внаслідок
постійного температурного стресу на фоні дихальної недостатності. Пік
смертності інфікованих лошат реєструється у 2–3-місячному віці. Патогенез. Rodococcus equi проникає в організм через органи дихання
лошат, потрапляє в легені, викликає пневмонію, зазвичай гнійну або абсцедуючу. R. equi все частіше розглядають як причину гранулематозного запалення легень у людей, інфікованих ВІЛ. Збудник культивується в макрофагах, і його вірулентність
визначається декількома поверхневими білками з М. м. 15–17 кД, які кодуються одним геном. Таkаi та ін. (1991 р.) встановили, що білки являються фактором патогенності збудника. Вірулентні для мишей. Автори накопичували VapA, використовуючи плазміди 85–90 КБ, однак цей білок втрачав вірулентність для лабораторних тварин
протягом декількох пасажів. У кишечнику збудник зумовлює ентероколіт у ділянці пеєрових бляшок, гранулематозне запалення брижових лімфовузлів і (або) лімфовузлів, розташованих у товстому кишечнику. Рідше спостерігають синовіт, остеомієліт,
артрит, целюліт. Кишкове носійство R. equi у дорослих коней пасивне, в основному внаслідок його занесення з зараженого грунту. Навпаки, цей мікроорганізм активно розмножується в кишечнику 3-місячних лошат, досягаючи кількості до 105 на грам калу. Оскільки лошата з ознаками пневмонії заковтують заражену слину, вірулентна бактерія потрапляє в кишечник і починає розмножуватися. Тому гній від лошат, уражених R. equi, є головним джерелом прогресуючого зараження навколишнього середовища вірулентними мікроорганізмами. За сприятливих умов високої літньої температури кількість R. equi за два тижні збільшується в навколишньому середовищу в 10000 разів. Тому 1 грам грунту, зараженого гноєм лошати, містить мільйони вірулентних мікроорганізмів R. equi. Вдихання часток пилу, насичених вірулентним матеріалом, є головним шляхом зараження пневмонією лошат. Одним з важливих шляхів впливу та імунізації є заковтування мікроорганізмів, яке не веде до прояву клінічних ознак набутої гематогенним шляхом пневмонії, поки на лоша багаторазово не вплине дуже велика кількість бактерій. Симптоми. Інкубаційний період триває 2–8 днів. Перебіг захворювання
підгострий або хронічний. Спочатку захворювання може не реєструватися
і виявляється тільки після підвищення температури тіла до 39–40°С, у вигляді
слабкості (лоша відстає від матері); потім з'являється неглибокий кашель. При подальшому прогресуванні хвороби у лошат
спостерігали апатичність, тахіпное та диспное, яке характеризується
розширенням ніздрів та роботою абдомінальних м’язів під час дихання (рис.
127). Аускультацією грудної клітини виявляють
вологі, крупнопузирчасті хрипи, при перкусії – осередкове притуплення і
тимпанічний звук. Респіраторне захворювання іноді
супроводжується проносом. Видимі слизові оболонки гіперемійовані. З носової
порожнини і очей виділяються нерясні слизові виділення. При доброякісному перебігу та своєчасному лікуванні захворювання закінчується через
3–4 дні. Важка форма хвороби триває 10–14 днів і закінчується смертю. У деяких випадках хвороба затягується до 2–3 місяців, при
цьому утворюються метастатичні гнійні вогнища в паренхіматозних органах.
Рис. 127. Запальний жолоб у лошати за
тяжкого перебігу родококової пневмонії Найпоширенішим
проявом клінічних ознак інфекційного зараження R. equi у лошат є хронічна
гнійна бронхопневмонія з утворенням великої кількості абсцесів. Повільне
поширення інфекції в легенях, поряд з помітною здатністю лошат компенсувати
прогресуючу втрату функції легень, ускладнює ранню клінічну діагностику
захворювання. Ранні клінічні ознаки включають лише невелике збільшення
частоти дихання і невисоке підвищення температури. Такі приховані клінічні
ознаки часто пропускають або ігнорують, сприяючи подальшому прогресуванню
захворювання. Тому навіть при хронічній формі перебігу захворювання респіраторні
ознаки часто виявляються несподівано. У міру прогресування захворювання
з'являються такі клінічні ознаки, як зниження апетиту, сонливість, лихоманка,
тахіпное і утруднене дихання, що характеризується роздуванням носових отворів
і підвищеною напругою черевної стінки. Періодично виникають кашель і
виділення з обох носових отворів. У багатьох хворих лошат зберігається
задовільний стан, але у важких випадках, особливо при хронічному перебігу
захворювання стає помітною втрата ваги. У переважної
більшості лошат з клінічними ознаками пневмонії ознаки ураження кишечника не
відзначаються. Кишкова форма R. equi характеризується багатовогнищевим
виразковим ентероколітом і тифлітом у ділянці пеєрових бляшок, з
гранулематозним запаленням мезентеріальних і (або) кишкових лімфатичних
вузлів. Іноді вдається виявити лише поодинокий великий абдомінальний абсцес.
Діагностичний прогноз таких лошат несприятливий, оскільки на момент
встановлення діагнозу часто спостерігається велика адгезія товстого або
тонкого відділів кишечника до місця абсцесу. Клінічні ознаки абдомінальної
форми захворювання включають лихоманку, занепад сил, анорексію, кахексію,
коліки і діарею. Полісиновіт,
особливо тібіотарсального і колінного суглобів, спостерігається приблизно в
одній третині випадків при нокардіоформних інфекційних пневмоніях (рис. 128).
Іноді уражаються всі суглоби. Ступінь випоту з суглобової сумки різна, і в
більшості випадків кульгавість відсутня або виявляється невпевненою ходою.
Під час цитологічного дослідження синовіальної рідини зазвичай виявляється
несептичний мононуклеарний плеоцитоз, а під час бактеріологічного дослідження
виявити збудника зазвичай не вдається. Такий полісіновіт вважається
імуно-опосередкованим і під час протимікробного лікування зазвичай проходить
після зникнення ознак пневмонії. Наявність несептичного полісіновіту в лошати
між 1 і 6 місяцями життя ймовірно свідчить про зараження нокардіоформною
інфекцією (R. equi). Відкладення імунних комплексів у деяких лошат також
сприяє розвитку ознак увеїту, анемії і тромбоцитопенії.
Рис. 128. Асептичний синовіт
гомілково-таранних суглобів лошати інфікованого родококом Проникнення
бактеріальної інфекції в кров з легень або шлунково-кишкового тракту (ШКТ)
іноді призводить до септичного артриту і (або) остеомієліту. Однак у лошат
може виникнути опосередкований R. equi септичний артрит або остеомієліт без
явних ознак легеневої інфекції або іншого, будь-якого джерела. Ступінь
кульгавості лошат з проявом ознак септичного артриту відрізняється від лошат
з імуно-опосередкованим полісіновітом. У підозрілих випадках потрібне
проведення культивування бактерій і цитологічне дослідження синовіальної
рідини. У лошат з проявом ознак R. equi остеомієліту зазвичай з'являються
ознаки кульгавості і набряку над ураженою ділянкою. Поширення інфекції в
кістках через кірковий шар метафізу і в навколишніх тканинах призводить до
появи целюліту, а іноді й ознак септичного артриту. Крім відповідного
протимікробного лікування (див. розділ Лікування), лошатам з ознаками R. equi
септичного артриту і остеомієліту часто потрібно місцеве інвазивне лікування,
і прогноз у таких тварин обережний. Також зустрічається R. equi
опосередкований хребетний остеомієліт. Ранні ознаки хребетного остеомієліту
часто обмежені лихоманкою, сонливістю, незграбністю, малорухливістю і
опірністю до пальпації. Однак діагноз рідко ставлять до поширення інфекції в
епідуральний простір, з ознаками здавлювання спинного мозку або нервів. Такі
ознаки включають парез, атаксію, параліч або синдром кінського хвоста,
залежно від тяжкості та ділянки здавлювання. Також
зустрічаються виразковий лімфангіт, целюліт і підшкірні абсцеси. Іншими
рідкісними ознаками і проявами цієї інфекції у лошат є панофтальміт, нефрит і
абсцеси печінки і нирок. Захворювання внаслідок R. equi інфекції у дорослих
коней виникають рідко й іноді внаслідок імуносупресії. У кількох
повідомленнях йдеться про епізодичні виникнення захворювань, аналогічних
захворюванням лошат, з ознаками ураження легень, кишечника, пов'язаних з ними
лімфатичних вузлів, і рідко виникають раневі інфекції. У рідкісних випадках
цей мікроорганізм ізолюється у безплідних кобил і абортованих плодів. Патолого-анатомічні зміни. Основні зміни відмічають головним чином у легенях; характеризуються гнійною і абсцедуючою пневмонією. Абсцеси та гнійники бувають різних розмірів – від
горошини до курячого яйця, іноді зібрані в грона (рис. 129). Гнійники можуть зливатися, утворюючи порожнини, які
містять гній. Старі гнійники інкапсулюються, на розрізі у них салоподібна поверхня. Слизова оболонка трахеї і бронхів жовтянична.
Рис. 129. Абсцеси на поверхні легень за
родококової пневмонії у лошати При розтині
приблизно у половини лошат з ознаками пневмонії виявляються також
абдомінальні ураження. Зміни в інших органах відмічають у вигляді метастатичних
абсцесів у печінці, кишечнику і на брижі. Діагностика. Збудника хвороби виділяють з органів
дихання, лімфатичних вузлів, печінки, селезінки. Негативні результати бактеріологічного
дослідження можуть пояснюватися застосуванням в якості засобів лікування
антибіотиків. Специфічні аглютинуючі антитіла не виявляють. До 30–40-ї доби після зараження
розвивається алергічна реакція (шкірна гіперчутливість уповільненого типу). Після введення алергену збільшення шкірної
складки відмічають через 48–72 год. Реакція шкірної гіперчутливості корелює з
тестом бласттрансформації. В
якості мітагенів використовують антигени, отримані шляхом теплової екстракції і
впливу лізоциму. Реакція бласттрансформації виявляється на 7–40-ту добу після підшкірного, інтраназального або інтратрахеального зараження лошат, однак кореляція між показниками
бласттрансформації і клінічним проявом хвороби не встановлена (М.А.
Еленбергер та ін.). Для кількісного визначення гуморальних антитіл
розроблено імуноферментний тест, який не дає перехресних реакцій з митним
стрептококом та іншими збудниками. Антитіла, які виявляються в ІФА,
з'являються у лошат після прийому молозива. До 5–6-го місяця вміст антитіл у лошат
досягає рівня, характерного для дорослих коней. Порівняння результатів, отриманих в РДП та
ІФА, показало відсутність кореляції між ними, мабуть, внаслідок виявлення антитіл різних класів (С. Китай та ін.). Диференціальна діагностика. Вона ґрунтується на лабораторних дослідженнях. Родококову інфекцію слід диференціювати від інфекції Bordetella bronchiseptica, Streptococcus zooepidemicus, Diplococcus pneumoniae, Pseudomonas aeroginosa, зумовленої В-гемолітичним стрептококом, а також деякі види патогенних грибів, мікоплазм, хламідій. Імунітет. Захист від інфекції R. equi забезпечується як гуморальними, так і клітинними
факторами. Антитіла до R. equi дуже поширені у коней. Захисна роль
антитіл до R. equi підтверджується високою ефективністю гіперімунних
сироваток під час їх застосування в неблагополучному господарстві. Водночас
колостральні антитіла до R. equi не володіють превентивними властивостями.
Останнє, очевидно, пояснюється існуванням різних ізотипів імуноглобулінів до
збудника. У клітинному імунітеті, який реалізується через активацію головного
комплексу гістосумісності, секрецію інтерлейкінів (цитокінів) та інших життєво важливу
роль відіграють нейтрофіли. Окрім того, стійкість R. equi до бактерицидної
дії макрофагів забезпечують міколові кислоти в складі бактеріальної клітини. Заходи
боротьби і профілактика. Поліетіологічність респіраторних
хвороб, можливість розвитку змішаних бактеріальних або вірусно-бактеріальних
інфекцій дуже ускладнюють вибір найбільш ефективної схеми лікування. Етіотропна терапія вірусних хвороб зазвичай
неможлива через вкрай убогий арсенал противірусних засобів або, точніше, їх
відсутність. Спроби використовувати для лікування вірусних хвороб коней деякі
препарати (імуномодулятори, цитокіни, інтерферони), що застосовуються в
медичній практиці, в одних випадках невиправдані, оскільки всі інтерферони
мають видову специфічність, в інших випадках не володіють противірусними або
імуномодулюючими властивостями. У зв'язку з цим лікування вірусних інфекцій коней
головним чином симптоматичне і комплексне. Важливий момент – своєчасне виявлення хворих
лошат на початковій стадії захворювання, при цьому забезпечується
своєчасність лікувальних заходів, попереджається вторинна бактеріальна
інфекція і розвиток інфекційного процесу до стадії катаральної або
гнійно-катаральної пневмонії. При підозрі на захворювання необхідна щоденна,
дворазова (вранці і ввечері) термометрія всіх лошат, які перебувають на
стайні або в табуні. Лошат з підвищеною температурою тіла разом з їх матерями
слід переводити в окреме приміщення або хоча б розміщувати в одному кінці
стайні. Для лікування хворих лошат застосовують жарознижуючі, протизапальні,
відхаркуючі і антибактеріальні засоби. У їх числі можуть бути використані
такі препарати: • цеякол (склад:
калію йодид, гвайфенезин, метамізол) – має знеболювальну, протизапальну,
жарознижуючу, муколітичною і відхаркуючу дію. Застосовують
внутрішньовенно по 5–15 мл один раз на добу до отримання позитивного ефекту; • вентіпульгін
(кленбутерол гідрохлорид) – бронходилятатор; показання до застосування:
гострі, підгострі та хронічні інфекції органів дихання, за наявності
бактеріальної інфекції і великої кількості слизу можливі бронхоспазм або
обструкція повітроносних шляхів. Застосовують внутрішньовенно повільно, але в
дозі 2,7 мл / 100 кг два рази на день не більше 10 днів; • L-аскорбінова
кислота, або вітамін С, сприяє детоксикації організму, зниженню порозності
кровоносних судин отже, зменшенню запальної ексудації і набряків.
Застосовують ін'єкційний вітамін С – внутрішньом’язево або внутрішньовенно по
0,5–2 г, дрібно, вранці і ввечері. З кормом – по 5–10 г на добу, також вранці
і ввечері. Рекомендовано внутрішньовенне застосування
сироватки за Кадиковим по 40–100 мл через день протягом 4–5 днів, розчин
новарсенола 1: 20 на фізіологічному розчині по 0,01 на 1 кг маси. На грудну
клітку ставлять зігрівальні компреси. Як антибактеріальні засоби
використовують антибіотики і сульфаніламідні препарати. З антибіотиків
застосовують біцилін-3 і цефалозолін (протягом 5 днів), а з сульфаніламідних
препаратів хороші результати дає котрімазін (в його складі триметоприм і
сульфадіазин) 15–20 мл внутрішньом'язово 1 раз на 5 днів або орально (20 мл
шприцом на корінь язика). За табунного утримання доцільно використовувати
біцилін-5 і котрімазін шляхом додавання в питну воду один раз на день
протягом 5 днів. Хороші антибактеріальні властивості має
Кобактан – β – лактамний антибіотик цефкіном, який відноситься до
цефалоспоринів IV покоління. Застосовують його в дозі 2–4 мл/50 кг маси
тварини внутрішньом’язово, 2–5 ін’єкцій з інтервалами 24 год. Препарат не
виділяється в порожнину шлунково-кишкового тракту, в результаті знижується
ризик розвитку дисбактеріозів. Через 5 хв після внутрішньом’язової ін'єкції в
крові створюється терапевтична концентрація препарату, яка залишається
активною для більшості збудників бактеріальних інфекцій протягом 24 год. Ексенел
– натрієва сіль цефтіофура, антибіотик широкого спектру дії, з групи
цефалоспоринів. Застосовують один раз на день 2 мг/кг маси тварини
внутрішньом'язово протягом 10 днів з інтервалами в 24 год між ін'єкціями. |
|||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||
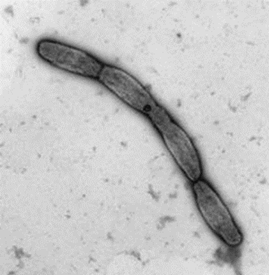
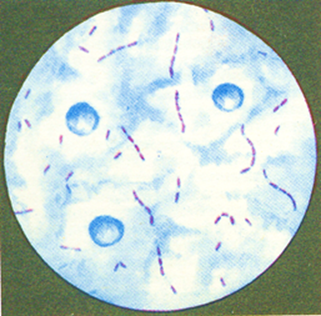
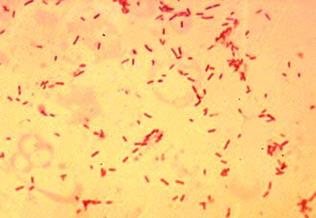













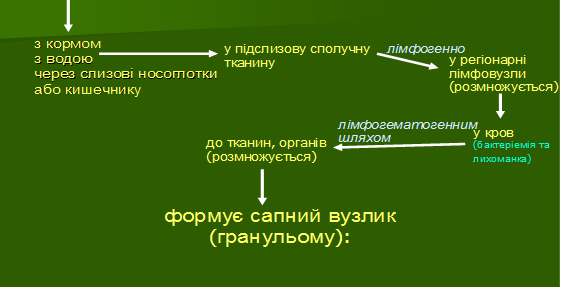


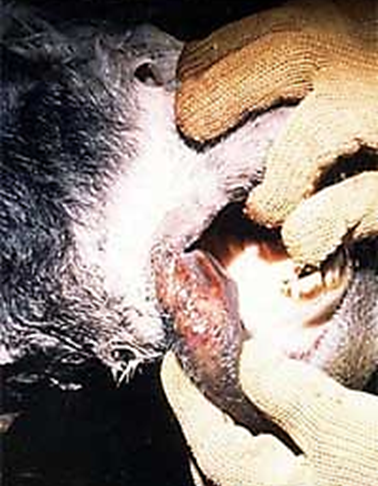

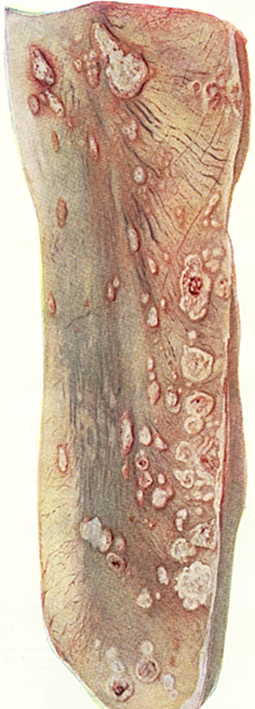
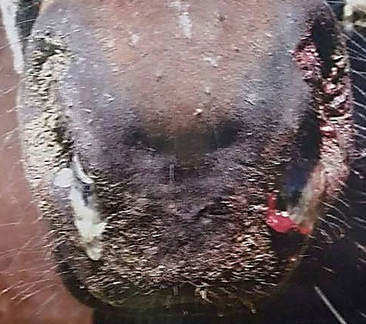
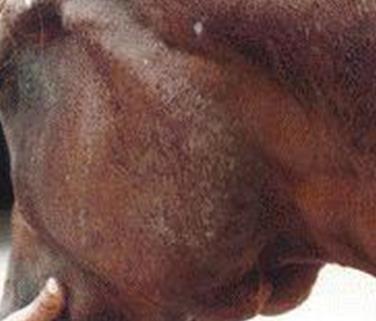
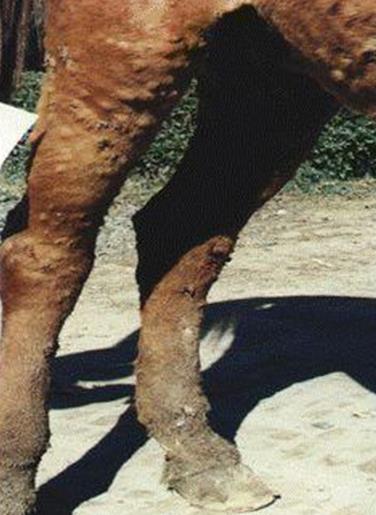

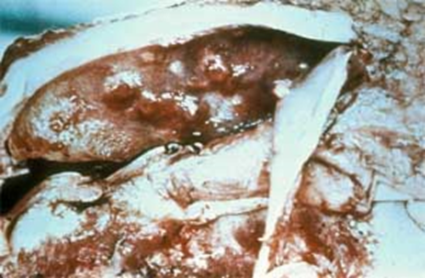
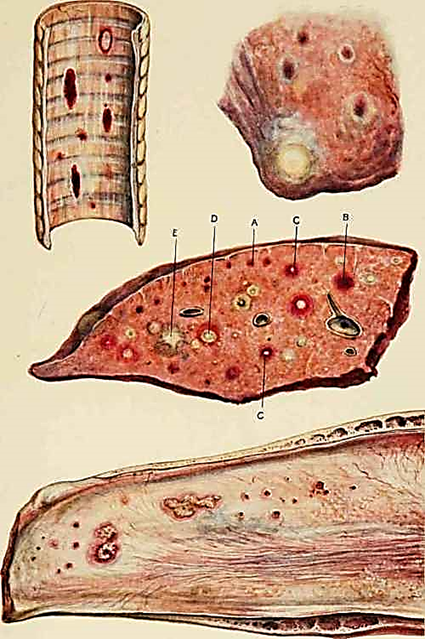
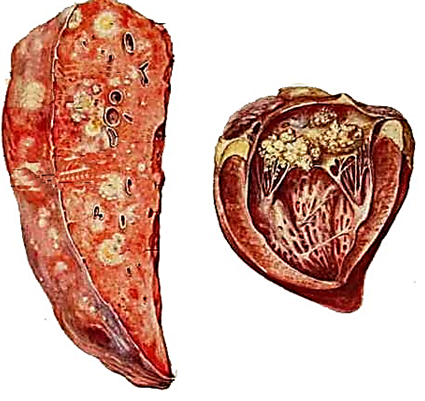
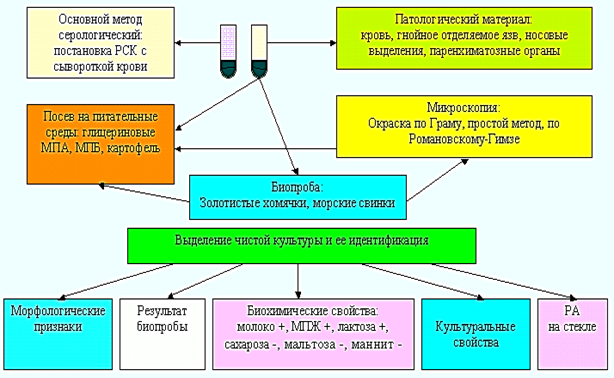

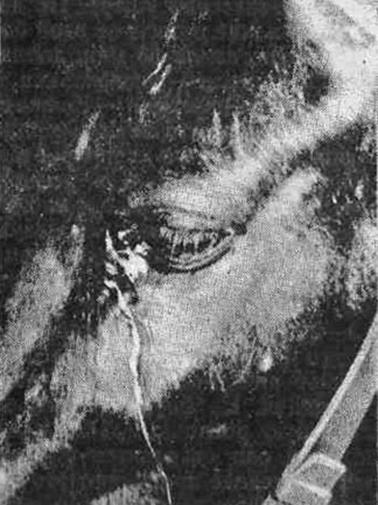
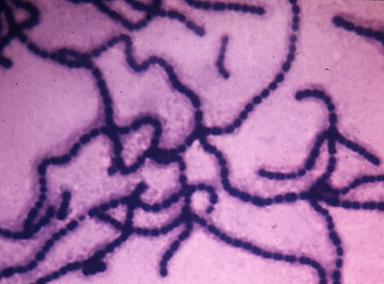
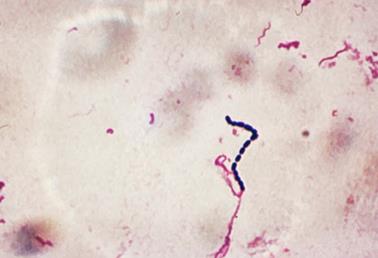
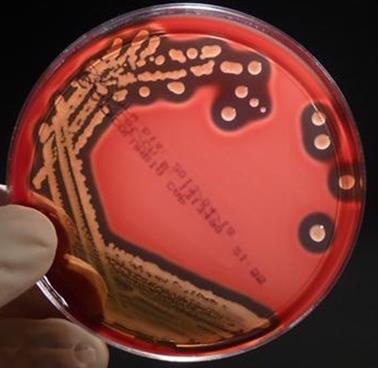





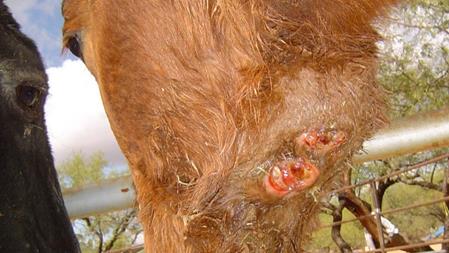
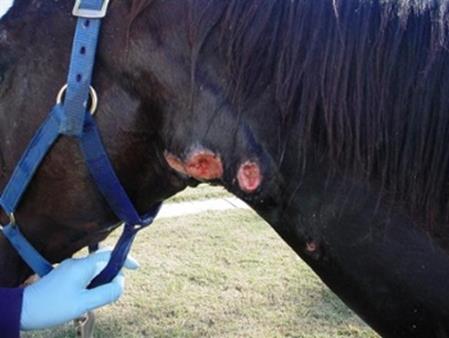
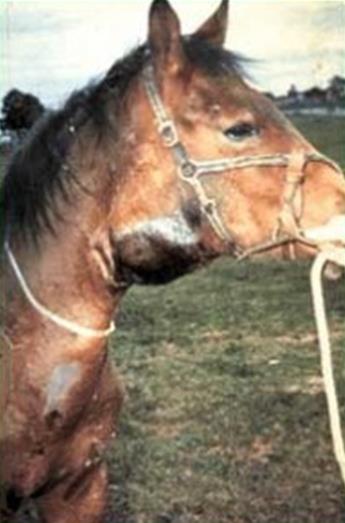

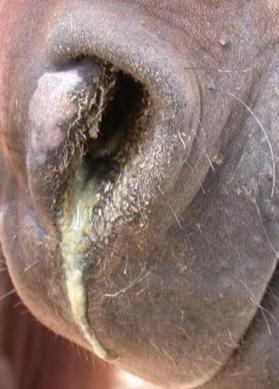
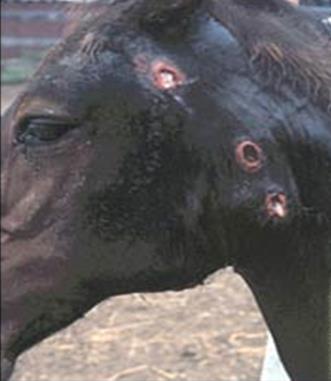


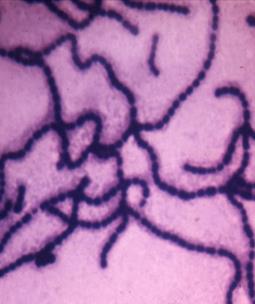
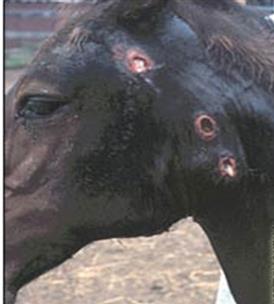
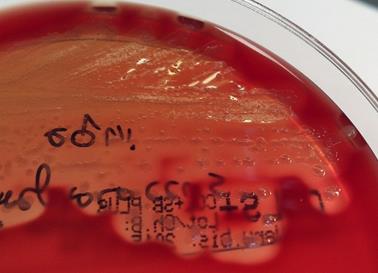

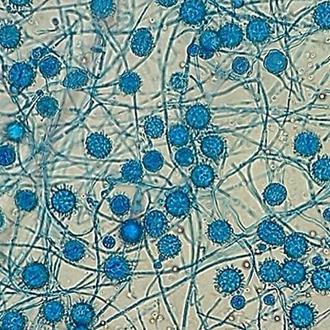
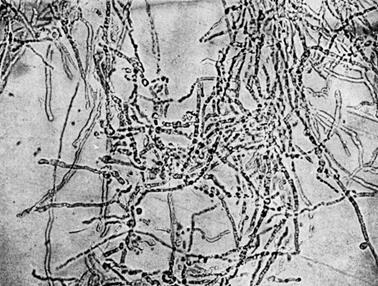
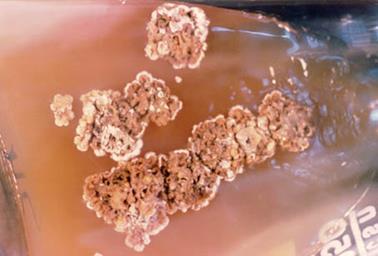
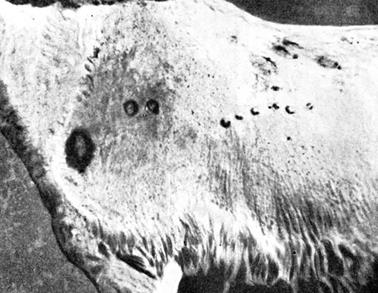
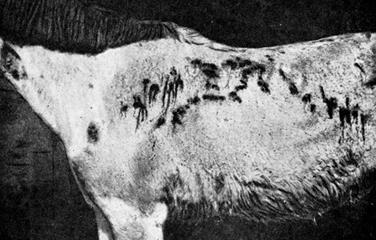
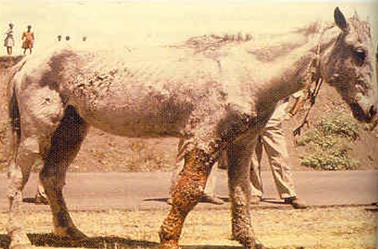
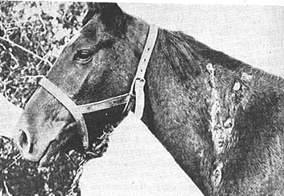
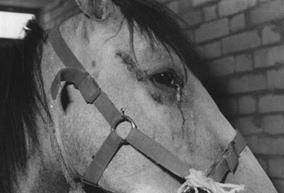
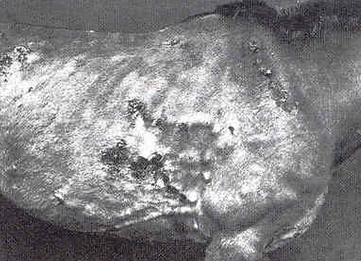


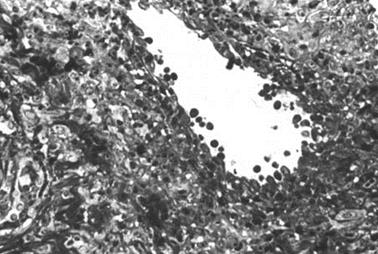
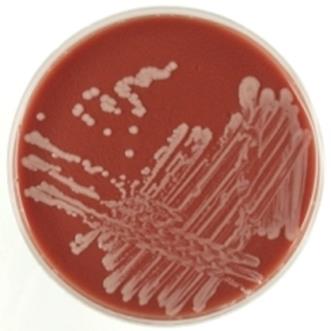




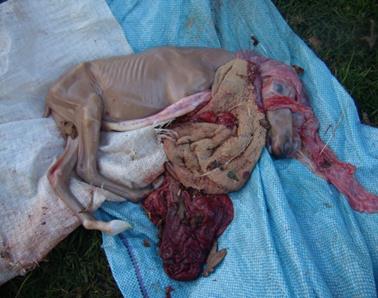

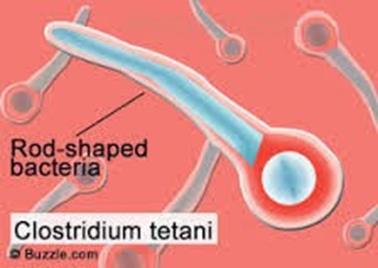
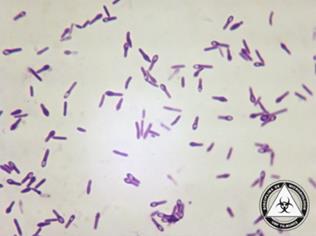


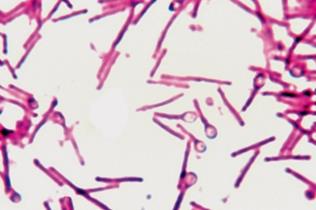








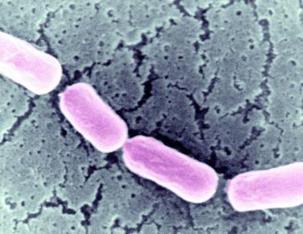
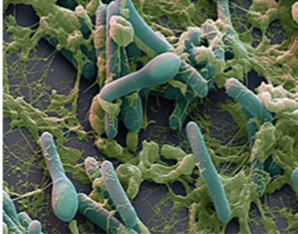
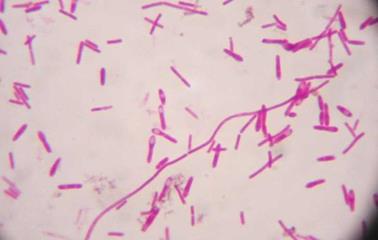

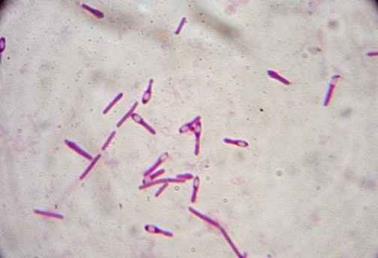
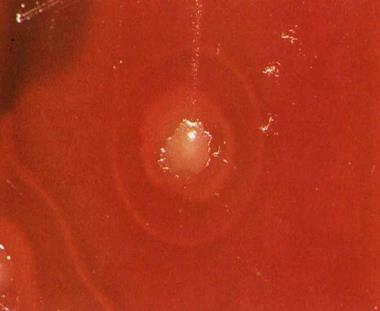
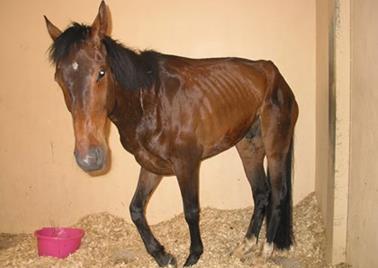

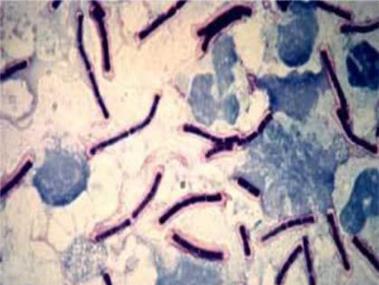
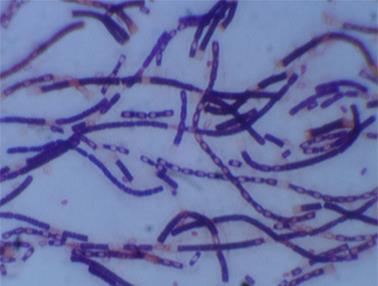

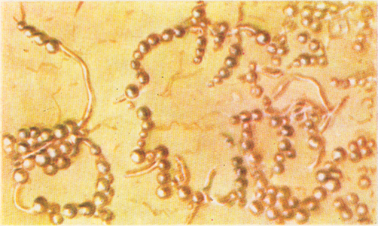


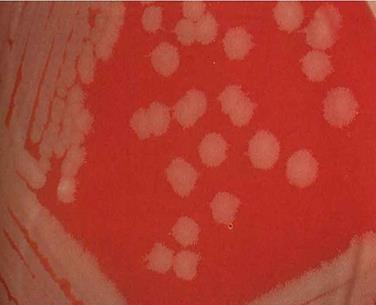


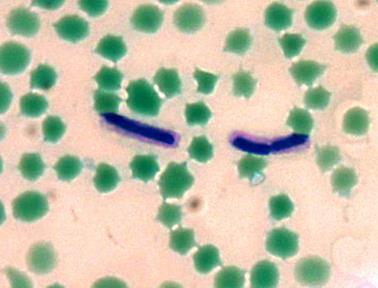
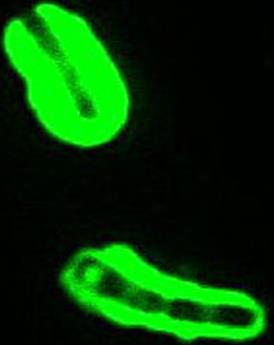



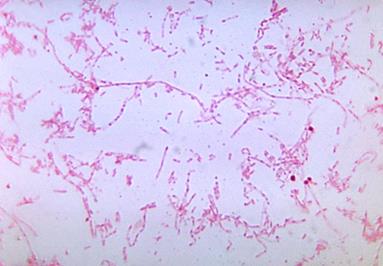

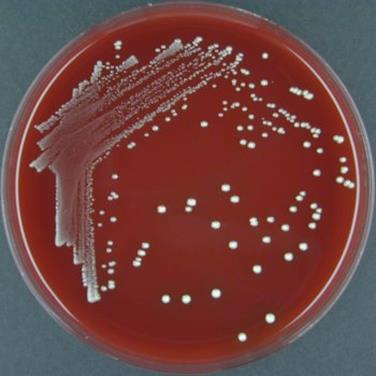
![[​IMG]](1.files/image228.jpg)